
3 курс / Фармакология / Кукес. Клиническая фармакология
.pdf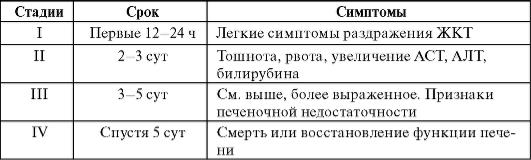
метаболит при введении терапевтических доз парацетамола нейтрализуется, взаимодействуя с глутатионом. Однако при приеме больших доз, а также у новорожденных и пациентов, страдающих алкоголизмом, запасы глутатиона могут истощаться, что приводит к повреждающему воздействию N-ацетилбензохинонимина на гепатоциты. Метаболиты парацетамола (в основном глюкурониды и сульфаты) выводятся с мочой. В неизмененном виде почками выводится не более 5% парацетамола.
Фармакодинамика. По выраженности противоболевого и жаропонижающего эффектов подобен ацетилсалициловой кислоте. Парацетамол характеризуется низкой противовоспалительной активностью, и как противовоспалительное средство его не применяют. Он также не влияет на агрегацию тромбоцитов, не обладает ульце-рогенным действием.
Показания к применению. Как анальгетик при болевом синдроме малой и средней интенсивности, в том числе и в послеоперационном периоде. Широко применяется как жаропонижающее средство. Несмотря на риск гепатотоксичности, предпочтителен как антипиретик для детей в разовой дозе 10 мг/кг. Препарат назначают внутрь (таблетки, суспензии, сиропы), ректально в виде свечей, внутривенно в виде раствора для инфузий.
НЛР. При применении в рекомендуемых дозах парацетамол хорошо переносится. Возможны аллергические реакции (кожная сыпь, крапивница, отек Квинке), тошнота, рвота, повышение активности печеночных трансаминаз. Редко могут развиться анемия, тром-боцитопения. Возможно нефротоксическое действие. Наибольшую опасность представляет гепатотоксическое действие парацетамола при его передозировке. Риск непреднамеренной передозировки особенно велик при приеме суспензии или сиропа парацетамола у детей первых месяцев жизни. У взрослых поражения печени могут развить-
ся от разового приема более 8 г парацетамола. У детей гепатотокси-ческое действие проявляется при одномоментном введении препарата в дозе более 140 мг/кг. Клиническая картина отравления развивается постепенно в несколько стадий (табл. 27-4).
Таблица 27-4. Отравление парацетамолом
Для спасения пациента с отравлением парацетамолом крайне важно своевременно поставить диагноз. Любая задержка с оказанием помощи грозит летальным исходом.
Меры помощи при интоксикации парацетамолом: промывание желудка, введение активированного угля, внутривенное введение ацетилцистеина с последующим переходом на прием внутрь (длительность применения не менее 72 ч). Рекомендовано введение фито-менадиона. Следует иметь в виду, что гемодиализ неэффективен, а форсированный диурез опасен. Нельзя применять фенобарбитал, антигистаминные препараты, глюкокортикоиды, этакриновую кислоту из-за риска усиления гепатотоксичности.
Метамизол натрия (анальгин*) - производное пиразолона. В ряде стран препараты метамизола натрия запрещены для использования в клинической практике из-за опасений развития агранулоцитоза. Однако, по данным фармакоэпидемиологических исследований, риск данной НЛР весьма незначителен. Тем не менее назначение препарата должно быть контролируемым.
Фармакодинамика. Обладает достаточно выраженным анальгети-ческим действием, которое обусловлено преимущественно центральными механизмами, в частности, изменением проведения болевых импульсов по проводящим путям спинного мозга. Обладает отчетливым и быстрым жаропонижающим действием.
Показания. Устранение болей при почечной колике, в стоматологии, при неврологических заболеваниях, травмах, в послеоперацион-
ный период. Как жаропонижающее средство, в частности, для парентерального введения.
НЛР. Аллергические реакции (крапивница, отек Квинке). При внутривенном введении возможен анафилактический шок. Длительный прием метамизола натрия может привести к развитию лейкопении и агранулоцитоза.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Лорноксикам - представитель группы оксикамов. Обладает выраженным противоболевым и противовоспалительным действием.
Фармакокинетика. При приеме внутрь хорошо всасывается с достижением максимума концентрации в плазме крови через 1-2 ч. Прием препарата вместе с пищей существенно снижает скорость и полноту всасывания. Биодоступность - 90-100%. Характеризуется высокой степенью связывания с белками плазмы крови - 99%. Подвергается метаболизму в печени с образованием неактивных метаболитов. Преимущественно выводится печенью (2/3) и частично почками (1/3).
Фармакодинамика. Лорноксикам в равной мере блокирует ЦОГ-1 и ЦОГ-2, при этом по способности блокировать ЦОГ превосходит другие препараты из группы оксикамов. Противоболевое действие препарата обусловлено как нарушением генерации болевых импульсов, так и ослаблением восприятия боли. Существуют данные о том, что при парентеральном введении лорноксикам может увеличивать концентрацию эндогенных опиоидов, тем самым активируя анти-ноцицептивную систему.
Показания к применению. Для устранения болей при почечной колике, при неврологических заболеваниях, травмах, у онкологических больных, в послеоперационном периоде.
НЛР. Аллергические реакции (кожная сыпь, тахикардия, одышка), эрозивно-язвенные поражения слизистой оболочки желудка и двенадцатиперстной кишки с риском желудочно-кишечных кровотечений. Возможны головная боль, шум в ушах, сонливость или нарушения сна, повышение АД, тромбоцитопения, лейкопения, кровоточивость.
Кеторолак - производное пирролизинкарбоксиловой кислоты, характеризуется выраженным обезболивающим действием.
Фармакокинетика. При приеме внутрь быстро всасывается из ЖКТ практически полностью. Биодоступность при приеме внутрь составляет 80-100%. Максимальная концентрация в плазме крови достигается через 30-50 мин после приема внутрь или внутримышечного введения препарата. Всасывание из ЖКТ может замедляться при приеме одновременно с жирной пищей. Связывается с белками
плазмы крови - 99%. В печени подвергается биотрансформации с образованием глюкуронидов. Выводится почками в неизмененном виде - 10% и в виде неактивных метаболитов (глюкурониды) - 90%. Продолжительность действия составляет около 4-6 ч.
Фармакодинамика. Кеторолак - неселективный ингибитор ЦОГ, с чем и связано его выраженное анальгетическое действие. Обладает также умеренными противовоспалительными свойствами. Оказывает жаропонижающее действие. Снижает агрегацию тромбоцитов.
Показания к применению. Рекомендован для обезболивания в послеоперационном периоде, купирования болей при травмах, в неврологической практике. Кеторолак необходимо назначать кратковременно - не более 5 сут. Препарат не следует применять в акушерской практике.
НЛР. Боли в эпигастральной области, тошнота, рвота. Реже могут развиваться эрозивно-язвенные поражения слизистой оболочки желудка и двенадцатиперстной кишки, желудочно-кишечное кровотечение. Достаточно часто возникают головная боль, головокружение, сонливость. Возможны асептический менингит, депрессия, психоз, снижение слуха, звон в ушах, нарушение зрения. Кеторолак может приводить к повышению АД, появлению отеков (лица, голеней, лодыжек). Возможно развитие анемии, лейкопении, кровоточивости. Отмечают аллергические реакции (крапивницу, кожный зуд, периорбитальный отек, бронхоспазм), синдромы Стивенса-Джонсона, Лайелла.
Кетопрофен - производное пропионовой кислоты.
Фармакокинетика. При приеме внутрь хорошо и быстро всасывается с биодоступностью более 90%. В крови активно связывается с белками плазмы - около 99%. Подвергается метаболизму в печени с образованием глюкуронидов. Метаболиты выводятся почками.
Фармакодинамика. Ингибирует ЦОГ-1 и ЦОГ-2, что определяет выраженное противоболевое действие, обладает отчетливым противовоспалительным эффектом. Анальгетическое действие кетопрофе-на обусловлено как периферическими, так и центральными механизмами. Кетопрофен оказывает также жаропонижающий эффект.
Показания к применению. Рекомендован для обезболивания в послеоперационном периоде, купирования болей при травмах, почечной колике, в неврологической практике. Из других показаний следует отметить болевой синдром в гинекологии и отоларингологии. Другие показания - типичные для НПВС.
НЛР. Аллергические реакции, гастродуоденопатия, желудочно-кишечные кровотечения, эзофагит, стоматит, депрессия, тревож-
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
ность, нарушения сна, повышение АД, отеки, тромбоцитопения, лейкопения, агранулоцитоз, нефротоксическое действие.
27.4. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СРЕДСТВ ДЛЯ НАРКОЗА
Под наркозом принято понимать искусственно вызванные наркотическими средствами угнетение сознания и стойкую утрату болевой чувствительности. Средства для наркоза или общие анестетики принято подразделять на два класса.
• Средства для ингаляционного наркоза:
- летучие жидкости - эфир диэтиловый, галотан, энфлуран, изофлуран, метоксифлуран*3; - газы - динитрогена оксид, ксенон.
• Средства для неингаляционного наркоза:
-препараты короткого действия - пропанидид®, пропофол;
-препараты средней продолжительности действия - кетамин, мидазолам, гексобарбитал, тиопентал натрия;
-препараты длительного действия - натрия оксибутират.
Клиническая фармакология средств для ингаляционного наркоза
Фармакокинетика. Скорость развития наркоза, его глубина зависят от поступления ингаляционных анестетиков в мозг из крови. В свою очередь, насыщение крови анестетиками обусловлено их содержанием в дыхательной смеси, поступающей в легкие. Повышение концентрации ингаляционного анестетика в дыхательной смеси ускоряет наступление анестезии. Парциальное давление анестетика последовательно увеличивается в альвеолах, крови и тканях до выравнивания во всех средах организма. Большое значение для распределения средств ингаляционного наркоза имеет их растворимость в крови и в тканевой жидкости.
Динитрогена оксид обладает сравнительно низкой растворимостью, а галотан, изофлуран, энфлуран® имеют большую растворимость. Еще выше растворимость у трихлорэтилена, метоксифлу-рана*3 и диэтилового эфира. Чем ниже растворимость анестетика, тем быстрее достигается равновесие парциального давления в дыхательной смеси, крови и ткани мозга. Следовательно, при ингаляции
динитрогена оксида быстро достигаются равновесные концентрации в крови и мозговой ткани. Соответственно сравнительно быстро наступает наркоз, а после прекращения введения анестетика он также быстро завершается.
Для хорошо растворимых препаратов характерны медленное развитие анестезии и медленное пробуждение после прекращения подачи ингаляционного анестетика. Это объясняется тем, что значительная часть препарата растворяется в крови и медленнее проникает в мозг в начале наркотизации. Однако анестетик, растворенный в крови, обеспечивает поддержание концентрации препарата в ткани мозга после окончания наркоза. В частности, при применении меток-сифлурана*3 необходимая глубина наркоза достигается через 15-20 мин, а пробуждение наступает через 40-60 мин после прекращения введения препарата.
Важным показателем, характеризующим растворимость общих анестетиков, считают коэффициент распределения «кровь - газ».
Перенос ингаляционных анестетиков в кровь зависит также от состояния легочного кровотока. Увеличение сердечного выброса и повышение кровотока в легких замедляет увеличение концентрации анестетиков в артериальной крови. Напротив, при малом сердечном выбросе, но сохраненном мозговом кровообращении, даже при вдыхании невысоких концентраций средств ингаляционного наркоза, наркоз наступает быстрее и характеризуется большей выраженностью.
Ингаляционные анестетики выводятся из организма в основном с выдыхаемым воздухом. Впрочем, некоторые из препаратов подвергаются частичному метаболизму ферментами печени и некоторых других тканей. В ходе операционной анестезии около 15-20% галота-на подвергается метаболизму. Окисляясь, он превращается в трифто-руксусную кислоту с освобождением ионов брома и хлора. При гипоксии может образовываться свободный радикал хлортрифторэтила, который взаимодействует с клеточными мембранами гепатоцитов. Практически не подвергается биотрансформации закись азота. Очень слабо метаболизируют энфлуран® и изофлуран. Метоксифлуран* подвергается активной биотрансформации в печени с образованием нефротоксичного иона фтора.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Фармакодинамика. По современным представлениям ингаляционные анестетики способны влиять на физикохимические свойства липидов мембран нейронов и изменять проницаемость ионных каналов. Уменьшается приток ионов натрия при сохранении
выхода ионов калия и повышении проницаемости для ионов хлора. Развивается гиперполяризация клеточных мембран. При этом нарушается не только функция постсинаптических структур, но и пре-синаптических образований, с угнетением высвобождения медиаторов. В связи с этим формируется основной нейрофизиологический эффект - повышение порога импульсации нервных клеток.
Наиболее чувствительными к действию ингаляционных анестетиков оказываются богатые синаптическими связями кора головного мозга, таламус, ретикулярная формация, спинной мозг. Дыхательный и сосудодвигательный центры продолговатого мозга устойчивы к влиянию средств для ингаляционного наркоза, но высокие дозы анестетиков подавляют и их активность, что ведет к остановке дыхания и нарушению сердечной деятельности.
Последовательное вовлечение структур ЦНС в действие ингаляционных анестетиков определяет стадийность развития ингаляционного наркоза. Типична динамика развития эфирного наркоза, насчитывающая четыре стадии: 1 - аналгезии; 2 - возбуждения; 3 - хирургическая стадия (глубокий наркотический сон с потерей всех видов чувствительности, расслаблением мышц, угнетением рефлексов, урежением и углублением дыхания); 4 - пробуждения.
НЛР. При передозировке ингаляционных анестетиков возможно угнетение дыхательного и сосудодвигательного центра продолговатого мозга. Уже на четвертом уровне хирургической стадии наркоза появляются признаки нарушения основных витальных функций. Дыхание сохраняется только диафрагмальное, становится поверхностным и аритмичным. Пульс нитевидный, определяется предельно низкое АД.
Некоторые из ингаляционных анестетиков обладают специфическими токсическими свойствами. Например, хорошо известно угнетающее влияние галотана на сократительную способность сердечной мышцы. Уменьшается сердечный выброс, что ведет к снижению АД. Галотан повышает чувствительность миокарда к катехоламинам и может провоцировать нарушения сердечного ритма.
Сравнительно редко наблюдается злокачественная гипертермия при введении галотана, метоксифлурана* , диэтилового эфира, циклопропана, а также при введении миорелаксанта суксамето-ния йодид. Злокачественная гипертермия развивается у генетически предрасположенных пациентов. Предполагают, что синдром злокачественной гипертермии развивается у больных с наследственной мио-патией, биохимическим показателем которой считают повышение
активности сывороточной кретининкиназы. Злокачественная гипертермия проявляется стремительным повышением температуры тела до 42 °С и выше при проведении наркоза. Развиваются ригидность скелетной мускулатуры, тахикардия и аритмия, одышка. Возникает выраженная гипоксия. Начало может быть более острым при введении суксаметония йодида. Синдром протекает крайне тяжело с летальностью примерно в 2/3 случаев.
Средства для ингаляционного наркоза оказывают отрицательное воздействие на медицинский персонал, работающий в операционных. Беременные - сотрудницы операционных блоков - не должны находиться в операционных, воздух которых загрязнен анестетиками, поскольку существует риск тератогенных влияний. Повышается опасность выкидыша.
Взаимодействие препаратов для ингаляционного наркоза с другими ЛС. В настоящее время ингаляционный наркоз с применением только одного препарата не проводят. Широко применяют потенцированный наркоз с предварительным введением средств, усиливающих действие общего анестетика. Существует также потенцированный наркоз с применением нескольких общих анестетиков и комбинированный, когда наркоз начинают с введения одного общего анестетика, а продолжают другим.
Для устранения ряда нежелательных эффектов ингаляционных анестетиков и усиления их основных свойств назначают средства премедикации (холиноблокаторы, бензодиазепиновые транквилизаторы, наркотические анальгетики). Поскольку не все общие анестетики обеспечивают необходимое расслабление поперечно-полосатой мускулатуры, применяют миорелаксанты.
Эфир для наркоза* (эфир диэтиловый) - летучая жидкость с температурой кипения 34-35 °С.
Фармакодинамика. Диэтиловый эфир обладает высокой наркотической активностью и значительной широтой терапевтического действия. Стадия аналгезии развивается при концентрации 0,2-0,4 г/л, а передозировка наблюдается при 1,8-2,0 г/л. Наркоз с введением диэтилового эфира хорошо управляем. Важные достоинства препарата - хорошая анальгетическая активность и выраженное мио-релаксирующее влияние. Усиливается активность симпатического отдела вегетативной нервной системы, что при введении диэтилового эфира в умеренной дозе обеспечивает увеличение сердечного выброса и повышение АД, увеличение концентрации глюкозы в крови. Впрочем, при значительном повышении дозы сердечный выброс
уменьшается и АД начинает снижаться. Диэтиловый эфир может повышать капиллярную кровоточивость.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Существенным клиническим недостатком препарата считают его раздражающее действие на слизистые оболочки, приводящее к усилению слюнотечения, увеличению бронхиальной секреции и развитию бронхоспазма.
Галотан
Фармакокинетика. Галотан выделяется из организма через легкие - до 80%, а 20% его подвергается метаболизму с образованием неактивных метаболитов (трихлоруксусная кислота и бромистый водород) и выводится почками.
Фармакодинамика. Средство для ингаляционного наркоза, по активности в 4-5 раз сильнее эфира. Обеспечивает быстрое введение в наркоз практически без стадии возбуждения. Не раздражает дыхательные пути, более того, обладает умеренным бронхорасши-ряющим действием. Ослабляет симпатический тонус, расширяет сосуды, особенно в коже, и снижает АД. Следовательно, у пациентов с кровотечением галотан может вызвать резкую гипотонию. К этому предрасполагает также и способность препарата оказывать прямое отрицательное инотропное действие. Повышение тонуса блуждающего нерва приводит к брадикардии.
Тонус скелетной мускулатуры галотан понижает умеренно, и обычно возникает необходимость в дополнительном введении миорелак-сантов. Галотан ослабляет сократительную способность матки.
Галотан применяют для ингаляционного наркоза при хирургических вмешательствах как общий анестетик у больных хроническими заболеваниями легких, бронхов и СД.
Энфлуран® обладает мощным действием. Благодаря низкому коэффициенту растворимости «кровь - газ» (1,9) вызывает быстрое наступление наркоза. Пробуждение тоже происходит быстро. Энфлуран® не вызывает нарушений сердечного ритма, не угнетает дыхание, оказывает выраженное миорелаксирующее действие. При введении больших доз возможно падение АД и угнетение дыхания, которые быстро устраняются при снижении глубины анестезии.
Изофлуран. Существенно не влияет на сократительную способность миокарда, не вызывает аритмии. Плохо растворяется в крови и быстро проникает в головной мозг. Соответственно состояние наркоза развивается достаточно скоро. Стадия выхода из наркоза
также непродолжительна. При глубоком наркозе может усиливаться мозговой кровоток и как следствие повышаться давление ликвора.
Динитрогена оксид - наименее токсичный общий анестетик. При применении динитрогена оксида (закиси азота*) обеспечиваются быстрая индукция анестезии и быстрое пробуждение. Он не обладает раздражающим действием на слизистые оболочки дыхательных путей. Вместе с тем даже при применении высоких концентраций закиси азота* (до 95%) расслабление скелетной мускулатуры не достигается, полного подавления рефлексов не происходит. Именно поэтому закись азота обычно сочетают с другими ингаляционными и неингаляционными общими анестетиками.
После наркоза с динитрогена оксидом не наблюдается выраженного последействия. Однако возможна гипоксия, и после окончания наркоза целесообразно проведение ингаляции кислорода в течение 4-5 мин.
Ксенон - инертный газ, без запаха. При вдыхании вызывает металлический привкус во рту. Обладает более выраженным наркозным действием, чем закись азота*. Наркоз протекает в четыре стадии: через 1-2 мин после начала ингаляции происходит снижение болевой чувствительности; через 2-3 мин развивается возбуждение с эйфорией, повышается мышечный тонус, учащается сердечный ритм; через 4-5 мин наступает выраженная аналгезия; наконец через 5-7 мин проявляется хирургическая стадия наркоза.
Пробуждение происходит быстро, через 2-3 мин после прекращения ингаляции восстанавливается сознание, а через 4-5 мин больной ориентирован во времени и пространстве.
Ксенон рекомендуют для проведения наркоза в детской хирургии, нейрохирургии, для обезболивания родов, купирования болевого синдрома при ИМ, почечной и печеночной коликах, проведения перевязок и болезненных манипуляций.
Клиническая фармакология средств
для неингаляционного наркоза
Неингаляционные анестетики вводят внутривенно, внутримышечно, ректально. Чаще всего используют внутривенное введение препаратов. Средства для неингаляционного наркоза выгодно отличают простота и удобство применения, быстрое наступление действия и отсутствие ряда осложнений, типичных для ингаляционного наркоза.
Внутривенные анестетики короткого действия
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Пропанидид® и пропофол - препараты короткого действия, которые применяют для кратковременной анестезии при вправлении вывихов, репозиции отломков костей при переломах, для проведения болезненных диагностических манипуляций (биопсии, установки катетера, бронхоскопии), для вводного наркоза.
Пропанидид®. Внутривенный анестетик короткого действия с быстрым наступлением эффекта без стадии возбуждения. Через 15-20 с после введения наступает сон. При этом развивается ряд вегетативных реакций в виде учащения дыхания и увеличения частоты сердечных сокращений. Спустя несколько секунд анестезия стабилизируется. Действие продолжается всего 3-6 мин, следовательно, пропанидид® можно считать средством ультракороткого действия. Спустя 25 мин после введения препарат уже не определяется в крови. По окончании наркоза происходит быстрое восстановление всех функций ЦНС. Благодаря этому пропанидид® считают уникальным препаратом для поликлинической хирургии.
НЛР. При применении пропанидида® может развиваться судорожный синдром. У больных эпилепсией подобное действие препарата наиболее возможно.
Среди побочных эффектов следует отметить возможность развития тромбофлебита, бронхоспазма. Возможны тошнота и икота, а также перекрестная аллергия с прокаином.
Пропофол
Фармакокинетика препарата характеризуется тремя фазами. Первая - быстрое распределение (Т1/2-2-4 мин), вторая - быстрое выведение из организма (Т1/2-30-60 мин), третья - медленная конечная фаза с перераспределением препарата из тканей, плохо снабжаемых кровью. Пропофол подвергается метаболизму в печени и выводится в виде неактивных метаболитов с мочой.
Фармакодинамика. Средство для внутривенного наркоза быстрого и короткого действия. Наркотический сон развивается через 30 с после введения препарата. После прекращения наркотизации сознание восстанавливается быстро. Скорость наступления эффекта и кратковременность действия обусловлены фармакокинетическими особенностями препарата.
Пропофол показан при вводной анестезии, для поддержания анестезии, обеспечения седативного эффекта у больных, которым проводится ИВЛ. Его применяют для получения седативного эффекта
с сохранением сознания при проведении диагностических процедур.
Следует отметить способность препарата оказывать противорвот-ное действие, что особенно важно в послеоперационном периоде. Пропофол уменьшает мозговой кровоток, снижает внутричерепное давление. В период индукции анестезии может наблюдаться существенное снижение АД из-за уменьшения периферического сосудистого тонуса.
Вводная анестезия обычно протекает без возбуждения. Могут наблюдаться артериальная гипотензия и кратковременное апноэ (при введении больших доз препарата). При пробуждении редко возникают тремор, галлюцинации, повышение внутричерепного давления, лихорадка. Возможны аллергические реакции с бронхоспазмом, ангионевротическим отеком, кожными высыпаниями. Пропофол проникает через плацентарный барьер, и его не рекомендуют использовать в акушерстве. Следует помнить, что жировая эмульсия - хорошая питательная среда для микроорганизмов, соответственно необходимо тщательно соблюдать условия стерильности.
Внутривенные анестетики средней продолжительности действия
К препаратам средней продолжительности действия относят препараты барбитурового ряда, а также кетамин и мидазолам.
Барбитураты
Фармакокинетика. Быстрое действие тиопентала натрия и гексо-барбитала обусловлено их высокой растворимостью в липидах и хорошей проницаемостью в головной мозг. Сравнительно небольшая длительность наркоза связана с быстрым снижением концентрации анестетиков в крови: либо из-за интенсивного метаболизма в печени (гексобарбитал), либо путем перераспределения в жировую ткань (тиопентал натрия). Оба препарата на 6575% связываются с альбуминами плазмы крови, и при гипопротеинемии выраженность наркотического действия барбитуратов усиливается. При ацидозе степень связывания с белками плазмы крови снижается, что ведет к увеличению свободной фракции препаратов и усилению их эффекта. При алкалозе, который развивается в результате гипервентиляции, напротив, связывание с белками плазмы усиливается и выраженность эффектов гексобарбитала и тиопентала натрия снижается.
Гексобарбитал быстро окисляется в печени с образованием неактивных метаболитов. Тиопентал натрия сначала распределяется во внеклеточной жидкости, а затем поступает в жировую ткань. Депонирование препарата в жировой ткани существенно замедляет выведение из организма, что определяет посленаркозную сонливость.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Фармакодинамика. Барбитураты способны угнетать активность ретикулярной формации среднего мозга и путем этого изменять функцию коры больших полушарий. Подавляется реакция на внешние раздражители. Общая анестезия достигается вторично и обусловлена развитием глубокой общей наркотической депрессии. Нейротропное действие барбитуратов объясняют их способностью изменять функцию ГАМК-эргических синапсов. Барбитураты повышают чувствительность ГАМК-рецепторов к ГАМК и могут сами выступать в качестве ГАМК-миметиков. Вместе с тем барбитураты подавляют эффекты возбуждающих аминокислот. В результате происходят увеличение тока ионов хлора через хлорные каналы мембран нервных клеток и, следовательно, гиперполяризация клеточных мембран. Это, в свою очередь, ведет к снижению активности нейронов в различных отделах головного мозга.
Среди многочисленных соединений барбитурового ряда по-прежнему наиболее приемлемыми анестетиками остаются тио-пентал натрия и гексобарбитал. После внутривенного введения этих препаратов состояние наркоза развивается быстро и продолжается в течение 20-25 мин. Стадия возбуждения практически отсутствует, особенно при медленном внутривенном введении. Выключение сознания совпадает с усилением рефлексов: роговичного и зрачкового, глоточного и гортанного, повышением реактивности на болевое раздражение. В это время любое вмешательство представляет опасность для больного: может повышаться АД, нарушаться сердечный ритм, возникать ларинго- и бронхоспазм.
Барбитураты не обладают самостоятельным анальгетическим действием. Они не обеспечивают достаточного расслабления скелетной мускулатуры.
Нежелательные лекарственные реакции
НЛР этих ЛС в значительной мере связаны с их основными свойствами и проявляются угнетением дыхания. При этом степень нарушения вентиляции прямо зависит от дозы и скорости внутривенного введения препаратов. Барбитураты угнетают сердечную деятельность, компенсаторно вызывая тахикардию.
Эти свойства определяют противопоказания для гексобарбитала и тиопентала натрия при ХСН, почечной и печеночной недостаточности, БА, кишечной непроходимости, шоке, болезни Аддисона.
Барбитураты угнетают дыхательный центр. Путем возбуждения блуждающего нерва вызывают повышение тонуса бронхов, увеличивают продукцию бронхиального секрета. Препараты понижают сократительную способность миокарда, уменьшают ударный объем сердца, приводят к умеренному расширению сосудов и снижению
АД.
Гексобарбитал оказывает угнетающее влияние на двигательные и сенсорные зоны коры головного мозга, тормозит стволовые образования. Слабее действует на спинной мозг, чем обусловлена сравнительно слабая миорелаксация при его введении. Наркоз развивается через 1-1,5 мин и длится 20-30 мин. В течение наркоза, вызванного гексобарбиталом, выделяют пять стадий: атараксия, сонливость; возбуждение (кратковременное); сон и устранение сознания (в эту стадию происходит усиление глоточного и гортанного рефлексов, возможно развитие апноэ и ларингоспазма, кашля и икоты); хирургический наркоз. При введении высоких доз наркоз может быть очень глубоким, с угнетением дыхания и развитием сердечно-сосудистой недостаточности.
Препарат применяют для вводного и базисного наркоза, а также для кратковременного однокомпонентного наркоза при малых хирургических вмешательствах. Показан для купирования судорог при столбняке, эклампсии, анафилаксии.
Тиопентал натрия сходен по своим характеристикам с гексобар-биталом, однако несколько активнее. Кроме того, он сильнее стимулирует активность парасимпатического отдела вегетативной нервной системы, чаще вызывает ларингоспазм и бронхоспазм.
Препарат применяют для вводного наркоза, а также для кратковременного однокомпонентного наркоза при малых хирургических вмешательствах. Хорошо подходит для купирования судорог при столбняке, эклампсии, анафилаксии.
Небарбитуровые анестетики средней продолжительности действия - кетамин и мидазолам. В настоящее время кетамин занимает одно из ведущих мест в анестезиологии. Наркоз, вызываемый кетамином, имеет ряд особенностей, и его рассматривают как диссоциированную анестезию. У пациента при кетаминовом наркозе подавляется боль, частично утрачивается сознание, но сохраняются рефлексы и повышается мышечный тонус.
Кетамин
Кетамин - неконкурентный антагонист возбуждающего медиатора ЦНС - глутамата. Чувствительные к глутамату NMDA-рецепторы регулируют функции натриевых, калиевых и кальциевых каналов, и при блокаде рецепторов кетамином нарушается процесс деполяризации мембран нервных клеток. Вместе с тем кетамин активирует обмен эндорфинов, приводит к стимуляции серотонинергической и норадреналинергической передачи.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
При внутривенном введении кетамина наркоз развивается через 0,5-1 мин и длится до 5-10 мин. При внутримышечном введении эффект наступает в течение 3-5 мин и длится до 30 мин. Кетамин обладает выраженным анальгетическим действием. В то же время он не снижает мышечный тонус, напротив, может развиваться каталептический мышечный гипертонус. Вместе с тем в течение нескольких часов после завершения кетаминовой анестезии сохраняется обезболивающее действие, что очень важно в послеоперационном периоде.
Кетамин практически не угнетает дыхание. Рефлексы с дыхательных путей не подавляются, что снижает вероятность аспирации при самостоятельном дыхании. С другой стороны, без применения миорелаксантов выполнение интубации невозможно. Секреция слюнных и бронхиальных желез повышается, что требует сочетания кетамина с атропином.
В целом кетамин отличает большая широта терапевтического действия и минимальная токсичность. Этот анестетик незаменим при малых хирургических вмешательствах, гинекологических операциях, перевязках у ожоговых больных, эндоскопических процедурах и транспортировке пациентов с травматическим шоком и кровопо-терей. Препарат можно применять для наркоза у пациентов с отягощенным аллергическим анамнезом. Кетамин подходит для вводного и комбинированного наркоза.
НЛР. При выходе из наркотического сна возможны галлюцинации и бред, что наблюдается при нарушении технологии использования анестетика. Препарат вызывает антероградную амнезию1. Избыточное возбуждение лимбических структур, вызываемое кетамином, требует коррекции с помощью бензодиазепинов. Действительно, сочетание кетамина с диазепамом обеспечивает оптимальное течение наркоза с минимальным риском осложнений.
1 Амнезия - утрата воспоминаний о событиях, непосредственно предшествовавших наркозу.
Кетамин повышает АД, вызывает тахикардию, что связано с мобилизацией центральных адренергических механизмов. Стимулирующее влияние кетамина на сердечно-сосудистую систему отличает его от всех других общих анестетиков и позволяет вводить его больным в состоянии шока. Препарат усиливает мозговой кровоток, повышает внутричерепное давление. Гемодинамические эффекты кетамина сглаживаются при его сочетании с диазепамом.
Натрия оксибутират
Средство неингаляционного наркоза длительного действия. После внутривенного введения наркоз развивается через 10-15 мин и длится до 1,5-2 ч. Механизм действия натрия оксибутирата связан с его трансформацией в мозговой ткани в тормозной медиатор ЦНС - ГАМК. Препарат малотоксичен. Он обладает свойствами антигипоксанта. Существуют сведения, что натрия оксибутират повышает устойчивость мозга, миокарда, печени, сетчатки глаза к гипоксии.
Накопление ГАМК в спинном мозге определяет расслабление скелетной мускулатуры. Препарат существенно не угнетает дыхательный и сосудодвигательный центры. Натрия оксибутират повышает АД, при этом интраоперационная гипертензия трудно поддается коррекции.
Учитывая недостаточную глубину анестезии и слабое анальгетиче-ское действие, натрия оксибутират при общем обезболивании обычно применяют в сочетании с другими препаратами. Он подходит для вводного и базисного наркоза, анестезии у больных с печеночной и почечной недостаточностью, тяжелыми интоксикациями и гипоксией.
27.5. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ МИОРЕЛАКСАНТОВ
Важным условием выполнения хирургического вмешательства считают хорошее мышечное расслабление при выполнении анестезиологического пособия. Не все общие анестетики обеспечивают снижение мышечного тонуса, для усиления их действия вводят мио-релаксанты. Особенно необходимы эти препараты для проведения эндотрахеального наркоза.
Классификация миорелаксантов периферического действия
• Недеполяризующие средства (конкурентного типа действия):
- бензилизохинолины - тубокурарина хлорид ; атракурия бези-лат; цисатракурия безилат; мивакурия хлорид;
- аминостероиды - пипекурония бромид, панкурония бромид; векурония бромид.
• Деполяризующие миорелаксанты - суксаметония хлорид.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Фармакокинетика. Скорость наступления эффекта миорелаксан-тов зависит от их поступления из крови (эти препараты вводят внутривенно) в область нервно-мышечных синапсов. Длительность действия определяется скоростью их элиминации. Изменение концентрации недеполяризующих миорелаксантов в крови происходит в две фазы - быструю, когда их плазменная концентрация быстро уменьшается, и медленную. Первая связана с поступлением препаратов в ткани. Вторая фаза характеризует их экскрецию из организма.
Тубокурарина хлорид® в малой степени подвергается метаболизму, и около 50-60% введенной дозы выводится почками за 24 ч.
Атракурия безилат биотрансформируется в печени с образованием неактивных соединений. Основной метаболит - лаудона-зин. Ранее считали, что лаудоназин, проникая через ГЭБ в ЦНС, может спровоцировать судороги. Однако клинические испытания не выявили связи между концентрацией лаудоназина в крови и развитием судорожного синдрома. Около 15% введенной дозы выводится почками. Прекращение нервно-мышечной блокады, вызванной препаратом, не зависит от его метаболизма в печени и от выведения с мочой. Следовательно, на длительность миорелаксантного эффекта атракурия безилата изменения функции печени и почек влияния не оказывают.
Панкурония бромид® преимущественно выделяется почками, но около 15-25% введенной дозы подвергается биотрансформации в печени. Его основной метаболит - 3-гидроксипанкуроний малоактивен. Пипекурония бромид также выводится в неизмененном виде почками. Векурония бромид выводится преимущественно с желчью. За 24 ч этим путем элиминируется 40-80% от введенной дозы. Около 30% выводится почками.
Суксаметония хлорид после внутривенного введения распределяется в крови и внеклеточной жидкости. Более 90% введенной дозы подвергается гидролизу бутирилхолинэстеразой крови. Таким образом, длительность действия препарата в первую очередь обусловлена активностью этого фермента.
Фармакодинамика. С клинической точки зрения недеполяризую-щие миорелаксанты целесообразно разделить на препараты короткого
действия (15-30 мин), средней продолжительности действия (30-40 мин) и длительного действия (60-120 мин). Коротко действующие - мивакурия хлорид; средней продолжительности действия - атраку-рия безилат, цисатракурия безилат, векурония бромид; длительного действия - панкурония бромид® и пипекурония бромид.
Анестезиологи выделяют также миорелаксанты двухфазного действия (суксаметония хлорид) и однофазного - препараты недеполя-ризующего типа. Такое разделение препаратов обусловлено клиническими различиями в развитии миорелаксации при их применении.
Для препаратов двухфазного действия типично появление мышечных подергиваний сразу после внутривенного введения. Их эффект усиливается при введении антихолинэстеразных средств, гипотермии, респираторном алкалозе. Выраженность действия уменьшается внезапно по мере снижения концентрации в области нервномышечного синапса.
Миорелаксанты однофазного действия не вызывают мышечных фасцикуляций, антихолинэстеразные средства уменьшают их эффект. Выраженность блокады нервно-мышечной передачи усиливается при повторном введении, анестезии диэтиловым эфиром, галотаном, гипотермии.
Недеполяризующие миорелаксанты (конкурентного типа действия) угнетают нервно-мышечную передачу, взаимодействуя с Н-холинорецепторами концевых пластинок постсинаптических мембран. Они конкурируют за места связывания с ацетилхолином и препятствуют деполяризации клеточных мембран. Если повысить концентрацию ацетилхолина в области Н-холинорецепторов концевой пластинки, то действие миорелаксантов будет ослабляться.
Деполяризующие средства возбуждают Н-холинорецепторы концевой пластинки нервно-мышечного синапса так же, как и ацетил-холин. Они вызывают стойкую деполяризацию мембран, поскольку не подвергаются гидролизу ацетилхолинэстеразой. В действии деполяризующих средств выделяется две фазы. Первая фаза проявляется мышечными сокращениями, вторая - расслаблением поперечнополосатой мускулатуры. Антихолинэстеразные средства усиливают влияние деполяризующих миорелаксантов на нервно-мышечную передачу, так как накопление ацетилхолина в синаптической щели еще больше увеличивает деполяризацию клеточных мембран.
При введении недеполяризующих миорелаксантов (курареподоб-ных средств) расслабление мускулатуры происходит в определенной последовательности. Сначала расслабляются мышцы глаз и век,
затем мимическая и жевательная мускулатура. Далее релаксируются мышцы гортани, глотки, рук и ног, живота. Последними расслабляются мышцы диафрагмы. При этом препараты не вызывают утраты сознания, седативного и обезболивающего действия. Восстановление функции поперечно-полосатой мускулатуры происходит в обратном порядке.
Показания к применению. Миорелаксанты вводят при общей анестезии для выполнения интубации трахеи, расслабления поперечно-полосатой мускулатуры во время ортопедических операций, вмешательств на органах
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
брюшной полости, проведения ИВЛ. При кратковременных вмешательствах средством выбора считают суксаметония хлорид.
НЛР. Недеполяризующие миорелаксанты могут вызывать освобождение гистамина, что ведет к гиперемии кожи, снижению АД, тахикардии, бронхоспазму.
Возможны некоторые вегетативные эффекты: снижение АД (тубо-курарина хлорид®) или его повышение (панкурония бромид®).
Для деполяризующего миорелаксанта - суксаметония хлорида характерны послеоперационные мышечные боли. Редко возникают миоглобинемия, тахикардия, гиперкалиемия, гипертермия, повышается или понижается АД, внутриглазное и внутричерепное давление.
Взаимодействие миорелаксантов с другими ЛС. Действие недеполя-ризующих миорелаксантов усиливают общие анестетики, фентанил, аминогликозидные антибиотики (гентамицин, амикацин), полипептидные антибиотики (полимиксин), клиндамицин, линкомицин, тетрациклины, метронидазол в высоких дозах, диуретики, БАБ, тиамин, хинидин, лидокаин, прокаинамид, препараты солей лития, α-адреноблокаторы, препараты магния.
Эффективность недеполяризующих миорелаксантов ослабляется при длительном предшествующем приеме глюкокортикоидов, фени-тоина, карбамазепина, азатиоприна, теофиллина, норэпинефрина, кальция хлорида. Антагонистами недеполяризующих миорелаксан-тов считают антихолинэстеразные средства.
Растворы недеполяризующих миорелаксантов разрушаются в щелочной среде, например, при смешивании в одном шприце с тиопенталом натрия.
Деполяризующий миорелаксант суксаметония хлорид при его введении с антихолинэстеразными средствами действует гораздо дольше, так как последние, блокируя бутирилхолинэстеразу крови,
подавляют разрушение препарата. Усиливают действие суксаметония хлорида аминазин, циклофосфамид, кетамин, морфин. Повышают длительность нервно-мышечной блокады, вызванной суксаметония хлоридом, следующие препараты: соли магния и лития, амино-гликозиды, полимиксин и клиндамицин, хинидин, прокаинамид, верапамил, БАБ.
27.6. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ СРЕДСТВ ДЛЯ МЕСТНОЙ АНЕСТЕЗИИ
Местные анестетики - препараты, обратимо снижающие возбудимость чувствительных нервных окончаний и блокирующие проведение импульсов в нервных волокнах зоны введения. Их применяют для устранения боли.
Существует клиническая классификация местных анестетиков, в основу которой положена возможность применения препаратов для определенного вида анестезии.
•Средства, применяемые для поверхностной анестезии: кокаин, тетракаин, анестезин, бумекаин.
•Средства, применяемые преимущественно для инфильтрацион-ной и проводниковой анестезии: прокаин, тримекаин, артикаин.
•Средства, применяемые для спинно-мозговой анестезии: бупи-вакаин.
•Средства, применяемые для всех видов анестезии: лидокаин.
Фармакокинетика местных анестетиков. Степень всасывания местных анестетиков зависит от васкуляризации области, в которую их вводят. В хорошо кровоснабжаемых органах проникновение препаратов в системный кровоток велико и можно ожидать резорбтивных эффектов. Более того, сосудорасширяющее действие самих местных анестетиков еще более усиливает их всасывание. Для уменьшения всасывания из места инъекций к растворам местных анестетиков добавляют раствор эпинефрина. Присутствие последнего необходимо учитывать, поскольку у некоторых больных этот препарат (даже в минимальных количествах) может спровоцировать нарушения сердечного ритма.
Местные анестетики производных амидов подвергаются биотрансформации в печени. Эфиры в основном гидролизуются эстера-зами крови и тканей. Метаболиты выводятся почками.
Местные анестетики проникают через плацентарный барьер и могут оказывать токсическое влияние на плод.
Фармакодинамика местных анестетиков. Все местноанестизирую-щие средства состоят из гидрофильной аминогруппы и липофильной ароматической группы. Они представляют собой основания, которые с кислотами образуют растворимые соли. При введении их в ткани со слабощелочной средой (рН7,4) происходит освобождение
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
