

Сначала нужно образовать транскрипционный комплекс. В него входят:
белки, обладающие хеликазной (т. е. «распутывающей нити») активностью; белки, связывающие ТАТА-бокс;
белки, стабилизирующие всю эту машину;
белки, связывающие РНК-полимеразу II с ДНК в области ее промотора; РНК-полимераза II типа (да, у эукариот их три) и белки, которые ее фосфорилируют.
Более того, в этой машине для синтеза РНК есть даже белки, которые обладают репаративной активностью, т. е. во время транскрипции осуществляют эксцизионную репарацию. Эксцизионная репарация — метод устранения структурных нарушений в ДНК (мутаций) путем «вырезания» или так называемой эксцизии участка ДНК, имеющего структурный дефект, и последующей достройки недостающего участка по принципу комплементарности.
В целом все эти белки можно обозвать факторами транскрипции, которым на Западе дали различные буквенные обозначения, но они сейчас нас мало интересуют. Получается здоровая такая бюрократическая машина, но с совсем не бюрократическими целями [1].
Инициация запускается в области промотора, но сама структура промотора не имеет ничего общего с кодирующей областью ДНК и с кодирующим полипептидом соответственно. Запускается она путем множественного фосфорилирования РНКполимеразы двумя участниками транскрипционного тандема.
Элонгация
Удлинение цепи без регистрации и СМС путем простого присоединения нуклеозидтрифосфатов по направлению к 3'-концу. РНК-полимераза II типа на стадии элонгации обладает нереально высокой активностью, которая поддерживается связанными с нею белками (факторами элонгации) [3].
Терминация
Когда весь здоровенный комплекс натыкается на сайты терминации, РНК-полимераза дефосфорилируется и слезает с ДНК, выдавая готовую прематричную РНК. Из нее уже можно получить что-то дельное [8].
Комментарий
У эукариот выделяют три РНК-полимеразы, но главную роль в генной экспрессии действительно играет именно РНК-полимераза II. РНК-полимераза II образует прерибосомные РНК, которые участвуют в образовании рибосом — подпольных фабрик по синтезу белка. РНК-полимераза III участвует в образовании специализированных РНК, функции которых до конца не охарактеризованы [3].
Нюансы и интересные факты
* РНК-полимеразы тоже плачут. Нечасто используемый, но чрезвычайно сильный антибиотик рифампицин (из группы ансамицинов) способен подавлять синтез бактериальных РНК путем связывания с -субъединицей бактериальных РНК-полимераз. В результате ее инактивации не происходит высвобождение промотора при транскрипции (по сути, не начинается транскрипция). Это позволяет использовать рифампицин в самых тяжелых случаях: при стафилококковом остеомиелите, эмпиеме плевры и даже различных формах туберкулеза [8, 9].
Процессинг как промежуточный этап на пути синтеза белка
После образования первичного транскрипта (первичной, или пре-мРНК) происходит ее обработка в виде процессинга. Он включает в себя:
Кэпирование (присоединение 7-метилгуанозина, связанного с 5'-концевым остатком мРНК). Функция этой метки — защита мРНК от рибонуклеаз, а еще он имеет значение для инициации трансляции.
Полиаденилирование — присоединение множества нуклеотидов с аденином на конец пре-мРНК, имеет ту же цель, что и кэпирование — защитить от рибонуклеаз ядра и цитоплазмы (защита недолгая, но какая есть). Полиаденилирование также способствует инициации трансляции: полиаденилированный конец мРНК способствуют правильной взаимной пространственной ориентации малой субъединицы рибосом и мРНК.
Сплайсинг. Это самая интересная часть, которая заключается в вырезании интронов — участков ДНК, не несущих в себе информации. Вновь синтезированная молекула РНК называется первичным транскриптом, и именно она подвергается дальнейшей модификации в виде сплайсинга. Вырезание интронов происходит под действием сплайсосом (кстати, они являются РНК по своей природе). На выходе мы получаем пептид, состоящий только из экзонов: в процессе сплайсинга интроны удаляются из первичного транскрипта, а экзоны соединяются с образованием непрерывной последовательности, которая и соответствует тому или иному функциональному полипептиду (рис. 13) [1, 3, 6, 8].
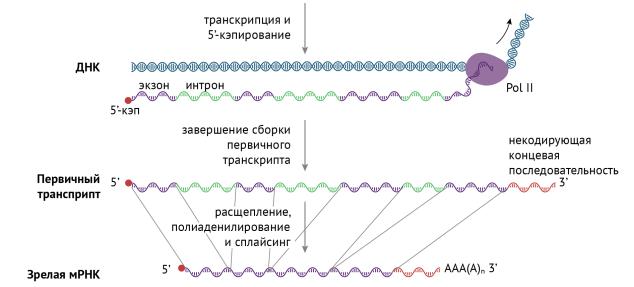
Рисунок 13 | Сплайсинг первичного транскрипта [6]
Наиболее интересно во всей этой истории явление альтернативного сплайсинга. Мы говорили о нем, когда упоминали, что клетка научилась виртуозно жонглировать экзонами и интронами и получать различные полипептиды из ограниченного числа генов. При альтернативном сплайсинге могут «нарезаться» самые разные комбинации экзонов. В итоге на выходе получаются различные белки из одного первичного транскрипта (т. е. из одного гена) [3]. Это очень удобно для клетки.
Как же это происходит? Первичный транскрипт содержит молекулярные сигналы для всех альтернативных путей сплайсинга (т. е. потенциально способен преобразоваться в любой вариант матричной РНК), но предпочтительный в данный момент путь определяется факторами процессинга — РНК-связывающими белками, которые и запускают один конкретный путь сплайсинга. Одним из наиболее ярких примеров альтернативного сплайсинга является образование антител В-лимфоцитами.
Трансляция
Этот процесс сложнее, чем кажется на первый взгляд. Для его осуществления клетке нужно сделать очень много чего.
В первую очередь нужно перевести аминокислоты в такую форму, в которой они смогут участвовать в биосинтезе белка. Для этого к аминокислоте (любой) присоединяются S- KoA группы с последующим добавлением к ней тРНК. Схематично и упрощенно процесс изображен на рис. 14 [6, 8]:
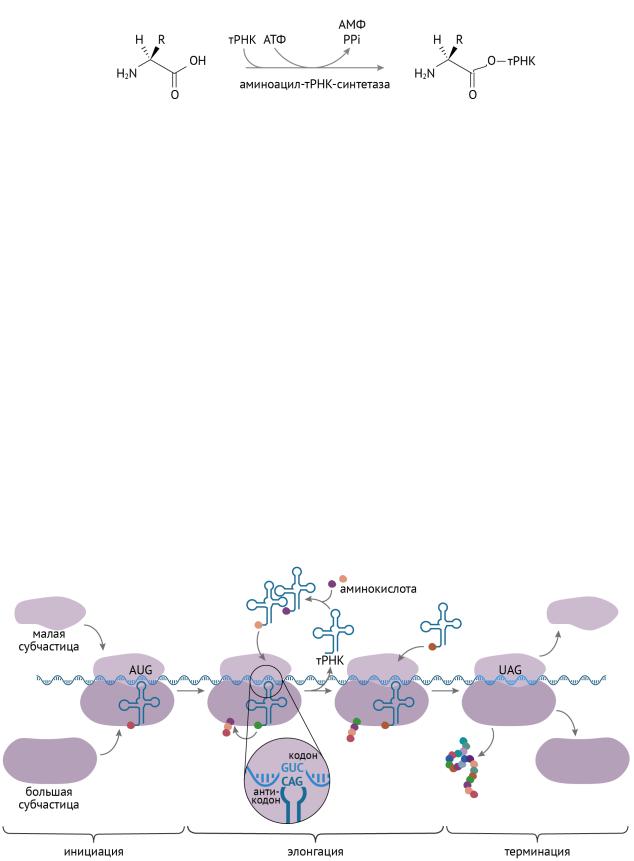
Рисунок 14 | Активация тРНК для ее участия в трансляции
Только в такой форме аминокислоты способны пройти фейсконтроль на входе в рибосомы. Для этого процесса, кстати, нужны ионы магния [1]. Без него машина под названием «аминоацил-тРНК-синтетаза» не работает. В целом весь процесс трансляции (биосинтеза белка) изображен на рис. 15.
Инициация
МРНК, образованная в ядре за счет транскрипции и процессинга, наконец-то попадает на место сходки. И сразу взаимодействует с меньшей субъединицей рибосомы и с активированной аминоацил-тРНК. После присоединения большой субъединицы рибосомы образуется инициаторный комплекс. Важно сказать, что инициаторной кислотой будет являться N-формилметионил- аминоацил-тРНК.
Но и это еще не все. Для инициации трансляции нужна энергия в виде ГТФ и присутствие факторов инициации трансляции [8].
Рисунок 15 | Фазы трансляции
Элонгация
Факторы элонгации, которых в клетке достаточно, осуществляют присоединение вновь прибывающих аминоацил-тРНК к предыдущей молекуле. Здесь, кстати, тоже соблюдается принцип комплементарности (англ. complement — дополнение) между мРНК и тРНК. Примечательно, что элонгация полипептида — это процесс, который требует энергии для осуществления, но ее источником служит не АТФ, а ГТФ. Сложно сказать, с чем связаны эти гастрономические предпочтения клетки [6, 8].
Терминация
Терминация трансляции и высвобождение полипептида осуществляются тогда, когда тРНК натыкается на стоп-кодон. В результате этой встречи рибосома понимает, что никто не вечен, и распадается на субъединицы. А довольный полипептид проходит следующие круги капиталистического синтеза и попадает в ЭПР и комплекс Гольджи, где происходит укладка полипептидов и их посттрансляционный процессинг.
Укладка полипептидов. Посттрансляционный процессинг полипептидов
Для того, чтобы стать полноценными в функциональном отношении белками, полипептиды должны принять третичную (нативную) структуру. Этот этап занимает важное место в жизни белка и называется фолдингом (от англ. folding — укладка). К белкам, помогающим другому белку стать «большим», относятся белки-шапероны, или белки теплового шока.
Сворачивание белка проходит через кинетически предпочтительные стадии, определяемые особенностями первичной структуры (у разных полипептидов они разные). Это значит, что процесс будет протекать тем быстрее, чем меньше энергии необходимо. Цепочка из аминокислот не может просто так взять и превратиться в третичную структуру, это требует затрат энергии, а процесс включает определенные пространственные и химические превращения. Белковой молекуле надо помочь, и делают это белки-шапероны [3, 6]. Проследим механизм их действия по рис. 16.
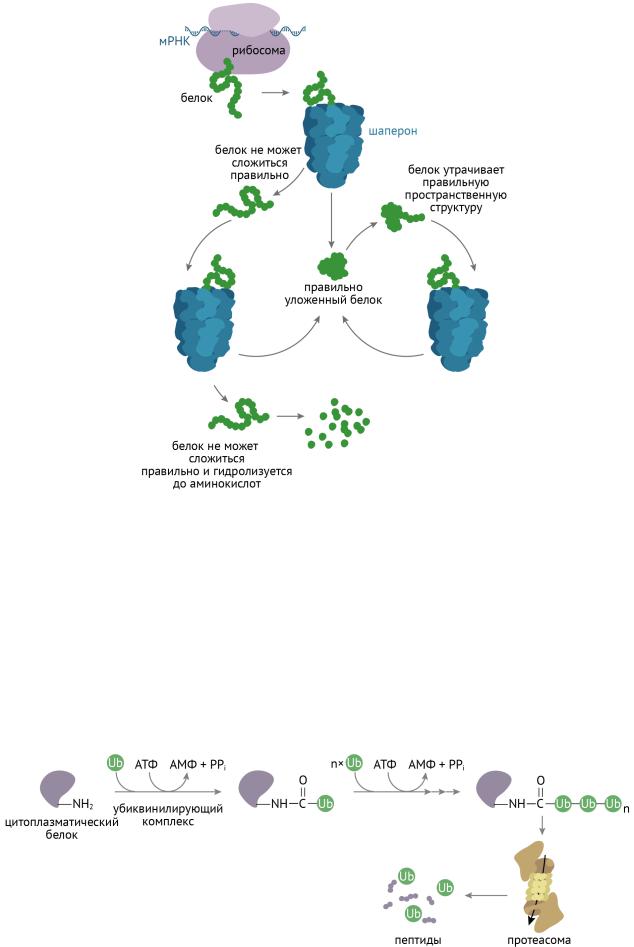
Рисунок 16 | Фолдинг белков
Шапероны предотвращают агрегацию белковых молекул путем защиты от других пептидов и связывания гидрофобных групп. Используя энергию АТФ, шапероны помогают пептиду преодолеть энергетический барьер на пути к формированию нативной белковой молекулы.
Для тех, у кого не получилось стать нормальным белком, клетка предусмотрела механизм убиквитин-протеасомной деградации [2, 6] (рис. 17).
Рисунок 17 | Протеасомная деградация неудачно свернутых пептидов
К неудачному в структурно-функциональном отношении пептиду присоединяется убиквитин под действием убиквитин-активирующего фермента. С этого момента неудачный пептид является прокаженным, ведь он обладает убиквитиновой меткой. Эта метка нужна для протеасом, которые захватывают пептиды и подвергают их гидролизу. Если дефектные белки не уничтожать, то клетка заполнится хламом в виде неудачно свернутого белка (как твоя комната в общаге на второй неделе учебы), в которой невозможно будет осуществлять нормальную жизнедеятельность (ну ты понял) [2, 5, 6].
Но бывают и более благоприятные варианты развития событий. Большая часть белка подвергается другому варианту посттрансляционного процессинга в ЭПР и в комплексе Гольджи. Здесь возможны самые разные варианты химического извращения, например, присоединение глюкозы и ее производных с образованием разнообразных гликопротеидов.
Клинические аспекты биосинтеза макромолекул
Антибактериальные и синтетические противомикробные препараты, угнетающие синтез белка в бактериальных клетках
Биосинтез белка и репликация ДНК, как ты мог догадаться, протекают и в бактериальных клетках, причем достаточно интенсивно. Отдельные представители размножаются со скоростью три деления в час, и это нереально быстро. Размножение бактерий сопряжено с повреждением тканей макроорганизма в месте данного безобразия, что вызывает воспалительную реакцию и становится патологоанатомической основой большинства инфекционных заболеваний бактериальной этиологии. Данные заболевания требуют назначения антибактериальных препаратов, без вариантов. Большинство этих препаратов воздействует на метаболизм белка или нуклеиновых кислот в бактериальных клетках.
Ингибиторы топоизомеразы II типа (ДНК-гиразы IV). Роль данных ферментов ты уже знаешь, но я напомню: ДНК-топоизомераза 2 типа разрывает обе цепи молекулы ДНК и пропускает в образующуюся брешь другой участок молекулы ДНК, что предотвращает спирализацию (скручивание) молекулы ДНК (рис. 7). Есть данные, что отсутствие ДНК-гиразы приводит к пространственному разобщению цепей ДНК в ходе их спирализации.
Для бактериальных клеток фермент имеет колоссальное значение, и при его отсутствии
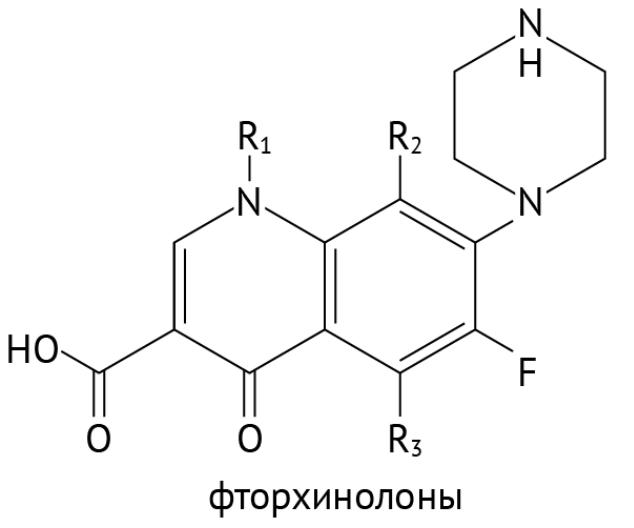
репликация попросту не начнется. Именно поэтому человечество создало препараты, способные угнетать данные ферменты, и это хинолоны/фторхинолоны [3, 6, 9].
Рисунок 18 | Формула фторхинолонов
Препаратов данного класса много, наиболее «ходовые» — ципрофлоксацин, левофлоксацин, норфлоксацин, моксифлоксацин. Общим для них является достаточно широкий спектр действия, но они не действуют на анаэробные бактерии, листерии (факультативный анаэроб), спирохеты (к ним относится возбудитель сифилиса Treponema pallidum), на микобактерии (среди них — возбудители лепры и туберкулеза). Хотя стоит заметить, что офлоксацин и ципрофлоксацин проявляют определенную активность и в отношении возбудителей туберкулеза. Препараты обладают серьезными преимуществами: они хорошо проникают в ткани, даже если поступают в организм в таблетированной форме, к ним долго развивается устойчивость бактерий, у них адекватный профиль токсичности. Однако их нельзя применять у детей (только по жизненным показаниям, off-label, через консилиум), поскольку есть данные о негативном влиянии на хрящевые зоны роста [17]. У пожилых на фоне применения фторхинолонов может развиться специфическое осложнение — разрыв ахиллова
сухожилия [18]. В силу широкого распространения антибиотикорезистентности фторхинолоны сейчас являются препаратами резерва и используются преимущественно тогда, когда другие антибактериальные препараты неэффективны.
Примечательно и то, что фторхинолоны не ингибируют топоизомеразы эукариотических клеток в терапевтических дозах. Это делает их сравнительно безопасными, хотя и не означает, что они лишены побочных явлений [9].
Ингибиторы биосинтеза белка бактерий. У бактерий рибосомы отличаются меньшим коэффициентом седиментации (70S vs 80S у эукариотических клеток). Существует ряд препаратов, селективно угнетающих биосинтез белка на бактериальных рибосомах.
Макролиды неравнодушны к пептидилтрансферазному центру 50S-субъединицы рибосом бактерий. Когда молекула макролида связывается с ним, нарушаются процессы транслокации аминокислот (то есть страдает фаза элонгации), и белок не собирается.
Несмотря на то, что биосинтез белка протекает во всех бактериальных клетках, макролиды не обладают достаточно широким спектром противомикробной активности. Он ограничивается преимущественно грамположительной микрофлорой. Но главным достоинством макролидов является их высокая эффективность против внутриклеточных бактерий, паразитирующих в эукариотических клетках. К таким относят микоплазмы и хламидии, в том числе уретральные.
Представители: азитромицин, кларитромицин, рокситромицин, телитромицин, старый как мир эритромицин и прочие. Препараты характеризуются удовлетворительной переносимостью и безопасностью, что обусловливает их широкое применение [3, 9].
Рисунок 19 | Азитромицин
К особенностям макролидов относят их способность создавать высокую концентрацию в очаге воспаления. Макролиды внедряются в макрофаги, которые добираются до очага воспаления (под действием соответствующих хемоаттрактантов) к концу первых суток от повреждения ткани. К другой особенности относят способность макролидов проникать в клетки микоплазм и хламидий. Особо важное значение это имеет для педиатрии: макролиды — практически единственные антибиотики, которыми можно победить респираторный микоплазмоз у детей младшего возраста. Другие эффективные по отношению к микоплазме препараты у детей используются лишь по жизненным показаниям в силу их профиля токсичности.
