29. ВычислитеpH растворахлоридааммониясконцентрациейсоли c NH 4Cl
NH 4Cl
 0 01 моль/л.
0 01 моль/л.
Решение.
NH 4Cl  HOH
HOH  NH 4OH
NH 4OH  HCl
HCl
NH 4  HOH
HOH  NH 4OH
NH 4OH  H
H  (средакислая)
(средакислая)
ДлярасчетаpH растворовсолей, гидролизующихсяпокатиону используетсяформула:
pH 7  1
1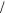 2 lg Kосн 1
2 lg Kосн 1 2 lg cс,
2 lg cс,
где Kосн — константа диссоциации основания (справочная величина); cс — концентрациясоли.
pH 7  1
1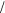 2 lg 1 74 10 5 1
2 lg 1 74 10 5 1 2 lg 1 10 2 5 62
2 lg 1 10 2 5 62
Ответ : pH  5 62.
5 62.
30. К 10 мл 0,1 М раствора формиата натрия прибавили 5 мл 0,05 М раствора соляной кислоты . Обладает ли полученный растворбуфернымдействием?
Решение. Междуреагентамипроисходитвзаимодействие:
HCOONa |
HCl |
HCOOH |
NaCl |
n HCOONa |
cV |
0 1 |
моль л 0 01 л 0 001 моль; |
n HCl 0 |
05 моль |
л 0 |
005 л |
0 00025 моль. |
Изполученныхданныхвидно, чтосолянаякислотаизрасходована полностью, и раствор содержит 0 001 0 00025  0 00075 моль формиатанатрияистолькоже(поуравнению)муравьинойкислоты.
0 00075 моль формиатанатрияистолькоже(поуравнению)муравьинойкислоты.
Таким образом, раствор содержит слабую кислоту и соль, образованную этой слабой кислотой и сильным основанием, что придаетему буферные свойства.
Ответ : данныйрастворобладает буфернымисвойствами.
31. КакизменитсяpH, есликацетатномубуферномураствору, состоящемуиз 100 мл кислоты и 100 мл раствора соли, с концентрацией компонентов по 0,1 моль/л, прибавить 10 мл раствора сконцентрациейгидроксиданатрия 0,1 моль/л? p Ka  4 76.
4 76.



 NH
NH 
 0 01 моль/л.
0 01 моль/л. HOH
HOH  NH
NH  HCl
HCl HOH
HOH  NH
NH  H
H  (средакислая)
(средакислая)
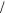


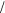

 5 62.
5 62. 0 00075 моль формиатанатрияистолькоже(поуравнению)муравьинойкислоты.
0 00075 моль формиатанатрияистолькоже(поуравнению)муравьинойкислоты. 4 76.
4 76.
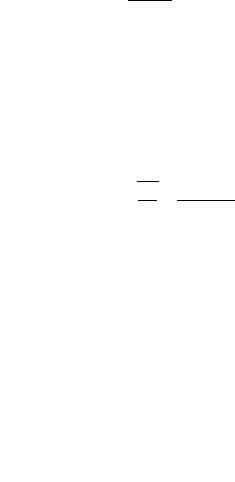







 Al
Al OH
OH 
 .
. Ag
Ag  NH
NH 
 Cl,
Cl,  Pt
Pt  NH
NH 
 Cl.
Cl. Ag
Ag  NH
NH 
 Cl
Cl 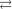
 Ag
Ag  NH
NH 


 Cl — первичнаядиссоциация, распадна внешнююи внутреннююсферы;
Cl — первичнаядиссоциация, распадна внешнююи внутреннююсферы; Ag
Ag  NH
NH 


 Ag
Ag
 2NH
2NH  Pt
Pt  NH
NH 
 Cl
Cl 
 Pt
Pt  NH
NH 


 Cl — первичная диссо-
Cl — первичная диссо- Pt
Pt  NH
NH 


 Pt
Pt 
 3NH
3NH  Cl — вторичная диссоциация;
Cl — вторичная диссоциация;