
с двумя молекулами цАМФ взаимодействует с РНК-полимеразой. Такое взаи-
модействие приводит к инициации транскрипции определенных генов.
Регуляция генов у эукариот
Регуляция генов в эукариотических клетках выполняется по схожей схеме, но она несколько сложнее, чем в прокариотических клетках. Одна из причин за- ключается в том, что типичный эукариотический ген намного больше типичного прокариотического гена. Вторая сложность связана с тем, что многие эукарио- тические клетки являются частью более крупного организма, и поэтому много- функциональны. Несмотря на схожее строение многих белков, клеткам печени необходимо производить белки, отличные по структуре от требующихся сердцу.
Гистоны
У эукариотической ДНК есть группа связанных с ней белков. Эти неболь-
шие, составленные из основных аминокислот белки, называются гистонами. Приблизительно 25% остатков из присутствующих в них аминокислот состав- ляют аргинин либо лизин. Они тесно связаны с ДНК и в сумме обеспечивают приблизительно половину массы хромосомы. Клеточная ДНК и связанный с
ней белок образуют комплекс, называемый хроматином, который включает 5 важных гистонов: HI, Н2А, Н2В, НЗ и Н4 (последние четыре взаимосвязаны
друг с другом).
Хроматин, по всей видимости, состоит из повторяющихся единиц, каждая из которых включает по две копии Н2А, Н2В, НЗ и Н4, а также примерно 200 пар оснований нити ДНК, плотно обернутых вокруг октамера гистонов. Ка- ждая из таких повторяющихся единиц называется нуклеосомой. Заворачивание ДНК в нуклеосому позволяет значительно уплотнить ее структуру. Детальные исследования показывают, что около 145 из 200 пар оснований связаны с ги- стоновым октамером, а остальные пары оснований образуют линкерную ДНК,
которая связывает октамеры гистонов между собой. Гистон Н1 сразу связыва-
ется с линкерной ДНК.
Восемь гистонов в октамерном гистоне скомпонованы в тетрамер с соста- вом (НЗ)2(Н4)2 8 2 два димера с составом (Н2А)(Н2В). У всех гистоновых бел-
ков длинные хвосты, которые богаты остатками аргинина и лизина и выходят
за пределы ядра. Для генной регуляции важное значение имеет возможность изменения таких хвостов.
Хроматин выступает важным фактором генной регуляции у эукариот. Плот-
но упакованная структура хроматина должна быть открыта, для того чтобы
ген был доступен для запуска механизма транскрипции. Кроме того, хроматин
контролирует доступ к регулирующим участкам ДНК. Гены-усилители нару- шают целостность этой структуры, что объясняет их влияние на экспрессию
332 ЧАСТЬ 5 Генетика: почему мы такие, какие есть

не регулирует процесс в одиночку. Такое взаимодействие факторов называется
комбинаторным контролем, который проявляется в многоклеточных организ- мах и отдельных эукариотических клетках.
Некоторые неполярные молекулы, подобные стероидным гормонам, мо-
гут легко проходить через гидрофобную клеточную мембрану и связываться с рецепторными белками. Такие молекулы оказывают специфичное действие. Одним из примеров стероидных гормонов является эстроген (рис. 16.13). По- добные ему соединения получили название лиганд.
он
Рис. 16.13. Структура эстрогена
Лиганд связывается с определенным местом, называемым лиганд-связываю- щим участком, которое находится рядом с концом рецепторного белка. В этой части белка содержится множество неполярных остатков, функционально сходных с гидрофобными молекулами. Большинство стероидов связываются с ядерными гормональными рецепторами. В таком случае в участке связыва- ния ДНК рядом с белковым центром содержится восемь остатков цистеина, необходимых для связывания ионов цинка — по четыре остатка на каждый ион. Ионы цинка стабилизируют структуру и дают такому участку название до-
мена цинкового пальца (поблизости находятся другие остатки цистеина и ионы
цинка). Присоединение молекулы к лиганд-связывающему участку приводит к значительной структурной реорганизации белка. Процесс может показаться по- хожим на транскрипционную регуляцию с помощью 1ас-репрессоров в прокари- отических клетках, но детальные исследования показывают, что это не так.
Следующими в действие вступают мелкие белки, называемые коактивато-
рами. Рядом с центром каждого из них находятся три области, включающие структуры Leu-X-X-Leu-Leu. Каждая из таких областей генерирует короткую гидрофобную а-спираль. Три такие спирали связываются с гидрофобной ча- стью лиганд-связывающего участка. Присутствие лиганда по всей видимости усиливает действие коактиватора. (Рецепторный белок может действовать как репрессор, особенно в присутствии корепрессора.)
334 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Какую роль играют коактиваторы и корепрессоры? Скорее всего их эффек- тивность связана со способностью образовывать ковалентные связи с хвоста- ми гистонов. Гистонацетилтрансферазы (ГАТ) катализируют такое изменение хвостов гистонов (в противоположность ферментам гистондеацетилазам; см.
рис. 16.14). В результате амид с выраженной полярностью (положительно за- ряженный лизин) изменяется на менее полярный (нейтральный) амид, что зна- чительно снижает взаимодействие хвоста с ассоциированной ДНК. В меньшей степени в этом процессе снижается взаимодействие всего гистона с ассоцииро-
ванной ДНК, что позволяет запустить ее частичную транскрипцию.
н о
NH-C |
О- |
СоА |
|
|
+ |
/о |
|
||
сн2 |
/ NH3+ |
S |
|
|
" сн- сн - сн2 |
|
сн |
|
|
|
|
|
, |
|
|
|
ГАТ |
|
|
|
о |
' ' |
|
|
|
|
|
|
|
NH-C |
С О" |
о |
СоА |
S |
|
|
+ |
||
СН2 |
/ NH-C |
|
\н |
|
4 |
сн- сн- сн2 |
сн3 |
|
н+ |
|
|
+ |
|
|
Рис. 16.14. Реакция, катализированная гистонацетилтрансферазой (ГАТ)
Остатки ацетилированного лизина также оказывают влияние на ацетилли-
зин-связывающий домен (Iбромодомен), который присутствует во многих регу-
ляторных белках, принимающих участие в транскрипции в эукариотической
клетке.
Есть два важных белка, содержащих бромодомен. Один из них представлен целым комплексом из десяти факторов, которые присоединяются к белку, свя- зывающему ТАТА-блоки, и отвечают за транскрипцию многих генов. Другие белки, содержащие бромодомены, входят в состав крупных комплексов, из-
вестных как факторы реконструирования хроматина. Как следует из назва-
ния, эти белки изменяют структуру хроматинов, тем самым перенастраивая их
функции.
Все рассмотренные вышек факторы влияют на доступность отдельных частей ДНК для транскрипции. После раскрывания ДНК в силу вступают про- цессы, рассмотренные ранее в этой главе.
ГЛАВА 16 Расшифруй это! Транскрипция РНК 335
Глава 17
Трансляция:
синтез белков
»Принципы трансляции в прокариотических клетках
»Основы синтеза белков
»Особенности трансляции в эукариотических клетках
Яр|филологии термином “ трансляция” обозначается перевод текста с одно- jMj|го языка на другой. В биохимии этот термин применяется для описания сходных процессов. В этой главе нам предстоит рассмотреть процесс
трансляции и понять его место в синтезе белков.
Трудности перевода
В биохимической трансляции четырехбуквенный алфавит, применяемый
для обозначения нуклеиновых кислот, переводится в двадцатибуквенный ал-
фавит описания белков — именно так передается генетическая информация
на клеточном уровне. Трансляция происходит в рибосомах клетки, которые
содержат рибосомную РНК (рРНК). Информация, необходимая для трансля-
ции, передается из ядра клетки в рибосомы с помощью информационной РНК
(иРНК). Информационная РНК связывается с рибосомой меньшего размера,
а транспортная РНК (тРНК) переносит аминокислоты к иРНК.
Зачем нужна трансляция
Целью трансляции является сбор строго заданного набора аминокислот в определенном порядке для получения специфического белка (“ специфиче-
ского” означает обладающего специальными функциями). В этом процессе информационная РНК выступает шаблоном или программой действий. Для выполнения такой программы нужно как-то переместить аминокислоты к иРНК — задача, рассчитанная на транспортную РНК.
У транспортной РНК есть два важных участка. Один из них предназначен
для прикрепления определенной аминокислоты. Например, только один спец-
ифический вид тРНК переносит аминокислоту метионин. Другой участок, на-
зываемый участком распознавания, содержит антикодон, представляющий последовательность из трех оснований, комплементарных к кодону в иРНК.
Последовательность АУГ кодона в иРНК совпадает с последовательностью УАЦ антикодона в тРНК. Все действия происходят в рибосоме — месте син-
теза рРНК.
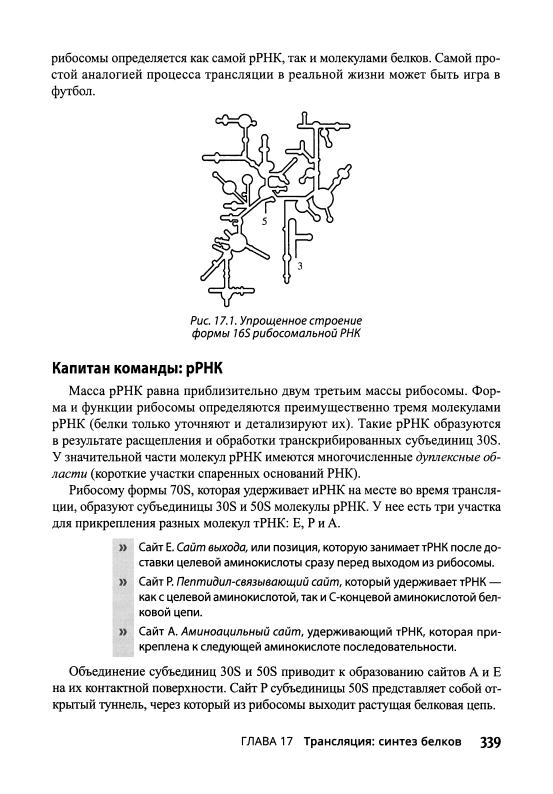
Все вместе: рибосома
Рибосома — это фабрика по производству белков. Даже в самых простых клетках содержатся тысячи рибосом. Это сложные единицы, состоящие из РНК и белка. У прокариот рибосому можно разделить на две отдельные части
или субъединицы. Одна, большая субъединица называется 50S, а вторая, мень- шая — 30S. В большой субъединице рибосомы содержится 34 различных бел- ка, обозначенных последовательностью названий от L1 до L34, и две молекулы РНК — 23S и 5S. Маленькая субъединица включает 21 белка, обозначенных
последовательностью названий от S1 до S21, и молекулу РНК — 16S.
Прокариотическая рибосома содержит три формы молекулы рРНК (23S,
16S и 5S), один набор белков S1-S21 (21 белок), один набор белков L1-L34 (34 белка) и по две копии белков L7 и L12. В общем случае у белка L7 такая же структура, как и у белка L12, за исключением ацетилированной N-концевой
аминогруппы. Также идентичны белки S20 и L26. Смешивание всех компонен-
тов in vitro приводит к воссозданию обеих субъединиц. В качестве примера на
рис. 17.1 приведена структура формы 16S рибосомальной РНК.
Участники трансляции
Для образования молекулы белка необходимо скоординированное взаимо-
действие ряда участников процесса с рРНК. Кроме того, важную роль в кон- троле за синтезом белка играет структура рибосомы. В свою очередь структура
338 ЧАСТЬ 5 Генетика: почему мы такие, какие есть
Перехват инициативы:иРНК
Последовательность оснований в иРНК считывается в направлении 5 — 3;
транскрипция происходит в этом же направлении. (Этим вызван запуск транс- ляции еще до окончания процесса транскрипции у прокариот. В эукариоти- ческих клетках такое невозможно из-за физического разделения процессов транскрипции и трансляции.) Перед тем, как выйти из ядра для перехода в ри- босому, полученная в результате транскрипции иРНК приобретает “ колпачок” и поли(А)хвост (см. глава 16).
Трансляция не начинается автоматически с пятого конца иРНК. Запуск трансляции, как и ее завершение, начинается по специальному коду. Конец 5 образует комплементарные пары оснований с концом 3 формы 16S молекулы рРНК. Обычно длина такой области равна 30 нуклеотидам (эта ее часть, бога-
тая пурином, называется последовательностью Шайна-Далъгарно).
Стартовый код размещается сразу после последовательности Шайна-Даль-
гарно. В большинстве случаев стартовый код представлен кодоном АУГ (мети-
онин), но в некоторых случаях он может выражаться последовательность ГУГ
(валин). В Е. coli стартовой аминокислотой является формилметионин (обычно удаляется вскоре после начала трансляции), а не метионин. У прокариотиче- ских клеток больше одного стартового и стоп-кода, поскольку многие молеку-
лы иРНК обладают полигенными или полицистронными функциями, позволяя образовывать больше одного белка. На рис. 17.2 показаны структуры метиони- на и формилметионина, присоединенных к тРНК.
о о о
H2N сн-с— о |
н |
/с N сн— С О |
|||
сн2 |
тРНК |
н сн2 |
тРНК |
||
|
|||||
сн2 |
|
|
сн2 |
|
|
S |
|
|
S |
|
|
, |
|
|
, |
|
|
сн |
|
|
сн |
|
|
Метионин |
|
|
Формилметионин |
||
Рис. 17.2. Структуры метионина и формилметионина,
присоединенных к тРНК
Игра в разгаре:тРНК
У всех форм тРНК есть несколько общих характерных черт. Каждая форма тРНК — это однонитиевая молекула, содержащая от 73 до 93 нуклеотидов.
ЗДО ЧАСТЬ 5 Генетика: почему мы такие, какие есть
В одной молекуле тРНК содержится от 7 до 15 нехарактерных (отличных от стандартных А, Ц, Г или У) оснований. Примерно у половины присутству- ющих нуклеотидов есть парные основания. К гидроксильной группе конца 3 нити присоединена активированная аминокислота. На аденозиновом остатке сегмента ЦЦА находится гидроксильная группа. Конец 5 нити подвергается фосфорилированию, которое обычно обозначается как рГ (фосфорилирован- ное основание Г). Антикодон содержится в петле вблизи центра молекулы, форма которой напоминает клеверный лист.
Многие из нехарактерных оснований представляют собой метилированные или диметилированные формы А, Ц, Г и У, обычно возникающие при изме- нении молекул в процессе транскрипции. Метальные группы препятствует
образованию некоторых пар оснований, что предохраняет молекулу от опре- деленных взаимодействий. Их неполярная природа делает области тРНК ги-
дрофобными, что оказывает непосредственное влияние на способность к вза-
имодействию метальных групп с рибосомальными белками. К нехарактерным основаниям относят такие соединения: дигидроуридин, диметилгуанозин, ино- зин, метилгуанозин, метилинозин, псевдоуридин, риботимидин. Инозин, по- казанный на рис. 17.3, является частью антикодона. Многие из нехарактерных оснований размещаются рядом или на изгибах структуры тРНК.
|
|
о |
N |
с |
sIH |
нс/ |
с |
:н |
N |
||
но |
|
N |
|
|
9Н2 О
iIVfОНй онI Н
Рис. 17.3.Структура инозина
В пяти областях, показанных на рис. 17.4, комплементарно-связанные пар- ные основания отсутствуют. (Заметьте, что структура, показанная на рис. 17.4,
не отражает реальное трехмерное строение молекулы тРНК.) Начиная с конца 5 к неспаренным участкам относятся: петля ДГУ, петля антикодона, дополнитель-
ная петля, псевдоуридиновая петля и ЦЦА конца 3. (Петля ДГУ получила на-
звание благодаря наличию нескольких остатков дигидроуридина; петля антико-
дона содержит сегмент, который распознает кодон в иРНК; в дополнительной петле содержится переменное количество остатков; псевдоуридиновая петля
ГЛАВА 17 Трансляция: синтез белков 341
