
- •ФГБОУ ВО УГМУ Минздрава России
- •План:
- ••«Гниение» белков в кишечнике. Роль УДФ- глюкуроновой кислоты и ФАФС в процессах обезвреживания
- •Белки - высокомолекулярные органические соединения, состоящие из остатков более 100 аминокислот (20 видов),
- •Элементарный состав белков:
- •Структуры белка
- •Первичная структура белков
- •Доказательства наличия пептидной связи в белках
- •Биуретовая реакция
- •Вторичная структура белка
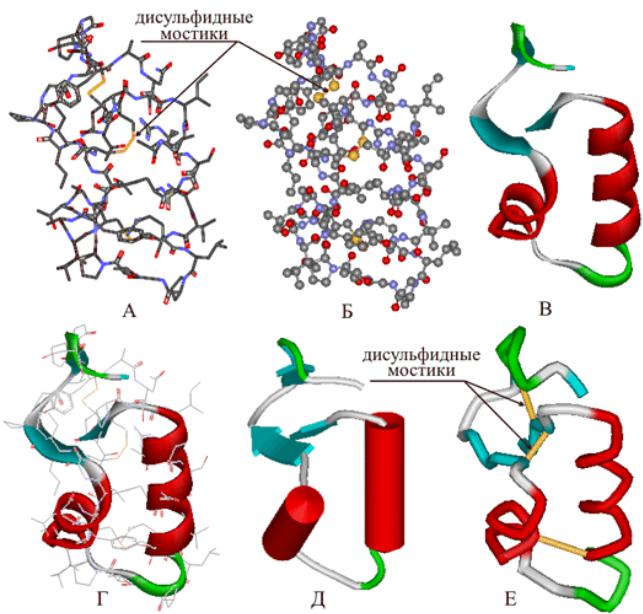
- •Третичная структура белка
- •а. Ковалентная б. Ионная в. Водородная
- •Четвертичная структура белка
- •Свойства белков
- •Денатурация – негидролитическое изменение структуры белка, приводящие к изменению его нативных свойств
- •Факторы денатурации:
- •Гидролиз - разрушение первичной структуры белка
- •Свойства белков в растворе
- •Белки – амфотерные вещества
- •Зависит от:
- •Функции белков в организме
- •Классификация белков
- •ПРИНЦИПЫ НОРМИРОВАНИЯ БЕЛКА В ПИТАНИИ
- •Азотистый баланс – разница между количеством азота, поступающего с пищей и количеством выделяемого
- •Нормы белка в питании
- •Питательная ценность белка зависит от:
- •Примеры неполноценных белков
- •Пищевой белок
- •Белковая недостаточность
- •Одним из самых ярких примеров является заболевание квашиоркор, что в переводе с Ганского
- •Ареал – развивающиеся страны (Гана)
- •Поздние симптомы:
- •ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖКТ
- •Протеолитические ферменты ЖКТ
- •Специфичность протеиназ ЖКТ
- •ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖЕЛУДКЕ
- •Состав желудочного сока
- •муцин
- •Белки желудка
- •Активация пепсинов желудочного сока
- •Механизм образования соляной кислоты
- •Функции НСl:
- •Виды кислотности
- ••Желудочная ахилия - отсутствие стимулированной (гистамином) секреции НСl и пепсина в желудочном соке.
- •ПЕРЕВАРИВАНИЕ БЕЛКОВ В КИШЕЧНИКЕ
- •Протеолитические ферменты
- •Схема активации ферментов панкреатического сока
- •Кишечный сок
- •Ферменты кишечного сока
- •Схема регуляции секреции пищеварительных соков
- •ВСАСЫВАНИЕ АМИНОКИСЛОТ В КИШЕЧНИКЕ
- •Существуют 2 основных механизма переноса аминокислот: симпорт с натрием и γ-глутамильный цикл.
- •2. γ-Глутамильный цикл.
- •Пути использования всосавшихся аминокислот
- •ГНИЕНИЕ
- •До индола, скатола, NH3,H2S осуществляют гниение
- •Этапы гниения
- •Анаэробное разложение белков представителями рода Clostridium
- •Катаболизм тирозина под действием бактерий.
- •Обезвреживание продуктов гниения в печени
- •Катаболизм триптофана под действием бактерий
- •Обезвреживание продуктов гниения
- •СПАСИБО ЗА ВНИМАНИЕ!
- •Регуляция образования соляной кислоты
Третичная структура белка
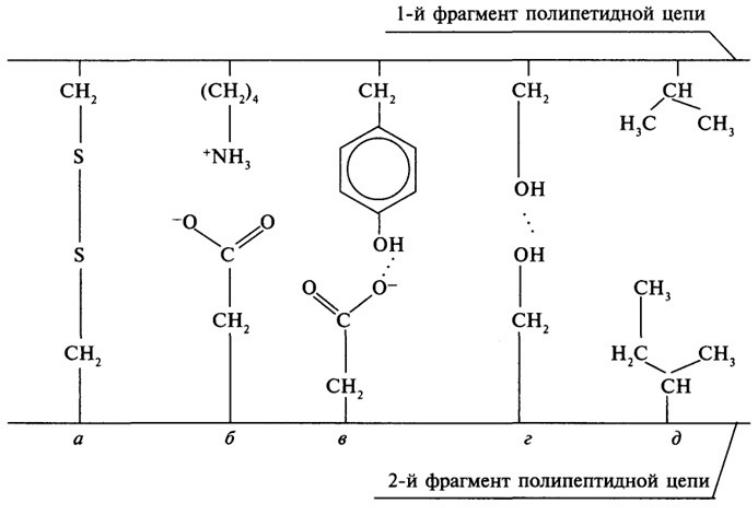
а. Ковалентная б. Ионная в. Водородная
г. Водородная д. Гидрофобная
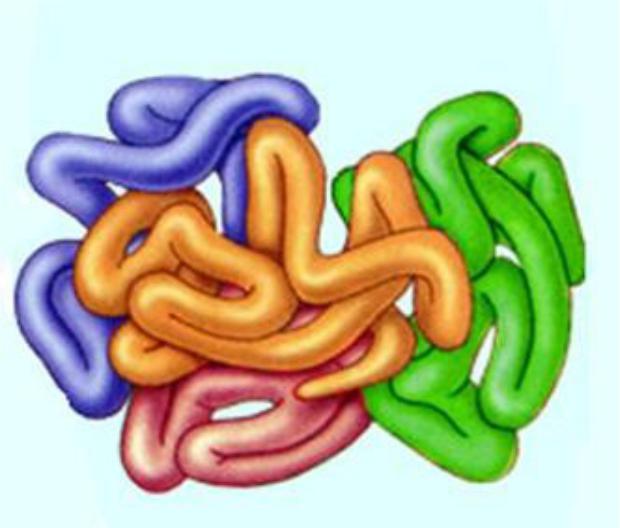
Четвертичная структура белка
Есть только у 5% белков
Свойства белков

Денатурация – негидролитическое изменение структуры белка, приводящие к изменению его нативных свойств
Нативный белок – белок с исходной структурой и проявляющий физиологическую биологическую активность.
Денатурация связана с:
•Разрушением вторичной, третичной и четвертичной структуры белка.
•Изменением химического состава белка
(Присоединение к белку тяжелых металлов, гликозилирование и др.)
Денатурация
Обратимая Необратимая
Факторы денатурации:
•Физические (t, давление, УЗ)
•Химические (кислоты, щелочи, тяжелые металлы)
•Биологические (протеолитические ферменты)
Признаки денатурации:
•Потеря биологической активности;
•Изменение конформации белковой молекулы;
•Увеличение числа функциональных групп (появляются гидрофобные);
•Уменьшение растворимости и осаждение;
•Изменение вязкости, оптической активности, прозрачности растворов белка;
•Изменение окрашиваемости (гистология);
•Большая доступность действию протеолитических ферментов.
Гидролиз - разрушение первичной структуры белка
1.Идет в кислой среде: 6 моль/л НСl при температуре около 110 °С в течение 24 ч. Сопровождается Глн→Глу, Асн →Асп, Цис →Цистин разрушаются Три, Сер и Тре.
2.Идет в щелочной среде: NaOH при кипячении.
Сопровождается рацемизации большинства АК и разрушением Сер, Тре, Арг, Цис.
3.С участием ферментов при небольших температурах: пепсин, трипсин, химотрепсин и др.
|
|
NH +–CH–CO–NH–CH–CO–NH–CH– |
|
|||||||
|
|
3 |
|
|
|
|
|
|
COОН |
|
|
|
|
|
|
|
|
|
|
||
|
|
| |
|
|
| |
|
|
| |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
||||
Н2О |
R1 |
|
R2 |
R3 |
|
|||||
Н2О |
|
|
|
|
|
Н2О |
|
|||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
+ |
ОН |
|
NH |
+ |
–CH–COОН |
+ |
ОН |
|||
NH3 |
–CH–CO |
|
|
NH3 |
–CH–CO |
|||||
|
| |
3 |
|
| |
|
|
| |
|||
|
|
|
|
|
|
|||||
|
R1 |
|
|
|
|
|
R2 |
|
R3 |
|
Свойства белков в растворе
•Образуют коллоидный раствор
•Не проходят через полупроницаемые мембраны
•Опалесцируют
•Рассеивают свет
•Способны к набуханию
•Характеризуются высокой вязкостью
•Обладают низким Росм и высоким Ронк
•Поглощают УФ λ=280 нм
Белки – амфотерные вещества
NH3+–CH–CO–NH–CH–CO–NH–CH–CO–NH–CH–CO–NH–CH–CO– NH–CH–COO–
| |
| |
| |
| |
| |
| |
R1 |
R2 |
R3 |
R4 |
R5 |
R6 |
Знак и величина заряда белка зависят от:
•аминокислотного состава (кислые АК: Асп, Глу, основные: арг, лиз). Белки бывают кислые (5,5<рН), нейтральные (5,5-6,3рН) и основные (6,3>рН).
•особенностей структуры
•Величины рН среды:
СОО– |
|
– |
Белок-СНСОО |
– |
+ |
СООH |
||
Белок-СН |
NH2 |
OH |
|
|
Н |
Белок- |
||
|
|
|
NH3+ |
|
СН |
NH3+ |
||
Щелочная среда (-) |
|
|
Изоэлектрическая |
|
Кислаясреда (+) |
|||
|
|
|
|
точка (0) |
|
|
|
|
Зависит от: |
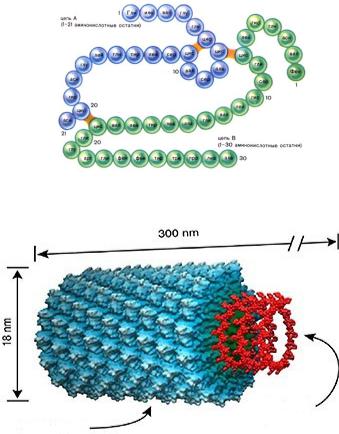
Молекулярная масса белков |
|
-Особенностей первичной структуры;
-Наличия четверичной структуры;
-Массы небелковой части (простой белок или сложный)
Молекулярные массы некоторых белков:
Инсулин |
5 733 |
Миоглобин |
17 600 |
Пепсин |
35 000 |
Альбумин яичный |
46 000 |
Гемоглобин |
68 000 |
γ – глобулин |
160 000 |
Каталаза |
250 000 |
Фибриноген |
450 000 |
Глутаматдегидрогеназа |
1 000 000 |
Вирус табачной мозайки |
40 000 000 |
