
- •4 Пространственная изомерия, конфигурация и конформация.
- •5. Ассимметрический атом углерода как центр хиральности. Стереоизомерия молекул с одним центром хиральности. Оптическая активность.
- •7. Электронное строение атома углерода. Типы гибридизаций атомных орбиталей.
- •8. Сопряженные системы с открытой и замкнутой цепью на примерах бутадиента 1,3 и бензола.
- •9. Ароматичность. Критерии ароматичности.
- •10. Электронные эффекты заместителей: индуктивный и мезомерный. Электродонорные и электроакцепторные заместители и их влияние на реакционную способность соединений.
- •11. Гомо/гетеролитические разрывы ковалентной связы в органических соединениях, образующиеся при этом частицы.
- •12. Радикальные, электрофильные, нуклеофильные реагенты, классификация хим реакций по типу реагента.
- •13. Классификация хим реакций по результату: замещенеие, присоединение, элиминирование, перегруппировка, овр
- •14. Кислоты и основания по бренстеду, их классификация.
- •15. Влияние различных факторов на кислотные и основные свойства веществ. Примеры.
- •16. Спирты и фенолы. Многоатомные спирты.
- •17. Химические свойства спиртов и фенолов.
- •19. Классификации карбоновых кислот по основности, насыщенности, наличию функциональной группы, числу атомов углерода в цепи.
- •20. Химические свойства карбоновых кислот с участием карбоксильной группы: декарбоксилирование, образование солей, амидов, ангидридов, галогенгидридов, сложных эфиров.
- •21. Высшие жирные карбоновые кислоты: классификация, номенклатура, структура, физические свойства.
- •22.Дикарбоновые кислоты: щавелевая, малоновая, янтарная, глутаровая, фумаровая. Их роль в организме. Соли щавелевой кислоты - оксалаты.
- •23. Оксо- гидроксикарбоновые кислоты: пировиноградная и молочная, яблочная и щавелевая, лимонная, ацетоуксусная и β-гидроксимасляная, α-кетоглутаровая, функции в организме.
- •24. Общее представление о липидах, классификация липидов.
- •25. Простые липиды: таг, состав, номенклатура, свойства, гидролиз таг, биологическая роль.
- •27. Соединения стеройдной группы: холестерин, желчные кислоты, представление о химическом строении и биологической роли.
- •28. Углеводы, классификация углеводов, функции углеводов в организме.
- •29. Классификация и химические свойства моносахаридов, (см выше) овр моносахаридов.
- •30. Стереоизомерия моносахаридов d- и l- ряды, открытые и циклические формулы (фишера, колли-толленса, хеуорса), пиранозы и фуранозы, α и β аномеры, циклоцепная таутомерия, явление мутаротации.
- •33. Классификация полисахаридов, функции в организме.
- •34. Дисахариды, структура и свойства основных биологически важных дисахаридов: мальтозы, лактозы, сахарозы, целлобиозы.
- •35. Гомополисахариды: крахмал (амилоза и амилопектин), гликоген, целлюлоза, строение, свойства, биологическая роль.
- •36. Гетерополисахариды, гиалуроновая кислота, хондроитинсульфаты, строение, биологическая роль.
- •37. Азотистые основания пиримидиновые (тимин, урацил, цитозин) и пуриновые (аденин, гуанин), строение, лактим-лактамная таутомерия.
- •38. Нуклеозиды, строение, номенклатура, гидролиз, характер связи нуклеинового основания с углеводным остатком.
- •39. Нуклеотиды, строение, номенклатура, гидролиз, характер связей между компонентами нуклеотида.
- •40. Свободные нуклеотиды: цамф и цгмф, атф, адф, фад, над, строение, функции в организме.
- •41. Первичная структура нуклеиновых кислот, нуклеотидный состав днк/рнк.
- •42. Понятие о вторичной структуре днк. Комплементарность азотистых оснований, водородные связи в комплементарных парах.
- •43. Аминокислоты, номенклатура, классификация по полярности радикала и пищевой ценности, примеры.
- •44. Стереоизомерия аминокислот.
- •45. Кислотно-основные свойства аминокислот. Биполярные ионы, изоэлектрическая точка.
- •46. Химические свойства аминокислот, биологически важные свойства аминокислот.
- •47. Физиологически активные пептиды, примеры.
- •48. Уровни организации белковой молекулы: первичная структура белка, электронное строение пептидной связи и ее характеристика, зависимость свойств белка от первичной структуры.
- •49. Вторичная структура белков, α-спираль, β-складчатый слой, беспорядочный клубок, связи, стабилизирующие вторичную структуру белка.
- •50. Третичная и четвертичная структуры белков, связи, их стабилизирующие, особенности строения и функционирования олигомерных белков на примере гемоглобина.
- •51. Классификации белков.
- •52. Физико-химические свойства белков, растворимость, ионизация, гидратация, денатурация, ренатурация.
- •56. Классификация сложных белков.
- •57. Гемопротеины, сравнительная характеристика структур и функций миоглобина и гемоглобина.
- •53. Кооперативное связывание кислорода гемоглобином, эффект бора, влияние 2,3-бфг на сродство гемоглобина к кислороду. Эффективность транспорта кислорода регулируется Изменение рН среды
- •Механизм эффекта Бора Кооперативное взаимодействие
7. Электронное строение атома углерода. Типы гибридизаций атомных орбиталей.
8. Сопряженные системы с открытой и замкнутой цепью на примерах бутадиента 1,3 и бензола.
Углерод, входящий в состав органических соединений, проявляет постоянную валентность. На последнем энергетическом уровне атома углерода содержится 4 электрона, два из которых занимают 2s-орбитали, имеющие гантелеподобную форму.При возбуждении один электрон из 2s-орбитали может переходить на одну из вакантных 2р-орбитали. Этот переход требует некоторых энерго. затрат. В результате возбужденный атом углерода имеет 4 неспаренных электрона и его электронная конфигурация выражается формулой 2s12р3.
Типы гибридизации:
sр3-гибридизация (первое валентное состояние углерода): химические связи образуют альфа связи (сигма-связи), форма молекулы в пространстве- тетраэдр.
sр2-гибридизация (второе валентное состояние углерода): присутствует двойная связь
sр-гибридизация (третье валентное состояние углерода): присутствует тройная связь
Сопряжение – это образование в молекуле единого делокализованного электронного облака в результате перекрывания негибридизованных р –орбиталей.
Пи,пи-сопряжение: Деколализованные молекулярные облака принадлежат двум или более пи-связям.
Условия пи,пи-сопряжения:
• кратные связи должны быть разделены ОДНОЙ простой связью
• Максимальное сопряжение достигается, когда обе кратные связи лежат в одной плоскости
• Если по пространственным соображениям две кратные связи не могут лежать в одной плоскости, то сопряжение между ними уменьшается с увеличением угла между плоскостями этих связей
р,пи-сопряжение: сопряжение пи-связи и соседней р-орбитали, содержащей пару электронов: С=С-•Х•
Условия р,пи-сопряжения:
• Атом, несущий свободную электронную пару должен быть отделен от кратной связи одной простой связью
• Наибольшей величины сопряжение достигает, если р-атомное облако перпендикулярно плоскости двойной связи
• Сопряжение невозможно, если р-атомное облако лежит в плоскости двойной связи
• Участие атома С в р,пи-сопряжении с кратной связью возможно только в том случае, еси он превратится в радикал, катион или анион
Сопряжение с открытой цепью (бутадиен):
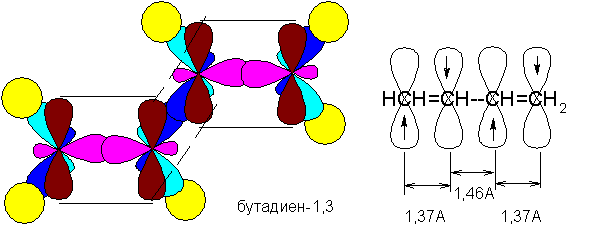
СН2=СН-СН=СН2
Сопряжение
с открытой цепью (бензол):
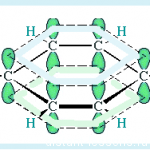 C6H6
C6H6
9. Ароматичность. Критерии ароматичности.
Ароматичность – понятие, характеризующее совокупность особых структурных, энергетических и магнитных свойств, а также особенностей реакционной способности циклических структур с системой сопряженных связей. Ароматичность понимается через совокупность особых признаков (критериев), присущих ряду циклических сопряженных молекул в той или иной мере. Часть этих критериев имеет экспериментальную, наблюдаемую природу, но другая часть основывается на квантовой теории строения молекул.
Для того чтобы молекула могла быть ароматической, она должна содержать хотя бы один цикл, каждый из атомов которого располагает пригодной для образования ароматической системы р-орбиталью. Ароматическим в полном смысле этого слова считается (в случае выполнения критериев, перечисленных ниже) именно этот цикл (кольцо, система колец).
В этом цикле должно быть 4n+2 (то есть 2, 6, 10, 14, 18, 22 и т.п.) p-электронов.
Это правило называется правилом или критерием ароматичности Хюккеля.
Критерии ароматичности:
• Энергетический критерий (повышение термодинамической устойчивости за счет делокализации электронов)из всех самый неудобный и неясный. Никогда нельзя сравнивать разные ароматические системы по величине энергий делокализации – нельзя сделать вывод, что молекула А ароматичнее молекулы В, потому что энергия делокализации больше.
• Структурный – очень важный, если не самый важный, критерий, так как имеет не теоретическую, а экспериментальную природу. Специфика геометрии молекул ароматических соединений заключается в тенденции к копланарному расположению атомов и выравниванию длин связей. Тенденция к копланарности обуславливается выгодностью параллельного расположения осей атомных р-орбиталей для их эффективного перекрывания.
• Магнитный (наличие кольцевого тока – диатропная система, влияние на химические сдвиги протонов снаружи и внутри кольца, примеры – бензол и [18]-аннулен). Самый удобный и доступный критерий, так как для его оценки достаточно спектра 1H ЯМР.
• Химический – склонность к реакциям замещения, а не присоединения. Самый наглядный критерий, ясно различающий химию ароматических соединений от химии полиенов.
Пиридин:
Из трех гибридных орбиталей атома азота две образуют альфа-связи С-N, а третья содержит неподеленную пару электронов, которые не участвуют а пи-электронной системе.
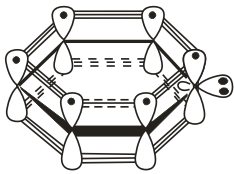 2HC≡CH
+ HC≡N C5H5N.
2HC≡CH
+ HC≡N C5H5N.
• свойство ароматического соединения
• свойства кислоты
Пиррол:
На негибридной р-орбитали азота находится неподеленная пара электронов, которые вступают в сопряжение с четырьмя р-электронами атомов С. В циклической системе сопряжения находится 6 электронов, что определяет ароматические свойства пиррола.
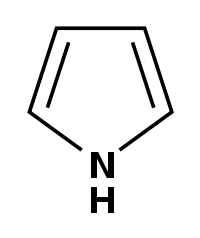
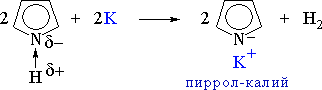
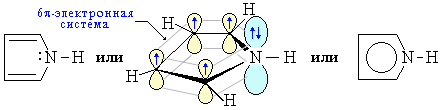
• свойство ароматического соединения
• свойства кислоты
Пиримидин С4Н4N2 – шестичленный гетероцикл с двумя атомами азота.

Проявляет свойства очень слабого основания, т.к. атомы азота в sp2- гибридизованном состоянии довольно прочно удерживают неподеленную электронную пару. Для пиримидина, подобно пиридину, характерна 6∏-электронная ароматическая система. Поэтому его цикл обладает повышенной устойчивостью.
