

MEDACH
Регуляция содержания
Буферные системы крови ионов водорода в жидких средах
физиология Биохимия буферные_системы |
Изогидрическое правило |
||
|
|||
Оформление: Cornu Ammonis |
Регуляция кислотно- |
||
Публикация: 30.06.2020 |
основного состояния в |
||
организме |
|||
|
|||
|
|
|
|
|
|
|
|
Во избежание недопонимания между читателями и автором в начале поста хотелось бы дать ряд определений, которые мы собираемся использовать в дальнейшем.
Первое — это определения кислот и оснований. Здесь стоит сделать оговорку, что существует несколько теорий кислот и оснований, охватывающих все множество кислотно-основных взаимодействий и рассматривающих кислотные и основные свойства с различных позиций для различных условий, но — для буферных систем крови мы воспользуемся протолитической теорией Бренстеда-Лоури, с
разъяснения которой мы и начнем свой рассказ.
Согласно Бренстеду-Лоури, кислоты представляют собой вещества, отдающие протон (ион водорода, или H+), а основания — вещества, присоединяющие протон. Сила кислоты зависит от ее способности отдать протон, а сила основания — от способности протон связать. Например, в растворе серной кислоты происходит следующее:
H2SO4 + H2O H3О+ + HSO4–
Серная кислота (H2SO4) передает протон основанию (H2O), при этом образуется новая кислота (H3О+) и новое основание (HSO4–).
Подобным же образом может происходить реакция между соляной кислотой и аммиаком:
HCl + NH3 NH4+ + Cl–
Соляная кислота (HCl) передает протон основанию (NH3), при этом образуется новая кислота (NH4+) и новое основание (Cl–).
Как было сказано выше, кислоты и основания бывают сильными и слабыми. Например, H2SO4 и HCl представляют собой сильные кислоты, так как они очень легко отдают протон в раствор; таким образом, сильные кислоты диссоциируют быстро и полностью. И наоборот, HSO4– и Cl– являются слабыми основаниями, так как слабо удерживают протон. В описанных выше реакциях равновесие сдвинуто в сторону образования более слабой кислоты (H3О+ и NH4+) и более слабого основания (HSO4– и Cl–) соответственно. Слабые кислоты (например, H2CO3) диссоциируют не полностью, а значит, концентрация протонов в растворах этих кислот будет ниже. Сильные основания (например, OH–) активно взаимодействуют с протонами в растворе, связывая их, а слабые основания (HCO3–) делают это менее активно.
Второе — единица рН — логарифмическая единица, выражающая концентрацию ионов водорода в растворе в эквивалентах на литр; обратно пропорциональна количеству протонов в растворе, т. е. при высоком содержании протонов рН понижается, при низком, соответственно, повышается.
Рассмотрим пример. Пусть есть 0,1 М (читается как децимолярный) раствор соляной кислоты. Попробуем рассчитать для него значение pH. Мы знаем, что pH = –lg[H+]. Соляная кислота является сильной и в водном растворе будет диссоциировать полностью. Значит, количество моль/л, или М, [H+] будет равно [HCl], то есть 0,1 М. Дальше нам нужно просто подставить это значение в формулу:
pH = –lg[0,1] ≈ – (–1) = 1
Таким образом, раствор 0,1 М соляной кислоты имеет pH, равную 1, что соответствует очень кислой среде.
Тут же стоит вспомнить, что нейтральный раствор характеризуется следующей
особенностью — значение концентрации ионов водорода [H+] равно значению концентрации гидроксильных ионов [OH–] = 10–7 моль/л, или pH = pOH = 7,0.
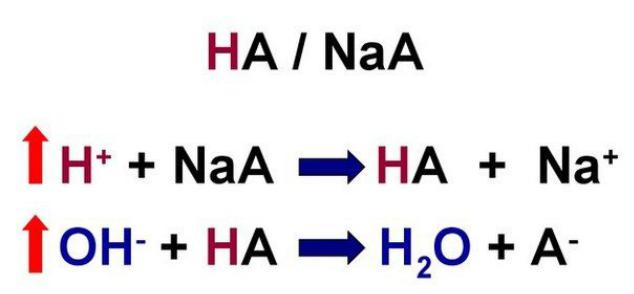
Третье — кислотно-основное равновесие (КОР) — последнее и самое главное. Буферные системы — это системы, состоящие из компонентов (например, слабой кислота и ее соль с сильным основанием или кислотно-основная пара), поддерживающих определенную концентрацию протонов в растворе, то есть определенный pH среды. Кислотность буферных растворов почти не меняется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований. Так, буферная система способна обратимо связывать протон (ион водорода). При связывании ионов водорода в условиях их повышенного количества в растворе получается слабая кислота и соль сильной кислоты, например:
HCl + NaHCO3 NaCl + H2CO3
И наоборот, при защелачивании среды происходит диссоциация вещества, выделяется слабое основание и вода:
H2CO3 + NaOH NaHCO3 + H2O
В обоих случаях буферные системы препятствуют резкому изменению pH. С помощью буферных систем и осуществляется регуляция КОР в организме. Однако, при работе буферной системы один из ее компонентов расходуется и требует восстановления.
Рисунок 1 | Общий вид буферной системы
Значения рН в жидких средах организма в норме:

рН артериальной крови равен 7,4 (изменения КОР, такие как ацидоз и алкалоз, рассматриваются относительно показателя рН в артериальной крови); рН венозной крови и тканевой жидкости — 7,35;
рН внутриклеточной жидкости варьируется от 6,0 до 7,4 в зависимости от клеточного компартмента; рН мочи может меняться в пределах от 4,5 до 8,0 в зависимости от КОР
в жидких средах организма, т. к. почки являются мощным регулятором КОР; наиболее низкий рН (0,8) в желудочном соке, который вырабатывают
обкладочные клетки желудка.
Диапазон патологических значений рН, при которых человек может жить в течение нескольких часов, варьируется от 6,8 до 8,0.
Расстройства кислотно-основного равновесия (КОР) — это нарушения физикохимического гомеостаза. Кислотно-основное равновесие определяется соотношением ионов Н+ и ОН– . От их соотношения зависят активность ферментов, интенсивность метаболических процессов, функции ряда органов, чувствительность рецепторов к медиаторам, проницаемость клеточных мембран. Расстройства КОР сопровождают практически все заболевания. Поэтому так же, как и другие виды нарушений обмена веществ, расстройства КОР относятся к типовым патологическим процессам.
Выделяют 2 типа расстройств КОР: ацидозы и алкалозы.
Ацидоз — это типовой патологический процесс, характеризующийся относительным или абсолютным понижением pH. Алкалоз — это типовой патологический процесс, характеризующийся относительным или абсолютным увеличением pH. Ацидозы и алкалозы могут быть компенсированными, субкомпенсированными и декомпенсированными.
Компенсированные формы связаны с сохранением жизнедеятельности клетки, в то время как некомпенсированные формы вызывают нарушения функции клетки. Показателем компенсации является величина рН артериальной крови. В норме, как уже было сказано выше, рН = 7,4 ± 0,05. Если величина рН снижается до 7,24 или увеличивается до 7,56 (колебания составляют ± 0,16), то можно говорить о развитии субкомпенсированных форм. В том случае, если эта величина превышает ± 0,16, можно говорить о развитии декомпенсированных форм ацидоза или алкалоза. По происхождению ацидозы и алкалозы бывают газовые (дыхательные) и негазовые
(метаболические), которые в свою очередь делятся на подтипы. Наряду с газовыми и негазовыми формами ацидозов и алкалозов встречаются смешанные формы. Кроме того, ацидозы и алкалозы могут быть острыми и хроническими.
Регуляция содержания ионов водорода в жидких средах
Существует три основные системы, регулирующие содержание протонов и препятствующих возникновению ацидоза и алкалоза:
1)Буферные системы организма — моментально регулируют содержание протонов в растворе путем их связывания, но они не способны вывести избыток протонов из организма. Работа буферных систем поддерживает рН крови в пределах 7,35–7,45, а сдвиг рН более чем на 0,4 в любую сторону ведет к гибели. В жидких средах организма существует несколько буферных систем:
— Бикарбонатная буферная система [H2CO3 / HCO3–] является основным буфером крови (до 53 % емкости от всех буферных систем);
— Гемоглобиновый буфер [HHb / Hb–] — до 35 % буферной емкости от всех буферных систем, является внутриклеточным буфером;
— Белковый буфер [HPr / Pr–] — до 7 % буферной емкости от всех буферных систем;
— Фосфатный буфер [H2PO4– / HPO42–] — до 5 % буферной емкости от всех буферных систем; действует преимущественно в костной ткани, моче и внутриклеточной жидкости;
— Аммонийный буфер [NH3 / NH4+] — действует преимущественно в моче.
2)Дыхательная система — регулирует КОР путем выведения избытка СО2, а следовательно и H2CO3, из внеклеточной жидкости.
3)Выделительная система — почки устраняют изменения КОР путем выведения избытка кислот или оснований с мочой; эта система работает гораздо медленнее, чем предыдущие, однако значительно эффективнее.
В первую очередь рассмотрим наиболее мощную систему из выше перечисленных, берущую на себя основную роль в регуляции КОР — бикарбонатную.
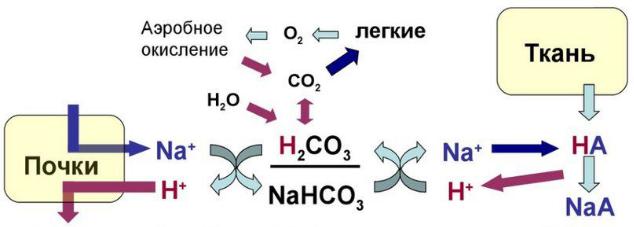
Бикарбонатная буферная система состоит из водного раствора, содержащего слабую угольную кислоту (H2CO3) и слабое основание — бикарбонат-ион (HCO3–), который во внеклеточной жидкости чаще всего находится в виде натриевой соли (NaHCO3). Вначале стоит разобрать такое понятие, как диапазон буферного действия — диапазон pH, в котором будет эффективен данный буфер. Характеризуется величиной pK.
Для бикарбонатного буфера pK будет равно 6,1 ± 1 — это далеко от среднего значения
pH в организме, поэтому мощность бикарбонатного буфера не слишком велика. Тем не менее, бикарбонатный буфер является наиболее эффективной буферной системой. Вопервых, концентрация бикарбоната во внеклеточной жидкости довольно высока, вовторых, оба компонента буферной пары легко контролируются дыхательной (CO2) и мочевыделительной (HCO3–) системами.
Тонкий баланс pH возможен в основном только благодаря способности легких и почек изменять соотношение H2CO3 / NaHCO3 (CO2 / HCO3–). Бикарбонатный буфер является самым чувствительным и связывает до 40 % «лишних» ионов водорода. Он поддерживает pH=7,4. В связи с вышеперечисленными фактами бикарбонатный буфер является индикатором нарушения КОР и определение компонентов этого буфера — основа диагностики нарушения КОР.
Рисунок 2 | Схема работы бикарбонатной буферной системы
При добавлении сильной кислоты в буферный раствор протоны, образовавшиеся при ее диссоциации, нейтрализуются путем взаимодействия с ионом бикарбоната, в результате формируется угольная кислота, которая разлагается на воду и углекислый газ под воздействием фермента карбоангидразы. Избыток углекислого газа, стимулирует барорецепторы в области бифуркации аорты и каротидного синуса, усиливает вентиляцию легких и таким образом выводится из организма. В норме отношение HCO3– / H2CO3 = 20/1. При этом, как уже упоминалось, работа этой системы неразрывно связана с легкими. Рассмотрим реакцию подробней. При поступлении в кровь кислоты более сильной, чем угольная, происходит реакция обмена и образуется новая соль и угольная кислота. В результате благодаря связыванию введенной в систему кислоты концентрация ионов водорода значительно понижается. (А — анион)
NaHCO3 + НА H2CO3 + NaА
Обратная реакция происходит при добавлении к раствору сильного основания: гидроксид-ион взаимодействует с угольной кислотой с выделением иона бикарбоната, в
результате чего концентрация угольной кислоты и, как следствие, углекислого газа в растворе снижается, что тормозит дыхательный центр, снижает вентиляцию легких и задерживает углекислый газ в организме. При этом повышается количество бикарбонат-ионов в плазме крови, что впоследствии компенсируется почками путем выделения их избытка с мочой. Рассмотрим реакцию подробней. При поступлении оснований они реагируют с угольной кислотой в результате чего образуются соль угольной кислоты. (К — катион)
H2CO3 + КОН КHCO3 + Н2О
Содержание компонентов карбонатной буферной системы точно регулируется почками, контролирующими выделение и реабсорбцию бикарбонатов, а также дыхательной системой, регулирующей выделение углекислого газа с дыханием.
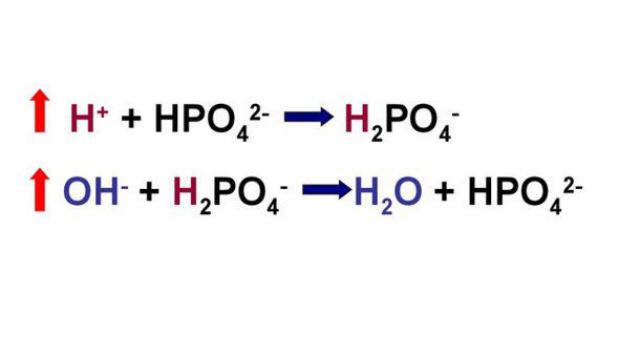
Фосфатная буферная система состоит из водного раствора H2PO4– и HPO42–, преимущественно в форме натриевой соли; имеет небольшое значение для регуляции КОР во внеклеточной жидкости, однако играет основную роль в регуляции его в просветах почечных канальцев (обеспечивает выведение ионов водорода с мочой) и во внутриклеточной среде. Если добавить в этот раствор сильную кислоту, то протоны, образованные при ее диссоциации, будут связываться с HPO42–, преобразуясь в H2PO4–. При добавлении сильного основания гидроксид-анион будет реагировать с H2PO4–, образуя HPO42– и воду. Таким образом, изменения рН в обоих случаях будут незначительными. D В норме соотношение NaH2PО4/Na2HPO4 = 1/4, а в моче
NaH2PО4/Na2HPO4 = 25/1.
Рисунок 3 | Схема работы фосфатной буферной системы
Фосфатная буферная система играет важную роль в регуляции КОР в просвете почечных канальцев в связи с тем, что концентрация фосфатов в канальцах растет. Кроме того рН мочи ниже рН других жидкостей организма и близок к значению константы диссоциации фосфатного буфера (pH = 6,8 = pK для фосфатного буфера), что позволяет ему работать на максимальных мощностях. По тем же причинам фосфатный буфер имеет большое значение в регуляции КОР во внутриклеточной жидкости.
Рассмотрим устройство фосфатной буферной системы подробней. Емкость фосфатной системы составляет около 1–2 % от всей буферной емкости крови и до 50 % буферной емкости мочи. Она образована дигидрофосфатом (NaH2PO4) и гидрофосфатом (Na2HPO4) натрия. Первое соединение (NaH2PO4) слабо диссоциирует и ведет себя как слабая кислота, второе (Na2HPO4) обладает щелочными свойствами. В норме отношение
HРO42– к H2РO4 — равно 4 : 1.
При взаимодействии кислот (ионов водорода) с двузамещенным фосфатом натрия (Na2HPO4) натрий вытесняется, образуется натриевая соль дигидрофосфата (H2PO4–). В результате благодаря связыванию введенной в систему кислоты концентрация ионов водорода значительно понижается. (А — анион)
HРO42– + НА H2PO4–+ А–
При поступлении оснований избыток ОН– групп нейтрализуется имеющимися в среде Н+, а расход ионов Н+ восполняется повышением диссоциации NaH2PO4 (К — катион)
H2PO4– + КОН К+ + HРO42– + Н2О
Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и моче. Как уже было отмечено выше в моче его роль состоит в сбережении бикарбоната натрия за счет дополнительного иона водорода (по сравнению с NaHCO3) в составе выводимого NaH2PO4.
Na2HPO4 + H2CO3 NaH2PO4 + NaHCO3
Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата, т. к. бикарбонат натрия в почечных канальцах реабсорбируется.
Белковая буферная система играет основную роль в регуляции КОР внутри клетки в связи с их богатым содержанием во внутриклеточной жидкости.
Несмотря на разницу между значениями рН внутри клетки и вне ее, колебания
внутриклеточного КОР находится в зависимости от внеклеточного. Компоненты бикарбонатной буферной системы медленно диффундируют через клеточную мембрану. Соответственно работа внутриклеточных буферных систем может оказывать посильную помощь в регуляции внеклеточного КОР, однако занимает этот процесс значительно большее время. Около 60–70 % буферной емкости всего организма приходится на белковые внутриклеточные системы, однако в связи с низкой скоростью переноса компонентов буфера через мембраны, коррекция КОР за счёт них может значительно опаздывать.
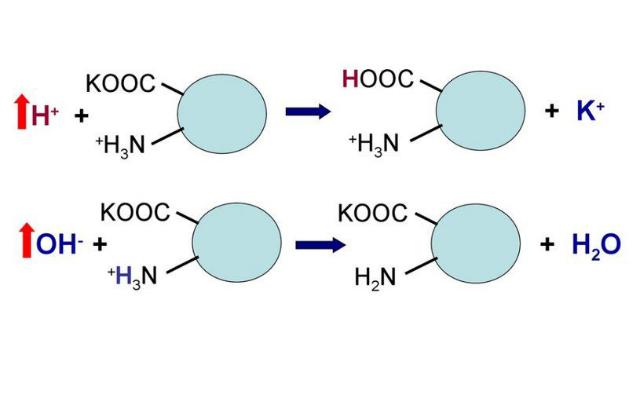
Сама по себе белковая буферная система состоит как из белков внутриклеточных, так и внеклеточных. Белки и их главные структурные компоненты, аминокислоты, являются амфолитами и потому в зависимости от величины pH среды способны принимать или отдавать ион водорода. Таким образом, кислые группы (например, COOH) могут отдавать ион водорода, при повышении pH, а аминогруппы (например, NH2) могут принимать ион водорода при падении pH. Пределы действия белковых кислотноосновных буферных систем ограничиваются количеством групп, способных отдавать или связывать ионы водорода. Жидкости организма, на основе их локализации, можно разделить на внеклеточные и внутриклеточные жидкости.
Рисунок 4 | Схема работы белковой буферной системы
К внеклеточным жидкостям тканей относятся межклеточные жидкости. Разновидностью межклеточных жидкостей является плазма крови. Плазма крови содержит белки, которые могут составляют одну буферных систем крови. Межклеточная
жидкость в тканях содержит волокна внеклеточного белка и растворенные аминокислоты. Все эти компоненты составляют буферную систему межклеточных жидкостей в тканях. Основным белковым буфером в случае крови является гемоглобиновый буфер.
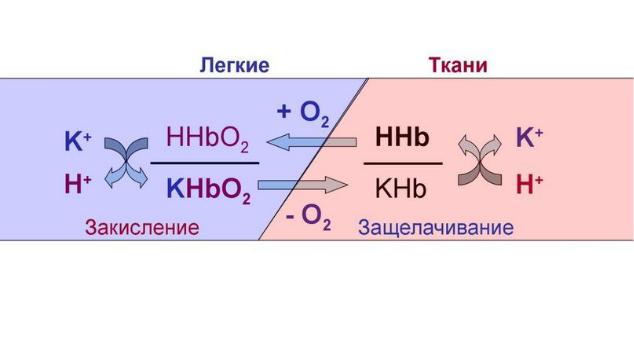
Гемоглобиновый буфер — мощный регулятор КОР; представлен в эритроцитах и плазме крови, с тем отличием, что проникновение компонентов бикарбонатного буфера через мембрану эритроцитов происходит значительно быстрее, чем у других клеток. Эта буферная система включает в себя восстановленный гемоглобин (HHb) и калиевую соль восстановленного гемоглобина (KHb). Так, буферные свойства данной системы обусловлены тем, что калиевая соль гемоглобина является солью слабой кислоты и может обменивать ион калия, К+ на ион водорода, H+, при этом образуется слабодиссоциирующая кислота. Вот так:
H+ + KHb К+ + HHb
Гемоглобин осуществляет буферирование за счет имидазольных групп гистидиновых остатков и имеет pKa = 6,8. Величина pH крови остаётся постоянной благодаря тому, что гемоглобин способен связывать углекислый газ и ионы водорода, тут гемоглобин играет роль основания. В легких находится окисленная форма гемоглобина HHbO2, которая является более сильной кислотой (при этом кислотность HHbO2 в 70 раз выше, чем у HHb), чем угольная кислота (H2CO3), в результате чего подавляется диссоциация последней. HHbO2 отдает свои ионы Н+ в среду, предотвращая повышение рН. В целом если говорить о крови, то ее буферные системы более устойчивы к действию кислот, чем оснований.
