
Полезные материалы за все 6 курсов / Ответы к занятиям, экзаменам / Высокомолекулярные соединения
.pdfВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ (Написано С.Б. Орловым, лето, 2011)
Студент должен знать:
•особенности растворов высокомолекулярных соединений (ВМС), их сходство и различия с растворами низкомолекулярных веществ (НМС);
•особенности вязкости растворов ВМС, способы её измерения, вычисление молекулярных масс полимеров по данным о вязкости растворов;
•явление осмоса в растворах ВМС и в природе;
•характер диссоциации белков;
•что такое изоэлектрическая точка белка;
•механизмы процессов застудневания и способы получения студней;
•свойства студней;
•физический смысл процессов синерезиса и коацервации.
Студент должен уметь:
•вычислять молекулярные массы полимеров по данным об осмотическом давлении растворов ВМС:
•вычислять молекулярные массы полимеров по данным о вязкости растворов ВМС;
•определять изоэлектрическую точку белка.
ВВЕДЕНИЕ
Высокомолекулярные соединения (ВМС) – это химические соединения, молекулы которых имеют высокие молекулярные массы (от нескольких тысяч до многих миллионов). Поэтому такие молекулы называют макромолекулами. Молекулярная масса ВМС составляет 104 – 106 (сравним с молекулярной массой воды, которая равна 18).
Макромолекулы имеют цепное строение; состоят из одинаковых или различных структурных единиц – составных звеньев, представляющих собой атомы или группы атомов, соединённые друг с другом ковалентными связями в линейные последовательности. Последовательность соединённых друг с другом атомов, образующих собственно цепь, называют хребтом цепи, а заместители у этих атомов – боковыми группами. Макромолекулы могут иметь линейное или разветвлённое строение. В разветвлённых макромолекулах различают основную и боковые цепи.
ВМС могут быть синтетическими и природными. К синтетическим ВМС относятся, например, полиэтилен, полиамид, полистирол, фторопласты, феноло-формальдегидные смолы и другие. Большинство синтетических ВМС не растворимы в воде и являются твёрдыми веществами.
Природные полимеры принято называть биополимерами. Биополимеры это природные высокомолекулярные соединения, из которых построены клетки живых организмов, и межклеточное вещество, связывающее их между собой. К биополимерам относятся белки, нуклеиновые кислоты, полисахариды и так называемые смешанные биополимеры. Биополимеры обеспечивают нормальную жизнедеятельность организмов, выполняя различные биологические функции.
Белки могут выполнять в живых организмах самые различные функции: быть катализаторами биохимических реакций (ферменты) и регулировать (гормоны) биохимические реакции; входить в состав соединительной ткани (коллаген) или мышц (актин, миозин); служить резервными питательными веществами (гранулы белка в цитоплазме) и др.
Функции дезоксирибонуклеиновой кислоты – передача генетической информации из поколения в поколение при клеточном делении. Этот биополимер служит исходной матрицей при передаче информации внутри клетки. В этом процессе участвует и рибонуклеиновая кислота, процесс приводит к синтезу специфических белков клетки.
Полисахариды могут служить резервными питательными веществами (например, крахмал, гликоген), выполнять структурные функции (например, целлюлоза, полисахариды соединительной ткани), обеспечивать специфические свойства поверхности клеток (например, антигенные полисахариды микроорганизмов) или защиту организма в целом (например, камеди и слизи растений).
Наиболее распространённым классом биополимеров являются смешанные биополимеры. К этому классу биополимеров относятся соединения, построенные из мономерных звеньев, относящихся к органическим веществам различных типов. Например, гликопротеиды содержат остатки углеводов и аминокислот; липопротеиды – остатки аминокислот, жирных кислот с длинной цепью и полиолов или аминоспиртов; липополисахариды – остатки моносахаридов и липидов и т.д.
Для смешанных биополимеров характерна локализация на поверхности клетки. Они выполняют специфические биологические функции, связанные с процессами межклеточного взаимодействия. Так, способность бактериофагов поражать одни виды бактерий и не взаимодействовать с другими видами определяется специфическим строением поверхностного антитела бактерий, являющегося липосахаридом. От структуры поверхностных антигенов зависит и патогенность тех или иных бактерий. Подобные же взаимодействия с участием смешанных биополимеров происходят, по-видимому, и при других биологических процессах, в которых клетки «узнают» друг друга, например при оплодотворении, соединении клеток в ткани и клеточной дифференцировке.
ЗНАЧЕНИЕ БЕЛКОВ В ПИТАНИИ
Белки – необходимая составная часть продуктов питания. Проблема пищевого белка стоит очень остро. По данным Международной организации по продовольствию и сельскому хозяйству при ООН больше половины человечества не получает с пищей необходимого количества белка. Недостаток белка в пище вызывает тяжелое заболевание – квашиоркор.
В процессе пищеварения белки подвергаются гидролизу до аминокислот, которые всасываются в кровь. Пищевая ценность белков зависит от их аминокислотного состава, содержания в них так называемых незаменимых аминокислот, не синтезирующихся в организмах. Для человека незаменимы следующие кислоты: триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин, фенилаланин. В питательном отношении растительные белки менее ценны, чем животные: они беднее лизином, метионином и триптофаном.
ОБЩАЯ ХАРАКТЕРИСТИКА РАСТВОРОВ ВМС
Высокомолекулярные вещества (или полимеры) растворяются в различных низкомолекулярных жидкостях, образуя устойчивые равновесные системы с молекулярной дисперсностью компонентов. Таким образом, растворы полимеров являются гомогенными системами, истинными растворами. Являясь истинными растворами, растворы ВМС всё же отличаются от растворов низкомолекулярных веществ, что связано с огромными размерами макромолекул. Однако, несмотря на огромные размеры молекул ВМС в растворах отсутствует граница раздела фаз, так как в одном направлении макромолекула имеет достаточно большую длину, а толщина макромолекулы имеет молекулярные размеры.
Кроме того, на поведение растворов полимеров сильное влияние оказывают форма и отдельные фрагменты строения макромолекул.
Растворение ВМС осуществляется с образованием менее упорядоченной системы из более упорядоченной и, значит, этот процесс протекает с увеличением энтропии (∆S > 0). Растворение ВМС – процесс самопроизвольный, следовательно, при растворении полимеров уменьшается свободная энергия: ∆G = ∆H - T∆S < 0.
Изменение энтальпии (знак ∆Н) при растворении может быть положительным (эндотермический процесс), отрицательным (экзотермический процесс) или равным нулю.
Так как растворы полимеров образуются самопроизвольно с уменьшением свободной энергии, они являются термодинамически устойчивыми системами, которые могут существовать без стабилизаторов неограниченное время. В этом заключается их основное отличие от лиофобных коллоидных систем. В отличие от лиофобных коллоидных систем растворы ВМС являются равновеснымим системами.
Растворы ВМС, подобно растворам низкомолекулярных соединений, могут быть и молекулярными, и ионными, причём в последнем случае природа зарядов связана с наличием функциональных групп.
ВЗАИМОДЕЙСТВИЕ ВМС С РАСТВОРИТЕЛЕМ
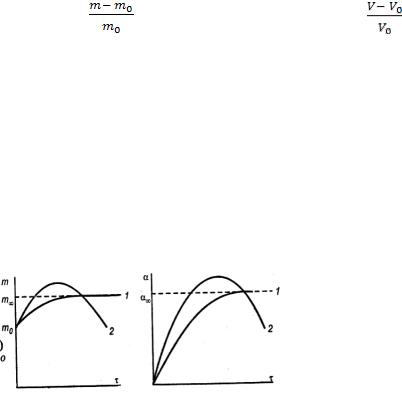
При взаимодействии ВМС с растворителем происходит их набухание. Набуханием полимера называется увеличение его объёма и массы во времени при контакте с растворителем.
При набухании объём и масса полимера могут увеличиться в 10 – 15 раз. Количественной мерой набухания является степень набухания α:
α = |
∙ 100% |
или |
α = |
∙ 100% |
где m0 и V0 – масса и объём сухого полимера; m и V – масса и объём набухшего полимера.
Набухание может быть ограниченным и неограниченным. В случае ограниченного набухания m и α достигают постоянных при данной температуре и концентрации предельных значений m∞ и α∞ (кривая 1) и далее не изменяются. При неограниченном набухании (кривая 2) эти параметры достигают максимальных значений, которые затем уменьшаются за счёт растворения полимера. В этом случае набухание – первая стадия растворения
полимера.
Рис. Кинетические кривые ограниченного (1) и неограниченного (2) набухания.
Причина набухания состоит в различии свойств ВМС и низкомолекулярных соединений (НМС). Молекулы ВМС отличаются от низкомолекулярных соединений на несколько порядков по размерам и по подвижности. Молекулы НМС быстро проникают в сетку полимера, раздвигая цепи и увеличивая его объём. Гибкость цепей ВМС облегчает проникновение малых молекул НМС в полимер. При набухании происходит одностороннее смещение малых молекул, обусловленное большими различиями в размерах молекул.
Однако набухание – это не простое механическое вхождение молекул НМС в пустоты полимера. Набухание это межмолекулярное взаимодействие, обусловленное, главным образом, сольватацией макромолекул. Полимер набухает не в любом, а лишь в «хорошем» растворителе, т.е. в том растворителе с которым он взаимодействует. Так, полярные полимеры набухают в полярных растворителях, например, белки в воде, а неполярные – в неполярных (каучук в бензоле).
Степень ограниченности процесса набухания и возможность самопроизвольного растворения определяются соотношением энергии связи в структуре полимера и энергии сольватации полимерной цепи с учётом энтропийного фактора.
Набухание сопровождает жизнедеятельность всех растительных и животных организмов. Так, первой фазой прорастания зерна является его набухание, т.е. увеличение его объёма после смачивания. Лишь после набухания зерна возможны реакции, сопровождающие рост и развитие, не идущие при сухом состоянии.
Почки человека помимо основной функции (выведение из организма продуктов обмена) осуществляют регулирование воды, а их соединительная ткань служит индикатором водного обмена между кровью и клетками. Вследствие набухания соединительная ткань способна воспринимать излишек воды и отдавать его клеткам или направлять в кровь.
В период интенсивного роста организма, усиленного деления клеток степень набухания велика. Так, например, в начале утробной жизни младенца степень набухания велика и вода составляет 95% массы плода. Содержание воды у новорожденного составляет уже 70 – 75%, у взрослого 50 – 60%. Постепенное старение организма сопровождается уменьшением способности к набуханию, в живом организме к старости замедляются процессы обмена, происходит буквально высыхание человека, уменьшается его объём. Появляются морщины, являющиеся характерным признаком старости.
ВЯЗКОСТЬ РАСТВОРОВ ПОЛИМЕРОВ
Вязкость жидкостей можно для простоты определить как сопротивление жидкости передвижению одного её слоя относителоьно другого при сдвиге,
растяжении и других видах деформации.
Вязкость характеризуют интенсивностью работы, затрачиваемой на осуществление течения газа или жидкости с определённой скоростью. При ламинарном сдвиговом течении жидкости между двумя плоскопараллельными пластинками, верхняя из которых движется с постоянной скоростью v под действием силы F , а нижняя неподвижна, слои жидкости перемещаются с разными скоростями: от максимальной у верхней
пластинки до нуля у нижней. При этом касательное напряжение τ =  , а скорость деформации γ =
, а скорость деформации γ =  , где S – площадь пластинок, Н – расстояние между
, где S – площадь пластинок, Н – расстояние между
пластинками. Если между τ и γ имеется линейная зависимость, жидкость называется ньютоновской, а отношение τ : γ называется динамической вязкостью (или просто вязкостью) η. Жидкости для которых эта зависимость является нелинейной называются неньютоновскими.
Истинные растворы НМС являются ньютоновскими жидкостями, для них вязкость описывается уравнением Ньютона:
F = η∙s∙
где F – сила, необходимая для возникновения перемещения двух соседних слоёв раствора; du / dx –градиент скорости; η – коэффициент вязкости. Вязкость, вычисленная по уравнению Ньютона, не зависит от напряжения сдвига, определяемой действующей силой, типом вискозиметра и т.д.
Величина вязкости при данной температуре для НМС является инвариантной (неменяющейся) характеристикой.
Вязкость золей (η) описывается уравнением Эйнштейна:
η = η0(1 + 2,5φ)
где η0 – вязкость дисперсионной среды; φ – объёмная концентрация дисперсной фазы.
[Эйнштейн Альберт (1879-1955), физик-теоретик, один из основателей современной физики, иностранный ч.-к. Российской АН. Эйнштейн создал теорию относительности, является автором основополагающих трудов по квантовой теории света: ввёл понятие фотона (1905), установил законы фотоэффекта и многое другое. Развил статистическую теорию броуновского движения, создал квантовую статистику и т.д. С 1933 г работал над проблемами космологии и единой теории поля. Нобелевская премия (1921)].
Уравнение Эйнштейна пригодно только при условии, что взвешанные в жидкости частицы являются твёрдыми шарообразными телами, концентрация дисперсной фазы сравнительно невелика и между частицами отсутствуют взаимодействия.
Вязкость растворов, содержащих макромолекулы, обычно выше вязкости растворов низкомолекулярных веществ и вязкости коллоидных систем при одной и той же концентрации. Например, вязкость 1%-ного раствора каучука в бензине в 18 раз выше вязкости чистого бензина.
Вязкость растворов ВМС не является постоянной величиной; она зависит от условий измерения, в первую очередь от скорости движения раствора в вискозиметре. Вычисленная по уравнению Ньютона вязкость в этом случае является чисто условной величиной и называется эффективной вязкостью. Растворы ВМС являются неньютоновскими жидкостями, так как они не обладают постоянной вязкостью. У растворов ВМС наблюдается
аномалия вязкости.
В растворах полимеров происходит образование пространственных структур, образуемых сцеплением макромолекул, что и вызывает резкое повышение вязкости. При течении растворов полимеров работа затрачивается не только на преодоление истинной (ньютоновской) вязкости, но и на разрушение структуры раствора.
Вязкость растворов ВМС зависит от условий определения, в частности от напряжения сдвига. Это связано с тем, что одни и те же макромолекулы
могут находиться в различных конформационных состояниях; от линейных до глобул.
{Напомним, что: а) различные геометрические формы молекул, переходящие друг в друга путём вращения вокруг σ-связей, называются конформациями; б) глобулы – это коллоидные частицы сферической формы или макромолекулы, свёрнутые в клубок). }.
По этой причине вязкость концентрированных растворов ВМС может быть неодинаковой (анизотропной) в различных направлениях. Вязкость макромолекул с выпрямленными и ориетированными хаотично по отношению к направлению движения звеньями выше, чем вязкость макромолекул, которые имеют форму клубка или глобул.
Если вязкий раствор ВМС продавливать под давлением через капилляр, то макромолекулы будут ориентироваться и вытягиваться в капилляре, а поэтому наблюдаемая вязкость раствора снижается.
Вязкость растворов ВМС в значительной степени зависит от температуры и свойств растворителя. Растворители способны влиять на конформационную форму макромолекул и за счёт этого изменять вязкость одного и того полимера в разных растворителях. Таким образом, вязкость растворов ВМС определяется природой полимера и природой растворителя.
Точное измерение абсолютной вязкости растворов полимеров затруднительно. Поэтому для растворов ВМС различают относительную, удельную, приведённую и характеристическую вязкость.
Относительная вязкость – это отношение вязкости раствора полимера ηр к вязкости растворителя η0
ηотн = 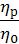
Относительную вязкость можно определить по времени истечения раствора ВМС tp и растворителя t0 через калиброванное отверстие вискозиметра:
ηотн = 
Относительная вязкость является мерой изменения вязкости раствора по сравнению с вязкостью чистого растворителя. Для растворов макромолекул относительная вязкость ηотн обычно больше единицы.
Удельная вязкость – отражает возрастание относительной вязкости по сравнению с единицей:
ηуд = ηотн – 1.
Чтобы учесть влияние концентрации раствора, т.е. оценить, насколько велика удельная вязкость, отнесённая к единице концентрации растворённого вещества, ηуд делят на с. Полученная величина называется приведённой вязкостью. Её величина выражается следующей формулой
ηпривед = 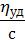
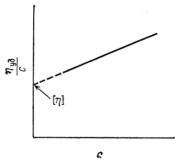
Так как ηуд сама зависит от концентрации, приходится вводить ещё одну величину [η] (собственную вязкость), которую получают путем экстраполяции зависимости ηуд / с от концентрации раствора с.
Величину [η] называют характеристической вязкостью или предельным числом вязкости.
[η] = lim ηуд / с
C → 0
Характеристическую вязкость определяют на основании вискозиметрических измерений, используя значения относительной, удельной и приведённой вязкости в качестве вспомогательных величин.
Характеристическая вязкость для данной пары веществ (растворитель – полимер) является условной, но постоянной величиной, которая не зависит от концентрации растворителя и конформационных состояний макромолекул.
В 1930 г Штаудингером было предложено полезное соотношение между молекулярной массой и характеристической вязкостью.
[η] = KM
Это соотношение имело ряд недостатков. Поэтому позже оно было модифицировано. В настоящее время оно известно, как уравнение Марка- Куна-Хаувинка и имеет следующий вид:
[η] = KM α,
где К – постоянная величина, экспериментально определяемая для данных макромолекул и растворителя. Показатель степени α зависит от формы макромолекул. Для белков компактной структуры – глобулярных белков – он составляет около 0,5. Для молекул, находящихся в конформации беспорядочного клубка, показатель степени возрастает до 2. Молекулярная масса, определяемая по уравнению Марка-Куна-Хаувинка, называется
средневязкостной молекулярной массой Мη.
Величина характеристической вязкости позволяет определить как относительную молекулярную массу полимера, так и размеры и форму его макромолекул. Например, если растворы белков характеризуются величинами [η, лежащими между 3,0 и 4,0 см3/г, то столь малое значение данных величин указывает на глобулярную, весьма компактную структуру этих белков, форма которых незначительно отличается от сферы. Большие значения [η указывают
либо на высокую степень асимметричности белков, либо на большой объём, занимаемый данными белками в растворе.
ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ Осмотическое давление – это одна из основных характеристик растворов
как низкомолекулярных веществ, так и полимеров. Основная трудность при изучении поведения низкомолекулярных соединений в растворе осмотическим методом заключается в сложности подбора полупроницаемой мембраны (мембраны проницаемой для растворителя, но не проницаемой для растворённого вещества).
При работе с растворами ВМС легче подобрать полупроницаемую мембрану, так как размеры молекул растворителя и растворённого вещества значительно отличаются друг от друга. Зависимость осмотического давления раствора ВМС от величины молекулярной массы этого соединения широко используется для определения молекулярной массы и исследования взаимодействия между молекулами растворителя и макромолекулами полимера в растворе.
Осмотическим методом можно определять молекулярные масса, лежащие в области 30 000 – 1 500 000. Нижний определяемый предел молекулярных масс обусловлен возможностью изготовления полупроницаемой мембраны. Верхний предел зависит от точности фиксирования высоты поднятия столба раствора в осмометре.
Если раствор полимера отделить от растворителя мембраной, не проницаемой для растворённого вещества, но проницаемой для растворителя, то растворитель диффундирует сквозь мембрану в раствор. Это явление называется осмосом. Сила, действующая на единицу поверхности, препятствующая молекулам растворителя проникать через полупроницаемую перегородку, получила название осмотического давления.
Экспериментально установлено, что осмотическое давление разбавленного раствора удовлетворяет уравнению
πV = n1RT
в котором n1 – число молей растворённого вещества (для которого мембрана непроницаема) в объёме V; π – осмотическое давление; R – газовая постоянная; T – абсолютная температура. Это соотношение открыто ВантГоффом в 1887 году. Данное уравнение идентично по форме уравнению состояния идеального газа.
Осмотическое давление можно выразить и по другому:
Pосм = 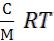 ,
,
где С –концентрация растворённого вещества в г/л; М – молярная масса растворённого вещества. Отсюда следует, что уравнение можно использовать для определения молярных масс.
С повышением концентрации ВМС (кроме глобулярных белков) их осмотическое давление перестаёт подчиняться закону Вант-Гоффв и растёт быстрее. Причина этого явления заключается в том, что существует относительная независимость теплового движения отдельных сегментов линейных макромолекул ВМС. Каждая макромолекула ведёт себя как совокупность нескольких молекул меньшего размера. Это и проявляется в увеличении осмотического давления. Для расчёта осмотического давления растворов полимеров Галлер предложил уравнение:
Pосм = ∙C + βC2,
∙C + βC2,
где М – молярная масса ВМС, г/моль; С – концентрация раствора ВМС, г/л; β – коэффициент, учитывающий гибкость и форму макромолекул в растворе.
Коэффициент β зависит от природы растворителя и растворённого вещества, но не зависит от молярной массы растворённого полимера. С увеличением длины макромолекулы и разветвлённости цепи величина β растёт. Увеличение эффективного числа подвижных единиц (кинетически активных единиц) в растворе учитывается дополнительным слагаемым βС2. При небольших концентрациях полимера значение слагаемого невелико и уравнение Галлера переходит в уравнение Вант-Гоффа. Уравнение Галлера можно преобразовать в уравнение прямой линии, разделив обе части на С:
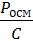 =
=  + βC.
+ βC.
Измерив осмотическое давление растворов с различной концентрацией С, можно построить графическую зависимость величины Росм / С от С и найти значение молярной массы М полимера и коэффициент β (β =tgα, где α – угол наклона прямой линии на графике).
Осмотическим методом обычно пользуются для определения молярных масс ВМС в интервале от 10 000 до 70 000г/моль. Нижний предел зависит от свойств мембран, а верхний определяется той чувствительностью, при которой можно измерять осмотическое давление. Погрешность результатов измерений осмотического давления растворов ВМС может быть связана с присутствием в растворе низкомолекулярных электролитов. Поэтому растворы ВМС подвергают диализу пере началом опыта.
Молекулярная масса полимера, определённая по измерению осмотического давления, называется среднечисловой молекулярной массой (Мn). Такое название понятно, так как π = сRT, то есть осмотическое давление зависит только от числа частиц в растворе (R и Т величины постоянные).
Для определения молекулярных масс ВМС осмотический метод оказался очень полезным. В 1925 г Адер впервые достоверно определил молекулярную массу гемоглобина. Значение молекулярной массы гемоглобина равно 68 000. Эта величина позже подтверждена данными других учёных, определявших молекулярную массу гемоглобина другими методами.
