
810
.pdfОдним из важных агротехнических приемов является срок сева, от которого зависит обеспеченность растений водой и физическая спелость почвы, определяющая почвенные условия для развития корневой системы. Удобрения вносят фоном на всех вариантах в одной дозе, которая зависит от биологических особенностей культур (табл.1), рекомендованной под данную культуру, с которой проводят опыт (табл. 2). В условиях Предуралья наиболее благоприятные сроки сева яровых зерновых культур – первая декада мая, хотя в отдельные годы его начинают с 10 мая из-за высокой влажности почвы, а озимых культур – во второй декаде августа.
Схема опыта:
яровые (пшеница, овес, ячмень) озимые (рожь, пшеница)
5 мая (контроль) |
1. |
5 августа |
|
15 мая |
2. |
15 |
августа (контроль) |
25 мая |
3. |
25 |
августа |
Для посева используют семена районированных сортов. В период вегетации по фазам развития проводят биометрические измерения растений, определяют площадь листьев, ФСП и ЧПФ. Методики определения их приведены в работе 48. Проводят определение структуры урожая (см. работу 93).
Результаты записывают в таблицы (приложения 3 и 4). Делают выводы о влиянии сроков посева на рост, развитие и продуктивность (яровой пшеницы, овса, ячменя, озимой ржи и пшеницы).
Работа 95. Влияние яровизации озимой ржи на рост, развитие и продуктивность растений (озимая пшеница)
Вводные пояснения. Яровизация озимых культур происходит при действии низких отрицательных температур –
271
менее -100С, при этом растения или наклюнувшиеся семена в дальнейшем приобретают способность синтезировать гормон цветения – гиббереллин. Доказательством того является обработка растений озимой ржи (пшеницы), которые выросли из неяровизированных семян, посеянных в мае, в фазу кущения раствором гиббереллина.
Цель работы: установить влияние яровизации на рост, развитие и продуктивность озимых культур.
Материалы и оборудование: минеральные удобрения,
семена неяровизированные и яровизированные, мерная лента, шпагат, колышки.
По сравнению с яровыми культурами, для прохождения стадии яровизации озимая рожь требует длительного воздействия (55-60 дней) низких отрицательных температур (-4-8°С).
Схема опыта
1.Посев 15 августа (контроль)
2.Посев яровизированными семенами 5-15 мая
3.Посев не яровизированными семенами 5-15 мая
4.Посев не яровизированными семенами 5-15 мая +обработка растений в фазу кущения 0,0001% раствором гибереллина.
В варианте 1 растения озимой ржи яровизацию проходят в полевых условиях при оптимальных сроках посева. В варианте 2 семена начинают готовить с начала марта: семена озимой ржи замачивают в воде и дают им наклюнуться. Когда корешок достигнет 0,1-0,2см, семена в марлевом мешке помещают в холодильник. Температуру семян снижают постепенно в течение недели. Для этого их с нижней полки постепенно переносят на верхнюю, а затем помещают в морозильную камеру при температуре –5 –6°С на 55-60 дней. Во всех вариантах семена ржи районированного сорта берут из одной партии.
Удобрения вносят фоном в дозах, рекомендованных под данную культуру (табл. 2), с которой проводят опыт. Для посева используют семена районированных сортов.
272
В период вегетации по фазам развития проводят биометрические измерения растений, определяют площадь листьев, ФСП и ЧПФ. Методики определения их приведены в работе 48. Проводят определение структуры урожая (работа
93).
Результаты записывают в таблицу по форме (приложение 3 и 4).Делают выводы о влиянии яровизации озимой ржи на рост, развитие и продуктивность растений.
Работа 96. Влияние сорта на рост, развитие, урожайность и качество клубней картофеля
Вводные пояснения. Все сельскохозяйственные культуры по температуре биологического нуля делят на три группы:
1.> 50С – яровая пшеница, овес, ячмень, которые высевают в ранние сроки, в первой декаде мая, когда почва достигает физической спелости;
2.> 100C – более теплолюбивые культуры: кукуруза,
картофель, просо, которые высевают при температуре почвы 100С на глубину 10см, во второй декаде мая;
3.> 150C – теплолюбивые культуры тропического происхождения: семейства тыквенные – огурцы, кабачки, патиссоны, арбузы, дыни; семейства пасленовые – томаты, перцы, баклажаны; гречиха.
Цель работы: ознакомить студентов с влиянием генотипа на рост, развитие, урожайность и качество клубней картофеля.
Материалы и оборудование: клубни различных сортов картофеля, минеральные удобрения, мерная лента, шпагат, колышки, лопаты.
Картофель является более теплолюбивой культурой, чем яровые зерновые. Его высаживают, когда почва прогре-
273
вается на 7-10 С на глубину посадки клубня 6-10см. На переувлажненных почвах клубни лучше сажать в гребни, которые быстрее прогреваются и просыхают. Минеральные удобрения вносят фоном в дозе N90Р90К120. Дозы минеральных удобрений увеличивают на 30%, когда не вносят навоз. Расчет доз удобрений в физической массе проводят по формуле 1. Посадку картофеля лучше проводить во второй декаде мая пророщенными клубнями с площадью питания 70см х 30см. Для посадки берут клубни различных сортов со средней массой клубня 60 г (фракция 50 – 70 г).
|
а) выявление наиболее урожайных сортов различных |
||||
групп спелости по схеме: |
|
|
|||
|
ранние |
|
среднеранние |
|
среднеспелые |
1. |
Весна (ст-т) |
1. |
Невский (ст-т) |
1. |
Луговской (ст-т) |
2. |
Ред Скарлетт |
2. |
Свитанок |
2. |
Петербургский |
3. |
Фреско |
3. |
Санте |
3. |
Голубизна |
4. |
Пушкинец |
4. |
Никита |
4. |
Зарево |
5. |
Удача |
5. |
Романо |
|
|
6. |
Каменский |
6. |
Елизавета |
|
|
7. |
Беллароза |
7. |
Чародей |
|
|
8. |
Маделине |
8. |
Виза |
|
|
9. |
Розалинд |
9. |
Отрада |
|
|
б) выявления оптимальных сроков посадки на урожайность по схеме:
1.10 мая
2.20 мая (контроль)
3.30 мая
4.10 июня
в) влияния массы посадочного клубня на урожайность по схеме:
1.70 г (контроль)
2.50 г
3.30 г
4.90 г
5.110 г
274
Опыты по определению оптимальных сроков посадки и массы посадочного клубня на урожайность картофеля можно проводить с любым из перечисленных выше сортов.
Биометрический анализ растений картофеля проводят по фазам развития: бутонизация, цветение и уборка или через 45, 55 дней от появления всходов и в период уборки. Для этого выкапывают по 5 растений картофеля с каждой делянки и проводят анализ растений и клубней. При анализе растений измеряют высоту стеблей, считают число стеблей и определяют массу ботвы, а также считают листья и измеряют их площадь с одного растения (см2), ИЛП (м2/м2), с одного гектара (тыс.м2/га), ФСП (тыс.м2*сутки/га), ЧПФ (г/м2*сутки). При биометрическом анализе урожая картофеля считают число клубней, в том числе по фракциям: > 100 г, 30 – 100 г и < 30 г (шт.) и взвешивают их. Определяют долю фракций в массе урожая (%), продуктивность одного куста (г), выход товарных клубней массой более 30 г (%). Урожайность определяют путем уборки клубней с учетной делянки, которые взвешивают и урожайность пересчитывают в ц/га.
Результаты записывают в таблицу (приложение 5 и 6). По результатам делают выводы о влиянии сорта, массы посадочного клубня и сроков посадки на рост, развитие, урожайность и качество клубней картофеля.
Работа 97.Наблюдения за развитием злаков по морфологическим изменениям в точках роста (по этапам органогенеза)
Вводные пояснения. Задача опытов по наблюдению за развитием растений в период летней полевой практики - ознакомление студентов на конкретном материале с основными вопросами физиологии развития растений. При постановке этих опытов важен выбор темы, подбор соответствующих опытных растений, умение препарировать точки роста стебля и колоса для того, чтобы судить о развитии растений по этапам органогенеза.
275
Морфологические изменения в точках роста позволят судить о скорости прохождения развития растений в зависимости от внешних условий, влажности почвы, минерального питания, фотопериодизма, температуры воздуха, почвы и др.
Процесс формирования органов в индивидуальном развитии растений называется органогенезом. Ф. М. Куперман с сотрудниками выявила, что формирование каждого органа, как и растения в целом, проходит через ряд этапов На основании развиваемых ею представлений можно выделить следующие этапы органогенеза у злаков.
I этап – органогенеза характеризуется недифференцированным конусом нарастания стебля; конус нарастания имеет вид небольшой выпуклости (протекает в фазу всходов).
II этап – удлинение конуса нарастания, дифференциация его на узлы и укорочение междоузлия зачаточного стебля; начало формирования зачатков стеблевых листьев (начало развития третьего листа).
III этап – вытягивание и сегментация конуса нарастания, процесс заложения и дифференцировки оси соцветия (фаза кущения).
IV этап – формирование колосковых бугорков и боковых осей соцветия у метельчатых злаков (начало выхода в трубку).
V этап – формирование цветков в колосках: закладка цветочных бугорков и при дальнейшей дифференциации – образование генеративных бугорков (тычиночных и пестичных); этот этап протекает в фазу выхода в трубку.
VI этап – формирование пыльцевых мешков и завязи пестика (образование пыльцевых зерен – микроспорогенез и зародышевого мешка – макроспорогенез).
276
VII этап – завершение процесса формирования пыльцы и зародышевого мешка, образование половых клеток; усиленный рост всех частей колоса и самого колоса (начало колошения)
VIII этап – выколашивание или выметывание.
IX этап – период цветения, оплодотворения, образования зиготы.
X этап – формирование плодов и семян.
XI этап – накопление питательных веществ (фаза молочной спелости зерна).
XII этап – превращение питательных веществ в запасные вещества, специфические для каждого вида (восковая спелость).
Цель работы: ознакомить студентов с морфологическими признаками в точках роста и зачаточном колосе или метелке, характеризующими развитие растений.
Материалы и оборудование: растения в вегетационных сосудах или на делянках заложенных опытов; препаровальная лупа; препаровальные иглы; микроскоп; рисовальная призма или рисовальный аппарат.
Ход работы. Для работы могут быть использованы различные злаки как в вегетационных сосудах, так и высеянные с этой целью на делянки.
Наблюдения следует начинать с момента появления второго листа. Растение выкапывают из почвы, корневую систему и листья обрезают, и под препаровальной лупой (лучше бинокулярной) выделяют точку роста. Это выделение требует тренировки и представляет некоторые трудности, пока растение мало. Выделенную точку роста зарисовывают при малом увеличении микроскопа.
Необходимо рассмотреть и зарисовать точки роста в различные этапы развития растений. Развитие точек роста представлено на рис. 33.
277
. 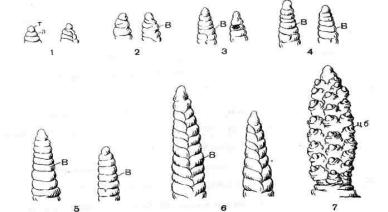
Рис.33. Развитие точки роста и колоса ячменя: 1— недифференцированная точка роста (т - точка роста, л - листовые бугорки), 2 - заложение колосковых валиков (В), 3 - 6 - дальнейшее развитие колосковых валиков (В), 7 — заложение цветочных бугорков (цб).
Сделать выводы, на каком этапе органогенеза находиться препарируемое растение.
Работа 98. Химический анализ сока растений (по К.П. Магницкому)
Вводные пояснения. Анализ сока растений дает возможность контролировать условия питания растений во время их роста в полевых условиях и ориентировочно устанавливать необходимость подкормки растений теми или иными удобрениями.
Пользуясь полевой лабораторией Магницкого, можно быстро и довольно точно определить содержание в клеточном соке главных элементов почвенного питания – азота, фосфора, калия и магния. К каплям сока, отжатого из черешков или стеблей, добавляют соответствующие реактивы. Окраску полученных растворов или осадков сравнивают с цветной шкалой, имеющейся в приборе Магницкого, и выражают результаты анализа в миллиграммах элемента на 1 кг сока или в баллах.
Сухой реактив на нитратный азот состоит из смеси сульфата бария (100 г), сульфата марганца (10 г), цинковой пыли (2 г), лимонной кислоты (4 г) и альфа-нафтиламина (2 г).
Реактивом на фосфор служит раствор молибденовокислого аммония (1 г указанной соли растворяют в 20 мл горячей воды, добавляют 20 мл концентрированной соляной
278
кислоты и 160 мл воды). Вторым реактивом служит оловянная палочка.
Реактив на калий: дипикриламинат магния, который готовят путем растворения 3 г дипикриламина и 1,3 г окиси магния в 100 мл воды, (этот раствор оставляют стоять на 15 - 20 час и фильтруют). Вторым реактивом служит разбавленная соляная кислота (к 1 части концентрированной кислоты добавляют 5 частей воды).
Реактивы на магний: раствор титанового желтого (10 мг реактива растворяют в 5 мл воды и 15 мл этилового спирта) и 10%-ный раствор едкого натра.
Цель работы. Научиться определять содержание азота, фосфора, калия и магния в соке растений в период вегетации полевой лабораторией Магницкого и устанавливать необходимость подкормки.
Материалы и оборудование: живые растения из опы-
тов, прибор «Полевая лаборатория Магницкого», дистиллированная вода, марлевая салфетка.
Ход работы: с пяти-шести растений срезают по одному листу определенного яруса. У картофеля, томатов, подсолнечника берут листья, закончившие рост: до бутонизации – 2-3-й лист, во время цветения и позже – 3-4-й лист, считая снизу. У злаков после выхода в трубку берут 2-4-й лист, у кукурузы после выбрасывания метелки – 5-6-й лист снизу. У свеклы пробу составляют из наружных листьев розетки. У деревьев и кустарников выбирают хорошо освещенные типичные однолетние побеги, и из нижней их части отбирают по одному листу. Для анализа берут черешки, а у сидячих листьев вырезают из нижней трети листа среднюю жилку. Можно использовать также нижние части стеблей молодых побегов.
Обтереть взятую пробу чистой салфеткой или ватой. Если черешки толстые, разрезать их вдоль и использовать половину или четвертую часть. Из нижней части каждого черешка, жилки или стебля вырезать острыми ножницами кусочек длиной 2-3см. Уложить материал в пресс, сдавливанием рычагов выжать сок и слить его в чистую сухую ка-
279
пельницу. Тщательно вымыть пресс водой и обтереть салфеткой или фильтровальной бумагой.
Для определения нитратного азота насыпают в углубление фарфоровой пластинки сухой реактив на азот в объеме, примерно равном зерну ржи, приливают три капли буферного раствора, а затем добавляют одну каплю исследуемого сока. Тщательно размешивают смесь стеклянной палочкой и через 1 минуту сравнивают полученную окраску с цветной шкалой прибора Магницкого.
При определении фосфора вносят в углубление фарфоровой пластинки каплю сока растения, добавляют три капли воды и две капли реактива на фосфор. Содержимое лунки помешивают оловянной палочкой (олово также является реактивом), пока окраска не станет устойчивой. Сравнивают окраску полученного раствора с цветной шкалой.
Калий определяется следующим образом. В углубление фарфоровой пластинки вносят каплю сока, добавляют каплю реактива на калий и одну каплю соляной кислоты, перемешивают стеклянной палочкой и сравнивают окраску получившегося осадка с цветной шкалой прибора.
Для определения магния в углубление пластинки помещают каплю сока растения, три капли воды и каплю раствора титанового желтого, перемешивают стеклянной палочкой и добавляют каплю раствора едкого натра. Если окраска изменяется нечетко, повторяют анализ, добавив перед внесением едкого натра каплю свежеприготовленного 1%-ого раствора крахмала. Полученную окраску сравнивают с цветной шкалой.
Из некоторых растений выжать сок трудно, или он получается сильно окрашенным, что затрудняет проведение цветных реакций. В этих случаях готовят водную вытяжку: измельчают материал, берут навеску 2 г, добавляют 0,2-0,5 г активированного угля (для поглощения красящих веществ)
и6 мл воды, тщательно растирают в маленькой ступке. Растертую массу завертывают в кусочек тонкой плотной ткани
иотжимают прессом. Поскольку на 2 г материала было взято 6 мл воды, то полученная вытяжка слабее сока примерно в 4 раза. Для определения фосфора и магния, как указыва-
280
