
810
.pdf
кожура и околоплодник препятствуют быстрой диффузии веществ, и разложить их на крахмальный агар в чашки Петри срезом вниз. Через определенный промежуток времени семена из чашек убирают, и крахмальный агар заливают раствором йода в йодистом калии. О наличие амилазы судят по бесцветным пятнам в агаровой пластинке.
Цель работы. Путем эксперимента с непроросшими и проросшими половинками зерновок пшеницы на крахмалистом агаре убедиться в активности амилазы в прорастающих семенах.
Материалы и оборудование: проросшие и непророс-
шие семена пшеницы; чашки Петри с крахмальным агаром*; скальпели; лезвия безопасной бритвы; пинцеты; слабый раствор йода в йодистом калии (концентрированный раствор разбавляют в 10 раз).
Ход работы. Разрезать несколько непроросших зерен пополам, срезы которых слегка смочить водой и разложить пинцетом в чашке Петри на одной половине пластинки из крахмального агара поверхностью среза вниз, не вдавливая семена в пластинку. На другую половину агаровой пластинки разложить несколько проросших семян того же растения, также разрезанных пополам и смоченных водой. Закрыть чашку Петри крышкой, чтобы не было подсыхания агаровой пластинки. Через час осторожно снять семена и облить всю пластинку слабым раствором йода в йодистом калии.
Отметить результаты и сделать выводы.
Вопросы для самоконтроля
1.Какое действие оказали семена на пластинку из крахмального агара?
2.Почему проросшие и непроросшие семена оказали неодинаковое действие?
3.Что такое экзо- и эндоферменты? Каково их значение в жизни растений?
* Способ приготовления см. в приложении.
241

Работа 85. Обнаружение амилазы в слюне человека
Вводные пояснения. Слюна – прозрачный вязкий секрет слюнных желез, выделяемый в ротовую полость. В состав слюны входит вода (98,5-99,5%) и растворенные в ней неорганические и органические вещества. Она имеет слабокислую или слабощелочную реакцию (рН 5,6-7,6). За сутки человек выделяет 1,5-2,0 л слюны.
Главная функция слюны состоит в смачивании пищи для облегчения жевания и прохождения еѐ через пищеварительный канал. В слюне имеются ферменты амилазы и лизоцим. Под действием амилаз слюны в ротовой полости начинается расщепление крахмала пищи, который превращается сначала в декстрины – полисахариды с более короткой цепью, а затем в мальтозу. Последняя под действием фермента мальтазы в кишечнике превращается в глюкозу.
Цель работы. Убедиться, что в слюне человека имеется фермент амилаза путем внесения слюны на агаровую пластинку.
Материалы и оборудование: чашки Петри с крахмаль-
ным агаром; фильтровальная и пергаментная бумага; раствор йода в йодистом калии.
Ход работы. На поверхности пластинки из крахмального агара делают надпись или рисунок с помощью слюны (мягкой кисточкой из фильтрованной бумаги). Чашку Петри закрывают крышкой, чтобы не подсыхала агаровая пластинка, и оставляют на столе в течение 1часа. По прошествии этого времени пластинку обливают слабым раствором йода.
Отмечают результат и делают выводы.
Вопросы для самоконтроля
1.Что представляет собой слюна человека?
2.В чем заключается главная функция слюны?
3.Какова роль амилазы слюны в пищеварении человека?
Работы 84 и 85 лучше выполнять одновременно на одной агаровой пластинке.
242
Работа 86. Влияние температуры и реакции среды на активность сахаразы (инвертазы)
Вводные пояснения. Фермент сахараза (инвертаза или β-фруктофуранозидаза) катализирует процесс расщепления сахарозы на глюкозу и фруктозу по уравнению:
С12Н22О11 + Н2О= С6Н12О6 + С6Н12О6
глюкоза фруктоза
Сахараза – типичный гидролитический фермент, имеющийся у большинства растений. Особенно много активной сахаразы содержится в клетках дрожжей, из которых она обычно и выделяется.
Для изучения влияния температуры и реакции среды на активность сахаразы проводится следующий опыт: в несколько пробирок наливают одинаковое количество вытяжки фермента и одинаковое количество сахарозы и выдерживают их в разных условиях. Через определенное время, одинаковое для всех вариантов, во всех пробирках проводят реакцию на редуцирующие сахара. При кипячении с фелинговой жидкостью глюкоза и фруктоза восстанавливают окисную медь до закиси меди. В пробирках, где гидролиза сахарозы не произошло, осадок закиси меди не образуется, так как сахароза не восстанавливает фелинговую жидкость (см. объяснение к работе 77).
По количеству осадка закиси меди судят о количестве моносахаридов, образовавшихся при гидролизе сахарозы. Поскольку количество фермента, количество субстрата (сахарозы) и продолжительность опыта во всех вариантах были одинаковы, количество продуктов гидролиза будет характеризовать активность фермента.
Цель работы. Изучить влияние температуры и реакции среды на активность сахарозы (инвертазы) путем реакции с фелинговой жидкостью.
Материалы и оборудование: дрожжи свежие или су-
хие; 10% раствор сахарозы; 0,1н раствор НСl; 0,1н раствор
243

NaOH; фелингова жидкость; кварцевый песок; дистиллированная вода; весы с разновесами; ступка с пестиком; бюретка с воронками (4 шт.); стеклянная палочка; штатив с пробирками (7шт.); фломастер; электроплитка; термометр; спиртовка; колбы на 100 мл (2 шт.); градуированные пипетки на 5-10 мл и на 1-2 мл; держатели для пробирок; бумажные фильтры; водяная баня, спички.
Ход работы. Сахаразу (инвертазу) выделяют из дрожжей. Для этого берут 10 г свежих или 5 г сухих дрожжей, помещают их в ступку, добавляют кварцевого песка, 5 мл воды и тщательно растирают. Затем добавляют еще 15 мл воды, нагретой до 500С, и продолжают растирание в течение 10 мин, после чего содержимое ступки переносят на складчатый фильтр и фильтруют. Первую мутную порцию фильтрата сливают обратно на фильтр. В полученном фильтрате содержится активный фермент сахараза*.
Поставить в штатив 7 пробирок, пронумеровать их, налить в каждую по 0,5мл вытяжки фермента сахаразы. В первые 4 пробирки наливают по 2 мл воды, в пятую пробирку добавляют 2 мл 0,1н HCl, в шестую – 0,2 мл 0,1н HCl и 1,8 мл воды, в седьмую – 2 мл 0,1н NaОН.
Содержимое четвертой пробирки тщательно кипятят в течение 3-х минут. Затем во все пробирки приливают по 2 мл 10% сахарозы. Содержимое пробирок перемешивают и первую пробирку помещают в снег или в морозильную камеру холодильника вместе с термометром, третью – на водяную баню с температурой 400С, а остальные оставляют в штативе при комнатной температуре.
Через15 минут во все пробирки приливают по 2мл фелинговой жидкости и нагревают их на кипящей водяной бане в течение 5минут.
*Вытяжку сахаразы лучше готовить заранее до занятия (лаборант) или поручать это делать студенту, который готовит еѐ для всей группы, соответственно увеличив количество дрожжей, песка и воды.
244

Количество выпавшего осадка закиси меди оценивают в баллах: 0 – нет, 1 – очень мало, 2 – мало, 3 – средне, 4 – много и 5 – очень много.
Результаты записывают в таблицу:
№№ пробирок |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Температура, 0С |
|
|
|
|
|
|
|
рН среды |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кол-во Cu2O |
|
|
|
|
|
|
|
На основе полученных данных делают выводы об активности сахаразы в зависимости от температуры и реакции среды.
Вопросы для самоконтроля
1.Какова роль сахаразы в жизни растений?
2.К какому классу ферментов относится сахараза (инвертаза)? Как называют продукты гидролиза сахарозы инвертазой?
3.Как вы объясните широкое распространение сахарозы в мире растений?
4.Каковы оптимальные условия для проявления высокой активности этого фермента?
Работа 87. Обнаружение каталазы
Вводные пояснения. Каталаза – фермент класса оксидоредуктаз подкласса оксидаз. Состоит из белка и простетической группы – гема, содержащего железо. Наиболее высокую активность проявляет в слабощелочной среде (рН – 7,7). Каталаза широко распространена в живых клетках растений и животных, где вместе с ферментами, образующими перекись водорода (оксидазами), содержится в специальных органоидах – микротельцах, называемых пероксисомами.
В процессе окисления веществ в растительных клетках накапливается перекись водорода, которая в повышенных концентрациях оказывает токсическое действие на цитоплазму клеток. Каталаза катализирует реакцию разложения перекиси водорода на воду и молекулярный кислород:
2Н2О2 |
каталаза |
2Н2О + О2 |
|
245
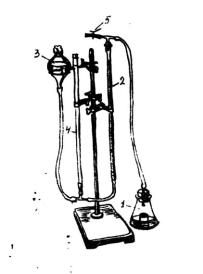
Цель работы. Обнаружить каталазу в клубне картофеля, корнеплодах: свекле, моркови; проросших семенах пшеницы, гороха путем внесения перекиси водорода.
Материалы и оборудование: клубень картофеля; кор-
неплоды свеклы, моркови; проросшие семена пшеницы, гороха и др.; 3% раствор перекиси водорода; марля; колба; терка; пипетка; пробирки; штатив для пробирок.
Ход работы. Натирают на терке очищенный клубень картофеля, корнеплоды моркови, свеклы, проросшие семена растирают в ступке с водой и отжимают сок через марлю в колбу. В пробирку с очень слабым раствором перекиси водорода (на 5мл воды 10 капель 3% раствора пероксида) вносят несколько капель сока растительного объекта. Происходит вспенивание вследствие выделения молекулярного кислорода. Следовательно, в исследуемом объекте содержится каталаза.
Вопросы для самоконтроля
1.Какова структура каталазы?
2.Роль каталазы в живом организме?
3.К какому классу ферментов относится каталаза?
4.Каково распространение каталазы в природе?
Рис. 32 Каталазник 1
1.Коническая колба;
2.Стеклянная трубка;
3.Груша;4. Бюретка;
5.Тройник
Работа 88. Определение активности каталазы газометрическим методом
Вводные пояснения. Актив-
ность каталазы определяется газометрическим методом, основанном на учете объема кислорода, выделенного в реакции после прибавления к водному экстракту каталазы из растений перекиси водорода. Активность фермента выражается в см3 кислорода, выделенного за 1 мин навеской в 1г.
Цель работы. Определить активность каталазы газометрическим методом в проросших и непроросших семенах зерновых культур.
246
Материалы и оборудование: установка для газометри-
ческого определения каталазы (рис.32); колбы конические мерные и круглые на 100 мл; мерный цилиндр на 20 мл; пипетки на 2 мл; пинцет; ступка с пестиком; бумага пергаментная для взвешивания навески; промытый песок; часы; 3% перекись водорода; проросшие и непроросшие семена зерновых культур; капроновые пробки объемом 2 мл.
Ход работы. Навеску растительного материала в 1-2 г тщательно растирают в ступке с кварцевым песком, добавляют 0,5 г СаСО3 для создания щелочной реакции среды. Во время растирания постепенно приливают дистиллированную воду, размешивают и полученную смесь аккуратно переносят в мерную колбу на 100 мл, доводя объем до метки. Из этой колбы для анализа берут 20 мл раствора в коническую колбу для титрования (1). Затем с помощью пинцета на дно этой колбы ставят капроновую пробку с 2 мл 3%-ого раствора перекиси водорода. Колбу плотно закрывают каучуковой пробкой со стеклянной трубкой (2), соединенной через тройник (5) с бюреткой (4), которая сообщается с грушей (3). Бюретка и груша заполнены водой. Уровень воды в бюретке и груше уравновешивают до положения, когда мениск воды в бюретке будет на нуле, и закрепляют в штативе. Затем закрывают свободный конец тройника зажимом, тем самым устраняя сообщение прибора с внешней средой.
Резким движение колбы опрокидывают стоящую внутри нее капроновую пробку с перекисью водорода и замечают время, переворачивая песочные часы. В течение 3х минут смесь в колбе перемешивают путем легкого встряхивания.
Каталаза, находящаяся в растительной вытяжке, расщепляет перекись водорода и выделяющийся кислород, вытесняет из бюретки воду, уровень которой отмечают по истечении 3х минут.
247
Результаты эксперимента заносят в таблицу:
Объект иссле- |
Навеска, г |
Объем О2 за 3 |
Активность каталазы, мл О2 за 1 |
|
дования |
минуты, мл |
мин на 1г навески |
||
|
||||
Семена: |
|
|
|
|
непроросшие |
|
|
|
|
проросшие |
|
|
|
На основе полученных данных делают вывод об активности каталазы в исследуемых растительных объектах.
Вопросы для самоконтроля
1.На чем основано определение активности каталазы данным методом?
2.В каких из исследованных объектах выше активность каталазы? Почему?
Работа 89. Определение активности пероксидазы в растениях
Вводные пояснения. Пероксидаза – двухкомпонентный фермент класса оксидоредуктаз подкласса оксидаз, активной группой которого, как и у каталазы, является гемин. Следовательно, по химическому строению пероксидаза сходна с каталазой. Различие в ферментативной деятельности каталазы и пероксидазы заключается только в разном свойстве белка. В растительных тканях она может быть в 2х формах: растворимой и нерастворимой.
Пероксидаза термостабильна: она может проявлять активность даже после кипячения. Оптимум рН – нейтральная или слабощелочная среда.
Пероксидаза повышает активность органических пероксидов, а также перекиси водорода, благодаря чему перекись приобретает способность действовать как акцептор водорода и окислять полифенолы (полифенолоксидаза), ароматические амины, жирные кислоты, цитохром (цитохромоксидаза) и другие соединения. Под действием перекиси водорода, активированной пероксидазой, может происходить окисление органических веществ типа гидрохинона, при этом бесцветный гидрохинон переходит в хинон бурого цвета. На этом и основан метод обнаружения пероксидазы. Реакция идет по следующей схеме:
248

пероксидаза
AH2+H2O2 |
|
|
A + 2H2O + -О- |
||||||||||
|
|
||||||||||||
|
OH |
|
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пероксидаза |
||||||||
|
|
|
|
+ H2O2 |
|
|
|
|
|
|
|
|
+ 2H2O |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
O |
|||
Гидрохинон |
Хинон |
|||
(бесцветный) |
(бурый) |
|||
Пероксидазы активны в клетках и тканях, где наиболее проявляются обменные процессы. Среди пероксидаз особенно хорошо изучена пероксидаза, содержащаяся в корнях хрена. Много этого фермента содержится в клубнях картофеля.
Цель работы. Определить активность пероксидазы в клубне картофеля, корнеплодах моркови и свеклы путем окисления бесцветного гидрохинона в хинон бурого цвета.
Материалы и оборудование: клубни картофеля и кор-
неплоды моркови, сахарной свеклы; 1% раствор гидрохинона; 3% раствор перекиси водорода; терка; марля; колба; пипетки на 1 и 10 мл; пробирки и штатив для пробирок.
Ход работы. На терке натирают очищенный клубень картофеля или корнеплод моркови, свеклы и отжимают сок через марлю в колбу и дают отстояться. Берут 7 пробирок. В них наливают по 5 мл 1% раствора гидрохинона. Затем: в 1- ю пробирку добавляют 1 мл 3% раствора перекиси водорода
и
1 мл сока исследуемого материала; во 2-ю пробирку – 1 мл 3% раствора перекиси водорода; в 3-ю пробирку – 1 мл сока исследуемого материала; в 4-ю пробирку – 1 мл 3% перекиси водорода и 1 мл прокипяченного сока исследуемого материала; в 5-ю пробирку – 1 мл 3% раствора перекиси водорода и 2 мл 10% NaOH; в 6-ю пробирку – 1 мл 3% раствора
249

перекиси водорода и 0,2 мл 10% NaOH; в 7-ю пробирку добавляют также 1 мл 3% перекиси водорода и 2 мл 10% соляной кислоты. Сравнивают цвета растворов в пробирках. Результаты заносят в таблицу:
№№ |
|
Состав смеси в пробирках |
|
Окраска |
||||
сок |
|
|
|
|
|
|||
проби- |
|
гидро- |
|
|
|
растворов в |
||
исследуемого |
Н2О2 |
NaOH |
HCl |
кипячение |
||||
рок |
хинон |
пробирках |
||||||
материала |
|
|
|
|
||||
|
|
|
|
|
|
|
||
1 |
1 |
1 |
5 |
- |
- |
- |
|
|
2 |
- |
1 |
5 |
- |
- |
- |
|
|
3 |
1 |
- |
5 |
- |
- |
- |
|
|
4 |
1 |
1 |
5 |
- |
- |
кипячение |
|
|
5 |
1 |
1 |
5 |
2 |
- |
- |
|
|
6 |
1 |
1 |
5 |
0,2 |
- |
- |
|
|
7 |
1 |
1 |
5 |
- |
2 |
- |
|
|
На основе полученных результатов делают выводы.
Вопросы для самоконтроля
1.К какому классу ферментов относится пероксидаза?
2.Какое значение в жизни растений имеет пероксидаза?
3.Чем отличается пероксидаза от каталазы?
4.На чем основано определение пероксидазы в данной работе?
5.Что является окислителем гидрохинона в проведенной реакции?
6.Какова при этом роль пероксидазы?
7.В какой пробирке побурение идет быстрее и почему?
Работа 90. Обнаружение активности дегидрогеназ в дрожжах
Вводные пояснения. Дегидрогеназы – двухкомпонентные ферменты класса оксидоредуктаз, катализирующие реакции отщепления водорода от одного субстрата (донора, восстановителя) и перенос его к другому (акцептору, окислителю).
дегидрогеназа
АН2 + В |
А +ВН2 |
По характеру действия дегидрогеназы делятся на аэробные и анаэробные. Аэробные дегидрогеназы, называемые оксидазами, переносят водород непосредственно на молекулярный кислород, в результате образуется вода или перекись водорода. Анаэробные дегидрогеназы могут переда-
250
