
701
.pdf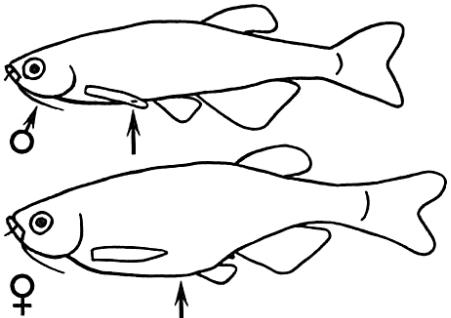
ло имеет цилиндрическую форму (рисунок 19), серебристое с 7-9 темно-синими горизонтальными полосами. Эти полосы идут к хвостовому и анальному плавникам (МР ЦОС ПВ Р
005-95).
Рисунок 19.Отличительные половые признаки и строение Brachydanio rerio Hamilton-Buchanan. Самка (внизу) и самец (вверху) (Кочетов А.М., 1991).
Методики биотестирования с помощью ракообразных и рыб. Рассмотрим разнообразие методик биотестирования с использованием ракообразных и рыб.
ПНД Ф Т 14.1:2:3:4.12-06 Т 16.1:2:2.3:3.9-06 (издание
2014 г.) Методика измерений количества Daphnia magna Straus для определения токсичности питьевых, пресных природных и сточных вод, водных вытяжек из грунтов, почв, осадков сточных вод, отходов производства и потребления методом прямого счета. Методика предназначена для определения в течение 48 часов острой токсичности питьевых, пресных природных и сточных вод, водных вытяжек из грунтов, почв, осадков сточных вод, отходов производства и потребления. Биотестирование по воздействию токсикантов,
80
содержащихся в пробе воды, на выживаемость рачков дафний.
ПНД Ф Т 14.1:2.14-06 Т 16.1:3.11-06 Методика определения токсичности высокоминерализованных поверхностных и сточных вод, почв и отходов по выживаемости солоноватоводных рачков Artemia salina L. Методика определения острой токсичности высокоминерализованных водных вытяжек из почв и отходов, поверхностных и сточных вод по реакции солоноватоводных рачков Artemia salina L. с уровнем солености от 6% и выше.
ПНД Ф Т 16.3.12-07 Методика определения токсичности золошлаковых отходов методом биотестирования на основе выживаемости парамеций и цериодафний. Документ устанавливает методику определения токсичности водных вытяжек из золошлаковых отходов, нейтрализованных двуокисью углерода (СО2) в лабораторных условиях. Методика распространяется на золошлаковые отвалы (ЗШО) тепловых электростанций (ТЭС) и котельных.
МР № ЦОС ПВ Р 005-95 Методические рекомендации по применению методов биотестирования для оценки качества воды в системах хозяйственно-питьевого водоснабжения. Рассмотрены методики биотестирования с использованием клеточного тест-объекта, инфузорий, бактерий (Escherichia coli), ракообразных, микроводорослей и рыб.
Руководство по определению методом биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов (Михеев Н.Н., 2002).
2.3.1 ЛАБОРАТОРНОЕ ЗАНЯТИЕ
Биотестирование с помощью ракообразных
Цель: научиться выбирать и пользоваться методом биотестирования различных объектов с помощью ракообразных.
Основные понятия (категории): биотестирование, фитотести-
81
рование, модельный токсикант, тест-реакция, Daphnia magna
Straus, Ceriodaphnia affinis Lilljeborg и Artemia salina L.
Изучаемые вопросы:
1.Выбор методики проведения биотестирования.
2.Выбор тест-объекта. Изучение методики биотестиро-
вания.
3.Биологические особенности Daphnia magna Straus,
Ceriodaphnia affinis Lilljeborg и Artemia salina L.
4.Составление схемы и постановка эксперимента по биотестированию проб воды, загрязнённых модельным токсикантом (бихромат калия).
5.Изучение особенностей синхронизации культуры для целей биотестирования. Выявление половых признаков.
6.Изучение особенностей содержания, кормления и ухода за ракообразными, используемыми в биотестировании.
7.Особенности визуальной диагностики в биотестиро-
вании.
8.Особенности статистической обработки результатов исследований.
9.Подготовка заключения по результатам биотестиро-
вания.
Последовательность выполнения:
а) Составьте схему по биотестированию проб воды, загрязнённых модельным токсикантом (бихромат калия).
б) Налейте анализируемую пробу воды по 100 см3 в три стеклянных стакана (опыт). Налейте культивационную воду по 100 см3 в три следующих стеклянных стакана (контроль).
в) В каждый стакан поместите по 10 дафний возрастом до 24 часов с помощью глазной пипетки или стеклянной трубки диаметром 5-7 мм.
г) Через час визуально посчитайте количество живых
82
дафний (острая токсичность). Живыми считают дафний, которые свободно передвигаются в толще воды или всплывают со дна сосуда не позднее, чем через 15 секунд после его легкого встряхивания. Остальных дафний считают погибшими.
д) Через 7 суток повторите подсчет. Длительный эксперимент позволяет выявить возможное хроническое токсическое действие пробы на выживаемость и плодовитость тесторганизма. Во время длительного биотестирования дафний кормят.
е) Сделайте заключение о токсичности исследуемой пробы воды. Критерием токсичности является гибель более 20% дафний или достоверное снижение их плодовитости по сравнению с контролем. Результаты биотестирования считаются достоверными, если гибель дафний в контроле за весь период наблюдений не превышает 10%.
2.3.2 ЛАБОРАТОРНОЕ ЗАНЯТИЕ
Биотестирование с помощью рыб
Цель: научиться выбирать и пользоваться методом биотестирования с помощью рыб.
Изучаемые вопросы:
1.Выбор методики проведения биотестирования.
2.Выбор тест-объекта. Изучение методики биотестиро-
вания.
3.Биологические особенности Poecilia reticulata Peters как тест-объекта.
4.Составление схемы и постановка эксперимента по биотестированию проб воды, загрязнённых модельным токсикантом (бихромат калия). Получение мальков.
5.Особенности визуальной диагностики в биотестировании с использованием рыб.
6.Статистическая обработка результатов исследований.
83
7. Подготовка заключения по результатам биотестирования.
Основные понятия (категории): Poecilia reticulata Peters,
биотестирование, модельный токсикант, тест-реакция.
Последовательность выполнения:
а) Составьте схему по биотестированию проб воды, загрязнённых модельным токсикантом (бихромат калия).
б) Налейте анализируемую пробу воды по 500 см3 в три стеклянных стакана (опыт). Налейте культивационную воду по 500 см3 в следующие три стеклянных стакана (контроль).
в) В каждый стакан поместите по 10 экземпляров гуппи возрастом от 24 до 48 часов.
г) Через час проведите визуальное наблюдение за поведением и состоянием мальков по вариантам опыта и повторностям.
д) Через 96 часов (4 суток) посчитайте количество живых мальков. Во время биотестирования мальков гуппи не кормят.
е) Сделайте заключение о токсичности исследуемой пробы воды. Критерием токсичности является гибель более 20% мальков гуппи. Результаты я считаются достоверными, если гибель мальков в контроле не превышает 10%.
Рекомендуется темы для обсуждения
1.Патенты на новые изобретения и модели, связанные с биотестированием с использованием ракообразных и рыб.
2.Новые научные публикации в российских и иностранных журналах, связанные с проблемой разработки, внедрения и использования методов биотестирования с использованием ракообразных и рыб.
3.Изучение официальных методик биотестирования с помощью ракообразных и рыб.
84
ВОПРОСЫ ДЛЯ ПОДГОТОВКИ К ЗАЧЕТУ
1.Понятие о биотестировании. Принципы биотестирования. Место биотестирования в системе экологического мониторинга.
2.Ответная реакция, селективность и чувствительность тест-организма (биотестера).
3.Разнообразие методик биотестирования и их классификация. Понятие об официальной методике исследований в биотестировании.
4.Методики биотестирования с использованием бактерий, половых клеток млекопитающих и специальное оборудование для этих целей.
5.Особенности организации и функционирования лаборатории по биотестированию.
6.Методы прямого учета (двигательная активность, смертность, интенсивность размножения и др.) и косвенного учета в биотестировании.
7.Микроскопирование в биотестировании. Основы работы с микроскопом.
8.Использование счетных камер в биотестировании и особенности работы с ними. Разнообразие счетных камер.
9.Фотоколориметрический и фуоресцентный метод в биотестировании.
10.Применение и особенности функционирования прибора серии «Биотестер».
11.Методика статистической обработки результатов исследований и их интерпретация.
12.Особенности заполнения отчетной документации и протоколов биотестирования.
13.Новые направления в биотестировании.
14.Видовое разнообразие микроводорослей, используемых в биотестировании. Систематика наиболее распространенных видов микроводорослей.
85
15.Методики биотестирования с помощью высших растений и их особенности.
16.Характеристика, разнообразие, систематика и биологические особенности простейших. Методы получения чистых культур простейших.
17.Характеристика представителей простейших, используемых в биотестировании. Методы определения видовой принадлежности простейших.
18.Особенности биотестирования с помощью
Paramecium caudatum.
19.Особенности биотестирования с помощью
Stylonychia mytilus.
20.Характеристика, разнообразие, систематика и биологические особенности ракообразных и рыб, используемых в биотестировании.
21.Методы определения видовой принадлежности, получения чистых культур и синхронизированных популяций ракообразных.
22.Особенности биотестирования с помощью ракооб-
разных.
23.Особенности биотестирования с помощью рыб.
86
ЗАКЛЮЧЕНИЕ
Экологический мониторинг заключается в непрерывной оценке состояния объектов окружающей среды с целью предупреждения и предотвращения негативного влияния на здоровье населения, природные объекты, а также биоту. Экологический мониторинг реализуется повсеместно, включая территорию Пермского края.
Программы мониторинга включают биологические методы мониторинга, в том числе и биотестирование.
Владение знаниями и практическими навыками в области биологических методов мониторинга и, в частности, биотестирования – одно из требований к биологам и экологам, занимающимся данным видом деятельности. Оно является важным и для экологов предприятий и организаций для правильной интерпретации данных о токсичности образующихся отходов производства и потребления. Эти знания и навыки позволяют учитывать современные тенденции включения методов биологического мониторинга в программы производственного экологического контроля.
Использование данного учебно-методического пособия позволит обучающимися улучшить освоение учебного материала. Теоретический материал, размещенный в первой главе является основной для выполнения всех лабораторных работ реализуемых во время изучения дисциплины. Данный материал включает методическое обоснование выбора метода учета, средств измерений, математический аппарат для обработки результатов биотестирования. Методическое обеспечение выполнения лабораторных работ изложено индивидуально в каждой работе. Использование приведенных в конце каждого раздела тем для обсуждения позволит глубже изучить учебный материал.
87
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1.Об утверждении федерального государственного образовательного стандарта высшего образования по направлению подготовки 05.03.06 Экология и природопользование (уровень бакалавриата) : приказ Минобрнауки России от 11.08.2016 № 998 ; ред. от 13.07.2017 // СПС КонсультантПлюс. Законодательство. – URL : http://www.consultant.ru/.
2.Барсуков, Н.П. Цитология, гистология, эмбриология : учебное пособие / Н.П. Барсуков. – Санкт-Петербург : Лань, 2019. – 248 с.
3.Биологический контроль окружающей среды : биоиндикация и биотестирование / Ред. О. П. Мелехова, Е. И. Сарапульцева. – Москва : Издательский центр Академия, 2010. – 288 с.
4.Биологический энциклопедический словарь / Ред. М. С. Гиляров. – Москва : Советская Энциклопедия, 1986. – 600 с.
5.Волкова, И. В. Оценка качества воды водоемов рыбохозяйственного назначения : учебное пособие для вузов / И. В. Волкова, Т. С. Ершова, С. В. Шипулин. – Москва : Издательство Юрайт, 2019. – 294 с.
6.Кочетов, А. М. Декоративное рыбоводство / А. М. Кочетов. – Москва : Просвещение, 1991. – 384 с.
7.Лемеза, Н.А. Практикум по основам ботаники. Водоросли и грибы : учебное пособие / Н.А. Лемеза. – Минск : Вышэйшая школа, 2017. – 255 с.
8.Липин, А. Н. Пресные воды и их жизнь / А. Н. Липин. – Москва : Учпедгиз, 1950. – 348 с.
9.Лобиков, А.В. Методы контроля качества среды, экомониторинг : методические указания к лабораторным работам / А.В. Лобиков, Е.В. Шашина. – М.: МАДИ, 2016. – 24 с.
10.Методические рекомендации по ускоренному определению токсичности
ибезвредности кормов и кормовых добавок. – Минск : Гродненский государственный аграрный университет, 2015. – 12 с.
11.Михеев, Н. Н. Руководство по определению методом биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов / Н. Н. Михеев. – Москва : РЭФИА, НИА-Природа, 2002. – URL : https://aquariumok.ru/sites/default/files/filenode/398/rukovodstvo _po_opredeleniyu_metodom_biotestirovaniya_toksichnosti_vod_donny.pdf.
12.Никитина, Н. Г. Аналитическая химия и физико-химические методы анализа : учебник и практикум для академического бакалавриата / Н. Г. Никитина, А. Г. Борисов, Т. И. Хаханина ; под редакцией Н. Г. Никитиной. – Москва : Издательство Юрайт, 2019. – 394 с.
13.Определитель пресноводных беспозвоночных России и сопредельных территорий. Т. 2. Ракообразные / С. Я. Цалолихин. – Санкт-Петербург : Наука, 1995. – 400 с.
14.Перечень методик. Токсикологические методы контроля. Федеральный центр анализа и оценки техногенного воздействия (ФЦАО) Росприроднадзора. –
URL : http://fcao.ru/sites /all/themes/fcao /docs/all_q uestions .pdf.
15.Петряков, В.В. Экологический мониторинг : методические указания / В.В. Петряков. – Кинель : РИО СГСХА, 2019. – 35 с.
16.Пименова, Е.В. Гигиеническое и экологическое нормирование качества окружающей среды: учебное пособие / Е.В. Пименова, Т.Ю. Насртдинова, С.В. Лихачев. – Пермь: ИПЦ «Прокрость», 2017. – 151 с.
88
17.Плешакова, В.И. Микробиология : учебное пособие / В.И. Плешакова, Н.А. Лещева, Т.И. Лоренгель. – Омск : Омский ГАУ, 2019. – 75 с.
18.Практическая экотоксикология: Оценка чувствительности биотесткультур / Ред. В. А. Терехова. – Москва : ГЕОС, 2016. – 54 с.
19.Рабочая программа дисциплины Экологический мониторинг для
05.03.06Экология и природопользование / сост. С. В. Лихачёв, Т. Ю. Насртдинова, Е. В. Пименова, С. Н. Жакова. – Пермь : Пермский государственный аграрнотехнологический университет имени академика Д. Н. Прянишникова, 2018. – 37 с.
20.Способ биотестирования проб воды и устройство для его осуществления / Д.Е. Иванов, Л.Л. Журавлева, А.В. Рейтер [и др.]. Патент РФ № 2409813. 2008. –
URL: http://www.freepatent.ru/patents/2409813.
21.Algae Base.World-wide electronic publication, National University of Ireland, Galway. – URL: http://www.algaebase.org.
22.Heijerick, D.G., De Schamphelaere K.A.C., Janssen C.R. Corrigendum to
«Biotic ligand model development predicting Zn toxicity to the alga Pseudokirchneriella subcapitata: possibilities and limitations» Comp. Biochem. Physiol. 2003. Issue 4. Vol.
135. – URL: https://link.springer.com/article/10.1007/s10646-005-0014-8.
23.Hoek van den C., Mann D.G., Jahns H.M. Algae. An introduction to phycology. Cambridge, 1995. Vol. – 623.
24.Ozkaleli Merve and Erdem Ayca Biotoxicity of TiO2 Nanoparticles on Raphidocelis subcapitata Microalgae Exemplified by Membrane Deformation // Int. J. Environ. Res. Public Health. 2018. 15(3). – URL: https://doi.org/10.
25.3390/ijerph15030416.
89
