
- •Функциональная организация ферментов.
- •Регуляция биосинтеза ферментов.
- •Изоферменты.
- •Мультиферментные системы.
- •Зависимость скорости ферментативной реакции от количества ферментов.
- •Зависимость скорости ферментативной реакции от температуры среды.
- •Зависимость скорости ферментативной реакции от рН среды.
- •Зависимость скорости ферментативной реакции от количества субстрата.
- •Способы регуляции активности ферментов.
- •Регуляция количества ферментов.
- •Влияние активаторов и ингибиторов на активность ферментов, активаторы ферментов, ингибиторы ферментов.
- •Регуляция каталитической эффективности ферментов.
- •Активность ферментов, методы измерения активности.
- •Воспроизводимые суммарные параметры реакций; Удельная активность, Степень активности фермента.
- •Очистка фермента, методы определения ферментных белков.
- •Пути исследования ферментов.
- •Методы выделения ферментов.
- •Методы очистки ферментов, физические методы, биологические методы. Выдавливание клеток.
- •Получение белков в чистом виде.
- •Высаливание. Методы дезинтеграции клеток.
- •Ферменты гликозилирования.
- •Медицинская энзимология: энзимопатология, энзимодиагностика и энзимотерапия, наследственные энзимопатии, клеточные ферменты, Секреторные ферменты, Экскреторные ферменты.
- •Применение ферментов в промышленности и сельском хозяйстве. Иммобилизованные ферменты.
- •Применение ферментных препаратов в молочной промышленности.
- •Применение ферментных препаратов в хлебопечении.
- •Ферменты как аналитические реагенты.
Активаторы =44
Ингибиторы =44
Способы регуляции активности ферментов.
Активность ферментов, а значит и скорость химической реакции, можно регулировать, изменяя следующие параметры:
1) Абсолютное количество фермента.
2) Условия протекания реакции (рН, t, р), количество субстрата, наличие активаторов, ингибиторов.
3) Каталитическую эффективность фермента.
(есть в 36-39)
Регуляция количества ферментов.
Абсолютное количество фермента в клетке определяется скоростями его синтеза и распада. В клетке существует два вида ферментов:
1. Конститутивные ферменты – всегда присутствуют в клетках данного организма. Они являются обязательными компонентами клетки, синтезируются с постоянной скоростью в постоянных количествах.
2. Адаптивные ферменты – их образование зависит от условий, складывающихся в клетке. Среди них выделяют индуцируемые и репрессируемые ферменты.
Индуцируемыми обычно бывают ферменты с катаболической функцией (катаболизм – процессы распада). Их образование может быть вызвано или ускорено субстратом данного фермента.
Репрессируемыми обычно бывают анаболические ферменты (анаболизм – процессы синтеза). Ингибитором (репрессором) синтеза ферментов может быть конечный продукт данной ферментативной реакции.
Влияние активаторов и ингибиторов на активность ферментов, активаторы ферментов, ингибиторы ферментов.
Активаторы ферментов – вещества, которые разными путями повышают способность ферментов ускорять реакцию.
Свойства активаторов:
1. Формируют активный центр фермента (Со2+, Mg2+, Zn2+, Fe2+, Cu2+). 2. Облегчают образование фермент-субстратного комплекса (Mg2+,
Мn2+).
3. Стабилизируют нативную структуру фермента.
4. Защищают функциональные группы активного центра от повреждения, например, восстанавливают SH-группы активного центра (глутатион, цистеин).
5. Воздействуют на субъединицы молекулы фермента (протеин-киназа регулируется цАМФ).
Активаторами обычно бывают катионы (в таблице Менделеева с 19 по 30), реже анионы. Исключение: ионы хлора и анионы других галогенов активируют пепсин, амилазу, аденилатциклазу. Активаторами могут быть белки: апопротеины АI активирует ЛХАТ, апопротеины СII → ЛПЛ.
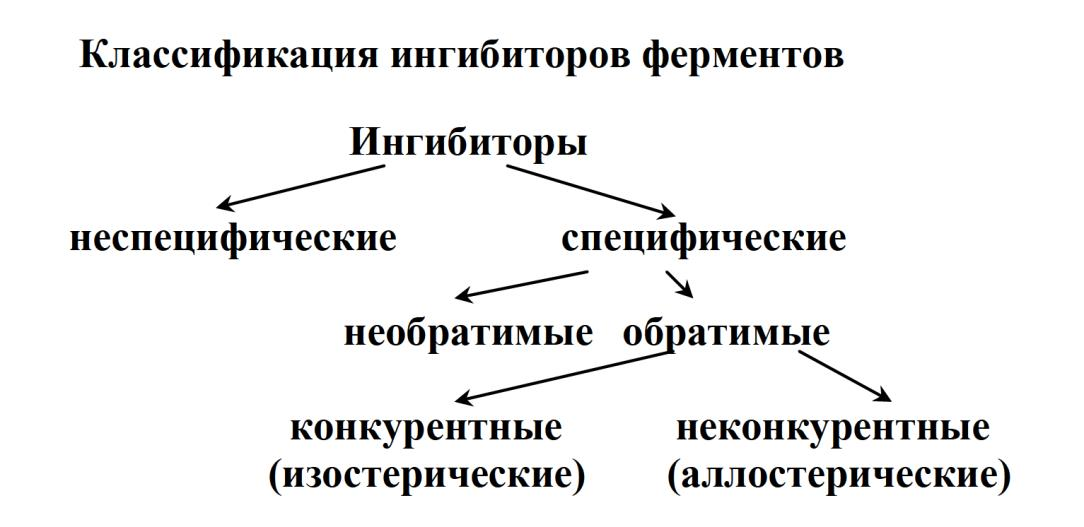
Ингибиторы ферментов
Это соединения, которые взаимодействуя с ферментом, препятствуют образованию нормального фермент-субстратного комплекса, уменьшая тем самым скорость реакции или прекращая её.
·
Неспецифические ингибиторы вызывают денатурацию фермента (соли тяжелых металлов, кислоты, щелочи). Их действие не связано с механизмом ферментативного катализа.
· Специфические ингибиторы – их действие связано с механизмом ферментативного катализа.
При необратимом ингибировании образуется прочный комплекс фермента и ингибитора, и фермент частично или полностью теряет свою активность. Даже если удалить свободный ингибитор из среды, та часть молекул фермента, которая успела связаться с ингибитором, остается угнетенной длительное время.
Примеры необратимых ингибиторов
1. Ингибиторы металлосодержащих ферментов – НСN, KCN, CO, NaN3 – дыхательные яды, они стойко меняют валентность Fe и Сu, входящих в состав ферментов дыхательной цепи, препятствуя переносу электронов на О2.
2. Вещества, связывающие SH группы активного центра – моноиодацетат, соединения ртути и мышьяка.
3. Вещества, связывающие OH-группы серина в активном центре – фосфорорганические соединения – боевые отравляющие вещества.
В случае обратимого действия ингибитор образует с ферментом непрочный комплекс, способный распадаться, в результате чего снова возникает активный фермент. Обратимые ингибиторы бывают конкурентные и неконкурентные.
Конкурентный ингибитор – эта молекула очень похожая на субстрат и фермент не может различить их, т.е. ингибитор и субстрат конкурируют за активный центр фермента.
В результате связывания конкурентного ингибитора с активным центром фермента падает концентрация фермент-субстратных комплексов и скорость реакции уменьшается, т.к. комплекс ингибитор-фермент I-Е не способен давать продукт. Однако для активного центра фермента все же лучше подходит субстрат. Поэтому при достаточно большой концентрации субстрата его молекулы начнут вытеснять ингибитор I из активного центра фермента, увеличится число молекул фермент-субстратного комплекса ЕS и скорость реакции увеличится.
 Т.е. путем увеличения концентрации субстрата можно
нейтрализовать
действие конкурентного ингибитора и
достичь
максимальной
скорости
реакции
(реакция
7.1).
Однако
для
ее
достижения
потребуется
гораздо
большая
концентрация
субстрата
(рисунок
7.1).
Т.е. путем увеличения концентрации субстрата можно
нейтрализовать
действие конкурентного ингибитора и
достичь
максимальной
скорости
реакции
(реакция
7.1).
Однако
для
ее
достижения
потребуется
гораздо
большая
концентрация
субстрата
(рисунок
7.1).
Действие конкурентных ингибиторов:
Вывод: конкурентные ингибиторы увеличивают Km реакции, но не влияют на Vmax.
Неконкурентные ингибиторы связываются не с активным центром фермента, а с каким-либо другим участком фермента (часто с аллостерическим центром). В результате активный центр фермента свободен и к нему может присоединиться субстрат, т.е. образуется комплекс ЕSI (реакция 7.2).
 Механизм
ингибирования
состоит
в
том,
что
комплекс
ЕSI
медленно
образует
продукт
и
увеличение
[S]
не
влияет
на
Vmах,
Vmах
реакции
будет
снижена
(рисунок
7.2).
Поскольку
эти
ингибиторы
не
мешают
связыванию
субстрата
с
активным
центром
–
величина
Кm
не
меняется.
Механизм
ингибирования
состоит
в
том,
что
комплекс
ЕSI
медленно
образует
продукт
и
увеличение
[S]
не
влияет
на
Vmах,
Vmах
реакции
будет
снижена
(рисунок
7.2).
Поскольку
эти
ингибиторы
не
мешают
связыванию
субстрата
с
активным
центром
–
величина
Кm
не
меняется.
 Действие
неконкурентных
ингибиторов:
Действие
неконкурентных
ингибиторов:
Реакция 7.2— Кинетика ферментативных реакций при действии неконкурентных ингибиторов
Вывод: неконкурентные ингибиторы понижают Vmax, но не влияют на Km.
