- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
Галогенирование:
Реакция протекает легко с хлором (Сl2), несколько труднее с бромом (Вг2), наиболее трудно – с йодом (I2). Фтор слишком активен и вызывает деструкцию алкена. Реакция с раствором Вr2 («бромная вода») является качественной на наличие кратной связи (в данном случае - двойной).
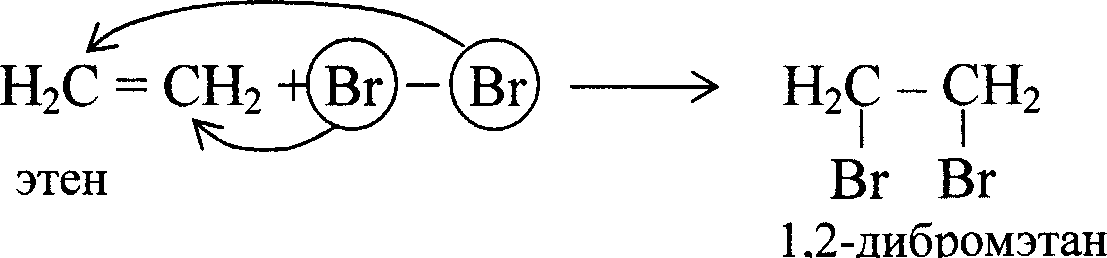
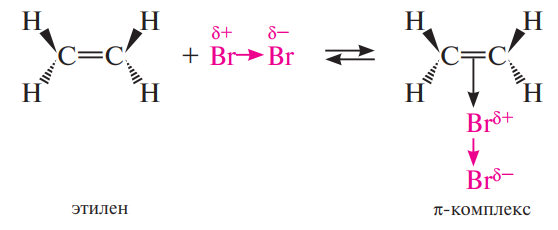
Механизм: (3 стадии)
На первой стадии происходит поляризация молекулы галогена под действием электронов π -связи алкена. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами π - связи нестабильный интермедиат, называемый π -комплексом или комплексом с переносом заряда. В этом комплексе просто реализуется донорно- акцепторное взаимодействие электронной пары π-связи как донора и галогена как акцептора.
Далее π-комплекс превращается в циклический бромониевый ион. В процессе образования этого циклического катиона происходит гетеролитический разрыв связи Br-Вr и пустая р-орбиталь sp2- гибридизованного атома углерода перекрывается с р-орбиталью "неподеленной пары" электронов атома галогена, образуя циклический ион бромония.
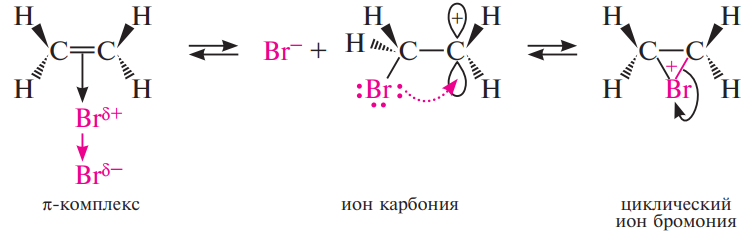
На последней, третьей стадии анион брома как нуклеофильный агент атакует один из атомов углерода бромониевого иона. Нуклеофильная атака бромид-иона приводит к раскрытию трехчленного цикла:
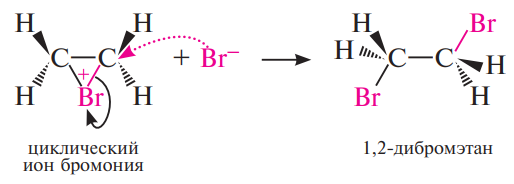
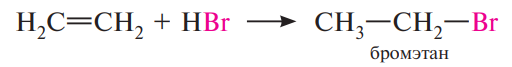
Гидрогалогенирование:
Реакционная способность галогеноводородов с алкенами возрастает в ряду: HF < HCl < HBr < HI.
Схема:
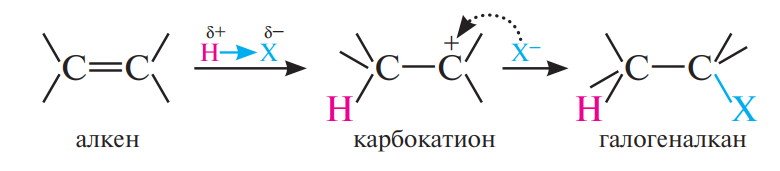
Пример:
Правило Марковникова и его объяснение:
В реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
Современная формулировка правила Марковникова: электрофильное присоединение к двойной связи идет через образование наиболее устойчивого карбокатиона.
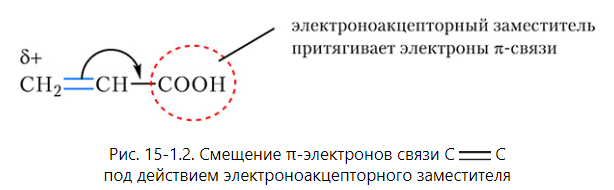
Правило Марковникова объясняется влиянием заместителей на электроны π-связи. По этому признаку все заместители можно разделить на две группы:
1.
Заместители, которые притягивают
электроны π-связи. Такие заместители
называются электроноакцепторными.
Примеры электроноакцепторных заместителей:
карбоксильная группа ![]() COOH и
нитрогруппа
NO2.
Смещение электронов π-связи под действием
электроноакцепторного заместителя
показано на рисунке 15-1.2:
COOH и
нитрогруппа
NO2.
Смещение электронов π-связи под действием
электроноакцепторного заместителя
показано на рисунке 15-1.2:
2. Заместители, которые отталкивают электроны π-связи (электронодонорные заместители). К электронодонорным заместителям относятся алкильные радикалы CH3, C2H5 и др., гидроксильная группа OH и аминогруппа NH2. Смещение электронов π-связи под действием электронодонорного заместителя показано на рисунке 15-1.3:
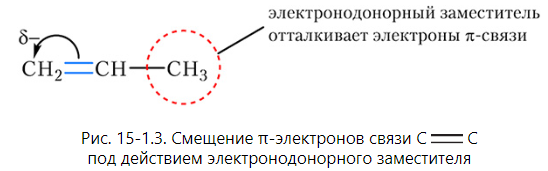
Рассмотрим присоединение хлороводорода к пропену с учётом влияния заместителей на электроны π-связи:

Положительно заряженный атом водорода молекулы хлороводорода присоединяется к атому углерода двойной связи, несущему отрицательный заряд. Этим атомом углерода является более гидрогенизированный атом C(1), что соответствует правилу Марковникова.
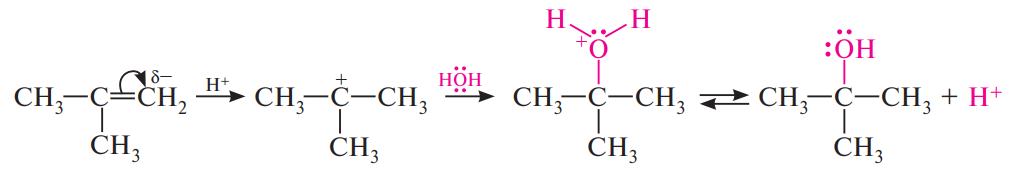
Гидратация:
В присутствии минеральных кислот — серной, азотной, хлорной и других — алкены присоединяют по месту разрыва двойной связи воду. Реакция протекает в соответствии с правилом Марковникова и приводит к образованию спиртов:
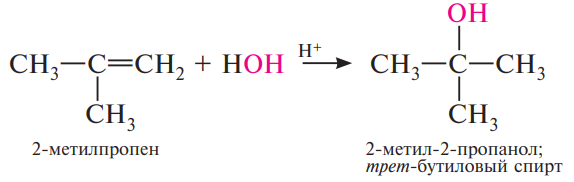
Механизм: