- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
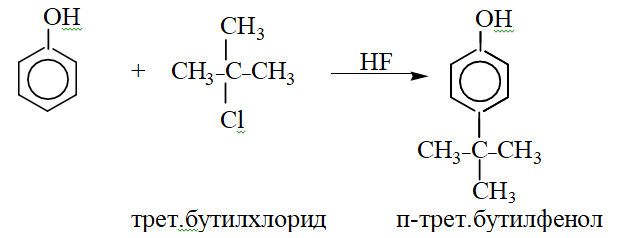
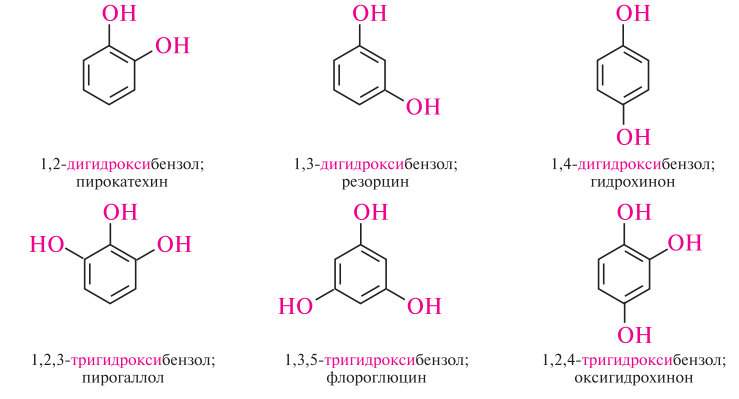
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
Фенолы – это ароматические соединения, молекула которых содержит гидроксильную (ные) группу (ы) напрямую соединенную с бензольным кольцом
 Фенол
– бесцветные
игольчатые кристаллы,
розовеющие на воздухе из-за окисления,
растворим в воде, токсичен, может вызывать
ожоги.
Фенол
– бесцветные
игольчатые кристаллы,
розовеющие на воздухе из-за окисления,
растворим в воде, токсичен, может вызывать
ожоги.
Пирокатехин – кристаллическое вещество, растворимое в воде и в спиртах. на свету и воздухе приобретает коричневую окраску вследствие окисления. обладает антисептическими свойствами, используется как исходное вещество в синтезе лекарственного препарата — адреналина;
Резорцин – кристаллическое вещество, растворимое в воде. Применяется в производстве красителей, резорциноформальдегидных смол. хороший антисептик при лечении кожных заболеваний. резорцин раздражает кожу и слизистые оболочки.
Пирогаллол – белое кристаллическое вещество, растворимое в воде, спиртах. на свету темнеет. Используется в производстве красителей, как восстановитель в органическом синтезе, проявитель в фотографии.
Флороглюцин – кристаллическое вещество, растворимое в спиртах и плохо — в воде, возгоняется. Применяется как азосоставляющий компонент светочувствительных бумаг и пленок.
Гидрохинон – белые или бесцветные призматические кристаллы, сладковатые на вкус, растворим в воде, обладает проявляющими свойствами.
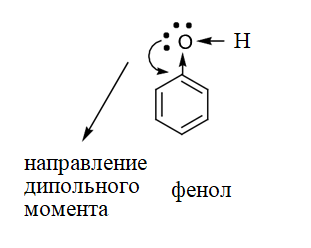
Фенолы полярные соединения. Фенолы имеют дипольный момент и он направлен в сторону бензольного кольца.
Фенолы проявляют значительно большую кислотность, чем спирты или вода, однако, как кислоты, они слабее, чем угольная и карбоновые кислоты.
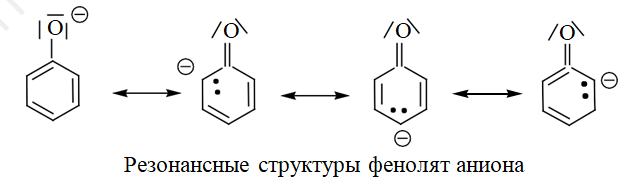
Увеличение кислых свойств фенолов связано с положительным мезомерным эфекфтом (+М), в результате которого в ароматическое кольцо смещается электронная плотность от кислорода, что в свою очередь, еще больше способствует поляризации ОН-группы.
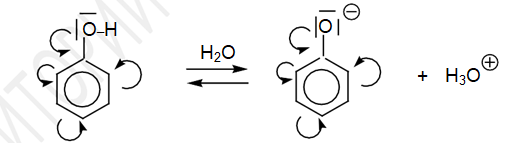
Образование фенолят аниона выгоднее, чем алкоголят-аниона, так как происходит образование устойчивого стабилизированного резонансом аниона.
Введение в ароматическое ядро фенола электронодонорных заместителей уменьшает кислотность, а введение электроноакцепторных увеличивает.
Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
Нуклеофильные свойства. Образование простых и сложных эфиров.
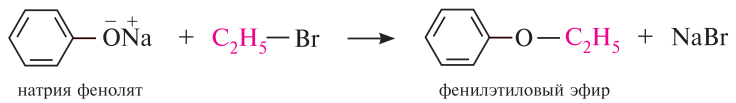
Аналогично протекает реакция образования сложных эфиров при взаимодействии фенолят-иона с ацилирующими реагентами — галогенангидридами и ангидридами карбоновых кислот (О-ацилирование)
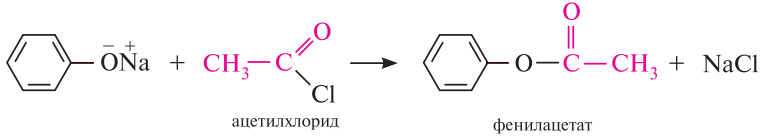
В реакцию О-ацилирования могут вступать и фенолы:

Арилирование фенолов проходит в жестких условиях в присутствии катализатора из-за малой подвижности атома галогена в ароматическом ядре.
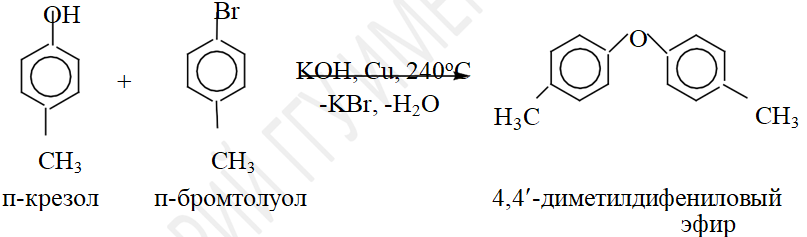
Электрофильные свойства:
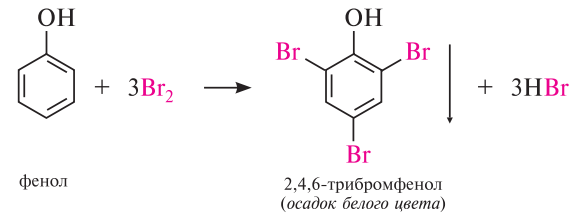
1. Галогенирование (качественная реакция!!!!)
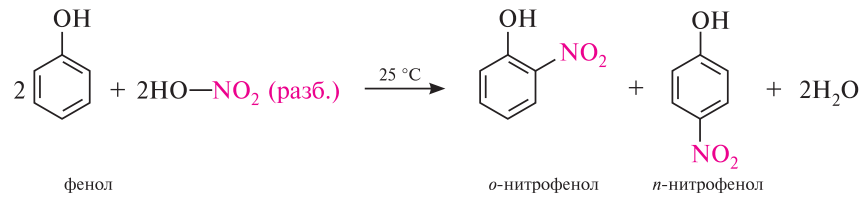
2. Нитрование
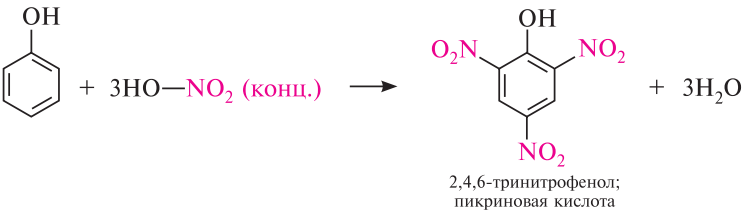
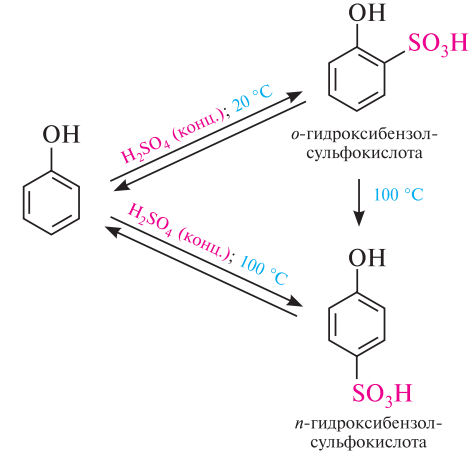
3. Сульфирование
4. Алкилирование фенолов можно проводить по реакции фриделя—крафтса (С алкилирование).