- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
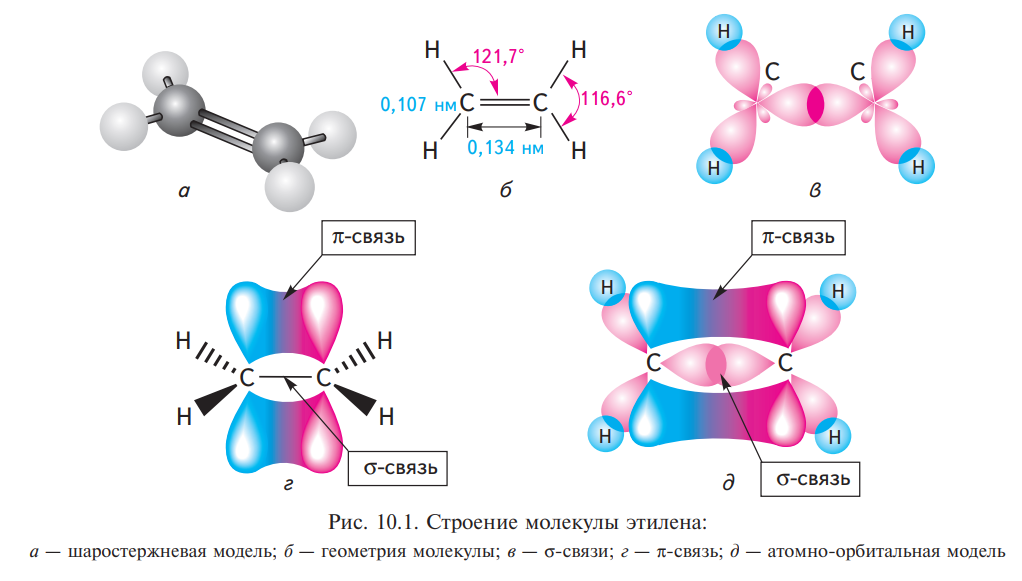
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
Непредельные углеводороды (ненасыщенные, алкены, олефины) ряда этилена, имеют общую формулу СnН2n. Согласно международной номенклатуре названия алкенов происходят от названий соответствующих алканов с заменой суффикса -ан- на -ен-.
Номенклатура:
Некоторые радикалы имеют также тривиальные названия:
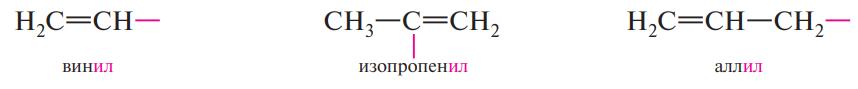
далее все как обычно
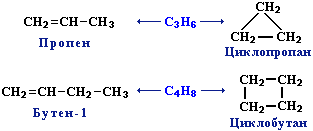
Изомерия:
Структурная изомерия(изомерия цепи и изомерия положения двойной связи, межклассовая изомерия с циклоалканами)
Пространственная изомерия, а именно геометрическа, или цис-транс- изомерия

Если у атомов углерода, связанных двойной связью, имеется три или четыре разных заместителя, используют Е,Z-систему обозначений конфигурации геометрических изомеров:
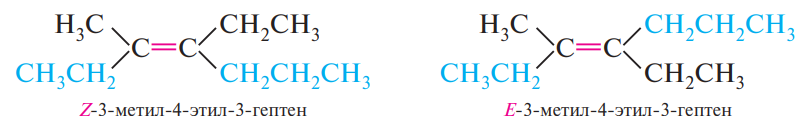
3-метил-4-этил-3-гептен может иметь Z-конфигурацию (старшие заместители при атомах углерода с двойной связью расположены по одну сторону относительно плоскости π-связи) и Е-конфигурацию (старшие заместители расположены по разные стороны относительно плоскости π-связи).
Физические свойства:
Первых четыре представителя гомологического ряда алкенов подобно алканам при нормальных условиях — газы, далее следуют жидкости (С5—С17), затем — твердые вещества.
Все алкены практически нерастворимы в воде, хорошо растворяются в органических растворителях.
Температуры кипения алкенов неразветвленного строения, как правило, выше, чем их изомеров с разветвленной цепью углеродных атомов. Цис-изомеры по сравнению с транс-изомерами имеют обычно более высокие температуры кипения и более низкие температуры плавления.
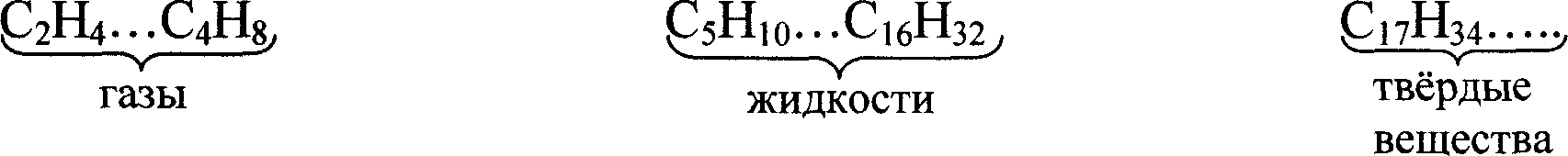
Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
Реакции электрофильного присоединения – за счет наличия в своей структуре π-связи алкены проявляют нуклеофильные (электронодонорные) свойства и вступают в реакции с электрофильными реагентами, такими, как галогены, галогеноводороды, серная кислота, вода в присутствии минеральных кислот и др.
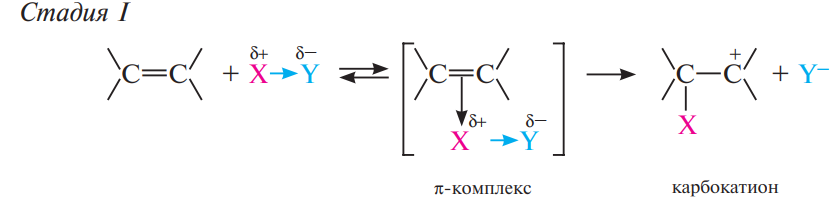
Механизм в 2 стадии:
На стадии I электрофильная частица или молекула электрофильного реагента Хδ+ Yδ– в результате электростатического взаимодействия с электронным облаком π-связи образует с молекулой алкена так называемый π-комплекс. Затем образуется ковалентная связь между электрофильной частицей X+ и одним из атомов углерода двойной связи, при этом π-комплекс превращается в карбокатион.
На стадии II карбокатион взаимодействует с освободившейся из электрофильного реагента нуклеофильной частицей Y– и образуется конечный продукт присоединения.
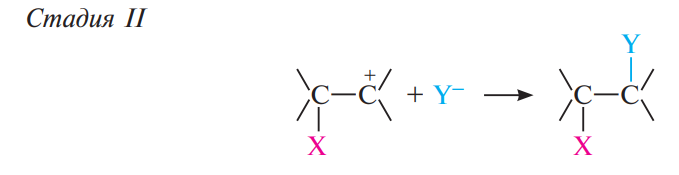
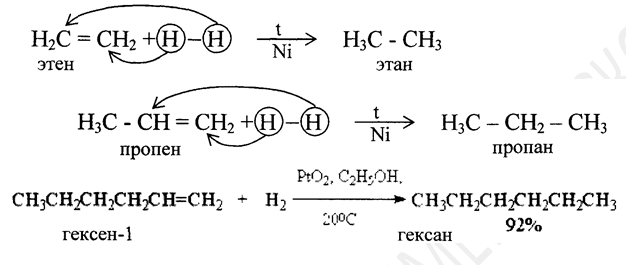
Каталитическое гидрирование
Гидрирование алкенов с катализатором PtO2 проводят обычно при нормальном давлении и температуре 20-500С в спирте, уксусной кислоте, этилацетате. Другие более активные металлы платиновой группы используют на инертных носителях, например, Pd/C или Pd/BaSO4, Ru/Al2O3; Rh/C и др. Палладий, нанесенный на уголь, катализирует гидрирование алкенов до алканов в спиртовом растворе при 0-200С и нормальном давлении. Также гидрирование происходит с такими катализаторами как Pt, Pd, Ni и др.