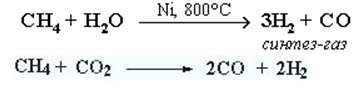- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
Алканами называют алифатические углеводороды, в молекулах которых атомы углерода связаны простыми ковалентными σсвязями.
Общая формула алканов СnН2n+2.
Алканы образуют гомологический ряд, родоначальником которого является метан. Каждый гомолог этого ряда отличается от последующего на звено СН2 (гомологическая разность). Алканы с неразветвленной цепью атомов углерода называют нормальными, или н-алканами.
Строение: Все атомы углерода в алканах находятся в состоянии sp3-гибридизации и имеют тетраэдрическую конфигурацию. Валентные углы между связями равны 109°28′ (тетраэдрический угол). Расстояние между атомами углерода в алканах составляет 0,154 нм, а между углеродным и водородным атомами – 0,110 нм.
Номенклатура: базовые знания, писать не буду
Физические свойства: В обычных условиях четыре первых представителя гомологического ряда алканов — газообразные вещества; нормальные алканы, содержащие от 5 до 17 атомов углерода — жидкости, последующие гомологи — твердые вещества. В гомологическом ряду алканов по мере увеличения молекулярной массы возрастают температуры плавления и кипения. Температуры кипения изомеров с разветвленной углеродной цепью более низкие по сравнению с алканами нормального строения. Газообразные и твердые алканы не имеют запаха, жидкие — обладают характерным «бензиновым» запахом. Все алканы легче воды и практически не растворяются в ней. Наряду с этим, они хорошо растворимы в неполярных растворителях — диэтиловом эфире, четыреххлористом углероде, бензоле и других, причем с увеличением молекулярной массы растворимость уменьшается.
Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
Алканы не вступают в реакции присоединения!!!!!
Для алканов различают типы химических реакций:
А. реакции замещения водорода (с разрывом связи С—Н);
Б. реакции расщепления (с разрывом связей С—С и С—Н);
В. изомеризации;
Г. окисления.
А) Реакции замещения
1. Галогенирование – реакция замещения одного или более атомов водорода в молекуле алкана на галоген. Фторирование метана и его ближайших гомологов протекает со взрывом. Взрыв при хлорировании возможен только при интенсивном освещении, а также при УФ - облучении. Бромирование протекает относительно медленно, а прямое иодирование невозможно.
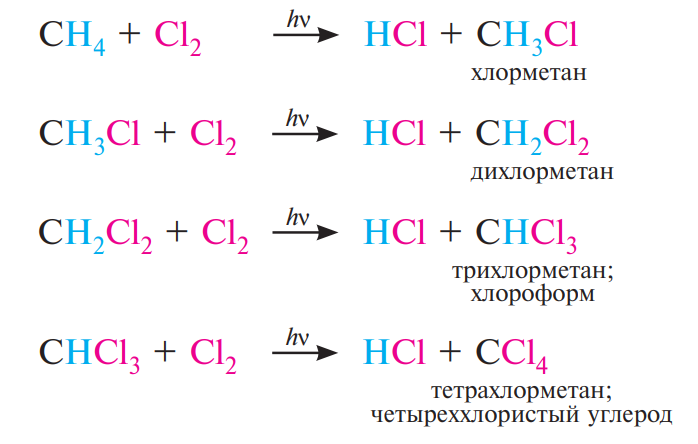
Механизм:
В цепном процессе выделяют три стадии: инициирование, рост цепи, обрыв цепи.
Инициирование. Под действием энергии квантов света (hn) или нагревания молекула хлора активируется и претерпевает гомолитический разрыв связи с образованием двух свободных радикалов:
![]()
Рост цепи. Свободные радикалы хлора атакуют связь С—Н в молекуле метана, отрывая при этом атом водорода с образованием хлороводорода HCl и свободного метильного радикала СН3·:
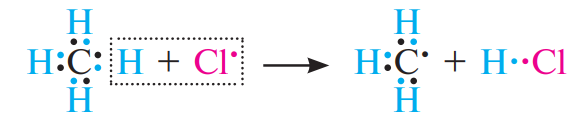
Метильный радикал, в свою очередь, атакует молекулу хлора, отрывает атом галогена и образует хлорметан СН3Сl и свободный радикал хлора:
![]()
Образовавшийся радикал хлора повторяет цикл указанных превращений, то есть происходит цепной процесс, в котором атом хлора, прореагировавший на предыдущей стадии роста цепи, способствует высвобождению нового радикала хлора на последующей стадии. В результате образуется смесь моно-, ди-, три- и тетрахлорпроизводных метана:
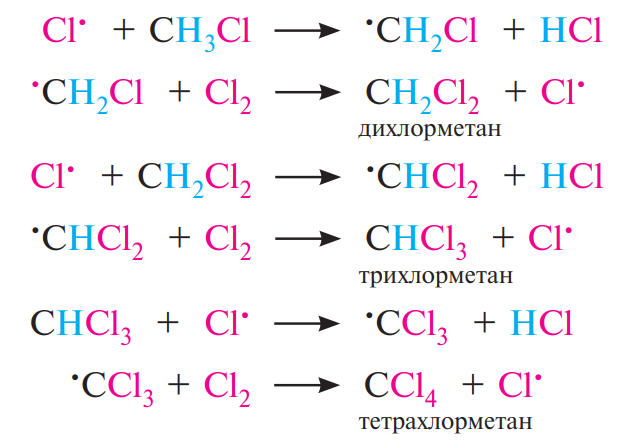
Обрыв цепи. В результате рекомбинации (димеризации) свободных радикалов происходит обрыв цепи:
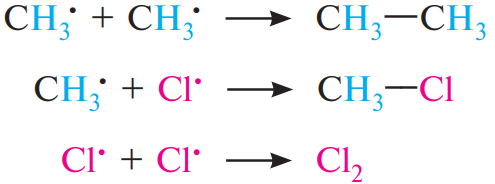
2. Нитрование (реакция Коновалова)
Осуществляется с использованием разбавленной азотной кислоты (концентрация 10—20 %) при температуре 110—140 °С, нормальном или повышенном давлении:
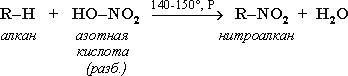
Если алканы нитруют концентрированной HNO3 при t = 500°C, то наблюдается разрыв связи (С-С)и образуются мононитропроизводные, имеющие разную длину цепи:
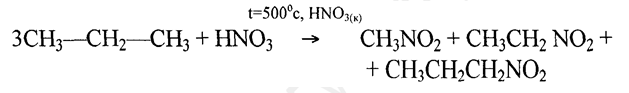
3. Сульфирование
При обычной температуре серная кислота с алканами не реагирует, но при слабом нагревании дымящаяся серная кислота сульфирует алканы:
![]()
4. Сульфохлорирование
Под действием серы (IV) оксида и хлора в условиях УФ-облучения алканы образуют алкансульфонилхлориды:
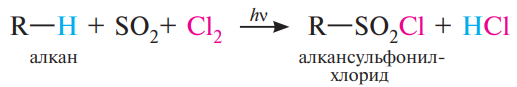
Б) Реакции расщепления
1. Дегидрирование
Реакция дегидрирования или отщепления водорода происходит в присутствии катализатора, например, Сг2О3 и при нагревании.

При t = 1500°С происходит межмолекулярное дегидрирование метана по схеме:
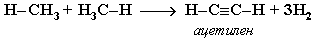
2. Крекинг – расщепление молекул органических соединений с разрывом связей (С-С) под действием высоких температур. Различают термический крекинг и каталитический крекинг. Термический крекинг проводят при температуре 800 °С и выше, каталитический — при температуре 450—550 °С в присутствии алюмосиликатных катализаторов (алюминия оксид Аl2О3 на силикагеле SiO2).
![]()
![]()
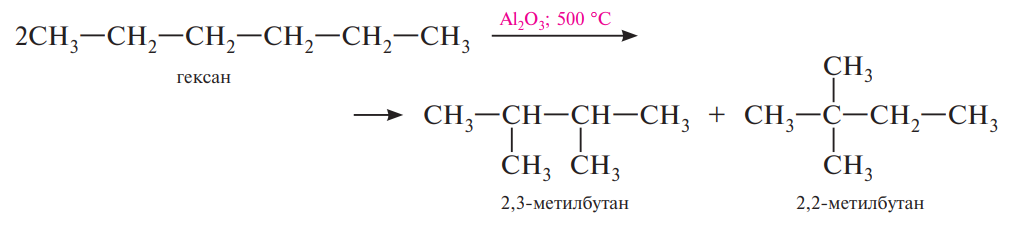
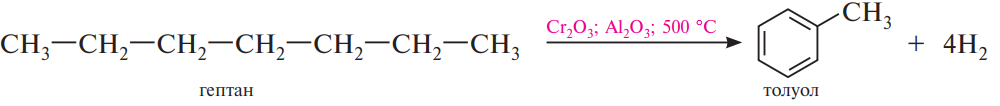
В) Изомеризация
Алканы нормального строения под влиянием катализаторов (обычно кислот Льюиса) и при нагревании способны превращаться в разветвленные алканы без изменения состава молекул.
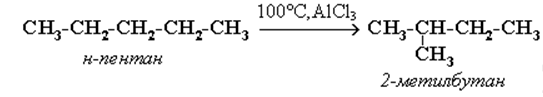
Г) Реакции окисления
При обычной температуре алканы не вступают в реакции даже с сильными окислителями (Н2Cr2O7, KMnO4 и т.п.). При внесении в открытое пламя алканы горят.
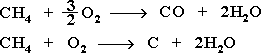
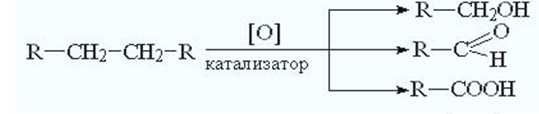
В промышленности широко используется способ получения уксусной кислоты окислением кислородом воздуха бутана.
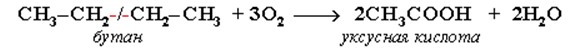
Важное значение имеет реакция взаимодействия метана с водяным паром (конверсия метана), в результате которой образуется смесь оксида углерода (II) с водородом – "синтез-газ":