
- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
Типы хим. связей:
1) Ионная – образуется между атомами, которые значительно отличаются по электроотрицательности
![]()
2) Ковалентная – между атомами, равными или близкими по электроотрицательности. Если атомы с одинаковой электроотрицательностью, то общая электронная пара располагается симметрично по отношению к обоим центрам атомов – связь неполярная
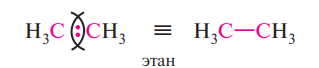
Если же атомы с разной электроотрицательностью, то электронная плотность располагается неравномерно и смещается к атому с большой электроотрицательностью – связь полярная (обозначается стрелочкой)
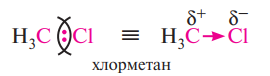
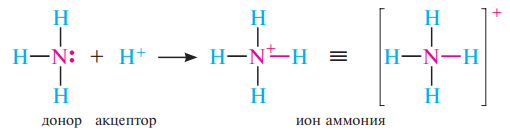
Донорноакцепторная связь представляет собой разновидность ковалентной связи. При этом атом, поставляющий пару электронов в общее пользование, называют донором, а атом, принимающий электроны,— акцептором. Донор должен иметь пару неподеленных электронов. Акцептором может быть протон или другой атом, у которого не хватает до образования октета двух электронов.
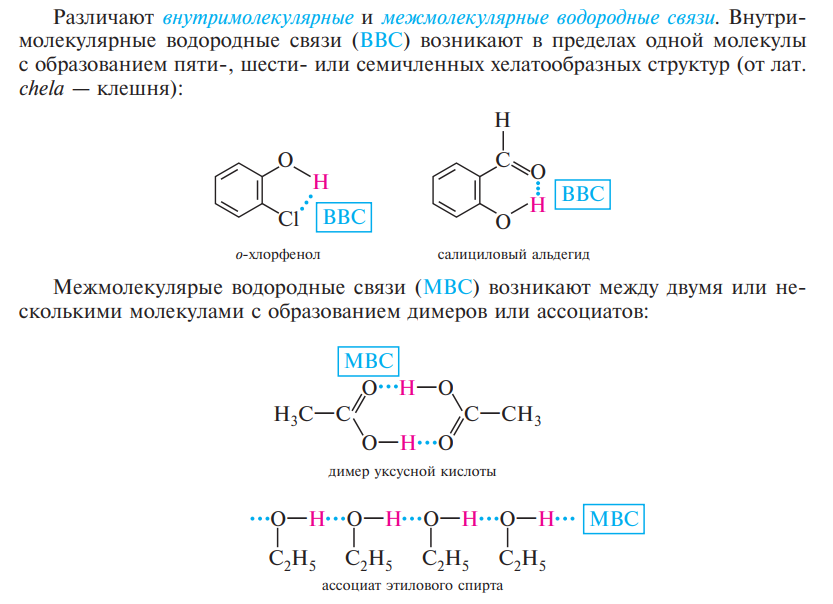
3) Водородная – электростатическое взаимодействие между атомами водорода и атомами неподеленной элоктронной парой (O, N, F, реже S, Cl) в этой же или другой молекуле.
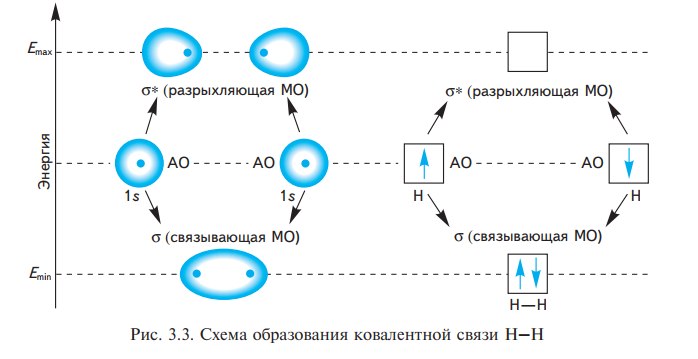
σ-Связью называют одинарную ковалентную связь, образованную в результате перекрывания атомных орбиталей вдоль линии, соединяющей ядра двух связываемых атомов (σ-перекрывание). Поскольку максимальная электронная плотность при σ-перекрывании сосредоточена в пространстве между ядрами атомов, σ-связь обладает большой прочностью.
Боковое перекрывание р-орбиталей называют π-перекрыванием, а образующуюся связь — π-связью
Гибридизация
Сущность гибридизации заключается в том, что из нескольких различных по форме и близких по энергии атомных орбиталей образуется такое же число одинаковых по форме и энергии гибридных орбиталей.
1) sp3 – форма тетраэдра, угол 109028’
2) sp2 – тригональная форма (треугольник), угол 1200
3) sp – линейная форма, угол 1800
Молекулярные орбитали отличаются от атомных тем, что электронные облака окружают ядро уже не одного атома, а двух или нескольких. Для образования МО необходимо, чтобы атомные орбитали имели близкие энергии, одинаковую симметрию относительно линии связи в молекуле и достаточную для перекрывания протяженность в пространстве. Одну из них, имеющую более низкую энергию, чем исходные АО, называют связывающей орбиталью, другую, которая обладает более высокой энергией, чем образующая ее АО, называют разрыхляющей, или антисвязывающей, орбиталью.
Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
В зависимости от способа разрыва связей в атакующем реагенте и субстрате различают три типа механизмов реакций: гомолитический (радикальный), гетеролитический (ионный) и перициклический (молекулярный). Гомолитическим, или свободнорадикальным, называют механизм, в котором при разрыве связей в реагирующих молекулах у каждого из образующихся фрагментов остается по одному электрону. Такие частицы называют радикалами:
![]()
Свободнорадикальный механизм обозначают символом R. Гетеролитическим, или ионным, называют механизм, в котором при разрыве связей в реагирующих молекулах оба электрона остаются на одном из образующихся фрагментов. Такие частицы называют ионами:
![]()
Реакции, протекающие по ионному механизму, в зависимости от электронной природы атакующего реагента делят на нуклеофильные (символ N ) и электрофильные (символ Е ). В нуклеофильных реакциях атакующим реагентом является нуклеофил (Nи), в электрофильных — электрофил (Е ). Нуклеофильными (ищущими ядра) называют реагенты, которые отдают электронную пару при образовании химической связи с субстратом. К нуклеофильным реагентам относят анионы и нейтральные молекулы, содержащие атомы с неподеленными парами электронов
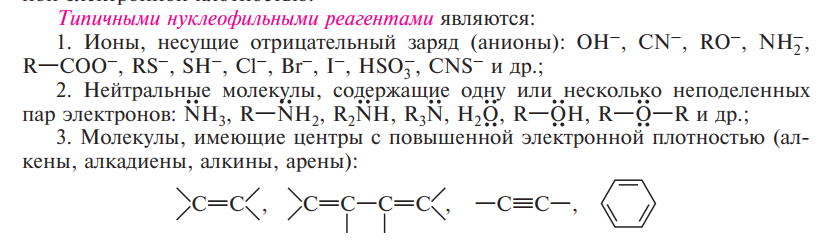
Электрофильными (ищущими электроны) называют реагенты, принимающие электронную пару от субстрата при образовании с ним химической связи.
К электрофильным реагентам относят катионы и нейтральные молекулы, имеющие вакантную орбиталь.

Реагенты
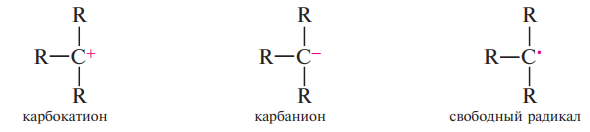
1) Карбкатион – это органический катион, содержащий положительно заряженный атом углерода. Есть вакантная p-АО.
2) Карбанион – это органический анион, содержащий отрицательно заряженный атом углерода, то есть четырехвалентный атом углерода с неопределенной парой электронов.
3) Свободный радикал – незаряженная частица, содержащая неспаренный электрон (одноэлектронную орбиталь).
