
- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
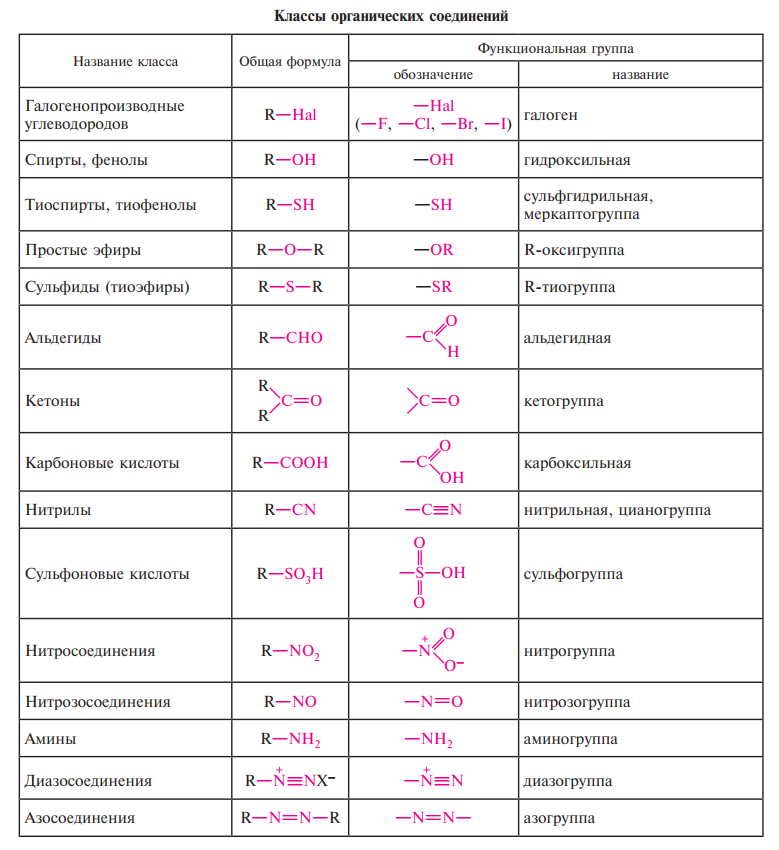
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
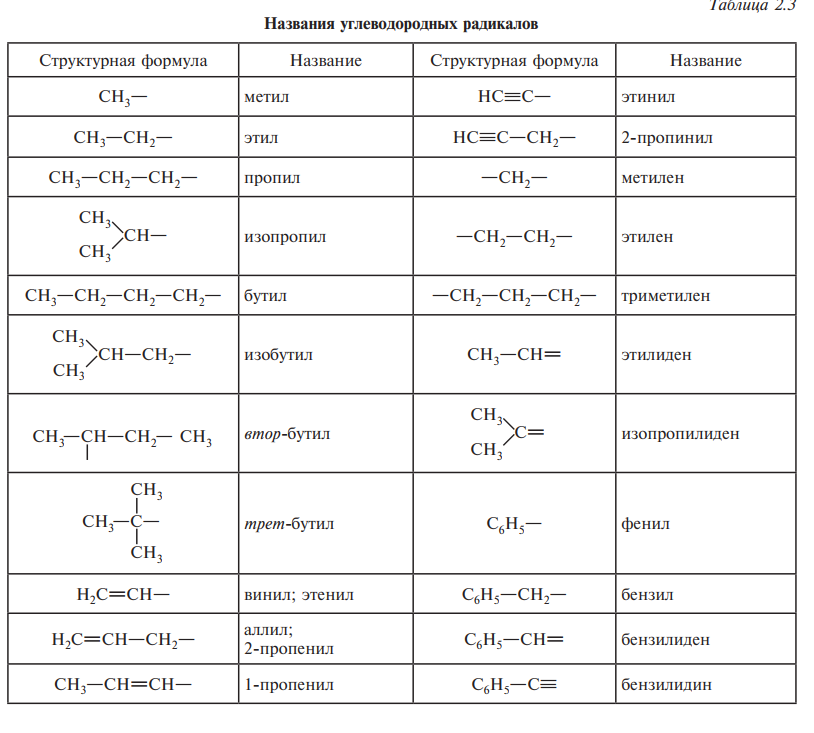
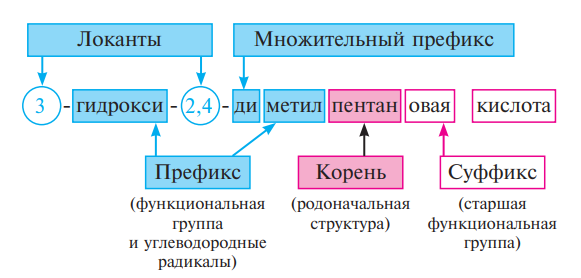
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Основные признаки классификации органических веществ. Основные классы органических веществ.
Органические соединения классифицируют, учитывая два основных структурных признака:
строение углеродной цепи (углеродного скелета);
наличие и строение функциональных групп.
Углеродный скелет (углеродная цепь) - последовательность химически связанных между собой атомов углерода.
Функциональная группа - атом или группа атомов, определяющие принадлежность соединения к определенному классу и ответственные за его
химические свойства.
Классификация соединений по строению углеродной цепи
В зависимости от строения углеродной цепи органические соединения делят на
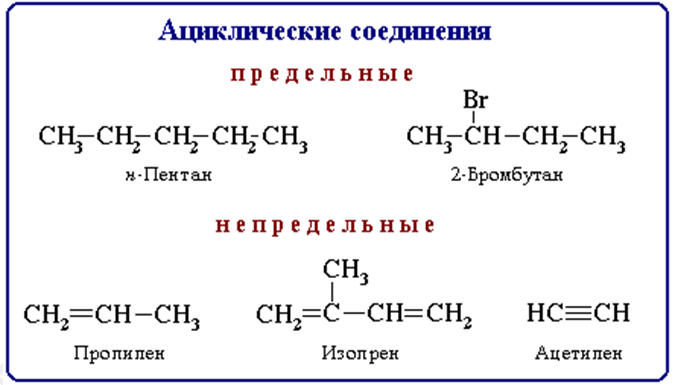
ациклические (алифатические) и циклические.
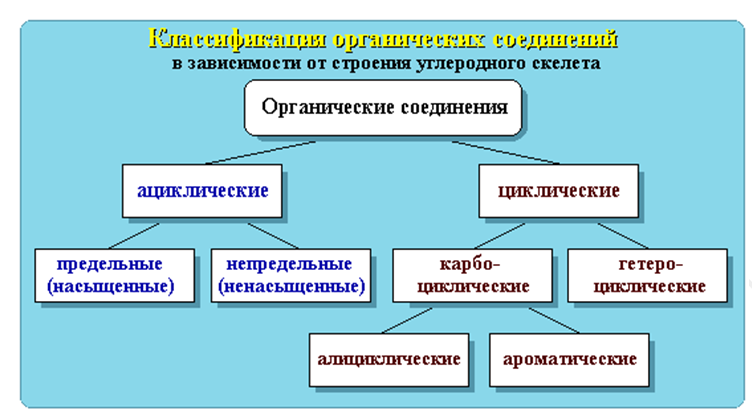
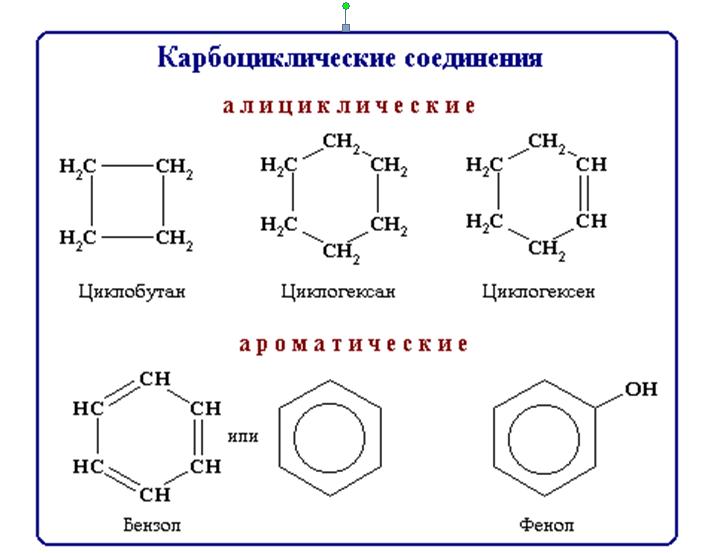
Карбоциклические соединения содержат в цикле только атомы углерода. Они делятся на две существенно различающихся по химическим свойствам группы: алифатические циклические - сокращенно алициклические - и ароматические соединения.
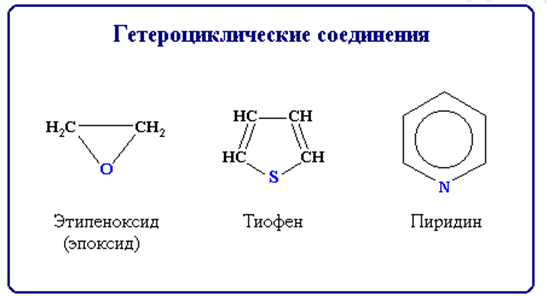
Гетероциклические соединения содержат в цикле, кроме атомов углерода, один или несколько атомов других элементов - гетероатомов (от греч. heteros - другой, иной) - кислород, азот, серу и др
Классификация по природе функциональной группы.
Номенклатура органических соединений. Основные принципы построения названий органических соединений.
В историческом аспекте следует выделить три основные номенклатурные системы: тривиальную, рациональную и международную (IUPAC).
Тривиальная номенклатура. Первые названия, которые давали органическим соединениям, были случайными. Тривиальные, или эмпирические, названия соединений отражают природные источники соединений (муравьиная, лимонная кислоты, мочевина, индиго, кофеин), способы получения (пирогаллол, пировиноградная кислота), характерные свойства (пикриновая и капроновая кислоты, флуоресцеин, малахитовый зеленый), имена первооткрывателей (реактив Гриньяра, кетон Михлера).
Рациональная номенклатура. Это первая номенклатура, в которой стали учитывать в названии вещества его строение. В основе рациональных названий используется принцип деления органических соединений на гомологические ряды.
Гомологическим называют ряд соединений, в котором каждый последующий представитель отличается от предыдущего на группу СН2
![]()
Систематическая номенклатура — международная единая химическая номенклатура, разработанная комиссией IUPAC по номенклатуре органических соединений. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия заместителей и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу.
Типы изомерии: структурная и пространственная. Способы изображения пространственного строения молекул. Конформации, конформеры. Энантиомеры. Понятие об оптической активности и хиральности. Рацематы. Принципы R-, S-номенклатуры; D- и L-ряды. Диастереомеры. Пространственная изомерия алкенов: цис-, транс- и Z-, E-номенклатуры.
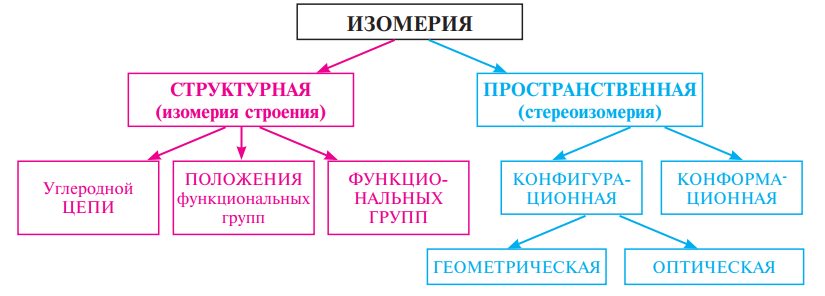
Структурные изомеры, или изомеры строения, отличаются друг от друга последовательностью связывания атомов в молекуле, то есть структурой. Структурную изомерию подразделяют на изомерию углеродной цепи, изомерию положения, изомерию функциональных групп.
В некоторых случаях два структурных изомера могут находиться в состоянии динамического равновесия друг с другом. Такое явление называют таутомерией, а структурные изомеры — таутомерами:
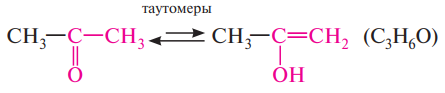
Вещества, имеющие одинаковый состав и порядок связывания атомов в молекуле, но отличающиеся друг от друга их расположением в пространстве, называют пространственными изомерами, или стереоизомерами. Для характеристики пространственных различий в стереоизомерии используют понятия «конфигурация» и «конформация».
Конфигурацией называют то или иное относительное расположение атомов молекулы в пространстве.
Конформацией называют различное пространственное расположение атомов или атомных групп в молекулах определенной конфигурации, обусловленное вращением вокруг σ-связей.
Конформеры – это стереоизомерные структуры, находящиеся в подвижном равновесии и способные к взаимопревращению путем вращения вокруг простых связей.
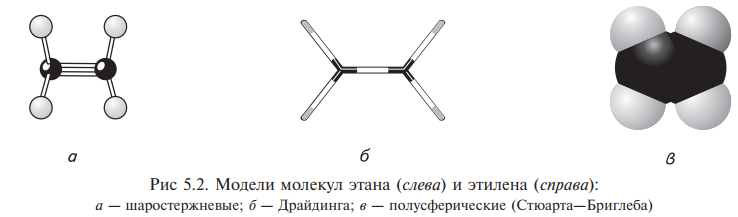
СПОСОБЫ ИЗОБРАЖЕНИЯ
1) Молекулярные модели – шаростержневые, скелетные и полусферические
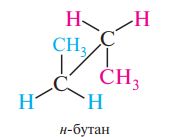
2) Стереоформулы
а) Перспективные формулы (вдоль связи углерод-углерод не заслоняя друг друга, по-другому «лесопильные козлы»)
б) Проекционные формулы Ньюмена (вдоль С-С связи, где атомы заслоняют друг друга)
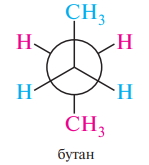
в) Проекционные формулы Фишера (изображение на плоскости)
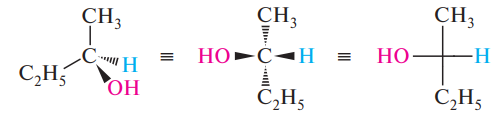
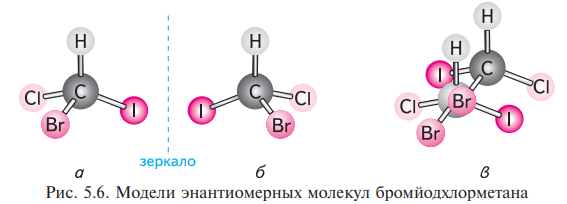
Оптической активностью называют свойство вещества вращать плоскость поляризации (т.е. в лучше электромагнитные колебания совершаются только в одной плоскости) поляризованного света. Обязательным условием для проявления органическим соединением оптической активности является асимметрия (отсутствие симметрии) его молекул (основными элементами симметрии являются плоскость, центр и ось симметрии). Различные объекты, в том числе и молекулы, не имеющие плоскости, центра и оси симметрии, обладают свойством не совмещаться со своим зеркальным изображением. Это свойство называют хиральностью, а молекулы им обладающие — хиральными. Хиральность молекул является обязательным условием для проявления веществом оптической активности.
Энантиомеры – молекулы, содержащие ассиметричный атом углерода, существуют в виде двух изомеров, относящихся друг к другу как хиральный предмет к своему зеркальному изображению.
Смесь равных количеств энантиомеров называют рацемической. Такая смесь не обладает оптической активностью, так как одинаковое по значению, но противоположное по направлению вращение взаимно компенсируется.
Диастереоизомеры – это стереоизомеры, которые не являютсс зеркальным отражением друг друга, они имеют одинаковую конфигурацию при одном асимметричном атоме углерода, но разную при другом.
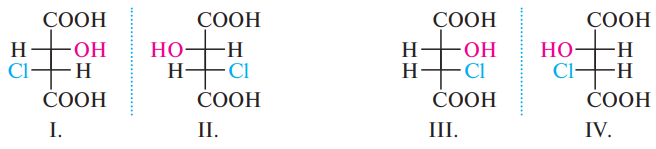
1-3: 1-4; 2-3, 2-4 – диастереоизомеры
D L
Правовращающему изомеру глицеринового альдегида была произвольно приписана абсолютная конфигурация, в фишеровской проекции которой группа —ОН находится справа. Такую конфигурацию обозначили буквой D. Левовращающему энантиомеру глицеринового альдегида соответственно приписана зеркальная конфигурация, которую обозначили буквой L (группа —ОН в проекции Фишера расположена слева):

Треоизомерами называют вещества, в проекциях Фишера которых одинаковые заместители при асимметрических атомах углерода расположены по разные стороны, эритроизомерами — соответственно по одну сторону.
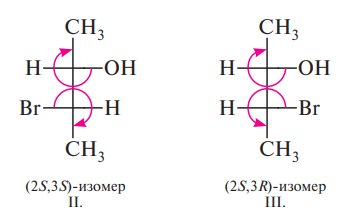
R,S-Система основана на определении направления последовательного убывания старшинства заместителей, связанных с асимметрическим атомом углерода. (старшинство заместителей определятеся подсчетом атомных номеров элементов)
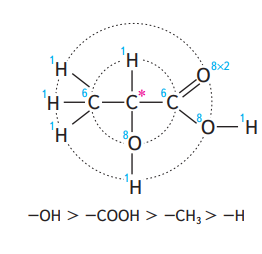
Если при этом три остальных заместителя расположены в пространстве так, что их старшинство последовательно убывает по часовой стрелке, абсолютная конфигурация обозначается буквой R, если же старшинство заместителей убывает против часовой стрелки, конфигурацию обозначают буквой S.
Для обозначения конфигурации геометрических изомеров используют цистранс- и E,Z-систему. Цистранссистема обозначений конфигурации имеет ограниченное применение. Ее можно использовать только тогда, когда связанные двойной связью углеродные атомы имеют одинаковые заместители. Если одинаковые заместители расположены по одну сторону от плоскости двойной связи, конфигурацию обозначают цис-, если по разные стороны — транс-:

Если применение цис-транс системы становится невозможным. В таких случаях используют Е,Zсистему обозначений:

Е,Z-система обозначений конфигурации основана на определении по Кану—Ингольду—Прелогу (как в R,S изомерии). Если при этом старшие заместители из каждой пары расположены по одну сторону от плоскости двойной связи, конфигурацию обозначают буквой Z (от нем. Zusammen — вместе), если по разные стороны — буквой Е, если по разные, то – Z
