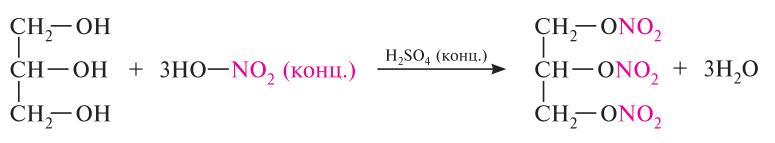- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
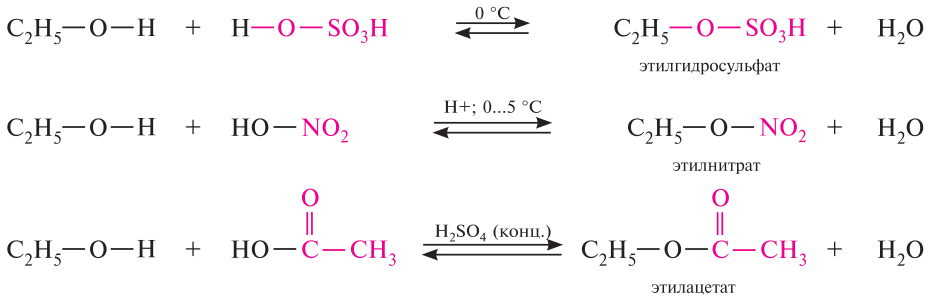
Реакция этерификации – образование сложных эфиров. (нуклеофильные свойства спиртов). Спирты взаимодействуют с минеральными и органическими кислотами с образованием сложных эфиров и воды:
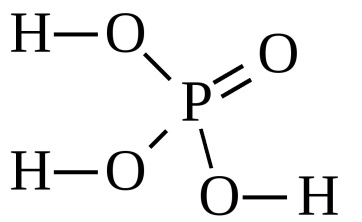
Реакция с ортофосфорной кислотой
 +
3
+
3![]() =
= +
3H2O
+
3H2O
Механизм реакции этерификации.
Образование сложных эфиров при взаимодействии карбоновых кислот со спиртами (этерификация) происходит в условиях кислотного катализа как реакция нуклеофильного замещения.
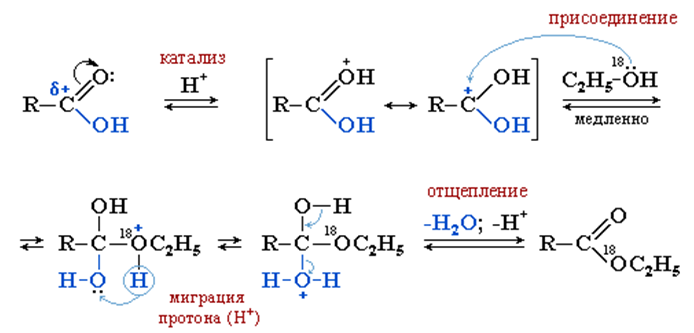
Стадия I. Активация карбоновой кислоты под действием катализатора – сильной кислоты (например, конц. H2SO4), превращающей нейтральную молекулу в карбокатион.
Стадия II (лимитирующая). Нуклеофильное присоединение спирта к карбокатиону.
Стадия III. Миграция протона H+ и формирование хорошей уходящей группы H2O.
Стадия IV. Отщепление воды и катализатора (H+) от неустойчивого продукта присоединения с образованием cложного эфира.
Процесс этерификации катализируется как кислотами, так и основаниями. Механизм кислотного катализа заключается в протонировании кислорода карбоксильной группы, что приводит к увеличению электронного дефицита на атоме углерода карбоксильной группы и ускорению атаки молекулой спирта – нуклеофильным реагентом.
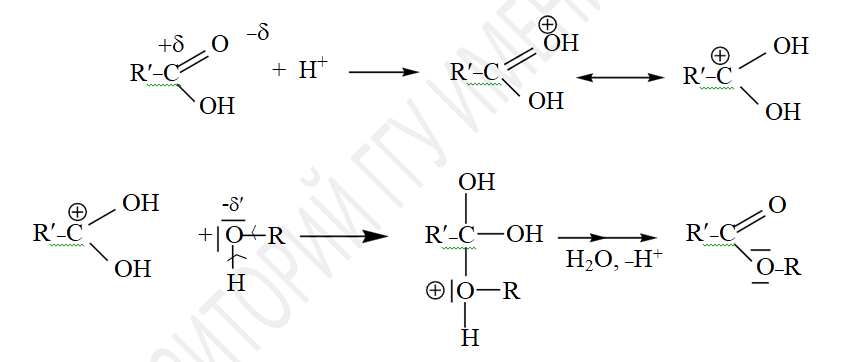
Механизм основного катализа заключается в повышении нуклеофильности молекулы спирта по обменной реакции:
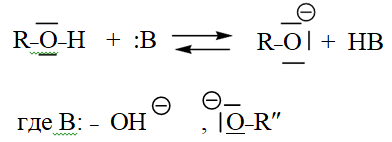
Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
Реакции дегидратации спиртов. Отщепление воды от молекул спирта (дегидратация спиртов) в зависимости от условий происходит как внутримолекулярная или межмолекулярная реакция.
Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при нагревании выше 140 °С.
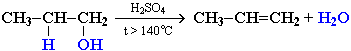
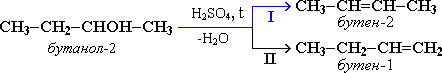
Межмолекулярная дегидратация спиртов происходит при температуре ниже 140 °С с образованием простых эфиров:
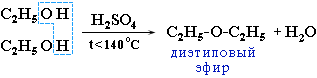
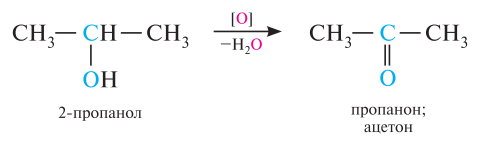
Независимо от выбранных условий первичные спирты окисляются до альдегидов, вторичные до кетонов. Альдегиды далее окисляются до кислот без изменения числа атомов углерода, а кетоны с разрывом С-С связей до смеси кислот. Третичные спирты окисляются в жестких условиях с разрывом углеродной цепи с образованием смеси кетонов и кислот.
Реакции неполного окисления спиртов в лабораторных условиях осуществляются под действием таких окислителей как: KMnO4, K2Cr2O7+H2SO4, CuO. Внешне реакция реакций окисления проявляется в том, что в случае перманганата калия исчезает его фиолетовая окраска, а в случае хромовой смеси её оранжевый цвет переходит в зелёный.
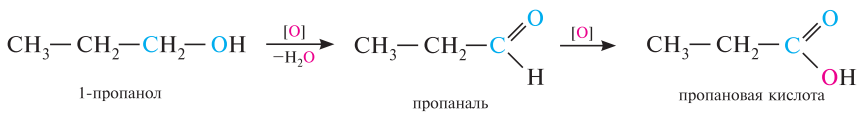

Многоатомные спирты. Этиленгликоль, глицерин, пентаэритрит, инозит. Химические свойства 1,2-диолов: кислотность, образование хелатных комплексов, окислительное расщепление 1,2-диолов (йодной кислотой), образование циклических простых и сложных эфиров азотной кислоты.
Двуатомные спирты – 2 ОН – по-другому гликоли
Трехатомные спирты – 3 ОН – по-другому глицерины
Многоатомные спирты – более 3 ОН – по-другому полиолы
Простейшим представителем двухатомных спиртов является этиленгликоль или просто гликоль. Так же как и другие низшие гликоли, этиленгликоль – бесцветная, сиропообразная жидкость, не имеет запаха, обладает сладким вкусом. При приёме внутрь – ядовита. Представителем трёхатомных спиртов является глицерин – это бесцветная жидкость, без запаха, сладкая на вкус. По внешнему виду напоминает сироп. Очень гигроскопичен, смешивается с водой в любых соотношениях.
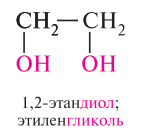
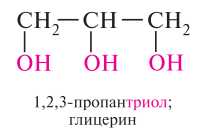
С увеличением числа гидроксильных групп в молекуле кислотные свойства соединения усиливаются. так, глицерин, по сравнению с этиленгликолем, имеет более выраженные кислотные свойства.
Многоатомные спирты, содержащие гидроксильные группы у соседних атомов углерода, при взаимодействии с гидроксидами тяжелых металлов, например гидроксидом меди (II) в щелочной среде, образуют внутрикомплексные, так называемые хелатные, соединения. Такие соединения обычно хорошо растворимы в воде и интенсивно окрашены, поэтому реакция используется как качественная. Синий цвет!!!
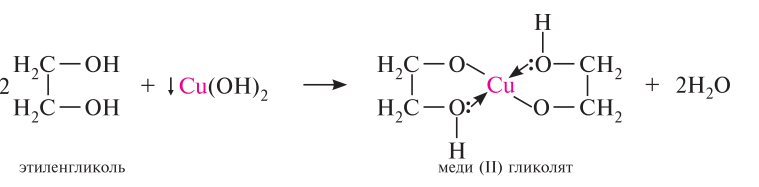
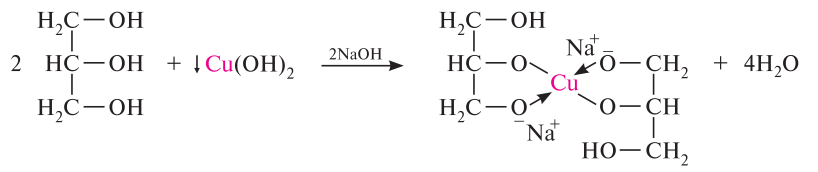
Специфической реакцией окисления 1,2-диолов является их взаимодействие с йодной кислотой НIO4 (гликольное расщепление). в процессе реакции происходит расщепление углерод-углеродной связи в диольном фрагменте, при котором в зависимости от строения гликоля образуются соответствующие альдегиды и кетоны:
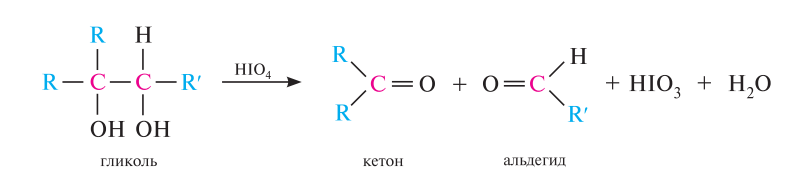
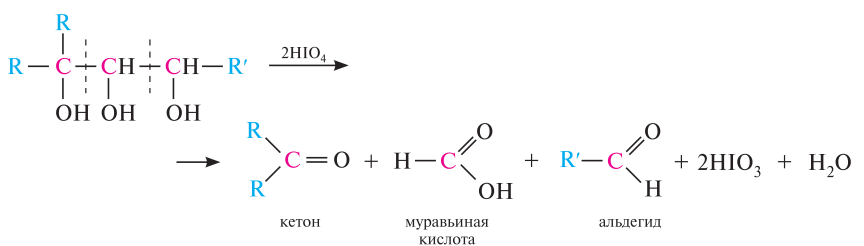
С азотистой кислотой:
простые эфиры
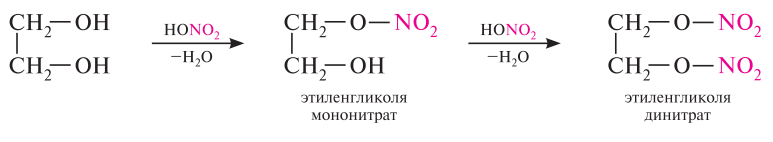
сложные эфиры (продукт реакции – нитроглицерин)