
- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Литий- и магнийорганические соединения и их использование в органическом синтезе.
Галогеноуглеводороды реагируют со щелочными металлами в инертных растворителях, образуя соответствующие металлоорганические соединения:
![]()
При взаимодействии алкил- и арилгалогенидов с натрием реакция не останавливается на стадии образования алкил(арил)натрия (реакции Вюрца, Вюрца- Фиттига):
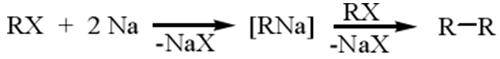
Литийорганические соединения получают по той же схеме, что и натрийорганические.
![]()
Легко получаются и литийпроизводные бензола:
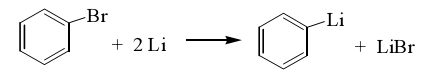
Из металлоорганических соединений наибольшее практическое значение имеют магнийорганические. Их получают взаимодействием алкил-галогенидов с магнием в абсолютном эфире (в отсутствие эфира магний с алкилгалогенидами не взаимодействует):
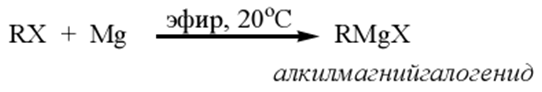
Органические магнийгалогениды называют реактивами Гринъяра. Арилгалогениды также легко образуют реактив Гриньяра:
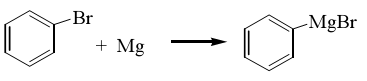
Фенилмагнийбромид – очень реакционноспособное вещество. Группа MgBr легко замещается на другие группировки.
Способность галогеналканов образовывать металлорганические соединения открывает новые широкие возможности для органического синтеза. В отличие от самих галогеналканов, имеющих дефицит электронной плотности на углероде, связанном с галогеном, образованные из них металлорганические соединения имеют избыток электронов на углеводородной части молекулы.
Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
Фторпроизводные углеводородов. Поли- и перфторалканы оказывают наркотизирующее действие на человека, вызывают поражения легочной ткани. Токсическое действие в ряду фторированных углеводородов возрастает с повышением температуры кипения.
Хлоралканы. В большинстве случаев это прозрачные бесцветные жидкости, плохо растворимые в воде. Соединения с одним атомом хлора легче воды. При контакте хлоралканов с нагретыми поверхностями образуется отравляющее вещество фосген.
Эти соединения широко мигрируют в окружающей среде, трансформируясь в атмосфере с образованием СО и СО2 и тем самым усиливая парниковый эффект, влияют на климат Земли. Хлоралканы в процессе фотоокисления образуют также соляную кислоту и ряд активных соединений, которые взаимодействуют с озоном, снижая его концентрацию в атмосфере и способствуя образованию озоновых дыр.
Хлоралканы обладают наркотизирующим эффектом, который возрастает с увеличением количества атомов хлора в молекуле. Почти все хлоралканы – ядовитые вещества. При отравлениях ими наблюдаются поражения печени, почек, ЦНС, сердца, поджелудочной железы. Некоторые хлоралканы (ССЦ) обладают мутагенным и канцерогенным действием.
Из антропогенных источников поступления хлорметана в окружающую среду стоит назвать табачный дым. При выкуривании одной сигареты выделяется от 100 до 700 мкг хлорметана.
Дихлорметан обладает раздражающим, наркотизирующим и мутагенным действием. При хронических отравлениях происходит Поражение печени и почек, нарушается функция ЦНС.
Трихлорметан (хлороформ). Это взрыво- и пожароопасная прозрачная жидкость с характерным запахом. На свету легко разлагается с образованием фосгена. Процесс идет наиболее интенсивно при контакте с открытым пламенем.
Йодоформ, в медицинской практике пользуется широким применением, преимущественно как наружное средство, вместо йода, вследствие свойства его не вызывать местного воспаления; менее ядовит сравнительно с йодом. Врачебное достоинство йодоформа главным образом обусловливается его антисептическим действием на раны и язвы без всяких явлений раздражения тканей, его болеутоляющим побочным действием и способностью всасывать продукты выделения.
Перфторуглеводороды (фторуглероды) – углеводороды, в которых все атомы водорода замещены на атомы фтора. В названиях фторуглеродов часто используют приставку «перфтор» или символ «F», напр. (CF3)3CF – перфторизобутан, или F-изобутан. Низшие фторуглероды – бесцветные газы (до C5) или жидкости (табл.), не растворяются в воде, раств. в углеводородах, плохо – в полярных органических растворителях.
Фторуглероды – диэлектрики, теплоносители, гидравлические жидкости, смазочные масла, низкотемпературные хладагенты, мономеры в производстве фторполимеров, эффективные газопереносящие среды, что позволяет использовать их в качестве искусственной крови.
Инсектици́ды — химические препараты, предназначенные для уничтожения вредных насекомых. Применяются при дезинсекции.Некоторые инсектициды убивают или наносят вред другим существам помимо тех, для кого они предназначены. Например, птицы могут отравиться, съев пищу, которую недавно опрыскали инсектицидами, или ошибочно приняв гранулу-инсектицид на земле за нечто съедобное.
Распылённый инсектицид может дрейфовать из местности, в которой он используется, в районы дикой природы, особенно когда он распыляется с самолётов.
