
- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
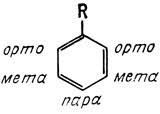
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
Электронодонорные заместители (D) повышают электронную плотность кольца и увеличивают скорость реакции S E (активирующие заместители): -NH2, -OH, -OR, -NHR, -NR2, -NH-C(O)R, алкильные группы 2) Электроноакцепторные заместители (А) понижают электронную плотность кольца и уменьшают скорость реакции S E (дезактивирующие заместители): -NO2, -CF3, -SO3H, -NR3, -CN


Реакции радикального замещения и окисления в боковой цепи. Причины устойчивости бензильных радикалов. (точного ответа на вопрос нет)
Бензольное кольцо в обычных условиях устойчиво к действию окислителей (KMnO4, K2Cr2O7), алкильные заместители, напротив, весьма легко подвергаются окислению и реагируют с другими реагентами радикального характера. Наиболее реакционным центром боковой цепи является атом углерода, непосредственно связанный с ароматическим ядром, так называемый α-атом. Действие перманганата калия в воде или бихромата калия в кислой среде окисляет алкильный заместитель. Окисление происходит таким образом, что вся боковая цепь "отгорает", а связанный с кольцом атом углерода окисляется до карбоксильной группы

Взаимодействие гомологов бензола с галогенами (хлором или бромом) в условиях свободнорадикального замещения (см. с. 139) осуществляется с участием боковой цепи. При этом на атом галогена замещается, как правило, атом водорода при атоме углерода, непосредственно связанном с бензольным кольцом (α-положение):

Стабильность бензильного радикала объясняется сопряжением неспаренного электрона, расположенного на р-орбитали, с -электронами бензольного кольца:

Классификация, номенклатура, изомерия галогенуглеводородов.
Классификация.
По типу атома галогена галогеноуглеводороды подразделяют на фторо-, хлоро, бромо-, иодопроизводные, а также смешанные производные
По числу атомов галогена различают моно-, ди-, тригалогениды и т.д.
В зависимости от того, с каким атомом углерода связан атом галогена, выделяют первичные, вторичные и третичные галогенуглеводороды.
По строению углеводородных радикалов, связанных с атомом галогена, галогеноуглеводороды подразделяют на:
Предельные (галогеналканы, галогеноциклоалканы)
Непредельные (галогеналкены, галогеналкины, галогенарены)
Изомерия.
Структурная изомерия:
— изомерия углеродного скелета (начиная с С4)
— изомерия положения атома галогена (начиная с С3);
Пространственная изомерия:
— цис-транс-изомерия (галогеналкены, дизамещенные алициклы);
— оптическая изомерия (галогеналканы, имеющие асимметрический атом углерода)
Номенклатура
1. Тривиальная номенклатура
Сохраняются следующие тривиальные названия: хлороформ — СНС13, бромоформ — СНВr3, йодоформ — CHI3.
2. В рациональной номенклатуре называют радикал, связанный с галогеном.
СН3Сl — метилхлорид,
CH3CH2I –этилиодид
3. Номенклатура IUPAC

Реакции нуклеофильного замещения атома галогена, их использование в синтезе органических соединений различных классов (спиртов, простых и сложных эфиров, аминов, тиолов и сульфидов, нитроалканов, нитрилов). Представление об идеализированных механизмах SN1 и SN2.
Реакции нуклеофильного замещения, механизмы SN1 и SN2
Механизм SN1 (мономолекулярное нуклеофильное замещение). Карбокатионный механизм характерен для третичных галогеналканов. В механизме SN1 разрыв связи C—Hal предшествует образованию связи C—Nu. По механизму SN1 реакция протекает в две стадии:

На стадии I происходит ионизация молекулы галогеналкана с образованием карбокатиона и галогенид-иона. Процесс ионизации протекает медленно, а поэтому он определяет скорость всей реакции. В ионизации галогеналкана оказывает содействие растворитель.
На стадии II образовавшийся катион быстро взаимодействует с нуклеофильным реагентом, образуя конечный продукт реакции.
Протеканию реакции по мономолекулярному механизму (SN1) способствуют:
увеличение степени замещенности реакционного центра алкильными радикалами; использование сильноионизирующего растворителя; применение слабого нуклеофила.
Механизм реакции бимолекулярного нуклеофильного замещения. SN2. Этот механизм характерен для первичных алкилгалогенидов. Термин бимолекулярная реакция указывает на то, что на самой медленной стадии участвуют две частицы — галогеналкан и нуклеофил. В реакции на промежуточной стадии возникает так называемое переходное состояние, или активированный комплекс, в котором новая связь еще не образовалась, а старая еще не разорвалась:

Таким образом, протеканию замещения по бимолекулярному механизму (SN2) благоприятствуют:
строение радикала, обеспечивающее беспрепятственный подход нуклеофила к реакционному центру:

проведение реакции в неполярном и полярных апротонных растворителях,
использование сильного нуклеофила.
Синтез (или просто хим. свойства):
1. Гидролиз галогеналканов с образованием спиртов: р-я обратима, поэтому обычно ее проводят в присутствии водных растворов щелочей или карбонатов щелочных металлов

![]()
2. Взаимодействие с алкоголятами и фенолятами (реакция Вильямса) – образование простых эфиров

3. Взаимодействие с солями карбоновых кислот (в среде полярного растворителя) с образованием сложных эфиров:

4. Взаимодействие с аммиаком с образованием алканаминов

5. Взаимодействие с солями циановодородистой кислоты.
Первичные и вторичные галогеналканы с солями щелочных металлов циановодородной кислоты (KCN, NaCN) в среде полярного растворителя образуют нитрилы

Основными продуктами реакции вторичных и третичных галогеналканов с серебра цианидом в среде протонного полярного растворителя являются изонитрилы (изоцианиды)

6. Взаимодействие с гидросульфидами и сульфидами щелочных металлов.
При действии на первичные и вторичные галогеналканы гидросульфидов щелочных металлов образуются тиоспирты (меркаптаны), при действии сульфидов — тиоэфиры.

Соединения с повышенной подвижностью атома галогена. (аллил- и бензилгалогениды). Соединения с пониженной подвижностью атома галогена (винилхлорид и хлорбензол). Реакции элиминирования галогеноводорода. Правило Зайцева.
Соединения с повышенной и пониженной подвижностью атома галогена
По легкости замещения галогена независимо от механизма реакции галогенпроизводные располагаются в следующий ряд:
аллил- и бензилгалогениды > алкилгалогениды > винил- и арилгалогениды
Аллил- и бензилгалогениды очень легко по сравнению с галогеналканами вступают в реакции нуклеофильного замещения.

Реакции нуклеофильного замещения аллил- и бензилгалогенидов протекают по механизму SN1.

Электронодонорные заместители (I рода), которые могут дополнительно стабилизировать интермедиат, повышают реакционную способность бензил-галогенидов.
Реакционная способность винил- и арилгалогенидов.
Винил- и арилгалогениды обладают более низкой реакционной способностью в реакциях нуклео-фильного замещения по сравнению с галогеналканами.

Арилгалогениды не взаимодействуют с нуклеофильными реагентами ни по механизму SN2, ни по механизму SN1. Предполагают, что реакция протекает через стадию дегидрирования с образованием дегидробензола и последующим присоединением (механизм отщепления-присоединения, ариновый механизм)

Реакции элиминирования галогеноводорода. Механизм Е 2. Правило Зайцева (Дегидрогалогенирование галогеналканов)
Как и в реакции замещения, известно элиминирование мономолекулярное и бимолекулярное. Как и при замещении среди различных галогеналканов легче всего в эту реакцию будут вступать иодиды.
Реакции отщепления протекают в соответствии с правилом Зайцева, которое гласит, что при дегидрогалогенировании алкилгалогенидов водород отщепляется от соседнего наименее гидрогенизированного атома углерода:

Правило можно сформулировать иначе: реакция идет преимущественно в направлении образования наиболее замещенных алкенов.
