- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
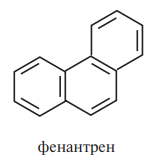
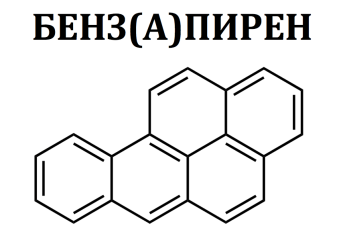
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
Классификация аренов:
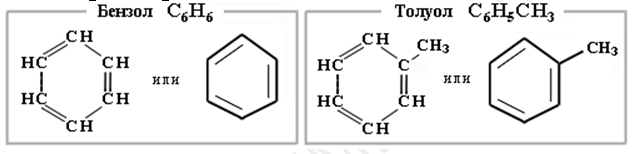
1. Одноядерные
2. Многоядерные
- с конденсированными ядрами
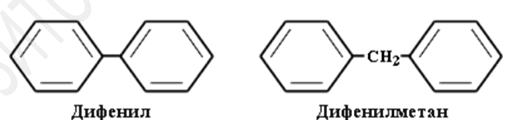
- с неконденсированными ядрами
3. Ароматические гетероциклы
Номенклатура
Тривиальная (стирол, толуол, ксилол, кумол); международная (с корнем «бензол»);
Молекула бензола представляет собой правильный плоский шестиугольник. Все углеродные атомы находятся в состоянии sp2-гибридизации. Каждый атом углерода образует три σ-связи (одну С—Н и две С—С), лежащие в одной плоскости под углом 120° друг к другу и предоставляет одну p-орбиталь для образования замкнутой сопряженной системы, электронная плотность которой равномерно распределена (делокализована) между углеродными атомами и сконцентрирована в основном над и под плоскостью σ-скелета молекулы. в бензольном кольце нет простых и двойных связей. На каждую углерод-углеродную связь, помимо двух σ-электронов, приходится электронная плотность одного π-электрона. Такую связь называют ароматической.
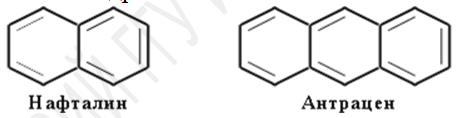
Конденсированные:
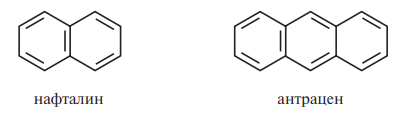
Нафталин – бесцветное кристаллическое вещество с характерным запахом, обладает высокой летучестью, т. пл. 80,3 °С. Хорошо растворяется в органических растворителях, плохо — в воде.
Антрацен – бесцветные кристаллы. Нерастворим в воде, растворим в ацетонитриле и ацетоне, при нагревании растворим в бензоле.
Фенантрен является структурным изомером антрацена. Наиболее активными являются положения 9 и 10. Фенантрен представляет собой блестящие бесцветные кристаллы. Не растворяется в воде, растворяется в органических растворителях (диэтиловом эфире, бензоле, хлороформе, метаноле, уксусной кислоте). Растворы фенантрена флуоресцируют голубым цветом.
Бензпире́н, или бензоапире́н, — ароматическое соединение, представитель семейства полициклических углеводородов, обладает сильнейшей канцерогенной активностью; чрезвычайно токсичен. По степени воздействия на организм относится к I (высшему) классу опасности. В чистом виде представляет собой жёлтые пластинки и иглы, легко расслаивающиеся на более мелкие. Хорошо растворим в неполярных органических растворителях: бензоле, толуоле, ксилоле, ограниченно растворим в полярных, практически нерастворим в воде.
Ароматичность, критерии ароматичности. Правило Хюккеля.
Совокупность специфических свойств бензола, а именно высокая стабильность, инертность в реакциях присоединения и склонность к реакциям замещения, получила общее название «ароматичность», или «ароматические свойства»
Критерии ароматичности. Правило Хюккеля
Основными характеристиками ароматических соединений являются:
склонность к реакциям замещения, а не присоединения (определяется легче всего, исторически первый признак, пример — бензол, в отличие от этилена не обесцвечивает бромную воду)
Энергетический критерий. Выигрыш по энергии, в сравнении с системой несопряженных двойных связей. Также называется Энергией Резонанса (выигрыш настолько велик, что молекула претерпевает значительные преобразования для достижения ароматичного состояния, например циклогексадиен легко дегидрируется до бензола, двух и трехатомные фенолы существуют преимущественно в форме фенолов (енолов), а не кетонов и.т.д.).
наличие кольцевого магнитного тока, этот ток обеспечивает смещение хим-сдвигов протонов, связанных с ароматическим кольцом в слабое поле, а протонов расположенных над/под плоскостью ароматической системы — в сильное поле.
Структурный критерий показывает, что в молекулах ароматических соединений не наблюдается альтернирования длин связей, которое хорошо заметно у неароматических соединений
наличие самой плоскости (минимально искаженной), в которой лежат все (либо не все — гомоароматичность) атомы образующие ароматическую систему. При этом кольца π-электронов, образующиеся при сопряжении двойных связей (либо электронов входящих в кольцо гетероатомов) лежат над и под плоскостью ароматической системы.
Практически всегда соблюдается Правило Хюккеля. НО!!! В то же время, в случае пери-сочленения, общее число π-электронов не соответствует правилу Хюккеля (фенален, пирен, коронен).
Правило Хюккеля гласит:
Ароматической является :
1) плоская,
2) циклическая,
3) сопряженная система,
4) содержащая (4n + 2) p-электронов (где n = 0, 1, 2, ...).
Реакции электрофильного замещения в бензоле (галогенирование, нитрование, сульфирование, алкилирование, ацилирование). Представление о механизме реакций электрофильного замещения в ароматическом ряду (- и -комплексы).
Арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности.
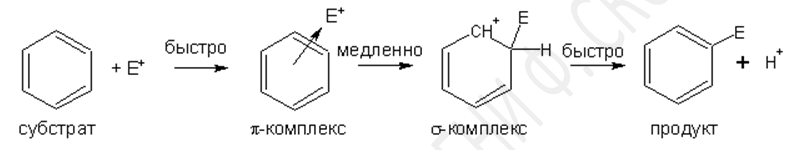
Реакции электрофильного замещения
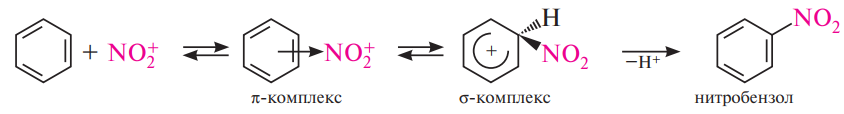
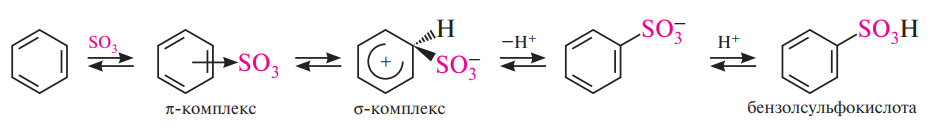
Механизм реакций замещения (SЕ)
1 стадия – образование p-комплекса в результате взаимодействия p-электроной системы бензольного кольца с положительно заряженной частицей:
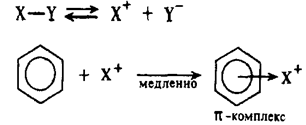
2 стадия – переход p-комплекса в s-комплекс (бензониевый ион) в результате выделения из системы шести p-электронов двух электронов для образования новой ковалентной связи С-Х. Оставшиеся четыре p- электрона распределяются между пятью углеродными атомами:
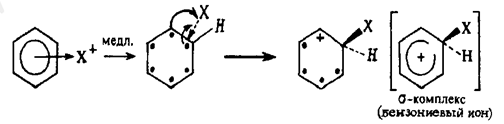
σ-комплекс – промежуточное образование лишённое ароматичности.
3 стадия состоит в быстром отщеплении протона водорода, которая приводит к стабилизации s-комплекса и восстановлению ароматической структуры:

Наиболее типичная схема реакции ароматического электрофильного замещения:
Нитрование. В качестве нитрующих агентов в реакции нитрования чаще используют концентрированную азотную кислоту или смесь концентрированных азотной и серной кислот (нитрующая смесь).
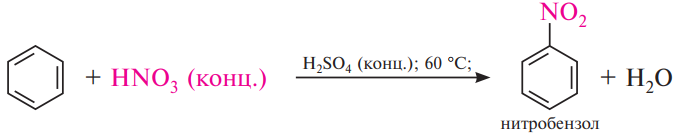
Сульфирование. Для сульфирования бензола и его гомологов чаще применяют концентрированную серную кислоту или дымящую серную кислоту (олеум).
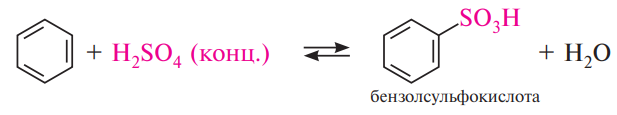
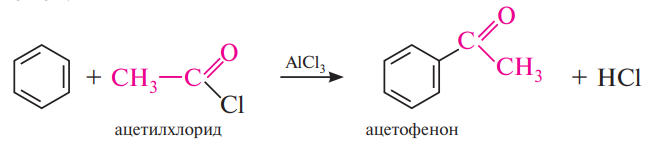
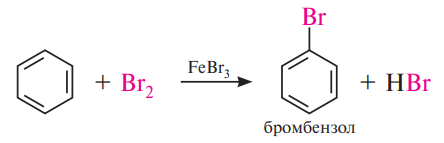
Галогенирование. Замещение атома водорода в бензольном ядре на атом хлора или брома осуществляют действием свободного хлора или брома в присутствии катализаторов — кислот Льюиса (AlCl3, FeBr3, ZnCl2 и др.):
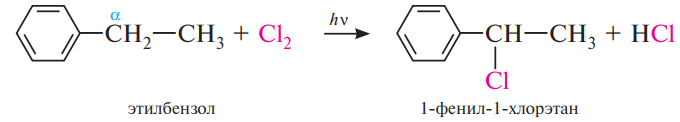
Алкилировавние по Фриделю-Крафтсу. Для алкилирования аренов, помимо галогеналканов, могут быть использованы спирты и алкены. Реакции с участием спиртов протекают в присутствии кислот Льюиса или минеральных кислот (H3PO4, H2SO4):
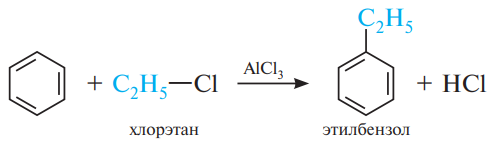

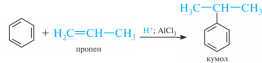 Алкилирование
аренов алкенами требует присутствия в
качестве катализатора кислоты Льюиса
и минеральной кислоты как источника
протонов.
Алкилирование
аренов алкенами требует присутствия в
качестве катализатора кислоты Льюиса
и минеральной кислоты как источника
протонов.
Ацилирование по Фриделю-Крафтсу. Ацилирование бензола и его гомологов по Фриделю—Крафтсу обычно осуществляют галогенангидридами или ангидридами карбоновых кислот в присутствии кислот Льюиса.