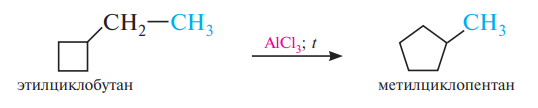- •Органическая химия
- •Состав органических веществ, их многообразие. Место органической химии в системе естественных наук. Источники органических соединений.
- •Формирование и основные положения теории строения органических соединений (а.М. Бутлеров, а. Кекуле, а. Купер).
- •Основные признаки классификации органических веществ. Основные классы органических веществ.
- •Номенклатура органических соединений. Основные принципы построения названий органических соединений.
- •Типы связей в молекулах органических соединений. Σ- и π-связи. Гибридизация, понятие о молекулярных орбиталях.
- •Представление о механизмах реакций. Представление о промежуточных частицах: радикалы, карбокатионы, карбанионы. Классификация реагентов: радикалы, нуклеофилы, электрофилы.
- •Энергетический профиль реакции; энергетический барьер реакции, энергия активации, энергия переходного состояния, тепловой эффект реакции. Кинетический и термодинамический контроль.
- •Кислоты и основания (Бренстед, Льюис). Сопряженные кислоты и основания. Кислотно-основые равновесия. Константа кислотной ионизации и ее показатель (рКа).
- •Взаимное влияние атомов в молекулах, ионах, радикалах. Электронные и пространственные эффекты в органических реакциях (индуктивный эффект, эффект поля, мезомерный эффект, гиперконьюгация).
- •Гомологический ряд, номенклатура, электронное строение, sp3-гибридизация и физические свойства алканов.
- •Химические свойства алканов. Общие представления о механизме цепных радикальных реакций замещения в алканах (на примере реакции галогенирования).
- •Номенклатура, структурная и пространственная изомерия, электронное строение, sp2-гибридизация и физические свойства алкенов.
- •Химические свойства алкенов: каталитическое гидрирование, реакции электрофильного присоединения к двойной связи алкенов, их механизмы.
- •Химические свойства алкенов: реакции присоединения галогенов, галогеноводородов, воды. Правило Марковникова и его объяснение.
- •Представление о стереохимии присоединения галогенов у алкенов. Перегруппировки карбокатионов. Реакции радикального присоединения (по Харашу).
- •Окислительное расщепление алкенов (восстановительный и окислительный озонолиз). Гидроборирование алкенов и использование в синтезе спиртов.
- •Полимеризация алкенов как важнейший метод получения высокомолекулярных соединений. Полиэтилен, полипропилен. Понятие о стереорегулярных полимерах.
- •Аллильное хлорирование алкенов, механизм. Аллильный радикал. Окисление алкенов кислородом воздуха (пероксидное окисление).
- •Номенклатура, классификация, изомерия диеновых углеводородов.
- •Классификация диенов:
- •Изопреновое звено в природных соединениях. Понятие об изопреноидах. Каучук. Синтетические каучуки.
- •Номенклатура, электронное строение, sp-гибридизация и физические свойства алкинов.
- •Химические свойства алкинов: каталитическое гидрирование и восстановление натрием в жидком аммиаке, использование в синтезе (z)- и (e)-алкенов.
- •Химические свойства алкинов: реакции электрофильного присоединения к тройной связи – галогенирование, гидрогалогенирование, гидратация (реакция Кучерова).
- •Кислотность ацетилена и терминальных алкинов. Димеризация, тримеризация ацетилена. Полиацетилен.
- •Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
- •Классификация и номенклатура аренов. Природа связей в молекуле бензола. Конденсированные ароматические углеводороды: нафталин, антрацен, фенантрен, бензпирен.
- •Ароматичность, критерии ароматичности. Правило Хюккеля.
- •Влияние заместителей в бензольном кольце на изомерный состав продуктов и скорость реакции. Активирующие и дезактивирующие заместители. Орто-, пара- и мета-ориентанты.
- •Классификация, номенклатура, изомерия галогенуглеводородов.
- •Литий- и магнийорганические соединения и их использование в органическом синтезе.
- •Биологическое действие галогенпроизводных, их применение в народном хозяйстве. Хлороформ, иодоформ, перфторуглеводороды, перфторполиэтилен (тефлон). Инсектициды.
- •Одноатомные спирты. Номенклатура, изомерия. Электронное строение. Физические свойства спиртов, роль водородной связи.
- •Химические свойства спиртов: кислотно-основные свойства. Алкоголяты металлов, их основные и нуклеофильные свойства.
- •Реакции нуклеофильного замещения с участием спиртов. Биологически важные реакции нуклеофильного замещения с участием эфиров фосфорных кислот.
- •Внутри- и межмолекулярная дегидратация спиртов (образование алкенов и простых эфиров). Окисление первичных и вторичных спиртов.
- •Фенолы. Номенклатура и изомерия. Простейшие представители: фенол, крезолы, пирокатехин, резорцин, гидрохинон, флороглюцин, пирогаллол. Электронное строение фенола. Кислотность фенолов.
- •Образование простых и сложных эфиров фенолов. Реакции электрофильного замещения в ряду фенолов (галогенирование, сульфирование, нитрование, алкилирование).
- •Карбоксилирование фенолятов щелочных металлов (реакция Кольбе). Окисление фенолов.
- •Хиноны и их биологическая роль. Фенольные соединения в природе. Витамин е. Флавоноиды.
- •Простые эфиры. Номенклатура, классификация. Расщепление кислотами. Образование гидропероксидов, их обнаружение и разложение. Циклические простые эфиры. Тетрагидрофуран. 1,4-Диоксан.
Классификация, номенклатура, структурная изомерия и пространственное строение циклоалканов.
Алициклические углеводороды классифицируют в зависимости от числа циклов, их величины и способа соединения. По числу циклов, входящих в состав молекулы, алициклические углеводороды подразделяют на моно- и полициклические (би-, трициклические и др.). В ряду моноциклических алициклических соединений выделяют малые циклы (С3 и С4), обычные (С5—С7), средние (С8—С11) и макроциклы (12 и более атомов углерода). В соответствии с правилами IUPAC названия моноциклических алициклических углеводородов образуют от названий алканов с соответствующим количеством атомов углерода, прибавляя префикс цикло-:

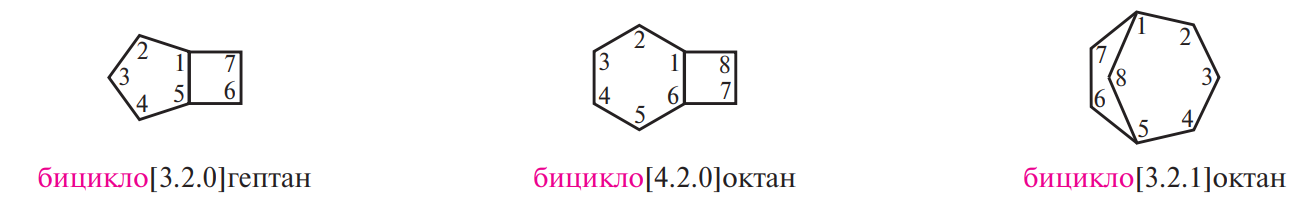
Структуры, состоящие из двух и более циклов, относят к полициклическим (многоядерным) углеводородам. В зависимости от взаимного расположения циклов многоядерные алициклические углеводороды подразделяют на следующие основные группы:

Название спирановой системы составляют, прибавляя префикс спиро- к названию углеводорода с соответствующим числом атомов углерода. Между префиксом и названием в квадратных скобках указывают (в порядке возрастания) число атомов углерода, исключая общий, в каждом из циклов. Нумерацию углеродных атомов спирановой системы начинают с меньшего цикла, причем узловой атом нумеруют последним.

Названия конденсированных и мостиковых алициклических соединений образуют, прибавляя префикс бицикло- к названию углеводорода с соответствующим числом атомов углерода. Между префиксом и названием углеводорода в квадратных скобках указывают (в порядке убывания) число атомов углерода в каждой из трех цепей, соединяющих два третичных (узловых) углеродных атома (последние при этом не учитывают). Нумерацию атомов углерода начинают с одного из узловых атомов и осуществляют таким образом, чтобы вначале была пронумерована самая длинная цепь, соединяющая узловые атомы, затем более короткая, а в случае мостиковых систем — в заключение нумеруют самую короткую углеродную цепь — мостик:
Общая формула циклоалканов CnH2n (n≥3)
Структурная изомерия обусловлена размером цикла, положением заместителей в цикле, структурой боковых цепей.
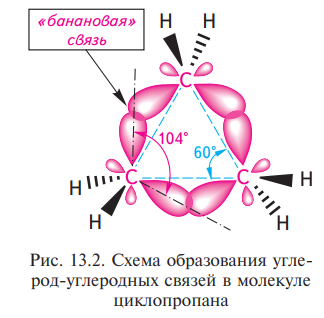
Пространственное строение циклоалканов определяется разной конформационной подвижностью углеродных атомов, зависящей от числа звеньев в цикле. Молекула любого циклоалкана стремится принять в пространстве такую форму (конформацию), в которой сумма углового, торсионного и вандерваальсового напряжений была бы минимальной. Вследствие взаимного отталкивания электронных облаков углерод-углеродных связей максимальная электронная плотность перекрывающихся орбиталей атомов углерода в трехчленном цикле расположена не по прямой, соединяющей центры связываемых атомов, а за пределами треугольника молекулы. Образующиеся при этом σ-связи отличаются от обычных σ-связей. Они занимают промежуточное положение между σ- и π-связями. Их называют τ-(греч. «тау»)связями, или «банановыми» связями. Несмотря на то что перекрывание за пределами треугольника менее эффективно, образование банановых связей для молекулы является выгодным процессом, поскольку в результате этого углы между связями, которые теоретически должны быть равными 60°, увеличиваются до 104°, что, следовательно, снижает угловое напряжение молекулы.
Конформации циклогексана и его производных, пространственная изомерия производных циклогексана. Типы напряжений в молекулах циклоалканов. Химические свойства циклоалканов (циклобутана, циклопентана и циклогексана, циклопропана).
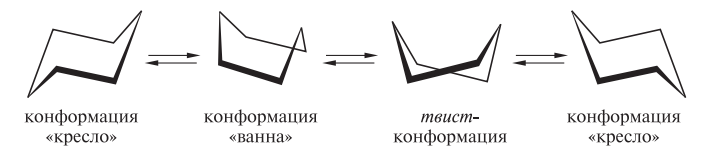
Избежать углового напряжения шестичленный цикл может при условии его существования в неплоских конформациях. Так, молекула циклогексана существует в виде двух крайних конформаций — «кресло» и «ванна» («лодка»), которые легко переходят друг в друга
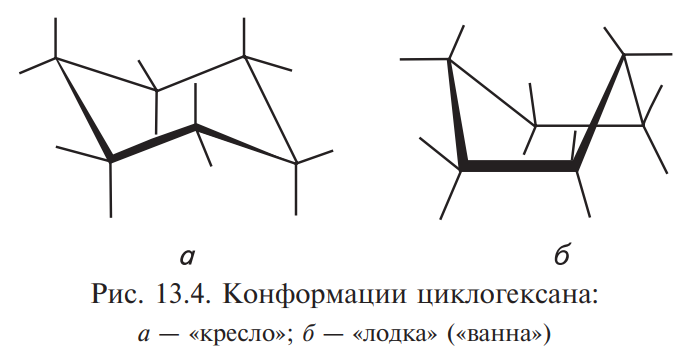
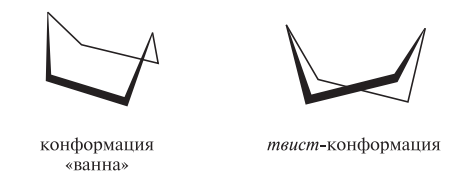
В конформации «ванна» при атомах углерода, расположенных в «основании ванны», водородные атомы находятся в заслоненной конформации,создающей определенное торсионное напряжение. Эта конформация, являясь гибкой структурой, может переходить в несколько более устойчивую форму (с меньшим заслонением), называемую твист-конформацией (искаженная «ванна»):
при обычных условиях преобладающая часть молекул циклогексана (99,9 %) существует в конформации «кресло», причем кольцо претерпевает непрерывную инверсию, то есть в результате вращения вокруг углерод-углеродных связей одна конформация «кресло» переходит в другую с промежуточным образованием конформации «ванна» и твист-конформации:
Геометрическая изомерия циклоалканов связана с различным расположением заместителей относительно плоскости цикла.
Оптическая изомерия характерна для циклоалканов, молекулы которых не имеют плоскости симметрии. Она неразрывно связана с геометрической изомерией. Так, транс-1,2-диметилциклопропан существует в виде пары энантиомеров.
Типы напряжения:
1. торсионное напряжение (напряжение Питцера), связанное со взаимодействием химических связей в заслоненной или частично заслоненной конформациях
2. Трансаннулярное напряжение (напряжение Прелога) – увеличение энерги молекулы вследствие взаимодействия несвязанных атомов и фрагментов
3. «угловое напряжение», или «напряжение Байера» – напряжение, связанное с отклонением валентных углов между углерод-углеродными связями в цикле от нормального (тетраэдрического) значения.
Химические свойства:
В химическом отношении циклоалканы во многом ведут себя подобно алканам. Для них характерны реакции замещения, протекающие по радикальному механизму (SR):
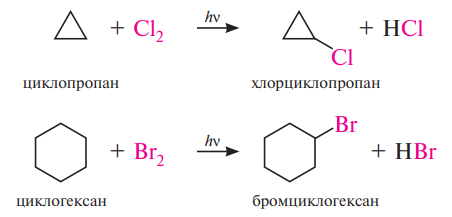
Соединения, содержащие трех- и четырехчленные циклы, наряду с реакциями замещения вступают также в реакции присоединения, сопровождающиеся раскрытием цикла. Циклопропан в присутствии катализаторов Ni, Рt и нагревании до 50 °С легко присоединяют водород:
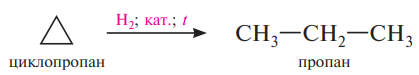
Циклобутан присоединяет водород при более высокой температуре (200 °С). Аналогично протекает реакция циклопропана с галогенами и галогеноводородами:
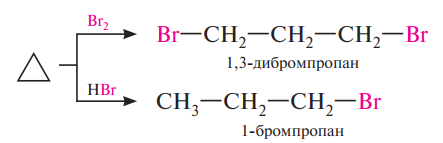
Присоединение галогеноводородов к алкилзамещенным циклопропана протекает в соответствии с правилом Марковникова

Для циклоалканов и их производных характерны реакции сужения и расширения циклов. Реакции протекают в присутствии катализаторов кислот Льюиса: