
Физика / lr7_0402_ответы
.docxВОПРОСЫ К ЛАБОРАТОРНОЙ РАБОТЕ № 7
-
Физический смысл универсальной газовой постоянной. Как она связана с постоянной Больцмана?
Универсальная газовая постоянная численно равна работе расширения одного моля идеального одноатомного газа в изобарном процессе при увеличении температуры на 1 К.
Универсальная
газовая постоянная выражается через
произведение постоянной
Больцмана на число
Авогадро, ![]() .
Универсальная газовая постоянная более
удобна при расчетах, когда число частиц
задано в молях.
.
Универсальная газовая постоянная более
удобна при расчетах, когда число частиц
задано в молях.
-
Уравнение Ван-Дер-Ваальса (график). Что такое бинодаль? Физический смысл коэффициентов Ван-дер-Ваальса.
ВАН-ДЕР-ВААЛЬСА УРАВНЕНИЕ - уравнение состояния реального газа
![]()
где V -
объём, р -
давление, T -
абс. темп-pa
газа, а и b -
постоянные, учитывающие притяжение и
отталкивание молекул. Член ![]() наз.
внутр. давлением, постоянная b равна
учетверённому объёму молекулы газа,
если в качестве модели молекулы принять
слабо притягивающиеся упругие сферы.
наз.
внутр. давлением, постоянная b равна
учетверённому объёму молекулы газа,
если в качестве модели молекулы принять
слабо притягивающиеся упругие сферы.
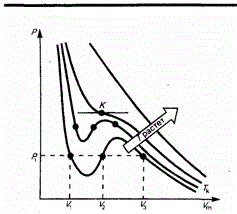 где
Тк – критическая температура, точка
перегиба К – критическая точка,
соответствующие этой точке объем Vк
и давление рк – называются также
критическими.
где
Тк – критическая температура, точка
перегиба К – критическая точка,
соответствующие этой точке объем Vк
и давление рк – называются также
критическими.
Бинодаль – кривая существования двух фаз
-
Теплоемкость идеального газа (CV, CQ, CP, CT)
Теплоемкость идеального газа — это отношение количества теплоты, сообщенного газу, к изменению температуры δТ, которое при этом произошло.
![]()
![]() где
где ![]() —
число степеней свободы частиц газа.
—
число степеней свободы частиц газа.
Cp = CV + R
-
Соотношение Майера.
Для любого идеального газа справедливо соотношение Майера:
![]() ,
,
где ![]() — универсальная
газовая постоянная,
— универсальная
газовая постоянная, ![]() —
молярная теплоёмкость при
постоянном давлении,
—
молярная теплоёмкость при
постоянном давлении, ![]() —
молярная теплоёмкость при постоянном
объёме.
—
молярная теплоёмкость при постоянном
объёме.
-
Работа идеального газа. Графическое изображение работы. Работа изотермического, изобарического, изохорического, адиабатического процессов.
Первый закон термодинамики - количество теплоты, подведенное к системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами:
![]()
Частные случаи первого закона термодинамики для изопроцессов
При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами:
![]()
При изотермическом процессе количество теплоты, переданное газу от нагревателя, полностью расходуется на совершение работы:
Q=A'
При изобарном расширении газа подведенное к нему количество теплоты расходуется как на увеличение его внутренней энергии и на совершение работы газом:
![]()
Адиабатный процесс - термодинамический процесс в теплоизолированной системе.
![]()
-
Первое начало термодинамики (для 4-х изопроцессов).
![]()
Теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Первое начало термодинамики:
-
при изобарном процессе
![]()
-
при изохорном процессе (
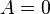 )
)
![]()
-
при изотермическом процессе

![]()
Здесь ![]() — масса газа,
— масса газа, ![]() — молярная
масса газа,
— молярная
масса газа, ![]() — молярная
теплоёмкость при
постоянном объёме,
— молярная
теплоёмкость при
постоянном объёме, ![]() — давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
— давление, объём и температура газа
соответственно, причём последнее
равенство верно только для идеального
газа.
-
Второе начало термодинамики.
Можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Короче: в процессах, происходящих в замкнутой системе, энтропия не убывает
-
Энтропия (термодинамическое определение, статистический смысл, формула Больцмана для энтропии).
Термодинамическая энтропия — термодинамическая функция, характеризующая меру неупорядоченности термодинамической системы, то есть неоднородность расположения и движения её частиц
![]() функция
состояния, дифференциалом которой
является
функция
состояния, дифференциалом которой
является
![]() называется энтропией и обозначается
S.
называется энтропией и обозначается
S.
Согласно Больцману, энтропия системы и термодинамическая вероятность связаны между собой следующим образом S = k lnW, где к – постоянная Больцмана.
-
Тепловая машина. КПД тепловой машины (Цикл Карно). Изображение цикла Карно в координатах PV, ST.
Цикл Карно — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин
Количество
теплоты, полученное рабочим телом от
нагревателя при изотермическом
расширении, равно
![]()
Аналогично,
при изотермическом сжатии рабочее тело
отдало холодильнику
![]()
Отсюда коэффициент полезного действия тепловой машины Карно равен
![]()

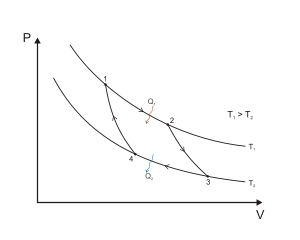
10. Семейство функций распределения Максвелла (изобразить)
Распределение Ма́ксвелла — распределение вероятности.Оно лежит в основании кинетической теории газов, которая объясняет многие фундаментальные свойства газов, включая давление и диффузию.
11. Распределение Больцмана.
Равновесное распределение частиц классического идеального газа по состояниям следует из уравнения Менделеева — Клапейрона, из которого можно вывести распределение газа в поле потенциальной энергии. Это распределение приводит к распределению Больцмана:
![]()
где ![]() —
среднее число частиц, находящихся в
—
среднее число частиц, находящихся в ![]() -ом
состоянии с энергией
-ом
состоянии с энергией ![]() ,
а константа
,
а константа ![]() определяется
условием нормировки:
определяется
условием нормировки:
![]()
где ![]() —
полное число частиц.
—
полное число частиц.
Распределение Больцмана является предельным случаем (квантовые эффекты пренебрежимо малы) распределений Ферми — Дирака и Бозе — Эйнштейна, и, соответственно, классический идеальный газ является предельным случаем Ферми-газа и Бозе-газа.
12. Распределение Максвелла-Больцмана по скоростям. (Средняя, среднеквадратичная и наиболее вероятная скорость.)
13. Уравнение Пуассона Уравнение адиабатического процесса (графики в координатах PV), построить графики адиабатического и изотермического процесса. Отметить точки пересечения, сколько этих точек, почему? Показатель адиабаты.
Уравнение Пуассона: pV=const –уравнение адиабатного процесса
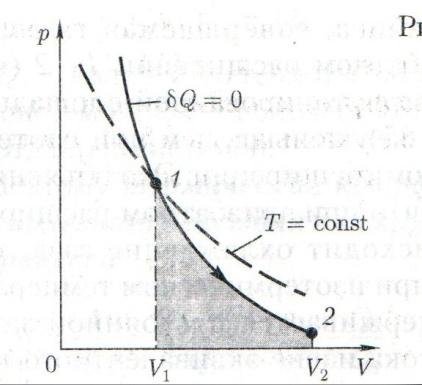
График зависимости между параметрами состояния идеального газа при ∂Q=0 называется адиабатой. Адиобата более крута, чем изотерма. Это объясняется тем, что при адиобатном сжатии увеличение давление газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
14. Степень свободы. Сколько степеней свободы имеет идеальный газ, (двухатомный, трехатомный). Что такое степени свободы?
Степень свободы – минимальное количество координат для определения положения объекта в пространстве.
Двухатомный газ имеет степень свободы 5
Трехатомный газ имеет степень совбоды 6
15. График процессов в 7-ой л/р. Какой процесс происходит после окончания выпуска газа из сосуда? График процесса.
16. Какой процесс происходит после окончания накачки газа в баллон в работе. Уравнение, графики.
17. Что больше Q1 или Q2, U1 или U2, A1 или A2 на рисунках? (см. лекции).
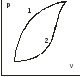 Q1>Q2;
U1=U2;
A1>A2
Q1>Q2;
U1=U2;
A1>A2
18. Изобразить в координатах PT, VT процесс, изображенный в PV.
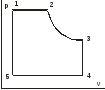
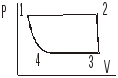
19. Цикл Карно в ST координатах. Укажите изотермический и адиабатический процесс.
Из всевозможных круговых процессов важное значение в термодинамике имеет цикл Карно – цикл, состоящий из четырех последовательных обратимых процессов: изотермического расширения, адиобатного расширения, изотермического сжатия и адиабатного сжатия.
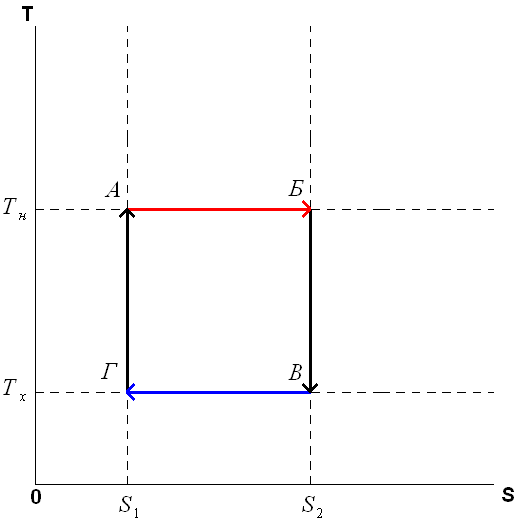 Цикл
Карно состоит из четырёх стадий:
Цикл
Карно состоит из четырёх стадий:
-
Изотермическое расширение (на рисунке — процесс A→Б).
-
Адиабатическое (изоэнтропическое) расширение(на рисунке — процесс Б→В).
-
Изотермическое сжатие (на рисунке — процесс В→Г).
-
Адиабатическое (изоэнтропическое) сжатие (на рисунке — процесс Г→А).
20. Число Авогадро (физ. смысл).
Число́ Авога́дро — физическая константа, численно равная количеству специфицированных структурных единиц (атомов, молекул, ионов, электронов или любых других частиц) в 1 моле (единица измерения количества вещества) вещества. Определяется как количество атомов в12 граммах (точно) чистого изотопа углерода-12. Обозначается обычно как NA,
21. Внутренняя энергия идеального газа.
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна
![]()
![]()
22. Барометрическая формула.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
Для идеального
газа,
имеющего постоянную температуру ![]() и
находящегося в однородном поле тяжести
(во всех точках его объёма ускорение
свободного падения
и
находящегося в однородном поле тяжести
(во всех точках его объёма ускорение
свободного падения ![]() одинаково),
барометрическая формула имеет следующий
вид:
одинаково),
барометрическая формула имеет следующий
вид:
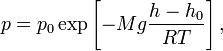
где ![]() —
давление газа в слое, расположенном на
высоте
—
давление газа в слое, расположенном на
высоте ![]() ,
, ![]() —
давление на нулевом уровне (
—
давление на нулевом уровне (![]() ),
), ![]() — молярная
масса газа,
— молярная
масса газа, ![]() — газовая
постоянная,
— газовая
постоянная, ![]() —абсолютная
температура.
—абсолютная
температура.
23. Уравнение Клапейрона-Менделеева (для изотермы, изохоры, изобары, графики этих процессов).
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]() ,
,
где
-
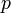 — давление,
— давление, -
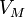 — молярный
объём,
— молярный
объём, -
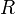 — универсальная
газовая постоянная
— универсальная
газовая постоянная -
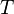 — абсолютная
температура,К.
— абсолютная
температура,К.
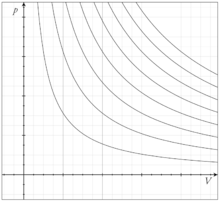
Изотермический процесс
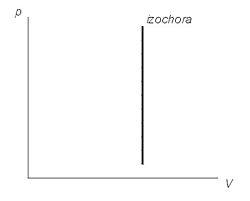
изохорный процесс
изобарный процесс
24. В прибор для определения показателя адиабаты методом Клемана и Дезорма попала вода. Как изменится при этом измеренный показатель адиабаты (дайте обоснованный ответ)?
