
-
Классификация кислот ( привести примеры )
-
Факторы, определяющие кислотность
-
Механизмы передачи влияния заместителя, Индукционный эффект
-
Мезомерный эффект
-
Выравнивающий эффект воды
-
Спирты, фенолы, SH-кислот
-
Индукционный эффект заместителей у атома кремния
-
Кислотность и основность элементоорганических соединений
-
Теория Аррениуса
-
Теория Льюиса
-
Теория Бренстеда и Лоурн
-
Теория Освальда
-
Теория Измайлова ---------------------------------------------------------------
-
Теория Усановича
-
Теория Шатенштейна
-
Теория Измайлова
-
Теория Франклина
-
Коллоиды и растворы
-
Чистые вещества и смеси
-
Разделение смесей
-
Кристаллические структуры
-
Закон Генри и следствие из него------------------------------------------------------
-
Замерзание и кипение растворов
-
Механизм химической реакции. Исходные, конечные и промежуточные вещества
-
Скорость химической реакции
-
Скорость образования и расходования промежуточных веществ
-
Порядок химической реакции
-
Комплексные соединения: комплексообразователь
-
Комплексные соединения: лиганд
-
Комплексные соединения: дентантность
-
Комплексные соединения: координационное число
-
Строение комплексных соединений
-
Нанообъекты и наноэффекты
-
Виды искусственных наноструктур (на примере углерода)
-
Получение искусственных наноматериалов.
-
Классификация кислот
по признаку элемента, атом которого связан с атомом водорода.
-
ОН кислоты: спирты, фенолы, карбоксильные кислоты, вода.
-
SH кислоты: тиолы, тиоловые кислоты, H2S и другие.
-
NH кислоты: амины, амиды, и другие.
-
СН кислоты: карбо-кислоты.
-
SiH кислоты, РН кислоты.
R-E-H
Общий вид нейтральной кислоты:
R-E:
R- сопряженное основания атом элемента или центр кислотности.
E- заместитель переменного строения связанный с Е.
В зависимости от природы Е, таких заместителей может быть несколько.
-
Факторы, определяющие кислотность.
-
Электроотрицательность реакционного центра.
-
Резонансный хар-ки реакционного центра (индукционный и мезомерные эффекты).
-
Энергия связи не поделенные электронные пары в атомном центре.
-
Электроотрицательность заместителей связанных с реакционным центром.
-
Резонансные хар-ки этих заместителей
-
Механизмы передачи влияния заместителя.
-
Индукционный или индуктивный эффект – передача путем последовательной поляризации б (сигма) связей.
-
Эффект поля (Кулоновский эффект)- это передача через пространство в соответствии с законами электростатики.
-
Эффект сопряжения (Мезомерный эффект) передача путем ПИ-ПИ перекрывания либо перекрывания ПИ –систем со свободными электронными парами заместителей.
-
Эффект отталкивания орбиталий.
4. Мезомерный эффект (М). –особый вид взаимного влияния атомов в молекуле. Заключается в поляризации сопряженной системой связей. Он обусловлен смещением ПИ электронов сопряженной связей или не поделенных электронных пар в сторону атомов с недостроенной электронной оболочкой, что приводит к появлению электрических зарядов на концах сопряженной цепи.( +М) –положительный;( -М) –отрицательный. Сила мезомерного эффекта зависит от электроотрицательности заместителя и числа электронов в нем. Анионы – являются сильными донорами электронов и дают +М . Катионы – сильные акцепторы и дают –М.
-
.
-
Спирты, фенолы, СН-кислоты. Спирты - В одноатомных насыщенных спиртах роль заместителя R играют различные алкильные радикалы. Поскольку эти заместители менее электроотрицательны чем водород, то наиболее типичные спирты не должны быть более сильные, чем вода. Спирты способны к растворению щелочных и щелочно-земельных металлах с выделением водорода. Введение в молекулу спирта электроотрицательных заместителей существенно повышается кислотность замещенных спиртов. Фенолы – ионы фенола стабилизированы за счет полярного сопряжения отрицательного заряженного кислорода с ароматическим циклом. Фенолы более значительные сильные кислоты, чем спирты и проявляют свои свойства в водных растворах. СН-кислоты –они сильнее гидроксильных кислот, заместитель R влияет на кислотность также как и в случае ОН кислот. Проявляют кислотные свойства в водных растворах. Тиофенолы являются более сильными кислотами чем фенолы.
-
.
-
.
-
Теория Аррениус. (1880-1890). – открытие теории электро-литической диссоциации. Кислота – водородосодержащие соединение, которое в водном растворе образует ионы водорода.
Основание – гидроксид содержащие соединения.
1. Теория не учитывает взаимодействие растворенного вещ-ва с растворителем.
2. Теория применима только для водных растворов.
Растворы различных кислот одной и той же концентрации имеют разную проводимость и химическую активность.
-
Теория Льюиса. – определение кислоты как вещ-ва способные присоединять пару не поделенных электронов от основания. Основания – вещ-ва способные отдавать пару не поделённых электронов.
В этой теории кислоты и основания могут быть нейтрализованы – это происходит путем образования ковалентной связи между атом основания у которого есть свободная электронная пара и атомом кислоты со свободной оболочкой.
-
Теория Бренстана и Лоури (1923) – предложили протолитическую теорию кислот и оснований.
Они предположили, что электрическая диссоциация не является физическим процессом отщепления Н+ и Н- , они считают что это результат химического взаимодействия растворенного вещества с растворителем.
Кислота – вещ-ва способные отдавать протон.
Основание – вещ-ва способны присоединять протон .
-
Теория Освальда (1888) – ввел понятие степень диссоциации
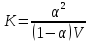
 –степень
диссоциации; V – объем раствора;
К – концентрация диссоциации.
–степень
диссоциации; V – объем раствора;
К – концентрация диссоциации.
Константа диссоциации может служить мерой силой кислот.
-
-------------------------------------------------------------------------------------------
-
Теория Усановича. –перекликается с теорией Льюиса.
Всякие химические процессы приводящие к образованию солей является кислотно основными ( реакции солеобразования ).
Кислота – вещ-во способное быть донором катиона в том числе и протона.
Недостаток теории: процессы широкие и расплывчатые. Все реакция рассматривается как кислотно-основные.
-
Теория Шатенстейна. Основание – электронно-донорный реагент обладающий с родством к протону.
Кислота – электро-акцепторный реагент, водород которого участвует в равновесной реакции с основанием. Кислота с основанием соединяется через водородную связь. В ней подчеркивается начальные и конечные стадии взаимодействия. По этой Теории – понятие кислота и основание условное.
Кислотно – основные свойства проявляются тогда, когда вещество становится реагентом. У углерода есть кислотные и основные свойства.
-
Теория Измайлова.(теория кислот и оснований). Диссоциируют не сами кислоты и основания, а продукты ассоциации молекул кислот и оснований с молекулами растворителя. Подтверждено опытными данными. Предложил количественную теорию диссоциации. Стадии : 1-я стадия (образования продукта присоединения растворителя к молекуле), 2-я стадия (сольватация. Осольватированные ионы могут быть ассоциированы в ионные пары). Ионные пары не участвуют в электропроводности растворов, т.е. ведут себя как молекулы но близки к ионам.
-
Теория Франклина(1924). Теория сольвато-систем – эта теория возникла в результате изучение реакции в жидкости аммиаке. Она предусматривает какие соединения становятся кислотами и основаниями в разных растворителях.
Он показал, что растворы амонимных солей в жидком аммиаке дают все реакции характерные для водных растворах кислот.
-
.
-
.
-
Разделение смесей. Способы :1)Фильтрация –пропускание смеси через фильтровальную бумагу. 2)Дистилляция ( см.рис. плитка, смесь, термометр, холодильник, приемники.). 3) Хроматография- химические вещества можно разделить основываясь о том как хорошо они впитываются в твердое тело.
4) Экстракция- альтернативный способ дистилляции (задача- найти жидкость, которая не растворялась бы в первой жидкости и при этом лучше чем эта жидкость растворялась бы во второй жидкости).
-
Кристаллические структуры. Типы кристаллической структуры зависит от того из каких атомов или ионов состоит кристалл. Все атомы в кристалле одного размера и они соединяются, образуя плотную структуру. Металлы склонны образовывать плотно-упакованные структуры – это структуры, в которых атомы находятся на столько близко друг к другу на сколько это возможно. Существует 2 способа которыми атомы могут соединяться в плотно-упакованную структуру: 1)Гексагональный 2)Кубический.
Трехмерную структуру кристалла называют – кристаллической решеткой ( самый маленький блок кристалла – электронная ячейка)
-
----------------------------------------------------------------------------------------------------------
-
Механизм химической реакции. Исходные, конечные и промежуточные вещества: Механическая реакция – совокупность стадий, из которых складывается химическая реакция. Исходные вещества – вещества вступающие в процесс химического превращения. Вещества образующиеся в процессе химического превращения и не претерпевающиеся дальнейших химических изменений называются продуктами химических реакций. Промежуточными веществами –вещества образующиеся в одних стадиях процесса и расходующиеся в других стадиях этого же процесса. Реакции образования и расходования промежуточных веществ называется – промежуточными реакциями.
-
Скорость химической реакции.- это кол-во вещ-ва вступающего в реакцию в единицу времени. Правильнее говорить не о скорости химического процесса в общем, а о скорости по некоторому компоненту. Изменение кол-ва этого компонента обозначается N изменение в единицу времени W=dN/dt. Численное значение производной зависит: 1)от процесса 2)от условия протекания 3)от взятого кол-ва исходных веществ. В качестве характеристике взятых веществ используют объем системы.
-
Скорость образования и расходования промежуточных веществ. –для промежуточных веществ изменение их концентрации во времени определяется наложением двух процессов: образование и расходование промежуточных веществ. Скорость образования промежуточного вещества называют ωo –изменение количества промежуточного вещества в единице времени в единицу объема.
Скорость расходования промежуточного вещества ωp -расходование количества промежуточного вещества в единицу времени в единицу объема.
dc/dt=ωo – ωp
-
Порядок химической реакции. Скорость зависит от ряда факторов при заданных внешних условиях ( +,Р, среда) скорость является функцией концентрации реагирующих веществ, в химической кинетике приходится иметь дело с процессами скорость которых оказывается пропорциональной произведению концентрации реагирующих веществ в степенях. ω= К
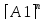
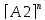 …
…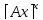
n-порядок реакции, чаще всего целое значение; К –называет с какой скоростью идет химический процесс при концентрации реагирующих веществ и называется const V -(скорости ) химической реакции. Если речь идет об отдельной стадии процесса, то порядок этой стадии не превышает 3. На ряду со скорость const V
химического процесса является основой величиной химического процесса.
-
Комплексные соединения: комплексообразователь. M+nL [ MLn ]
M –нейтральный атом ; ( + )или ( - ) –заряженный ион; L-молекулы, координируются во круг атома; n –число молекул. Атом комплексообразователя может нулевой степенью окисления. В комплексном соединении может быть несколько центральных атомов.
-
Комплексные соединения: лиганды. –в комплексном ионе во круг центрального атома координируются более простые атомы эти частицы называются – лигандами.
Лиганды не связанны друг с другом, между ними действует сила отталкивания. Лиганды логут быть органические и неорганические ионы.
-
Комплексные соединения : дентантность. Дентантность лигандов – лиганд связан с комплексообразователем через один из свободных атомов химической связи эти Лиганды…Монодентантные – к ним относится аммиак, ционит ионы. Бидентантные –молекула образует с комплексообразователем 2 химические связи.
-
Комплексные соединения: координационное число. –количество химических связей которые образуется между Лигондами и комплексообразователями.
Это число определяется строением комплексообразователя. Значение зависит от природы комплексообразователя, степени окисления, условий реакции, природы лигондов. Координационное число может принимать значение от 2 до 8.
Частые 4 и 6.
-
Строение комплексных соединений. –между координационным числом и строением комплексных соединений существует взаимосвязь.
1)Если координационное число = 2 (в этом случае ион имеет линейное строение и комплексообразование с Лигондами расположены на 1 прямой.).
2)Если коор.число. = 3 (комплекс имеет форму равностороннего треугольника. В центре комплексообразователь по углам Лиганды.).
3)Если к.ч. = 4 а)тетраэдрическое размещение (чище всего) ; б)плоский квадрат.
4)Если к.ч.=5 (тригональная бипирамида); 5)Если к.ч.=6 (октаидрическое расположение); 6)Если к.ч.=7(пентагональной бипирамиды)
-
Нанообъекты и наноэффекты.(природные)-Вирусы имеют размер от 10 до 200 нм. Размер аминокислот 1 нм. ДНК- цепи закручены с периодом 3нм., а диаметр цепи 2нм. Установлено, что наночастицы из золота можно прикрепить к любым молекулам. Задача нано-науки –заметить, правильно оценить и успешно применить на практике. Лотос эффект –немецкий ученый обнаружил, что некоторые цветки вообще не загружаются. С помощью электронных микроскопов ученые обнаружили, что поверхность покрыта тонкой мембраной.
-
Виды искусственных наноструктур. 1)самым простым материалом могут служить фрагменты вещ-ва измельченного до нано…. Уменьшение размера кристалла может привести к изменению материала.
Углерод и его формы-(алмаз, графит, карбин, лонделит) при переходе углерода от обыкновенного угля до графита. Изменяется свойство материала. Атомы углерода связанны между собой ковалентными связями. Специфическое свойство графита ( низкая, кольца шестиугольные). Алмаз ковалентные связи (самый твердый) углерод при повышенной температуре образует Кластеры.
Кластер – совокупность 2 или более однородных элементов.
-
Получение искусственных наноматериалов. (Нано-системы)-на основе природных полимеров используются в медицине.
Фелериновая дуга (синтез в плазме дугового разряда между графитовыми электродами)=Углеродные нанотрубки; Газофазный метод (t=4000 C ,ивыше)=Газофазные наномалекулы; Каталитическое разложение углеводородов(продувка смеси газообразного углеводорода по кварцевой трубке с металлическим порошком t от 700 до 1000 С.)=Углеродные нити; Порошковая технология (электроразрядное стекание и горячая обработка давлением)=Металлы и сплавы; Кристаллизация изоморфного состояния(при обычном и высоком давлении)=Аморфные металлические покрытия; Пеленочная технология(химическое осаждение покрытий из газовой фазы)=Металлы, сплавы, полимеры.
