
- •Ответы на экзаменационные вопросы 2014 года.
- •Глава 3. Основы химической термодинамики и биоэнергетики (1-4)
- •Глава 4. Основы кинетики биохимических реакций и химического равновесия. (5-8)
- •Глава 5. Растворы и их коллигативные свойства. (9-11)
- •Глава 6. Растворы электролитов и ионные равновесия. (12-13)
- •Глава 7. Теория кислот и оснований Бренстеда. Протолитические равновесия. (14-15)
- •Глава 8. Окислительно – восстановительные реакции. (16-18)
- •Глава 9. Комплексные соединения и их свойства (19-20)
- •Глава 10. Химия Биогенных элементов. (21-26)
- •Глава 11. Химия ионов – металлов жизни. (27-28)
- •Глава 12. Межфазные электрические потенциалы. Гальванические цепи. (29 –32)
- •Глава 13. Физико - химические основы поверхностных явлений. (33-38)
- •Глава 14. Физико – химия дисперсных систем. (39-44)
Глава 7. Теория кислот и оснований Бренстеда. Протолитические равновесия. (14-15)
Буферные растворы, их классификация, механизм буферного действия. Уравнение Гендерсона – Хассельбаха для расчета pH буферных растворов. Область буферного действия. Буферная емкость, ее виды и факторы, от которых зависит ее значение.
Буферный раствор– это раствор, содержащий протолитическую равновесную систему, способную поддерживать практически постоянные значениеpHпри разбавлении или при добавлении небольших количеств кислоты или щелочи.
По принадлежности слабого электролита к классу кислот или оснований буферные системы делятся на кислотные и основные.
Кислотнымибуферными системами называются растворы, содержащие слабую кислоту (донор протона) и соль этой кислоты (акцептор протона). (Ацетатная, гидрокарбонатная, гидрофосфатная)
Уравнение Гендерсона – Хассельбаха(Гендерсона – Хассельбальха [Для Элеоноры Григорьевны]):
pH=pKa
+ lg
Основными буферными растворами называются растворы, содержащие слабое основание (акцептор протона) и соль этого основания (донор протона). (NH3*H2Oи его солиNH4Cl)
Уравнение Гендерсона – Хассельбаха(Гендерсона – Хассельбальха [Для Элеоноры Григорьевны]):
pH=pKa(BH)+
+ lg
Механизм буферного действия: при разбавлении буферных растворов концентрации всех компонентов уменьшаются, но так как они изменяются одинаково, то их отношение остается неизменным. Величина константы диссоциации слабого электролита также не изменяется при разведении. ВеличинаpHтоже не меняется. В действительности это наблюдается до тех пор, пока концентрация компонентом буферных растворов не станет меньше 0,01 моль/л.
При добавлении сильной кислоты или щелочи в буферный раствор моментально вызывает защитную реакцию протолитической буферной системы по поддержанию постоянного значения pHсреды. Это происходит за счет связывания добавляемых ионовH+илиOH- соответствующими компонентами буферной системы с образование малодиссоциирующих соединений.
Защитные свойства буферных растворов по отношению к действию кислот и щелочей будут сохраняться тех пор, пока концентрации компонентов буферных систем, связывающихH+иOH-, будут больше концентрации добавляемых ионов.
Область буферного действия на основании данного слабого электролита можно приготовить буферные растворы, поддерживающие значение pH в диапазоне от pH1=pKa - 1 до pH2 = pKa + 1 (pH=pKa ± 1)
Буферная емкость (B) называется число моль – эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1 литру буферного раствора, чтобы изменить величину pH на единицу.

Факторы, от которых зависит значение буферной емкости: концентрация компонентов в буферном растворе и их отношение (чем выше концентрация, тем больше буферная емкость).
Учебник: 194 - 197.
Буферные системы плазмы крови: гидрокарбонатная, белковая и гидрофосфатная. Основные компоненты и их соотношение в этих системах. Сопряжение гидрокарбонатной и белковой буферных систем. Механизм их действия.
Гидрокарбонатная буферная система образована оксидом углерода (IV), взаимодействие которого с водой приводит к равновесной системе:
CO2+H2O ⇌ CO2*H2O ⇌ H2CO3 ⇌ H+ + HCO3-
Донор – угольная кислота H2CO3
Акцептор – гидрокарбонат – ион HCO3-‑.
Физиологические условия:
Ka*I= = 7, 95 * 10-7 pKa*I=6,1
= 7, 95 * 10-7 pKa*I=6,1
Стандартные условия:
KaI=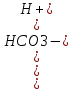 = 4,45 * 10-7 pKaI=6,36
= 4,45 * 10-7 pKaI=6,36
pH=pKa(BH)+
+ lg = 6,1 + lg
= 6,1 + lg

Если в кровь поступает кислота и увеличивается концентрация иона водорода, то он, взаимодействуя с HCO3-, смещает равновесие в сторону H2CO3 и приводит к выделению газообразного CO2, который выводится из организма в процессе дыхания через легкие.
H+ + HCO3- ⇌ H2CO3 ⇌ CO2 ↑ + H2O
Если в кровь поступает основание, оно связывается с угольной кислотой, и равновесие смещается в сторону HCO3-:
OH- + H2CO3 ⇌ HCO3- + H2O
Главное значение гидрокарбонатного буфера заключается в нейтрализации кислот + обеспечивает 55 % буферной ёмкости крови.
Белковые (протеиновые) буферные системы бывают:
- Анионного типа. Анионный белковый буфер работает при pH > pIбелка и состоит из донора протонов – молекулы белка HProt и акцептора протонов –аниона белка (Prot)-.
H3N+-Prot-COO- ⇌ H+ +H2N-Prot-COO-
При добавлении кислоты это равновесие смещается в сторону образования молекулы белка, а при добавлении основания в системе увеличивается содержание аниона белка.
- Катионного типа. Катионный белковый буфер работает при pH <pIбелка и состоит из донора протонов – катиона белка (H2Prot)+ и акцептора протона – молекулы белка HProt.
H3N+-Prot-COOH ⇌ H+ +H3N+-Prot-COO-
Гидрофосфатная буферная система
В клетках представлена K2HPO4 и KH2PO4, а в плазме крови и межклеточной жидкости Na2HPO4 и NaH2PO4.
Донор – ион H2PO4- (pKa = 6,8)
Акцептор – ион HPO42-
Работа буферной системы описывается уравнением буферного действия:
pH = 6,8 + lg ([HPO42-]/[H2PO4-]) (в норме 4/1)
При увеличении концентрации катионов H+ во внутриклеточной жидкости, например, в результате переработки мясной пищи, происходит их нейтрализация ионами HPO42-
H+ + HPO42- ⇌ H2PO4-
При увеличении концентрации оснований в организме, например, при употреблении растительной пищи, они нейтрализуются ионами H2PO4-:
OH- + H2PO4- ⇌ HPO42- + H2O
Избыточный гидрофосфат и дигидрофосфат выделяется с помощью почек.
Учебник: 197 – 203.
