- •4 Теория кислотности - основности Лоура –Бренстеда. Сравните кислотные св-ва следующих соединений:
- •II Окси и оксокислоты
- •5 Оксокислоты. Общие хим св-ва. Реакции на карбонильную и карбоксильную группы. Взаимодействие пировиноградной кислоты с н2, nh2 – nh2,c6h5 – nh2, c6h5ohNaOh/
- •6 Оксокислоты. Кето – енольная таутомерия на примере ацетоуксусного эфира и оксалилуксусной кислоты. Реакции с nh2-nh2, FeCl3
- •IV. Аминокислоты с полярными (гидрофильными) отрицательно заряженными радикалами (2):
- •5 Понятие о полипептиднах и первичной структуре белка. Напишите трипептид, ала-гис-глн дайте характеристику физико – химических свойств данного полипептида.
- •IV Углеводы
- •1Моносахариды. Цикло-цепная таутомерия моносахаридов на примере глюкозы и фруктозы. Формулы Фишера, Колли- Толленса и Хеуорса. Дайте название каждого таутомера. Явление мутаротации.
- •При растворении кристаллической таутомерной формы углевода в воде наблюдается явление мутаротации.
- •2 Кето – енольная таутомерия на примере глюкозы. Эпимеры. Эпимеризация. Чем обусловлен процесс.
- •6. Химические свойства моносахаридов
- •1. Окисление
- •Галактаровая и др.) кислоты
- •Восстановление глюкозы
- •Восстановление фруктозы
1 Спирты Тиолы Фенолы
1 Водородная связь. Ее виды и энергия. Влияние водородной связи на св-ва соединений H2O,ROH,RCOOHВодородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода. (например N,O,F). Является разновидностью донорно – акцепторной связи. Графически обозначается тремя точками. Бывает межмолекулярная ( у спиртов) связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы. Внутримолекулярная водородная связь объединяет части одной молекулы (Это особенно характерно для многих органических соединений). Водородные связи играют важную роль в формировании пространственной структуры высокомолекулярных соединений. У спиртов за счет Н-связей температура кипения значительно выше, например у этилового. Также Н-связи способствуют улучшению растворимости. При благоприятном пространственном расположении в молекуле соответствующих групп атомов, специфически влияет на св-ва. У салициловой к-ты повышает ее кислотность.
2 Водородная связь. Покажите образование межмолекулярных водородных связей на примере этилового спирта, уксусной кислоты. Как это явление проявляется на физических свойствах этих соединений. Приведите примеры роли водородных связей в природных соединения.Н-связь – это связь по типу диполь-дипольного притяжения между электроотрицательным элементом одной молекулы (таким, как O, N, F, Cl, S), являющимся отрицательным концом диполя, и атомом водорода другой молекулы, являющимся положительным концом диполя. Эта связь слабая – 4–5 ккал/моль. Ее обозначают тремя точками. За счет Н-связи молекулы, способные к ее образованию, находятся в ассоциированном состоянии. Это объясняет повышенную температуру кипения и хорошую растворимость низкомолекулярных спиртов. Водородная связь увеличивает длину связи Х-Н, что приводит к смещению соответствующей полосы валентных колебаний в ИК-спектре в сторону более низких частот. Метод ИК-спектроскопии является главным методом изучения водородной связи.
При образовании водородной связи полярность связи Х-Н возрастает, что приводит к повышению дипольного момента молекулярного комплекса в сравнении с расчетными данными, полученными путем векторного сложения диполей молекул R-X-H и B-Y.
Протоны, участвующие в водородной связи, характеризуются более низкой электронной плотностью, поэтому они деэкранируются, что приводит к существенному смещению соответствующих резонансных сигналов в спектрах ЯМР 1Н в слабое поле. Протонный магнитный резонанс наряду с ИК-спектрами является наиболее чувствительным к образованию Н-связи.
Для межмолекулярных водородных связей обнаружено смещение кислотно-основного равновесия молекулярный комплекс _ ионная пара вправо при повышении полярности растворителя.http://www.chemistry.ssu.samara.ru/chem1/P4_112.htmхорошая статья!!!!
3 Спирты. Тиолы. Фенолы. Реакция мягкого окисления на примере всех возможных изомеров бутиловых спиртов, этантиола, фенола. Укажите биологическую роль этих реакций. Реакции внутри и межмолекулярной дегидратации бутиловых спиртов. Спирты - Производные углеводородов, в которых один или несколько атомов водорода замещены на ОН-группы, называют спиртами. Общая формулаR-O-H.
Классификация:
1) по атомности – по количеству ОН-групп на одно- и многоатомные спирты;
2)по характеру радикала – предельные и непредельные; алифатические и ароматические;
3) по характеру атома углерода, с которым связана ОН-группа, – первичные, вторичные, третичные спирты.
Тиолы - Подобно тому, как спирты и простые эфиры являются органическими аналогами воды, тиолы (тиоспирты, меркаптаны) (R-SH) и сульфиды (R-S-R) представляют собой органические аналоги сероводорода
Фенолы – гидроксилсодержащие ароматические соединения, в молекулах которых гидроксил связан непосредственно с углеродным атомом бензольного ядра. По числу гидроксильных групп различают одно-, двух- и многоатомные фенолы
Тиолы
окисляются самым широким спектром
окислителей (кислород, пероксиды, оксиды
азота, галогены и др.). Мягкие окислители
(йод, алифатические сульфоксиды,
активированный диоксид марганца и т.
п.) реагируют с тиолами с образованием
дисульфидов: Этантиол легко
окисляется. При действии кислорода в
щелочной среде, йода, o-йодбензойной
кислоты , алифатичных сульфоксидов,
активированных окиси марганца (IV),
перекиси водорода и окиси азота (IV)
образуется дисульфиды RSSR фенол -
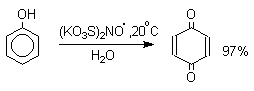
Внутримолекулярная дегидратация спиртов. –при отщеплении воды от молекул вторичных и третичных спиртов атом водорода отрывается от соседнего наименее гидрогенизированного атома углерода; образующийся алкен содержит наибольшее число заместителей при двойной связи (правило Зайцева). При дегидратации втор-бутилового спирта (бутанола-2) образуется бутен-2: СH3CH(OH)-CH2CH3 ––t°,H2SO4→ CH3CH=CHCH3 + Н2О
Реакция
межмолекулярной дегидратации происходит
в присутствии серной кислоты и при
температуре приблизительно 140 градусов
Цельсия.
СН3(СН3)3с-ОН
Н2So4СН2=С
СН3 + Н2О


4 Теория кислотности - основности Лоура –Бренстеда. Сравните кислотные св-ва следующих соединений:
А) 3 хлор -1 бутанол, 3 метил -1 бутанол, 2 хлор – 1 –бутанол Б) этиловый спирт, этиленгликоль, глицерин В) фенол, п-фторфенол, п –аминофенол Г) уксусная кислота, α – хлорпропионовая, α – фторпропионовая, β –хлорпропионовая. Дайте ответ на основе электронных эффектов заместителей подтвердите свой ответ соответствующими реакциями. По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон
. Согласно протонной теории кислот и оснований Бренстеда-Лоури, кислотно-основное взаимодействие - это процесс, который ведет к переносу протона от одной частицы (кислоты) к другой (основанию). По Бренстеду, основание - это частица, способная поделиться одной из своих электронных пар с протоном и образовать с ним ковалентную связь (протонироваться). Кислотой Бренстеда является частица, способная к отщеплению протона (депротонированию). Самой сильной кислотой является сам протон. Свободные протоны существуют лишь в газовой фазе, в растворах они связаны с тем или иным основанием, в роли которого чаще всего выступает молекула растворителя. Поэтому результатом реакции переноса протона является образование новой пары частиц кислота (В-Н+) - основание (А-):
II Окси и оксокислоты
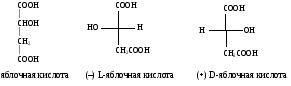
1Стереоизомерия.
Дистереоизомерия и энантиомерия на
примере яблочной и винной кислот D и L
стереохимические ряды. Глицериновый
альдегид как стандарт конфигураций D и
L стереоизомеров.Cтереоизомерия
- более широкое понятие структуры
молекулы (сюда включают конфигурацию
и конформацию, они отражают трехмерность
молекулы). Молекулы обладающие одинаковым
хим строением, на различные в
пространственном строении и есть
стереоизомеры (пространственные
изомеры). Могут быть конфигурационными
и конформационными. Конфигурация
– это порядок расположения атомов в
пространстве без учета различий,
возникающих из-за вращения вокруг
одинарных связей. Делятся на 2 типа –
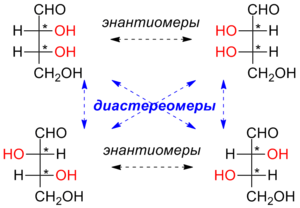
энантиомеры и дистериомеры. Энантиомеры
– стереоизомеры , относящиеся друг к
другу, как предмет и несовместимое с
ним зеркальное отображение. В виде
энантиомеров могут существовать только
хиральные молекулы. Энантиомеры обладают
одинаковыми хим и физ св-вами (температуры
плавления и кипения, плотность и
растворимость) но проявляют различную
оптическую активность т е способность
отклонять плоскость поляризованного
света.Диастереомеры
– стереоизомеры, не являющиеся зеркальным
отражением друг друга, обладают разными
физико-химич св-вами. α
– диастереомеры
- это те которые содержат в молекуле
более одного хирального центра,
определяется как 2n ,n- число центров
хиральности. Некоторые пары стереоизомеров
будут иметь противоположные конфигурации
всех соответствующих стереоцентров и
являться, таким образом, энантиомерами.
Все остальные парные комбинации
стереоизомеров будут различаться лишь
некоторыми конфигурациями, не являясь
зеркальными отражениями друг друга.
Такие пары являются диастереомерами.π
диастереомеры – конфигурационные
изомеры содержащие π связьπ-Диастереомеры,
также называемые геометрическими
изомерами, отличаются друг от друга
пространственным расположением
заместителей относительно плоскости
двойной связи. Например, малеиноваяифумароваякислоты
отличаются друг от друга взаимным
расположениемкарбоксильных
группу двойной связи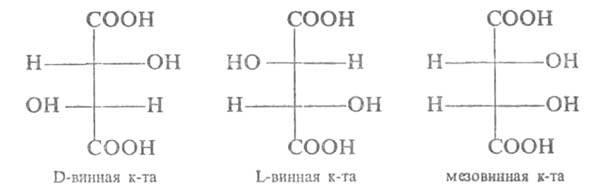

В
системе классификаций Глицериновый
альдегид(глицераль,
глицериновый альдегид,глицероза,
2,3-дигидроксипропаналь) принят
за стандарт. Его левовращающему
энантиомеру была присвоена произвольно
приписная формула (I) обозначаетсяL.
Правовращающему приписана (II),
конфигурация обозначается D
D- и L-глицеральдегид представляет собой сладкое бесцветное кристаллическое вещество хорошо растворимое в воде (с образованием вязкого сиропа), малорастворимое в этаноле и диэтиловом эфире, нерастворим в неполярных растворителях. Водный раствор глицеральдегида обладает оптической активностью (вращает плоскость поляризации).
2
оптическая активность гидрокси – и
аминокислот. Определение оптической
активности у молекул глицериновой
кислоты, винной кислоты, глюкозы, рибита,
аланина. Укажите условия проявления
оптической активности. Оптическая
активность — это способность среды
(кристаллов, растворов, паров
вещества)вращать
плоскость поляризованного света вправо
и влево.Метод исследования оптической
активности —поляриметрия.Глицериновая кислотаСН2ОН—СНОН—СООНполучаетсяокислениемглицерина,
чаще всего действиемазотной
кислоты- оптически
недеятельна.Кристаллизациейсолейбруцинаона
может быть разделена наоптические
антиподы. Особым
окислительнымброжениемглицерина(Bacillus
aethaceticus) она может быть получена в
виде правовращающегостереоизомера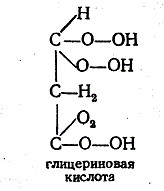
Рибит
- получается
из L-рибозы при
восстановлении её амальгамой натрия. Кроме
право- и левовращающих, есть и третий
тип изомеров – оптически неактивные.
Это обнаружил в 1830 знаменитый немецкий
химик Йёнс Якоб Берцелиус на
примере виноградной (дигидроксиянтарной)
кислоты НООС–СН(ОН)–СН(ОН)–СООН: эта
кислота оптически неактивна, а винная
кислота точно такого же состава обладает
в растворе правым вращением.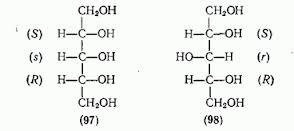

Рибит ксилит
Позднее была открыта и не встречающаяся в природе «левая» винная кислота– антипод правовращающей. Различить оптические изомеры можно с помощью поляриметра – прибора, измеряющего угол поворота плоскости поляризации.
Для
растворов этот угол линейно зависит от
толщины слоя и концентрации оптически
активного вещества (закон Био). Для
разных веществ оптическая активность
может изменяться в очень широких
пределах. Так, в случае водных растворов
разных аминокислот при 25° С удельная
активность (она обозначается как [a]D и
измеряется для света с длиной волны 589
нм при концентрации 1 г/мл и толщине слоя
10 см) для аланина, +13,5°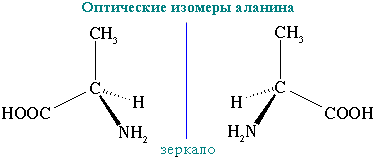
Глюкозаоптически
активна, вращает поляризованный луч
вправо. Принадлежность
к DилиLряду
по хиральному центру наиболее удаленного
от оксогруппы. Для
медицинских целей
употребляютглюкозувпорошкахитаблетках,
а также изотонический (4,5—5%) и
гипертонический (10—40%)растворы
глюкозы.Изотонические
растворыприменяют (вводят подкожно
и в клизмах) для пополненияорганизмажидкостью;
они являются также источником легко
усвояемого питательного материала.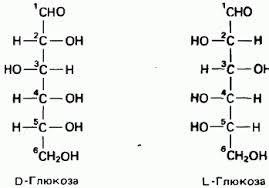
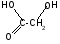
3 Оксикислоты. Структура молочной, яблочной , винной, лимонной, β гидроксимасляной кислоты. Химические св-ва.Реакция образования солей и сложных эфиров. Их названия по кислотным остаткам. Биологическая роль. Оксикислоты -карбоновые кислоты, в которых одновременно содержатсякарбоксильнаяигидроксильнаягруппы. Проявляют общие св-ва спиртов и кислот. В зависимости от реагентов и условий проведения реакции. . Гидроксикислоты проявляютспецифические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.
Например, своеобразная реакция отщепления воды при нагревании.
Она позволяет отличить -,-,- и другие гидроксикислоты.
а)
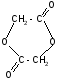
t°


гидролиз
+ 2H2O 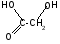
+ H+илиOH-
лактиды
(циклические
сложные
эфиры)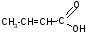
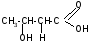
б) t°

-H2O
-оксимасляная кислота кротоновая кислота
в)
t°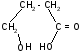
+
H2O

гидролиз
H+
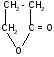
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)
t°
+
H2O

гидролиз
H+
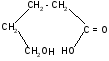
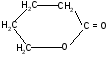
-гидроксивалериановая - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
2. Разложение -гидроксикислот при нагревании в присутствии H2SO4:
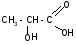
t°, H2SO4
CH3–CHO
+ HCOOH
Многоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как -гидроксикислоты:
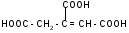
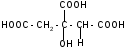
t°


-Н2О
лимонная
кислота цис-аконитовая
к-та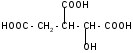
+ Н2О
изолимонная
кислота
против правила
Марковникова
Молочная
(α – гидроксипропионовая (лактаты)
)ИЮПАК – 2 гидроксипропановая (2х
атомная и одноосновная) является
продуктом жизнедеятельности ряда
бактерий. Используется как консервант,
предохроняющий от продуктов гниения.
Встречается в виде 2х стереоизомерных
форм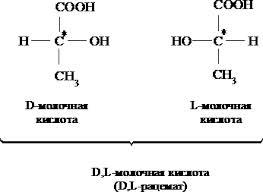
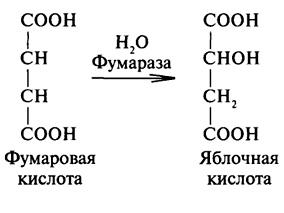
Яблочная
–α гидроксиянтарная (малаты) ИЮПАК
2 гидроксибутандиовая 3 атомная 2 основная
. в рябине, яблоках. Один из продуктов
распада углеводов в организме. Соли
железа (малаты) применяются в медецине
при малокровии. Существ в виде 2х формах.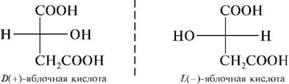
Винная
(виноградная), или,-дигидроксиянтарная
кислота (тартраты) 2,3-дигидрокси
бутандиовая кислота 4х атомная 2 основная.
Винная кислота — распространённое
природное соединение. В значительном
количестве она содержится в
кисломсокемногих
фруктов, например, ввиноградномсоке.
Соли винной кислоты — тартраты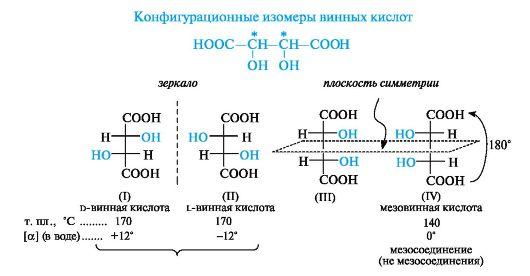
При пиролизе D-винная кислота декарбоксилируется с образованием пировиноградной СН3СОСООН и пировинной (метилянтарной) НООССН(СН3)СН2СООН кислот. Она восстанавливается до янтарной кислоты, восстанавливает аммиачный раствор AgNO3 до Ag; в щелочной среде растворяет Сu(ОН)2 с образованием прозрачного ярко-синего раствора - реактива Фелинга.Применяется в пищевой промышленности (пищевая добавка Е334), в медицине, ваналитической химиидля обнаружения альдегидов, сахаров и др., в химической и фармакологической промышленности для разделения рацематов органических веществ на изомеры.Соливинной кислоты (тартраты) используются в медицине, при крашениитканей
Лимонная
, или-гидрокси--карбокси-глутаровая
(цитраты) 3-гидрокси-3-карбоксипентан
диовая 4х атомная 3 основная. Соли и эфиры
лимонной кислоты называютсяцитратами.
Лимонная кислота, являясь главным
промежуточным продуктом метаболическогоцикла
трикарбоновых кислот, играет важную
роль в системе биохимических
реакцийклеточного
дыханиямножества организмов.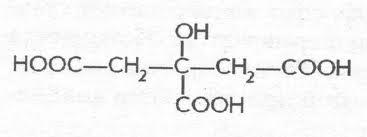
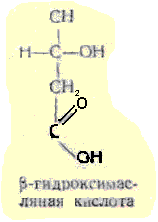
β
гидроксимасляная 1-3 гидроскибутановая
- как промежуточный продукт окисления
жирных кислот накапливается в организме
у больных сахарным диабетом, являясь,
в свою очередь, предшественником
ацетоуксусной кислоты. Сложные эфиры
можно рассматривать как производные
кислот, водород карбоксильной группы
которых замещен радикалом (R').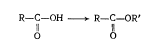
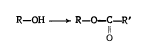
Их можно также рассматривать как производные спиртов, в молекуле которых водород гидроксила замещен остатком кислоты.
Получение сложных эфиров сводится к взаимодействию соответствующих спирта и кислоты в присутствии водоотнимаю-щих средств или действием на спирт ангидридов кислот (амил-нитрит).
Низкомолекулярные сложные эфиры - подвижные жидкости с характерным специфическим запахом, высокомолекулярные - твердые вещества. Все сложные эфиры нерастворимы в воде и хорошо растворимы в органических растворителях. Если эфир образован кислотой, которая является окислителем, то он взрывоопасен, так как возможно внутримолекулярное окисление спирта, например нитроглицерин.
Характерным свойством сложных эфиров является их способность легко гидролизоваться. Гидролиз катализируется присутствием щелочей, кислот, нагреванием, присутствием окислителей и восстановителей
Глицерин тринаитрат глицерина тринаитрат глицерина взрычатое в-во. В малых концентрациях ( в виде 1% раствора в этаноле) прим как сосудорасширяющее средство.
СН2ОН
СН2ОН
-NO2
СН2ОН
3НNO3 H2SO4
СН2ОН -NO2

СН2ОН -3H2 OСН2ОН -NO2
Реакции солеобразования, этерификации и окисления на примере молочной и яблочной кислоты. Реакции протекающие при нагревании альфа, бета, гамма кислот. Лактиды и лактоны.Например, своеобразная реакция отщепления воды при нагревании.
Она
позволяет отличить -,-,-
и другие гидроксикислоты.
а)

t°


гидролиз + 2H2O
+ H+илиOH-
лактиды
(циклические
сложные
эфиры)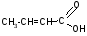
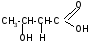
б) t°

-H2O
-оксимасляная кислота кротоновая кислота
в)
t°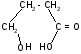

+
H2O

гидролиз
H+
-гидроксимасляная - бутиролактон
кислота (ГОМК)
ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях.
г)
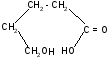
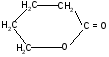
t°
+
H2O

гидролиз
H+
-гидроксивалериановая - валеролактон
лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот.
2.
Разложение -гидроксикислот
при нагревании в присутствии H2SO4: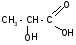
t°,H2SO4CH3–CHO+HCOOH
Многоосновные кислоты ведут себя так же.
Термин “этерификация” происходит от слова Ether – эфир. Таким образом, этерификация – это образование сложных эфиров. Карбоновые кислоты реагируют со спиртами в присутствии катализатора – серной кислоты – с образованием сложных эфиров
Этиллактат
(этиловый эфир молочной кислоты),
бесцветная жидкость, т.кип. 154 oC.
Используется как растворитель эфиров
целлюлозы и олиф и как ароматизирующее
вещество для пищевых продуктов.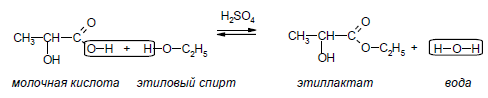
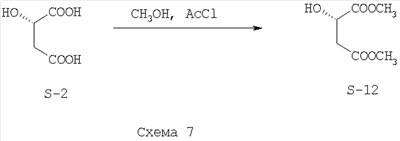
Этерификация (S)-яблочной кислоты