
- •Подзолков Владимир Петрович
- •1.1. Общая анестезия
- •2.5.27. Коарктация аорты
- •Г.И.Цукерман и.И.Скопин
- •Л.А.Бокерия
- •В. И. Бураковский в.С.РаботниковД.Г. Иоселиани
- •7.16.3. Реплантация пальцев
- •7.16.4. Микрохирургия лимфатических путей
- •1. Общие вопросы сердечно-сосудистой хирургии
- •2. Врожденные пороки сердца
- •3. Приобретенные болезни сердца и пе рикарда
- •6. Трансплантация сердца
- •4. Нарушения ритма сердца
- •5. Ишемическая болезнь сердца
- •7. Болезни сосудов
- •2. Congenital heart diseases
- •3. Acquired heart and pericardium diseases
- •4. Rhythm disorders of the heart
- •5. Ischemic heart disease
- •6. Transplantation of the heart
- •7. Vessel diseases
- •26.06.96. Формат бумаги 84x108716- Бумага мелованная офсетная.
В. И. Бураковский в.С.РаботниковД.Г. Иоселиани
По определению группы экспертов Всемирной организации здравоохранения (1971), «ишемическая болезнь сердца представляет собой острую или хроническую дисфункцию сердца, возникшую вследствие относительного или абсолютного уменьшения снабжения миокарда артериальной кровью».
Патогенез. В патогенезе ишемической болезни сердца (ИБС) основную роль играет нарушение баланса между потребностью миокарда в кислороде и доставкой его к мышце сердца.
При всей сложности механизмов регуляции коронарного кровообращения и многообразия факторов, влияющих на него, в патогенезе ИБС можно рассматривать два основных периода или два этапа развития болезни: 1) ангиоспастиче-ский и 2) период неадекватного кровоснабжения. Однако деление этих периодов весьма условно, поскольку в большинстве случаев функциональные и анатомические изменения взаимосвязаны [Шхвацабая И. К., 1975].
Патологическая анатомия. Более чем в 90% случаев анатомической основой ИБС является стенозирующее поражение артерий сердца, которое может быть следствием множества патологических процессов—от артериита при коллагеновых заболеваниях до эмболии при бактериальном эндокардите. Но наиболее частой и хорошо изученной причиной поражения коронарных артерий является атеросклероз. Атеросклеротические изменения обнаруживаются в артериях крупного и среднего калибра и поражают в первую очередь внутреннюю стенку сосуда. В зависимости от проявлений, видимых невооруженным глазом, атеросклеротические поражения можно разделить на три типа: 1) липидные пятна; 2) фиброзные бляшки; 3) сложные поражения. Микроскопическая картина всех этих изменений клеточных и соединительнотканных структур весьма многообразна.
Клинические симптомы появляются при развитии фиброзных бляшек или сложных поражений сосудистой стенки, Фиброзные бляшки растут в просвет сосуда. Они состоят из липидного ядра, свободно лежащего в сосудистой стенке и выстланного со стороны просвета сосуда слоем фиброзно-мышечной ткани, которая иногда представляет собой утолщенную оболочку сосуда. Такие изменения обычно появляются прежде всего в аорте, коронарных и сонных артериях, как правило, у людей старше 25—30 лет с последующим прогрессированием по мере увеличения возраста. Увеличение фиброзной бляшки предположительно происходит за счет трех различных механизмов—накопления липидов, геморрагии и пристеночного тромбоза (рис. 5.1). Эти механизмы скорее всего действуют одновременно. Не исключено также обнаружение и других факторов, ведущих к росту бляшки.
В большинстве случаев атеросклероз поражает проксимальные отделы основных венечных артерий, особенно в начальной стадии заболевания. А. В. Смольянников и соавт. (1963) считают, что атеросклеротические бляшки в начале заболевания локализуются в местах изгибов либо отхожде-ния от артерий крупных ветвей или в зоне погружения артерий в толщу миокарда. В системе левой коронарной артерии в 70% случаев стенозирующие атеросклеротические бляшки расположены в 4 см от устья коронарных артерий, тогда как в правой коронарной артерии атеросклеротиче-ский процесс имеет тенденцию распространяться дисталь-нее. Он не распространяется на те участки венечных артерий, которые располагаются в толще миокарда.
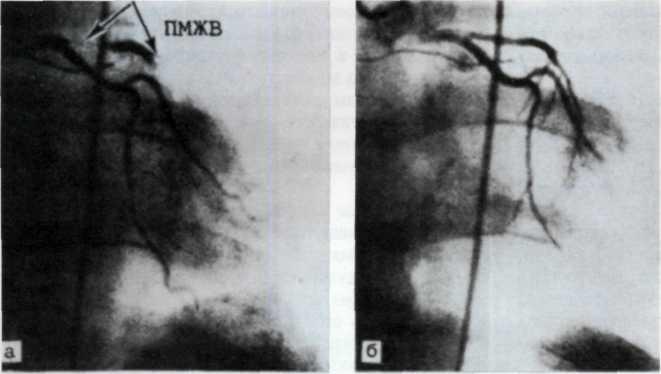
Ранее других атеросклерозом поражается передняя межжелудочковая ветвь левой венечной артерии (ПМЖВ ЛВА) (рис. 5.2). Она одинаково часто поражается при любом типе коронарного кровоснабжения. Эта артерия кровоснабжает переднюю стенку левого желудочка, а также переднюю часть межжелудочковой перегородки, переднюю ветвь левой ножки предсердно-желудочкового пучка.
Второе место по частоте поражения атеросклерозом занимает правая венечная артерия (ПВА). Она вовлекается в процесс почти исключительно при правом и среднеправом типах коронарного кровообращения и значительно реже при левом типе. ПВА кровоснабжает правый желудочек, заднюю и частично боковую стенки левого желудочка и заднюю часть межжелудочковой перегородки. Она кровоснабжает синусно-предсердный и предсердно-желудочковый узлы, а также заднюю ветвь левой ножки предсердно-желудочкового пучка.
Важную роль в васкуляризации сердца играет огибающая ветвь левой венечной артерии (ОВ ЛВА). Она кровоснабжает боковую стенку левого желудочка и в зависимости от типа коронарного кровоснабжения может васкуляризиро-вать синусно-предсердный узел и заднюю стенку левого желудочка (рис. 5.3).
Значительно реже наблюдается поражение ствола левой коронарной артерии, при этом клиническое течение заболевания крайне тяжелое, прогноз плохой.
Вслед за стенозирующим атеросклеротическим процессом в системе венечного кровообращения сердца происходит компенсаторное развитие функционально значимых коллатеральных сообщений. Именно от выраженности анастомозов между венечными артериями во многом зависит течение заболевания. Коллатерали смягчают клиническое проявление стенокардии, предотвращают развитие инфаркта миокарда и продлевают жизнь. Весьма вероятно, что нарушение компенсации коллатерального кровообращения в результате прогрессирования стенозирующего поражения сосуда или по другой причине играет также важную роль в патогенезе ИБС.
Еще одним патогенетическим фактором ИБС является спазм венечных сосудов сердца (рис. 5.4). Функциональная транзиторная «обструкция» коронарного русла также играет немаловажную роль в патогенезе ИБС, особенно при таких ее формах, как стенокардия в состоянии покоя при сохраненной высокой толерантности к физическим нагрузкам, «вариантная стенокардия», стенокардия, возникающая от холода при интактных коронарных артериях и т. д. A. Maseri (1982) считает, что даже у одного и того же больного могут быть разные механизмы возникновения приступов стенокардии. Возникновение ишемии миокарда и приступа стенокардии из-за несоответствия потребности миокарда в кислороде и невозможности компенсации ввиду стенозирующего поражения венечных артерий объясняет классический механизм стенокардии. Однако нельзя исключить и другой вариант — возникновение ишемии миокарда без повышения потребности в кислороде, т. е. в результате транзиторно возникшего препятствия венечному кровотоку, например, при спазме венечных артерий.
В большинстве случаев в патогенезе заболевания имеется комбинация перечисленных выше факторов с преобладанием того или иного в зависимости от формы заболевания.
Классификация ишемической болезни сердца. В настоящее время нет единой классификации ИБС.
Наиболее широкое распространение получила клиническая номенклатура, разработанная и предложенная в 1979 г. рабочей группой экспертов ВОЗ. Согласно этой номенклатуре выделяют пять форм ИБС.
535
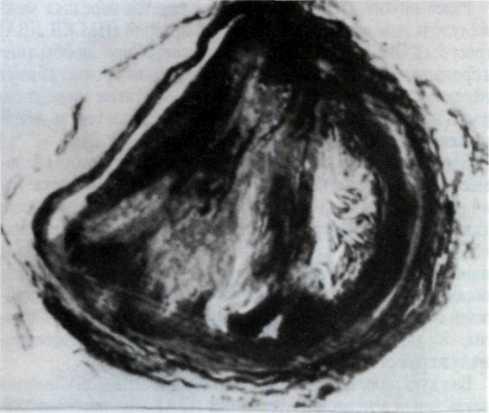
5.1. Поперечный срез венечной артерии больного, страдавшего ИБС.
Виден участок окклюзирующего атероматоза сосуда с организованным тромбом и очагами обызвествления.
Первичная остановка кровообращения
Стенокардия
2.1. Стенокардия напряжения
Впервые возникшая
Стабильная
Прогрессирующая
2.2. Стенокардия покоя (спонтанная стенокардия) 2.2.1. Особая форма стенокардии
3. Инфаркт миокарда 3.1.1. Определенный 3.2.1. Возможный
3.3. Перенесенный инфаркт миокарда
Сердечная недостаточность
Аритмия
Эта классификация достаточно полно включает в себя наиболее распространенные формы. Между тем в ней не нашел полного отражения такой синдром, как нестабильная стенокардия. Представляется также не совсем оправданным выделение в отдельную форму перенесенного инфаркта миокарда и сердечной недостаточности. Эти состояния могут быть у больных как со стенокардией, так и с инфарктом миокарда. Следовательно, они могут наблюдаться у больных, относящихся к каждой из указанных групп.
В 1984 г. в нашей стране предложена классификация ИБС, разработанная сотрудниками ВКНЦ АМН СССР на основе приведенных выше предложений Комитета экспертов ВОЗ. В нее входит шесть клинических форм.
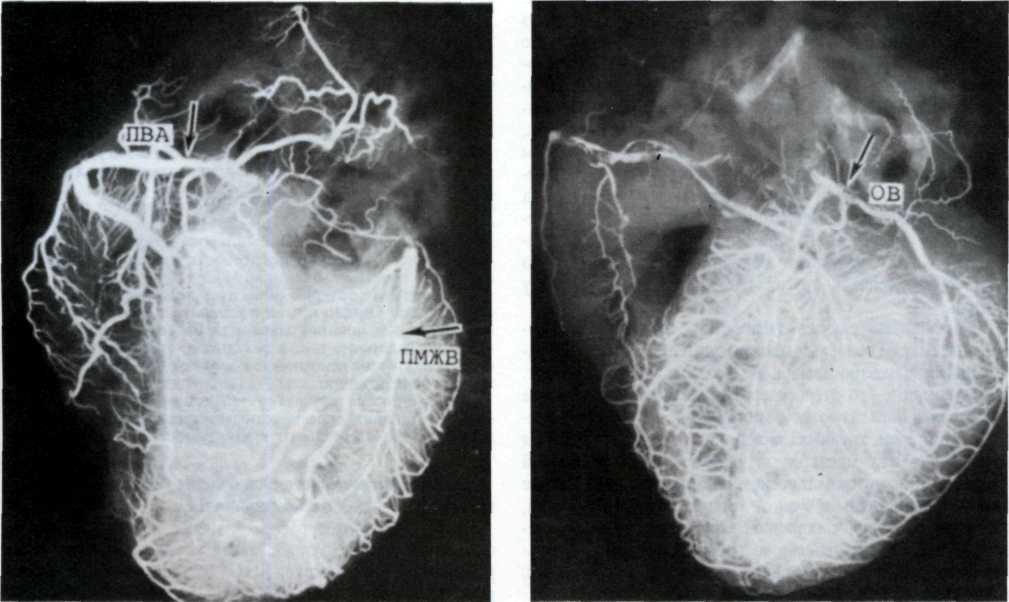
5.2. Посмертная ангиограмма сердца больного, страдавшего
ИБС.
Имеется тяжелый стенозирующип атеросклероз основных
ветвей венечного русла. Стрелками указаны участки стено-
зирующего поражения проксимальных отделов передней
межжелудочковой ветви левой венечной артерии (ПМЖВ)
и правой венечной артерии (ПВА).
5.3. Посмертная ангиограмма сердца больного, страдавшего ИБС. Виден тяжелый етенозирующий, окклюзирующий атеросклероз трех венечных сосудов сердца. Стрелкой указан участок окклюзирующего атеросклероза проксимального отдела огибающей ветви (ОВ) левой венечной артерии.
536
/. Внезапная коронарная смерть (первичная остановки сердца).
Первичная .остановка сердца — внезапное событие, предположительно связанное с электрической нестабильностью миокарда, если нет признаков, позволяющих поставить другой диагноз.
2. Стенокардия.
2.1. Стенокардия напряжения.
Стенокардия напряжения характеризуется преходящими приступами загрудинных болей, вызываемых физической или эмоциональной нагрузкой или другими факторами, ведущими к повышению метаболических потребностей миокарда (повышение артериального давления, тахикардия). Как правило, боль быстро исчезает в покое или при приеме нитроглицерина под язык.
2.1.1. Впервые возникшая стенокардия напряжения.
Продолжительность до 1 мес с момента появления. Полиморфна по течению и прогнозу: может регрессировать, перейти в стабильную стенокардию или принять прогрессирующее течение.
2.1.2. Стабильная стенокардия напряжения. Продолжительность более 1 мес. В диагнозе необходимо
указывать функциональный класс больного в зависимости от способности выполнять физические нагрузки.
Класс I. Больной хорошо переносит обычные физические нагрузки. Приступы стенокардии возникают только при нагрузках высокой интенсивности.
Класс II. Небольшое ограничение обычной физической активности. Приступы стенокардии возникают при ходьбе по ровному месту на расстояние более 500 м, при подъеме более чем на один этаж. Вероятность возникновения приступа стенокардии увеличивается при ходьбе в холодную погоду, против ветра, при психоэмоциональном возбуждении или в первые часы после пробуждения.
Класс III. Выраженное ограничение обычной физической активности. Приступы возникают при ходьбе в нормальном темпе по ровному месту на расстояние 100—500 м, при подъеме на один этаж.
Класс IV. Стенокардия возникает при небольших физических нагрузках, ходьбе по ровному месту на расстояние менее 100 м. Характерно возникновение приступов стенокардии в покое, обусловленных, так же как и приступы стенокардии напряжения, повышением метаболических потребностей миокарда (повышение артериального давления, тахикардия, увеличение венозного притока крови к сердцу при переходе больного в горизонтальное положение). Редкие приступы стенокардии в покое не являются обязательным критерием отнесения больного к IV функциональному классу.
2.1.3. Прогрессирующая стенокардия напряжения.
Внезапное увеличение частоты, тяжести и продолжительности приступов стенокардии в ответ на обычную для данного больного нагрузку.
2.2. Спонтанная (особая) стенокардия.
Приступы стенокардии возникают без особой связи с факторами, ведущими к повышению метаболических потребностей миокарда. Спонтанная стенокардия может существовать как синдром, проявляющийся только в покое, но чаще сочетается со стенокардией напряжения.
3. Инфаркт миокарда.
Диагноз инфаркта миокарда ставится на основании клинической картины, измененной ЭКГ и активности ферментов в сыворотке крови.
3.1. Крупноочаговый (трансмуральный) инфаркт мио карда.
Диагноз ставится при наличии патогномоничных изменений ЭКГ при активности ферментов в сыворотке крови даже при нетипичной клинической картине.
3.2. Мелкоочаговый инфаркт миокарда. Синонимы: «не- трансмуральный», «субэндокардиальный», «интрамураль- ный».
4. Постинфарктный кардиосклероз.
Диагноз ставится не ранее чем через 2 мес с момента возникновения инфаркта миокарда.
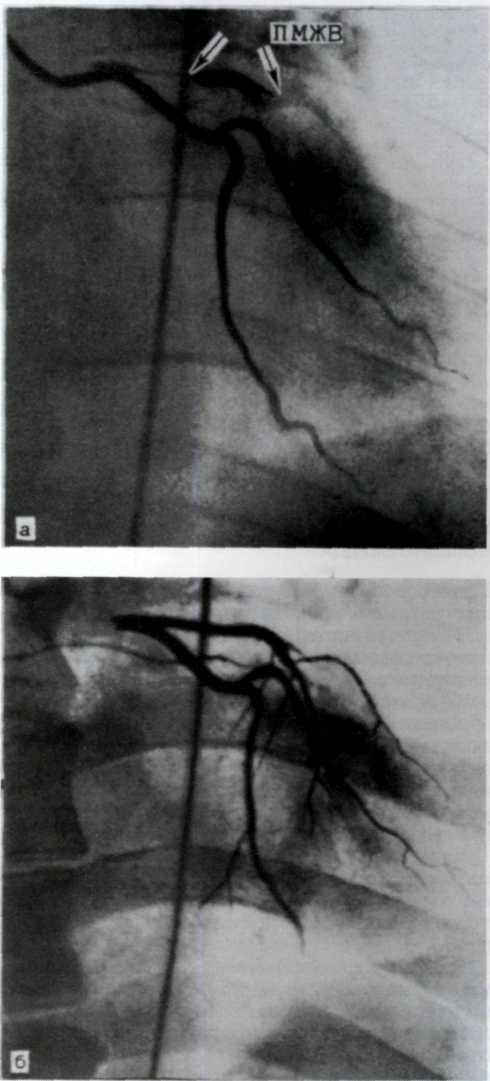
5.4. Прижизненная селективная ангиограмма левой венечной артерии сердца дольного с ИБС, вазоспастическая форма (а). Стрелкой указан окклюзирующий спазм проксимального участка передней межжелудочковой ветви (ПМЖВ). После внутрикоронарного введения нитроглицерина (б) отмечается контрастирование передней межжелудочковой ветви на всем протяжении. Сосуд без существенных стено-зирующих изменений просвета.
537
5. Нарушение сердечного ритма (с указанием формы). Обычно нарушения проводимости и сердечного ритма
осложняют другие формы ИБС, но иногда могут быть и единственным проявлением заболевания. В этих случаях диагноз ИБС требует уточнения при проведении функциональных проб с нагрузкой, селективной коронарографии.
6. Сердечная недостаточность (с указанием формы и стадии).
Сердечная недостаточность может осложнить любую форму ИБС. Если у больного с сердечной недостаточностью нет клинических или электрокардиографических признаков ИБС (в настоящее время или в анамнезе), диагноз ИБС остается сомнительным.
Мы считаем целесообразным наряду с перечисленными формами ИБС отдельно рассматривать синдром нестабильной стенокардии. Это особенно важно для кардиохирур-гических клиник, поскольку при нестабильной стенокардии нередко отмечается относительная рефрактерность к лекарственной терапии. Последняя требует использования других методов, в том числе ангиопластики венечных артерий, внутриаортальной контрпульсации, операции аортокоро-нарного шунтирования и т. д.
5.1. ХРОНИЧЕСКАЯ ИШЕМИЧЕСКАЯ БОЛЕЗНЬ СЕРДЦА
Клиника. Основным и частым симптомом ИБС является приступ грудной жабы, описанный Геберденом [Heberden, 1772]. Приступ характеризуется ощущением давления в области грудины, появляющегося при физическом усилии, нарастающего по выраженности и распространенности. Обычно боль сопровождается чувством дискомфорта в груди, иррадиирует в левое плечо, руку или обе руки, шею, челюсть, зубы. В этот момент больные обычно испытывают затрудненное дыхание, страх, перестают двигаться и застывают в неподвижной позе до прекращения приступа. У них может появляться бледность кожных покровов, а при сильном приступе выступает холодный пот на коже лба.
Важное диагностическое значение имеет такой признак, как быстрое исчезновение описанных ощущений после приема нитроглицерина или устранения физического напряжения и других условий и факторов, спровоцировавших приступ.
При прогрессировании заболевания может наступить момент, когда происходит срыв существующей относительной компенсации, и для возникновения приступа стенокардии становится достаточной минимальная нагрузка или же приступы могут возникать в условиях физического покоя. Стенокардия покоя, присоединившаяся к стенокардии напряжения, обычно сочетается с ней.
У части больных приступы стенокардии покоя могут возникать без предшествующих приступов стенокардии напряжения. Важно отметить, что у большинства больных приступы стенокардии покоя могут иметь место при сравнительно высокой толерантности к физическим нагрузкам. К этой группе следует отнести больных с так называемой вариантной стенокардией, или стенокардией типа Принцметала. Для этой формы стенокардии характерны приступы ангинозных болей, возникающих в покое, которые сопровождаются преходящими электрокардиографическими признаками повреждения субэпикардиальных отделов миокарда.
Имеются убедительные доказательства того, что в патогенезе стенокардии Принцметала важное, если не решающее, значение имеет периодически наступающий спазм венечных артерий сердца. Коронароспазм может возникать у больных как с неизмененными и малоизмененными венечными артериями, так и при распространенном стенозирующем ате-росклеротическом процессе в коронарных артериях.
Обнаружена достоверная корреляционная зависимость между частотой приступов стенокардии и количеством пораженных стенозирующим атеросклерозом венечных артерий. Такая же высокая корреляционная зависимость обнаружена между частотой приступов стенокардии и суммарной тяжестью поражения атеросклерозом венечных артерий.
Особо следует выделить больных со стенозирующим поражением ствола левой коронарной артерии. У них отмечаются крайне тяжелое клиническое течение заболевания и неблагоприятный прогноз.
Одним из наиболее грозных клинических проявлений ИБС является сердечная недостаточность, которая ведет к временной или стойкой утрате трудоспособности, инвалидности и смертности. Сердечная недостаточность настолько часто развивается при хронической ИБС, что ее проявления можно считать типичными для этого заболевания. Одной из причин развития недостаточности кровообращения у больных ИБС является изменение метаболизма миокарда вследствие недостаточной доставки кислорода к миокардиаль-ным клеткам. Второй важной причиной снижения функциональной способности сердца у больных ИБС является истощение резервов уменьшенного объема функционирующей сердечной мышцы в результате постинфарктного или атеросклеротического кардиосклероза либо их комбинаций. У больных, перенесших инфаркт миокарда, почти в каждом случае можно выявить недостаточность сократительной функции миокарда. В патогенезе сердечной недостаточности у больных ИБС важное значение имеет обширность постинфарктных рубцовых изменений миокарда. Снижение фракции выброса левого желудочка наблюдается при асинергии более чем 17% миокарда левого желудочка [Lea P. et al., 1972]. Стойкие нарушения внутрисердечной гемодинамики и сократительной способности миокарда наступают при Рубцовых изменениях, занимающих более 15% миокарда левого желудочка, а при поражении более 40% развивается необратимая рефрактерная сердечная недостаточность [Ideker R. et al., 1978].
Диагностика. В диагностике стенокардии важная роль принадлежит выяснению анамнеза заболевания. Во многих случаях диагноз можно установить только на основании жалоб больного. Однако у некоторых больных заболевание протекает со стертой, атипичной симптоматикой или бессимптомно. Следовательно, врачу необходимо найти как можно больше объективных признаков ИБС.
С этой целью используют ряд диагностических методов, среди которых важное место занимает электрокардиографическое исследование.
ЭКГ позволяет диагностировать заболевание, оценить его тяжесть, выявить локализацию и обширность недостаточности кровоснабжения миокарда и постинфарктного кардиосклероза, а также обнаружить нарушения ритма и проводимости сердца. Всем больным с подозрением на ИБС следует проводить электрокардиографическое исследование в 12 общепринятых отведениях. Выявление признаков ише-
538
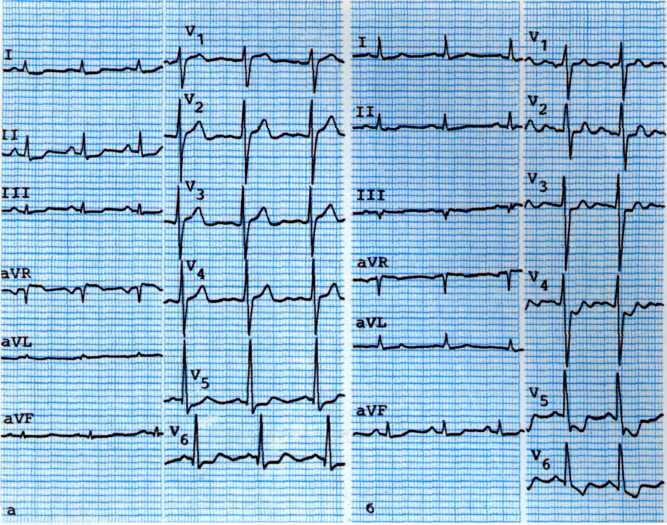
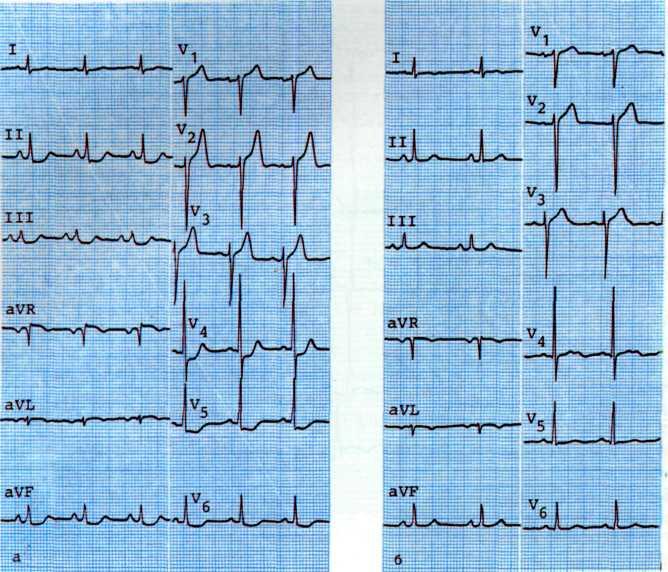
а—исходная ЭКГ больного с умеренными признаками гипоксии миокарда (смещение сегмента ST на 1 мм ниже изоэлектрической линии в I, II, III, К,, Vt отведениях: б—ЭКГ, зарегистрировавши во время приступа стенокардии. Отмечаются усугубление признаков гипоксии миокарда в тех же отведениях и появление признаков ишемии миокарда дополнительно в отведениях V3, V4.
мии миокарда или рубцовых изменений дает возможность считать диагноз ИБС достоверным.
Одним из ранних признаков хронической ИБС является изменение формы сегмента 57" с четко видимым крутым переходом его в зубец Т. При горизонтальном смещении сегмента ST от изозлектрической линии на 1 мм и более можно уверенно говорить об ИБС (рис. 5.5).
При хронической ИБС могут наблюдаться различные изменения зубца Т. Наиболее специфичен для этого заболевания отрицательный симметричный «коронарный» зубец Т заостренной формы, хотя могут регистрироваться также двухфазные зубцы Т.
Для уточнения диагноза и выявления компенсаторных возможностей коронарного кровообращения можно использовать нитроглицериновую пробу при электрокардиографии. Положительная динамика сегмента ST и зубца Т после применения нитроглицерина указывает на обратимость гипоксических изменений миокарда (рис. 5.6).
У 35% больных ИБС на ЭКГ, зарегистрированной в состоянии покоя, не выявляются признаки гипоксии миокарда. В этих случаях для уточнения диагноза и определения резервных возможностей коронарного кровообращения следует выполнять ряд дополнительных электрокардиографических исследований, среди которых наиболее важными являются пробы с физической нагрузкой и 24-часовое непрерывное мониторирование ЭКГ.
Проба с физической нагрузкой представляет собой один из основных методов диагностики и используется для выявления ишемических расстройств миокарда, нарушений ритма гипоксического происхождения, а также определения функционального резерва венечного кровоснабжения. Чувствительность нагрузочных проб колеблется от 48 до 84%. а специфичность—от 80 до 100%.
Наиболее широкое распространение получил метод ве-лоэргометриисо ступенеобразной непрерывно возраста-
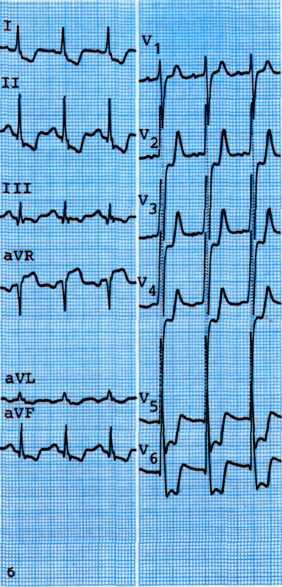
ющей нагрузкой. Электрокардиографический контроль в 12 общепринятых отведениях должен осуществляться до, в период и в течение 10 мин после прекращения нагрузки. Кли-нико-электрокардиографическими критериями прекращения нагрузки являются: 1) возникновение приступа стенокардии: 2) выраженная общая слабость: 3) значительные нарушения ритма и проводимости сердца; 4) характерные изменения сегмента ST на ЭКГ (смещение более чем на 1 мм от изоэлектрической линии); 5) достижение во время нагрузки числа сердечных сокращений, составляющих 85% от максимальной величины.
Пробу расценивают как положительную, если в момент нагрузки отмечают: 1) возникновение приступа стенокардии; 2) появление удушья; 3) смещение сегмента ST «ишемиче-ского» типа от изоэлектрической линии на 1 мм и более. Наиболее убедительным и приемлемым критерием оценки пробы с физической нагрузкой является «горизонтальное» смещение сегмента 5Тот изоэлектрической линии (рис. 5.7). Для определения толерантности к физической нагрузке используют показатели мощности и общего объема выполненной работы. При выполнении физической нагрузки мощностью от 150 до 450 кгм/мин (25—75 Вт) толерантность к нагрузке расценивается как низкая, при мощности 600— 750 кгм/мин (100—125 Вт) как средняя и при 750 кгм/мин и более (125 Вт) как высокая.
Сопоставление данных велоэргометрии и селективной ко-ронарографии показало, что имеется четкая зависимость между тяжестью поражения венечных артерий стенозиру-юще-окклюзирующим атеросклерозом и снижением толерантности к физической нагрузке, а также достоверная обратная зависимость между мощностью выполненной работы при физической нагрузке и суммарной тяжестью поражения коронарного русла стенозирующим атеросклерозом.
Таким образом, проба с физической нагрузкой позволяет в большинстве случаев выявить признаки скрытой коронар-
539
540
ной недостаточности, оценить компенсаторные возможности венечного кровообращения и, что очень важно для кардиохирургической клиники, определить тяжесть поражения коронарных артерий.
Если в основе коронарной недостаточности лежит функциональное нарушение васкуляризации миокарда—спазм венечных артерий, то проба с физической нагрузкой не может способствовать уточнению диагноза. В этих случаях более действенным диагностическим тестом является эрго-метриновая (эргоновиновая) проба.
Эргометрина малеат (эргоновин) вводят внутривенно струйно начиная с 0,05 мг, увеличивая дозу до 0,15 и 0,3 мг. Между введением очередной дозы нужно выдерживать интервал в 5 мин. Суммарная доза эргометрина не должна превышать 0,5 мг. Пробу с эргометрином проводят под электрокардиографическим контролем, который продолжают еще 15 мин после введения последней дозы.
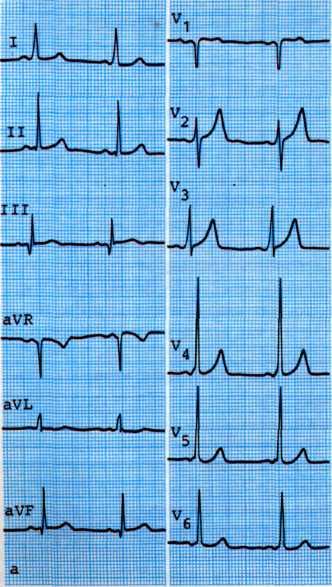
Критериями положительной пробы являются смещение сегмента 5Тот изоэлектрической линии и появление приступа стенокардии. В случаях положительной эргоновиновой пробы ее следует повторить при ангиографическом исследовании для документации факта спазма венечных артерий и определения его локализации. При коронарографии введение препарата начинают с той дозы, при которой была в первый раз получена положительная реакция (рис. 5.8).
Незаменимую помощь в постановке диагноза ИБС, а также в оценке характера стенокардии и нарушений ритма и проводимости может оказать метод непрерывного суточ-вого мониторирования ЭКГ с помощью специальных аналоговых магнитофонов (холтеровское мониторирование). Он позволяет зафиксировать транзиторные нарушения ритма и проводимости, как и преходящие нарушения реполяри-зации миокарда, связанные с ишемией миокарда, и сопоставить во времени выявленное отклонение с суточной активностью обследуемого и его ощущениями. Метод обладает 91% чувствительностью и 78% специфичностью в диагностике гипоксии миокарда.
Рентгенологическое обследование больного ИБС включает рентгеноскопию органов грудной клетки и рентгеноэлект-рокимографию сердца. Эти методы могут дать представление о наличии осложнений ИБС (аневризма сердца, постинфарктные ДМЖП) и сопутствующих заболеваний органов грудной клетки.
Важное место в диагностике ИБС заняли методы, позволяющие изучать функционально-морфологическое состояние миокарда левого желудочка. Особенно важна дифферен-: циальная диагностика между обратимым (гипоксическим) : и необратимым (некротическим, рубцовым) повреждением ; миокарда. В этом отношении представляются ценными ра-i дионуклидные методы исследования.
Сцинтиграфия миокарда с 201Т1, выполненная в состоянии ! покоя, нередко не выявляет каких-либо отклонений от нор-| мы у больных со стенозирующим атеросклерозом венечных сосудов, поскольку имеется относительная компенсация васкуляризации миокарда благодаря коллатеральному кровообращению. В этих случаях большую помощь в постановке [правильного диагноза оказывает сцинтиграфия миокарда, [илюлненная в период пробы с физической нагрузкой. В ре-[зультате несоответствия между потребностью миокарда [в кислороде и его поступлением в миокард возникает ло-[ шьная зона преходящей ишемии, проявляющаяся на сцин-
тиграммах как новый «холодный» очаг или как расширение имевшейся ранее зоны нарушения перфузии.
Важное место в изучении функциональной способности левого желудочка занимает радионуклидная вентрикулогра-фия. Несомненным достоинством метода являются его высокая информативность, безопасность, атравматичность и возможность проведения повторных исследований с применением дозированной физической нагрузки или медикаментозных тестов.
Радионуклидные методы исследования позволяют изучить ударный и минутный объем сердца, объем циркулирующей крови, время кровотока в малом круге кровообращения и объем циркулирующей крови в легких.
Эхокардиография сердца позволяет неинвазивным методом исследовать структуры сердца и функцию миокарда. Метод эхокардиографии используют для изучения функциональной способности левого желудочка и внутрисердечной гемодинамики, а также для диагностики таких осложнений ИБС, как постинфарктный ДМЖП или недостаточность митрального клапана в результате постинфарктной дисфункции сосочковой мышцы, постинфарктная аневризма левого желудочка и другие нарушения структурной целостности сердца.
Эхокардиография позволяет также проводить дифференциальную диагностику с заболеваниями, которые по клинике и электрокардиографическим данным сходны с ИБС. К таким заболеваниям относятся гипертрофическая кардио-миопатия и пролапс митрального клапана.
При изучении левого желудочка эхокардиография позволяет получить информацию о внутренних размерах полости, толщине передней и задней стенок левого желудочка, кинетике задней стенки, движении межжелудочковой перегородки, конечно-систолическом и конечно-диастоличе-ском объеме левого желудочка, фракции выброса, ударном объеме.
При изучении методом эхокардиографии функциональной способности левого желудочка и кинетики стенок можно использовать фармакологические пробы. Например, при оценке локальных нарушений сократимости миокарда используют фармакологический тест с нитроглицерином. Исчезновение зоны гипоксии после приема нитроглицерина, проявляющееся в увеличении амплитуды систолического движения миокарда, указывает на ишемический характер изменений. Скорость утолщения стенки миокарда не изменяется в непораженных областях и в участках дискинезии, обусловленных Рубцовыми изменениями миокарда [Feigenbaum H., 1981]. После хирургической реваскуляриза-ции улучшение сократительной способности миокарда, как правило, наблюдают лишь в тех участках, в которых до операции при эхокардиографическом исследовании была получена положительная реакция на нитроглицерин [Schamroth L, 1975].
Особенно ценным в диагностике локальных нарушений кинетики стенок левого желудочка является секторальное сканирование (двухмерная эхокардиография), позволяющее выявлять сегментарные нарушения сократимости миокарда (рис. 5.9).
Катетеризация левых отделов сердца позволяет измерить конечно-диастолическое давление в левом желудочке, которое имеет важное значение для оценки его функциональной способности, особенно если это исследование сочетать с из-
547
мерением сердечного выброса. В результате этих исследований можно построить кривую функции левого желудочка.
Левая вентрику.юграфия является составной частью оценки состояния больного ИБС при катетеризации сердца, она позволяет изучить движение стенок и их кинетику, а также рассчитать объемы и толщину стенок левого желудочка. С целью проведения дифференциальной диагностики между нарушением функции левого желудочка, в основе которого лежат обратимые (гипоксия) и необратимые (рубцовые) изменения миокарда, можно выполнить левую вентрикулогра-фию до и после приема нитроглицерина.
Если фракция выброса не изменяется после приема нитроглицерина, можно с высокой вероятностью считать, что в основе нарушения функции левого желудочка лежат рубцовые (необратимые) изменения миокарда. Имеется достоверная обратная корреляционная зависимость между фракцией выброса левого желудочка и размером постинфарктных рубцовых изменений миокарда.
Для выявления более ранних и менее выраженных изменений функциональной способности левого желудочка целесообразно изучить сегментарную фракцию выброса, т. е. условное разделение левого желудочка на определенные сегменты и фракции выброса отдельно в каждом из этих сегментов [Ideker R. et al., 1978]. Снижение фракции выброса в отдельных сегментах не всегда приводит к изменению общей фракции выброса, следовательно, метод изучения
сегментарной функции левого желудочка является более чувствительным и может выявить нарушения сократительной способности миокарда на более ранних стадиях заболевания.
Селективная коронарография, разработанная и внедренная в клиническую практику F. Sones в 1959 г., предназначена для объективной визуализации коронарных артерий и основных ветвей, изучения их анатомического и функционального состояния, степени и характера поражения атеро-склеротическим процессом, компенсаторного коллатерального кровообращения, дистального русла венечных артерий и т. д. Селективная коронарография в 90—95% случаев объективно и точно отражает анатомическое состояние венечного русла.
При оценке ангиограмм венечных сосудов можно использовать классификацию атеросклеротических поражений коронарных артерий [Петросян Ю. С, Зингерман Л. С, 1974], которая включает анатомический тип кровоснабжения сердца, локализацию, распространенность, степень поражения и коллатеральное кровообращение.
КЛАССИФИКАЦИЯ АТЕРОСКЛЕРОТИЧЕСКИХ ПОРАЖЕНИЙ ВЕНЕЧНЫХ (КОРОНАРНЫХ) АРТЕРИЙ
А. Анатомический тип кровоснабжения сердца: а) левый;
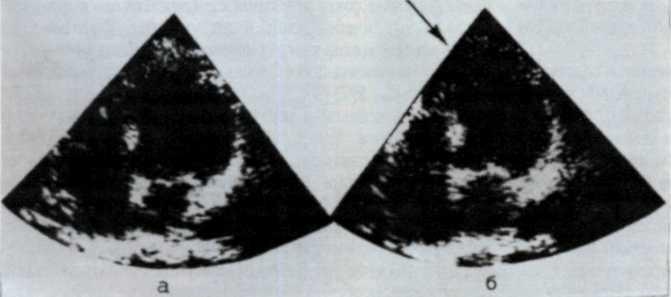
а — диастола; б — систола (стрелкой указано парадоксальное выпячивание контура левого желудочка в верхушеч-но-перегородочной области, что подтверждает наличие аневризмы левого .желудочка в этой области).
542
б) правый;
в) сбалансированный.
Б. Локализация поражения:
ЛКА—ствол левой коронарной артерии.
ПМЖВ — передняя межжелудочковая ветвь.
ОВ — огибающая ветвь.
ДВ — диагональная ветвь.
ПКА — правая коронарная артерия.
KB — краевая ветвь правой коронарной артерии. В. Распространенность поражения:
Л—локализованное;
Д—диффузное;
п/з—в проксимальной трети артерии;
с/з — в средней трети артерии;
д/з — в дистальной трети артерии. Г. Степень сужения просвета артерии:
О—без сужения просвета;
I — умеренное (до 50%);
II—выраженное (до 75%);
III —резкое (более 75%);
IV—окклюзия. Д. Коллатеральный кровоток:
Анастомозы между ПМЖВ и ПКА в области верхушки сердца.
Анастомозы между ПМЖВ и ОВ ЛКА.
Анастомозы между ОВ и ПКА.
Анастомозы круга Вьессена.
Прочие анастомозы.
Для суммарной оценки тяжести поражения венечного русла удобен метод, предложенный Ю. С. Петросяном и Д. Г. Иоселиани (1976), учитывающий сумму стенозиру-ющих поражений всех основных венечных артерий на разных уровнях при разных типах венечного кровообращения. Показания к коронарографнн и левой вентрикулографни. Коронарографию следует выполнять больным: 1) при относительной рефрактерное™ к консервативной терапии с целью оценки тяжести и характера нарушения коронарного кровообращения и выбора дальнейшей тактики и метода лечения; 2) для уточнения диагноза в тех случаях, когда другие методы исследования не могут полностью подтвердить или исключить диагноз ИБС; 3) с целью проведения дифференциального диагноза между ИБС и другими заболеваниями сердца.
Противопоказания к выполнению селективной коронаро-графии и левой вентрикулографии: 1) тяжелые органические поражения паренхиматозных органов; 2) не поддающаяся лечению эритремия.
Противопоказания к коронарографии, по-видимому, будут сужаться по мере расширения показаний к использованию этого метода.
Общие принципы лечения больных хронической ИБС. Паго-I физиологической основой стенокардии является гипоксия [ миокарда, возникающая в результате несоответствия между I потребностями миокарда в кислороде и его доставкой, сле-I довательно, эффект лечения во многом будет зависеть от ' того, насколько удастся изменить нарушенный баланс \ в благоприятную сторону. Учитывая также, что основными | клиническими проявлениями хронической ИБС являются > стенокардия, сердечная недостаточность и выраженные на-| рушения ритма, нередко приводящие к фибрилляции желудочков и «внезапной» смерти, основные лечебные меропри-! ятия должны быть направлены на ликвидацию или облегчение перечисленных клинических проявлений.
Лекарственная коррекция нарушенного баланса между по-[ требностью в кислороде и доставкой его к сердечной мышце | может осуществляться двумя основными путями: 1) улучше-
нием перфузии ишемизированного миокарда с помощью усиления кровотока в коронарных артериях; 2) уменьшением потребности ишемизированного миокарда в кислороде.
С целью улучшения коронарного кровотока за счет сосудорасширяющего эффекта наиболее эффективным является использование нитроглицерина и других органических и неорганических нитросоединений. Важнейшими звеньями действия препарата являются снижение потребности миокарда в кислороде за счет уменьшения напряжения миокарда и повышение доставки кислорода к ишемизированной зоне благодаря перераспределению коронарного кровотока и устранению спазма венечных артерий. Несмотря на сложность и недостаточную изученность фармакологического действия нитроглицерина, абсолютно ясно, что у большинства больных этот препарат в дозе 0,3—0,6 мг под язык купирует приступ стенокардии по меньшей мере на 30 мин. Для достижения более стойкого и длительного эффекта в настоящее время используют пролонгированные нитросоедине-ния, которые делятся в основном на две группы: 1) нитриты неорганические: амилнитрит, натрия нитрат и др.; 2) нитраты органические: препараты депо нитроглицерина (сустак, нитронг, тринитролонг), производные нитроглицерина (эри-нит, нитропентон, нитросорбид).
Оптимальные дозы препаратов, подобранные под контролем артериального давления и частоты сердечных сокращений, могут быть эффективными в течение 6—8 ч.
Наряду с нитросоединениями широко используются для лечения стенокардии препараты, блокирующие Р-адренер-гические рецепторы. Они оказались эффективными для улучшения сердечной функции при ИБС благодаря уменьшению потребности миокарда в кислороде за счет снижения кон-трактильности миокарда, частоты сердечных сокращений и системного артериального давления.
Наибольшее распространение в клинической практике среди препаратов, блокирующих Р-адренергические рецепторы, получил анаприлин (пропранолол, обзидан, индерал). В настоящее время считается доказанным, что предохраняющее действие анаприлина на миокард достигается не только за счет снижения потребности сердечной мышцы в кислороде, но и благодаря повышению доставки кислорода и энергии к ней [Frischman W. et al., 1975]. Эффект и продолжительность действия анаприлина во многом зависят от его дозы. Начальная доза анаприлина должна быть небольшой—до 40 мг/сут. В дальнейшем при необходимости суточную дозу повышают до 80—100 мг/сут (максимальная—до 240 мг/ сут, крайне редко—300 мг/сут). Если высокие дозы препарата не дают желаемого эффекта, то дальнейшее использование его нецелесообразно и нужно искать другие пути лечения. Длительное применение анаприлина может привести к увеличению размеров сердца, что предрасполагает к хронической сердечной недостаточности. Анаприлин следует с осторожностью назначать больным с брадикардией, со сниженной сократительной функцией миокарда.
В последние годы все более широкое применение в лечении ИБС приобретают антагонисты кальция [Rosen M., Hoffman В., 1984]. Механизм их действия заключается в задержке или значительном замедлении обратного возврата некоторых положительно заряженных ионов в гладкомы-шечные клетки сердца и сосудов, в результате чего снижается контрактильность миокарда, замедляется преобразование импульса в синусно-предсердном узле, его проведение и уве-
543
личивается эффективный рефрактерный период клеток пред-сердно-желудочкового узла. За счет урежения частоты сердечных сокращений и снижения контрактильности миокарда антагонисты кальция уменьшают потребность миокарда в кислороде, а периферическая вазодилатация снижает постнагрузку на сердце и улучшает доставку кислорода к миокарду.
Антагонисты кальция являются высокоэффективными препаратами при лечении стенокардии, в основе которой преобладает спазм венечных артерий. Нифедипин (корин-фар) в дозе 40—120 мг/сут эффективен примерно у 90% больных со спастической формой стенокардии. Верапамил(изоптин, феноптин) назначают в дозе 120—300 мг/сут. Эти препараты эффективны также и при классической форме стенокардии.
Прогноз при консервативном лечении. Как видно из табл. 5.1, ежегодная летальность колеблется от 3 до 8,8%. Такое существенное различие можно объяснить тем, что в этих исследованиях были изучены разные по своей тяжести больные. Различной была, по всей вероятности, и лекарственная терапия, так как с годами меняется ассортиментиспользуемых препаратов. Хорошо известно, что прогноз у больных ИБС в значительной степени зависит от состояния коронарных артерий и миокарда, а также от многих других факторов.
Таблица 5.1. Ежегодная летальность больных хронической ИБС при консервативной лекарственной терапии
|
Автор |
Год |
Ежегодная |
|
исследования |
исследо- |
леталь- |
|
|
вания |
ность, % |
|
W. Zukel |
1959 |
3 |
|
W. Kannel |
1972 |
4 |
|
G. Burggraf |
1975 |
6 |
|
R. Seldon |
1975 |
8,8 |
|
В. С. Гасилин |
1983 |
3,8 |
Ангиопластика венечных артерий. В последние 10—15 лет в лечении ИБС используют реваскуляризацию миокарда путем транслюминальной баллонной дилатации (ангиопластики) стенозированных венечных артерий. В кардиологическую практику метод был внедрен в 1977 г. A. Gruntzig.
Показанием к ангиопластике венечных артерий у больных ИБС служит гемодинамически значимое поражение коронарной артерии в ее проксимальных отделах при условииотсутствия выраженного кальциноза и поражения дисталь-ного русла этой артерии.
За сутки до процедуры с целью профилактики острого тромбоза назначают ацетилсалициловую кислоту в суточной дозе 1—1,5 г или этот препарат в комбинации с дипи-ридамолом. Эту терапию продолжают и после процедуры в течение 3 дней. Непосредственно перед началом процедуры большинство авторов рекомендуют внутривенное или внутриартериальное введение 5000—10000 ЕД гепарина,внутривенное или внутрикоронарное введение 0,12—0,5 мг нитроглицерина, прием 20 мг фенигидина (нифедипина) под язык. Хотя нет единого мнения относительно тактики лекарственной терапии в отдаленные сроки после проведения процедуры, большинство исследователей считают, что при-
менение антикоагулянтов непрямого действия или же ацетилсалициловой кислоты снижает риск рестеноза и окклюзии дилатированного сосуда.
Необходимым условием выполнения ангиопластики венечных артерий является наличие готовой операционной и хирургической бригады для выполнения экстренной операции аортокоронарного шунтирования в случае появления осложнений при выполнении процедуры. Такими осложнениями могут быть: острая окклюзия венечной артерии, расслоение внутренней оболочки коронарной артерии без полной окклюзии, острая ишемия миокарда в случае отсутствия эффекта от ангиопластики и т. д.
Метод ангиопластики. Для выполнения ангиопластики венечных артерий используют систему двух катетеров: катетер-проводник (наружный диаметр 8—9F) и дилатаци-онный катетер (диаметр 4F). После, выполнения коронаро-графии обычным методом ангиографический катетер заменяют катетером-проводником, через который проводят ди-латационный катетер в стенозированную венечную артерию. Максимальный диаметр баллончика 3—3,7 мм при его наполнении, в спавшемся состоянии его диаметр составляет 1,2—1,3 мм. Катетер проводят в стенозированную артерию. Дистальнее области стеноза антеградное давление в артерии падает и тем самым фиксируется перфузионное давление дистальнее стеноза (за счет коллатерального кровотока). При достижении баллончиком стенозированного сегмента последний под давлением 5—16 атм заполняют 30% раствором контрастного вещества. В таком состоянии баллончик находится в течение 90—120 с, после чего его опорожняют и вновь измеряют перфузионное давление ниже стеноза. При необходимости баллончик можно наполнить несколько раз. Уменьшение градиента давления служит основным ориентиром для прекращения процедуры. Повторный ангиографический контроль позволяет определить степень остаточного стеноза (рис. 5.10). Основным критерием успеха считается уменьшение степени стеноза после ангиопластики более чем на 20%.
По сводным данным национального института сердца, легких и крови (США), суммарный положительный результат баллонной дилатации коронарных артерий достигается примерно у 65% больных. Вероятность успеха при этой процедуре возрастает у больных молодого возраста с непродолжительным анамнезом стенокардии и при проксимальных поражениях артерий.
Основными осложнениями ангиопластики венечных артерий являются острый инфаркт миокарда (5,3%), окклюзиякоронарной артерии (4,6%), спазм коронарной артерии (4,5%), фибрилляция желудочков (1,8%). Госпитальная летальность составляет 1,2%.
Клинический эффект ангиопластики венечных артерий заключается в исчезновении или значительном урежении приступов стенокардии примерно у 80% больных с успешным результатом процедуры, в повышении толерантности к физическим нагрузкам более чем у 90%, улучшении сократительной способности миокарда и его перфузии. Все это прослеживается и в отдаленные сроки наблюдения, причемэффективность процедуры через 3 года составляет 67% [Ischinger T. et al., 1982].
Эндоваскулярное протезирование венечной артерии сердца. В настоящее время во многих клиниках мира широко и успешно используют транслюминальную баллонную ангиопластику венечных артерий (ТБАВА) сердца для леченияразных форм ИБС. Эта процедура позволяет примерно в 85—90% случаев дилатировать сосуд и восстановить егоадекватный просвет при низкой частоте тяжелых осложне-
544
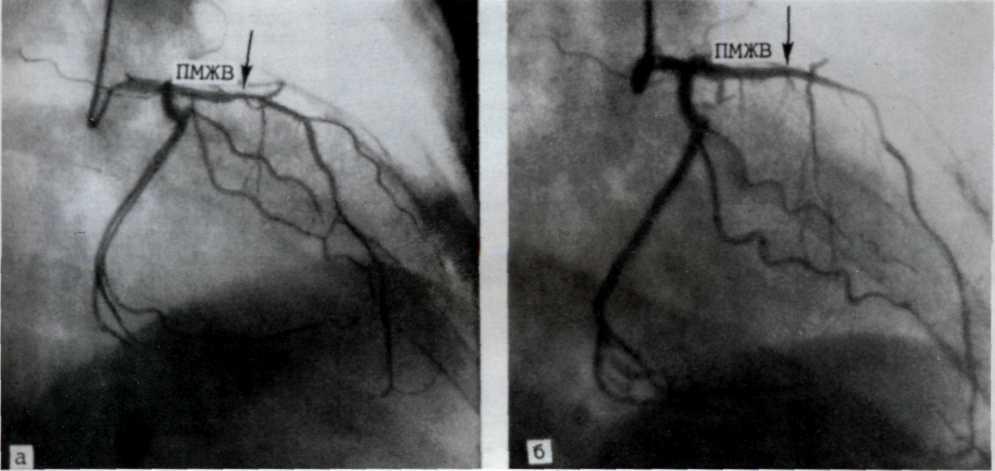
а—ангиограмма левой венечной артерии больного с ИБС [стрелкой указан участок выраженного стенотичеекого по-ражения в проксимальной трети передней межжелудочковой ветви IПМЖВ) левой венечной артерии]: 6—после проведения ангиопластики восстановлен нормальный просвет ПМЖВ (стрелкой указан участок бывшего стеноза ПМЖВ).
ний. Однако, несмотря на хорошие непосредственные результаты ТБВА. основным недостатком этого метода лечения является высокая частота рестенозов дилатированных сосудов, которая, по данным разных авторов, колеблется от 25 до 40% [Gruentzig et al., 1987; Nobuoshi et al., 1988]. Особенно высока частота рестенозов и реокклюзий у больных сахарным диабетом, продолжающих курение после процедуры. ОИМ, с поражением передней межжелудочковой ветви левой венечной артерии (ПМЖВ ЛВА) [Serruys et al., 1988].
Изложенное выше послужило основанием для поиска более эффективных и усовершенствованных методов дилата-ции венечных сосудов. Одним из таких методов является чрескожное катетерное эндопротезирование венечных артерий, которое в последние несколько лет начали применять в клинической практике некоторых кардиологических центров мира. Впервые ригидный металлический эндоваскуляр-ный протез для восстановления адекватного кровотока в сосуде в клинической практике использовал R. Schatz (США) в 1987 г. С того времени многое в эндопротезировании сосудов изменилось. Это касается как техники процедуры, так и конструкции протеза и аксессуаров, необходимых для успешного проведения протеза в венечный сосуд.
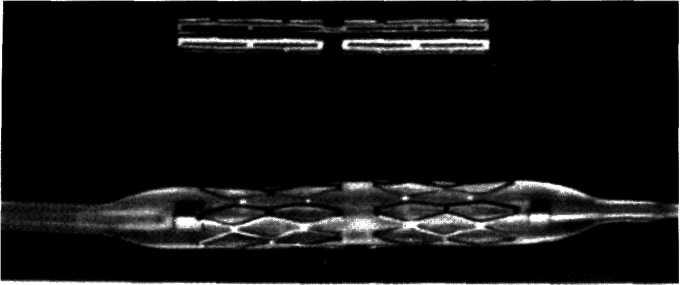
Конструкция протеза выглядит следующим образом (рис. 5.11): эндоваскулярный протез типа Palmaz—Schatz представляет собой ригидную трубку из нержавеющей стали типа 316 L (тантал) длиной 15 мм, которая в середине состоит из гибкого материала, что придает протезу определенную возможность модулирования при проведении его до
места назначения. Конструкция протеза основана на том, что металл, используемый для создания протеза, после его растяжения сверх определенного предела не меняет приобретенной при растяжении формы. Исходный диаметр протеза не превышает 1.6 мм, однако при растяжении, например баллоном, он может достигать 5—6 мм. Стенка протеза, толщина которой 0,08 мм, сетчатой конструкции и состоит из зигзагообразно соединенных металлических прямоугольников. При растяжении протеза в результате раздувания баллона прямоугольники приобретают ромбовидную форму, что позволяет протезу достичь своего максимального диаметра (5—6 мм). Проведение и установление протеза в стенозированном сосуде осуществляют с помощью дилатационного баллонного катетера с внутренним диаметром 0,079 дюйма или более, при этом протез как бы обволакивает баллон.
Техника протезирования венечных артерий. Успешное подведение протеза к пораженной венечной артерии во многом зависит от правильного выбора типа катетера-гида. Этому может способствовать использование множественных проекций для получения изображения сосуда. Только таким образом можно убедиться в том, как установлен кончик катетера в устье венечной артерии. Для того чтобы выбрать протез необходимого размера, следует измерять диаметр сосуда непосредственно до и после стенози-рующего повреждения (для расчета размера можно брать за основу диаметр катетера). Желательно использовать протез, диаметр которого немного больше диаметра сосуда.
После выбора адекватного протеза в стенозированный сосуд вводят проводник диаметром 0,014 дюйма. Желательно использовать длинный проводник (до 3 м), чтобы через него можно было менять баллонные катетеры. На этом же этапе следует решить вопрос о том, удастся ли провести через стенозированный сосуд комплекс протез+баллонный катетер (ПБ) или же перед этим необходимо произвести предилатацию путем обычной ТБАВА. При решении вопроса о предварительном выполнении ТБАВА следует использовать баллонный катетер диаметром не более 2,5 мм,
545
чтобы при ангиопластике не вызвать перерастяжения стенки сосуда и ее диссекции, т. е. не стоит стремиться к полному восстановлению диаметра просвета сосуда. Лучше достичь, если можно так выразиться, «субдилатации» артерии. Затем баллонный катетер удаляют и в сосуде остается только проводник, по которому в него вводят комплекс ПБ. После проведения ПБ через кончик катетера-гида и вхождения его в устье стенозированного сосуда желательно периодически контрастировать сосуд для определения места установления протеза. ПБ продвигают по сосуду до момента установле-. ния меток ПБ в месте максимального сужения. Затем нужно вновь контрастировать сосуд, чтобы убедиться в правильном выборе места установления протеза. После этого осторожно удаляют футляр, в который был помещен комплекс ПБ. Следует отметить, что футляр также имеет метки, поэтому легко будет убедиться в том, что удаляется только футляр, тогда как протез остается на месте.
После удаления футляра необходимо еще раз контрастировать сосуд, чтобы убедиться в том, что протез находится в нужном месте. Только после этого осуществляют однократное раздувание баллона (5—6 атм), причем следует полно и равномерно раскрыть протез. Раздувание проводят в течение 10—15 с, после чего давление прекращают и баллон извлекают. При этом проводник остается в сосуде и соответственно в протезе. Затем выполняют контрольную ангиографию. Ангиографическая картина, отражающая оптимальное расположение протеза в сосуде, такова: проксимальный конец протеза должен быть немного шире, чем пограничный участок венечной артерии, в середине протеза—перемычка, а дистальный участок протеза несколько уже, чем пограничный участок венечной артерии. Такая форма протеза во многом способствует уменьшению вероятности тромботических и других окклюзирующих осложнений в протезе.
Результаты эндопротезирования венечных артерий. Следует отметить, что количество операций по протезированию венечных артерий во всем мире пока невелико. По обзорным данным R. Schatz (1993), из 263 больных хорошие непосредственные результаты эндопротезирования венечных артерий получены у 94%. Baim (1990) приводит еще более высокий процент успешного выполнения операций (98%). Авторы отмечают, что вероятность успешного проведения вмешательства возросла после того, как начали использовать футляр, покрывающий протез. Острый тромбоз или острую окклюзию протеза в первые 24 ч, по данным R. Schatz (1993), не наблюдали ни у одного больного. Под-
острый тромбоз протеза (возникший через 24 ч—2 нед) выявлен у 2,8% оперированных. ОИМ развился у 1,2% больных. Смертельных исходов не наблюдали.
По данным М. Levine и соавт. (1990), у 94% из 37 больных протезирование правой венечной артерии выполнено успешно. У 2 больных не удалось провести протез через стенози-рованный сосуд, причем у одного при эвакуации протеза произошла его эмболизация в сосуды таза, однако без клинических последствий. В этой серии наблюдений не было ни одного случая ОИМ или смерти, лишь у 1 больного произошла подострая окклюзия протеза вследствие прекращения антикоагулянтной терапии. Реканализация была достигнута с помощью тромболитической терапии и повторной дилата-ции. У 6 больных возникли сосудистые осложнения: у 4 развилась ложная аневризма бедренной артерии, в связи с чем потребовалось произвести операцию под местной анестезией; у 2 больных образовалась гематома: у одного ретро-перитонеальная, у другого—паховая.
J. Fajadet и соавт. (1990) сообщают, что протезирование венечной артерии было успешным у 149 (93%) из 160 больных, находившихся в клинике им. Пастера (Тулуза, Франция). Тяжелые осложнения возникли у 3,8%. Острая окклюзия протеза наблюдалась у 5 (3,4%) пациентов, у 4 больных удалось реканализировать сосуд. Один пациент умер на 5-й день после протезирования ПМЖВ ЛВА; еще 1 больному была выполнена ургентная операция прямой реваскуляриза-ции миокарда в связи с диссекцией ПКА.
В отдаленные сроки у больных после протезирования венечных артерий рестенозы наблюдаются значительно реже, чем у больных, которым была произведена ТБАВА. Если рестеноз возникает, то с ним можно бороться с помощью тех же методов, что и при рестенозах после ТБАВА. Однако следует отметить, что небольшое количество и непродолжительность наблюдений не позволяют сделать какие-либо выводы по этому поводу. Следовательно, для получения окончательного ответа на вопрос о месте эндопротезирования венечных артерий в лечении ИБС необходимы дальнейшее накопление опыта и изучение отдаленных результатов.
Что касается тактики ведения больных после протезирования венечных артерий, то следует отметить два наиболее важных условия, которые необходимо соблюдать во избежание тяжелых осложнений. Во-первых, максимальная стерильность в период выполнения процедуры и в ближайшее время после ее завершения. Это крайне важно, так как в организм имплантируют инородное тело, в связи с чем при
546
несоблюдении асептики велика вероятность инфицирования. Во избежание септических осложнений, возможно, в течение 1-й недели после процедуры следует проводить антибиоти-котерапию. Во-вторых, применение прямых и непрямых антикоагулянтов для профилактики тромбозов и окклюзии протеза. С этой целью необходимо по возможности длительно (во всяком случае не менее 1 нед) использовать прямые антикоагулянты (гепарин). В этот период время кровотечения следует поддерживать на уровне 10—15 мин. В дальнейшем, по меньшей мере в течение 3—6 мес, необходимо активно применять непрямые антикоагулянты (фе-нилин). Протромбиновый индекс желательно поддерживать не выше 45—50%. Спустя 6 мес следует провести повторное обследование больного с выполнением коронарографии. В случае появления у больного симптомов коронарной недостаточности или признаков острой окклюзии протезированного сосуда ему необходимо срочно выполнить корона-рографию и при наличии показаний провести тромболити-ческую терапию и/или дилатацию протеза. В остальном тактика ведения больных после эндоваскулярного протезирования венечных артерий не отличается от таковой при ТБАВА.
Эндоваскулярная эндартерэктомня из венечных артерий. Широкое внедрение в клиническую практику эндоваскуляр-ных методов лечения ИБС, в первую очередь ТБАВА, с одной стороны, и в то же время определенные ограничения в применении этого метода, с другой, стимулировали поиск альтернативных методов чрескожного эндоваскулярного восстановления нарушенного венечного кровообращения. Эти методы могли бы служить для реваскуляризации миокарда в тех случаях, когда выполнение обычной процедуры ТБАВА невозможно, либо для лечения осложнений, возникающих при ТБАВА (острая окклюзия или сложная дис-секция венечного сосуда, рестеноз и т. д.).
Один из таких методов был разработан Simpson и соавт. (1986). Его принцип заключается в частичном или полном удалении атеросклеротической бляшки из сосуда. Они же
предложили термин «атерэктомия» для обозначения этого процесса. По мнению Simpson, с помощью этой процедуры можно достичь восстановления более широкого просвета сосуда с гладкими краями стенок. Он же разработал первый катетер для атерэктомии, который состоит из самого катетера и наконечника («головки») на дистальном конце. В «головке» помещено режущее устройство, которое при ее подведении к атеросклеротической бляшке иссекает бляшку с помощью режущего устройства, установленного в боковом отверстии «головки». Для придания «головке» правильного положения по отношению к бляшке на конце баллона находится ручка катетера. Именно благодаря такой способности придавать дистальному концу баллона нужное направление эта процедура получила название «направленная атерэктомия». Первая направленная атерэктомия у человека была выполнена в 1985 г. из поверхностной бедренной артерии во время операции, а в последующем был с успехом использован чрескожный доступ к сосуду [Simpson et al., 1986]. Первая успешная направленная атерэктомия из венечной артерии была выполнена в 1987 г. в США в госпитале Sequoia [Hinohara et al., 1990].
Оснащение, необходимое для выполнения направленной атерэктомии. Прежде чем приступить к описанию данной процедуры, необходимо кратко остановиться на оснащении, необходимом для ее проведения. На рис. 5.12 представлена система для атерэктомии Simpson, которую в основном используют с некоторыми модификациями для направленной атерэктомии. На дистальном конце катетера установлена цилиндрической формы «головка», изготовленная из позолоченной нержавеющей стали. Длина цилиндра 17 мм. На боковой поверхности цилиндра находится прямоугольное «окно» длиной 10 мм. В последнее время используют более короткие «головки» с «окном» размером 5 мм, облегчающие прохождение катетера через ригидные и неровные сегменты сосуда. В глубине этого «окна» находится режущее устройство, способное выполнять 2000 вращений в 1 мин. На противоположной стороне «окна»
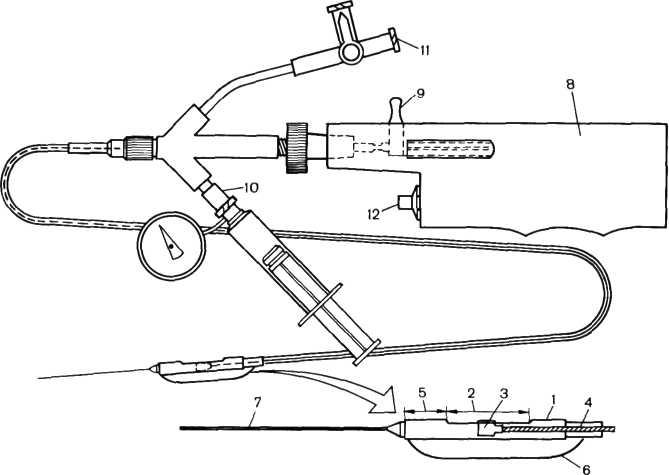
1—«головка» цилиндрической формы; 2—прямоугольное «окно», расположенное по боковой стенке «головки»; 3 — режущее устройство; 4—кабель, соединяющий режущее устройство с мо-тором; 5 — контейнер для собирания продуктов деградации атеросклероти-ческих бляшек; 6 — сопутствующий баллон для ангиопластики; 7—фиксированный проводник; 8—моторчик; 9 — рычаг, регулирующий расстояние дви-Шасения режущего устройства; 10—от-щирстие для раздувания баллона; Л — | отверстие для промывания системы; 12—включатель моторчика.
547
расположен баллон с самостоятельным просветом для раздувания, выполненный из полиэтилентерефталата. Назначение баллона в том, что при его раздувании атеросклероти-ческая бляшка, находящаяся на противоположной стороне баллона, вдавливается в «окно» и вплотную приближается к режущему устройству.
«Головка» заканчивается носовой частью, имеющей форму конуса, выполненной из закрученной спиралью пружины, находящейся в уретане. В современных конструкциях катетеров носовая часть очень гибкая и податливая, что позволяет проводить катетер через значительные сужения сосудов. Носовая часть устройства служит также для сбора в нее удаленных частиц атеросклеротической бляшки, т. е. выполняет функцию контейнера. Длина катетера достигает 125 см, а диаметр составляет 2,3 мм (7F), однако дистальная часть катетера длиной 10 см более узкая—6F. В центр катетера помещена довольно жесткая трубка, через которую проводят гид-проводник размером 0,014 дюйма. Проксимальный конец катетера имеет несколько ответвлений, к одному из которых подключают прибор для вращения режущего устройства; два других конца предназначены соответственно для введения раствора с целью промывания устройства и для раздувания баллона. «Головки» баллона бывают размером от 1,7 до 2,3 мм, используют их в зависимости от размеров венечных артерий и стенозирующих ате-росклеротических бляшек.
Учитывая, что на дистальном конце катетеров для направленной атерэктомии имеются ригидные металлические «головки», для их проведения в венечные артерии нужны специальные катетеры-гиды, которые в определенной степени отличаются от катетеров-гидов, используемых при ТБАВА. В настоящее время для катетеризации левой венечной артерии используют катетеры-гиды размером 10—11F, а для правой венечной артерии—9,5—10F. Форма дистального отдела этих катетеров отличается от таковой классических катетеров-гидов; ^используемых для ТБАВА, тем, что у них сглажены острые углы. Это обеспечивает более легкое прохождение катетера для направленной атерэктомии через катетер-гид. Учитывая большие размеры катетеров-гидов, используемых для направленной атерэктомии, необходимо наличие в них боковых отверстий и мягкого кончика катетера для адекватной перфузии венечных артерий при проведении процедуры.
Техника направленной атерэктомии. Премеди-кация при выполнении процедуры не отличается от таковой при других эндоваскулярных процедурах, в том числе при ТБАВА. Для обеспечения доступа к бедренной артерии используют интрадюсеры размером 10—11F. Рекомендуется катетеризировать также бедренную вену, чтобы иметь доступ к центральной вене. Учитывая, что катетеры-гиды, используемые при направленной атерэктомии, более ригидные, чем те, которые применяют при ТБАВА, во избежание травмы сосуда при введении катетера-гида в едином комплексе с индрадюсером целесообразно использовать так называемый катетер-интрадюсер. Этот комплекс с помощью проводника размером 0,035 дюйма вводят в артериальное русло, после чего по этому же проводнику вводят катетер-гид. Лишь после того, как кончик катетера-гида достигнет аорты, из артериального русла удаляют проводник и катетер-интрадюсер.
Далее в катетер-гид вводят катетер для направленной
атерэктомии и «головку» продвигают к дистальному концу катетера-гида, устанавливая проксимальнее бокового отверстия катетера, чтобы не нарушать перфузию венечных артерий через боковые отверстия. Затем проводник размером 0,014 дюйма проводят через сужение венечной артерии, в которой должна быть выполнена направленная атерэктомия. Лишь после этого нужно ввести в венечное русло «головку» катетера для атерэктомии и плавным надавливанием продвинуть ее до стенозирующего поражения сосуда. Для облегчения прохождения катетера сквозь сосуд желательно, чтобы кончик катетера-гида и венечный сосуд находились на одной линии. В большинстве случаев удается без особых препятствий провести «головку» катетера сквозь сужение сосуда, однако иногда возникают определенные сложности. В таких случаях можно выполнить предилатацию этого места путем обычной ТБАВА с помощью баллона диаметром 2 мм. Предилатация особенно показана при выраженном кальцинозе атеросклеротической бляшки.
На рис. 5.13 схематически представлены этапы процедуры направленной атерэктомии. После того как «головку» катетера установят в месте стеноза, необходимо расположить «окно» «головки» катетера напротив атеросклеротической бляшки, после чего произойдет тесный контакт режущего приспособления и поверхности атеросклеротической бляшки. Затем следует включить прибор для вращения режущего устройства и продвигать катетер в дистальном направлении в течение 4—7 с. Иссеченные за это время фрагменты бляшки попадают в носовую часть «головки», имеющую форму конуса. После этого сдувают баллон и проводят коррекцию расположения «головки» по отношению к бляшке, затем баллон вновь раздувают и включают режущее устройство. Можно выполнить до 15 срезов, прежде чем носовая часть головки заполнится частичками атеросклеротической бляшки. После этого катетер следует удалить и освободить от продуктов разрушения бляшки. В том случае, если иссечение бляшки к этому времени не завершено, процедуру можно повторить. Процедуру можно считать эффективной, если резидуальный стеноз не превышает 10—15% от просвета близлежащего интактного сосуда. После завершения процедуры можно прекратить использование гепарина. Интрадю-сер удаляют спустя 4—6 ч.
Осложнения. Согласно данным литературы, острая окклюзия сосуда во время процедуры возникает у 2—3% больных, еще у 1,3% происходит окклюзия на госпитальном этапе. Перфорация сосуда во время процедуры наблюдается крайне редко, не более чем у 0,1% больных. Острый инфаркт миокарда развивается у 5% больных, частота летальных исходов составляет 0,3%.
Результаты направленной атерэктомии. К 1990 г. было выполнено более 1500 процедур направленной атерэктомии, хорошие результаты получены в 85% случаев (имеется в виду увеличение просвета сосуда не менее чем на 50%). Частота летальных исходов составила 0,5%, острый инфаркт миокарда развился у 0,8% больных, срочная прямая реваскуляризация миокарда понадобилась в 4% случаев [US Directional Coronary Atherectomy Investigator Group, 1990]. Основываясь на результатах проведенных наблюдений, исследователи пришли к выводу, что направленная атерэктомия наиболее эффективна у пациентов с эксцентрически расположенной бляшкой с неровными краями и изъязвлениями. Эффективность процедуры не снижается
548
и в тех случаях, когда атеросклеротическая бляшка сочетается с тромбом. Направленную атерэктомию считают методом выбора у больных с поражением устья передней межжелудочковой ветви левой венечной артерии. Использование в этих случаях направленной атерэктомии дает выраженный эффект. Направленную атерэктомию можно также применить при неэффективности ТБАВА, особенно в тех случаях, когда не удается дилатировать сосуд из-за ригидности бляшки. Наиболее эффективным считают использование направленной атерэктомии для дилатации аортокоронарных шунтов.
Транслюмннальная экстракционная эндартерэктомия. Еще одним эндоваскулярным методом восстановления кровотока в венечных артериях является транслюминальная экстракционная эндартерэктомия (ТЭЭ). Она особенно эффективна при дискретном концентрическом поражении устьев венечных артерий, полных окклюзиях сосудов, сочетании атеросклеротических бляшек с тромботическими наложениями, так же как при дегенеративно измененных аортокоронарных шунтах. Принцип метода заключается в возможности иссечения и удаления атеросклеротических бляшек и других веществ, препятствующих нормальному кровотоку в венечных артериях, путем использования специального катетера. Этот катетер был разработан в 1989 г. R. S. Stack в содружестве с фирмой «Interventional Technologies, Inc.» (San Diego, CA).
Иссечение бляшки при ТЭЭ осуществляется режущим устройством, имеющим форму конуса, которое расположено на «головке» катетера, путем вращения этого устройства со скоростью 750 об/мин. Специальные «окна», расположенные вдоль его краев, позволяют засасывать иссеченные части бляшки в катетер, предупреждая тем самым эмболизацию дистальных отделов венечных артерий. Вращение режущего устройства и самой «головки» катетера с большой скоростью сводит до минимума возможность разрыва бляшки и надрыва медии сосуда, сглаживая стенки артерий в месте осуществления процедуры. При гистологических исследованиях, проведенных после процедуры, в некоторых случаях выявлены разрывы бляшек с локализованной диссекцией медии, повреждением стенки сосуда вне бляшки и компрессией бляшек. Конечно, такие изменения могут приводить к острой окклюзии сосуда и рестенозам. Однако аккуратное выполнение процедуры с соблюдением всех рекомендаций и коррекции реологических свойств до процедуры могут свести до минимума возможные осложнения [Safian et al., 1990; Kuntz et al., 1992]. Ангиоскопические исследования у людей, которым была произведена ТЭЭ, показали, что, как правило, имеются поверхностные повреждения бляшек без поражения более глубоких слоев тканей. Диаметр сосудов значительно увеличивается в месте выполнения процедуры—в среднем с 0,8 до 1,6 мм. Просвет сосудов в этом месте имел циркулярную форму с гладкими краями стенок [Hinohara et al., 1991].
На дистальном конце катетера для ТЭЭ имеется «головка», которая состоит из двух стальных лезвий и прилегающих к ним двух «окон». Вся «головка» имеет форму конуса. Конец «головки» соединен с проксимальным концом катетера гибкой трубкой, которая заканчивается цилиндром, в котором поддерживается отрицательное давление. В этот цилиндр всасываются иссеченные при эндартерэк-томии частицы. На конце «головки» имеется отверстие,
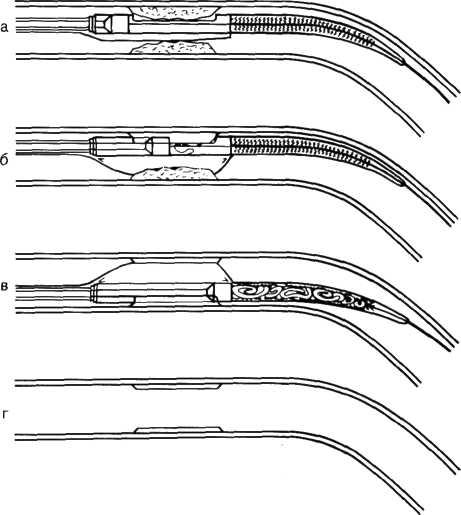
5.13. Схематическое изображение направленной венечной атерэктомии.
а — катетер для атерэктомии установлен в месте сужения венечной артерии; б — при раздувании баллона (5—10 атм) происходит тесный контакт атеросклеротической бляшки и «окна» «головки»; в—режущее устройство при вращении производит срезы с атеросклеротической бляшки; г — просвет венечной артерии после атерэктомии.
через которое проводят дистальный конец проводника размером 0,014 дюйма. При ТЭЭ используют специальный проводник, на дистальном конце которого имеется металлический шарик размером 0,021 дюйма для предупреждения застревания проводника или отклонения его от нужного направления. Правильной ориентации катетера способствует также возможность его ротации с помощью ручки на конце катетера. Ригидная трубка длиной 153 см соединяет «головку» катетера с вращающим устройством, которое начинает работать при нажатии на кнопку.
Для проведения процедуры ТЭЭ необходимо пункцион-ным методом установить в бедренной артерии интрадюсер размером 10,5 дюйма. Катетеризируют также бедренную вену с установкой в ней интрадюсера. Непосредственно перед процедурой внутривенно вводят 10 000 ЕД гепарина. Как минимум за 48 ч до процедуры необходимо начать терапию аспирином в дозе 325 мг/сут. Перед началом процедуры следует собрать прибор для ТЭЭ и проверить работу моторчика, вращающего катетер, а также вакуумной системы. Затем весь прибор промывают изотоническим раствором хлорида натрия. Для успешного проведения процедуры необходимо использовать катетер-гид размером 10F. С учетом больших размеров катетера-гида необходима крайняя осторожность при его проведении в артериальное русло. С этой целью следует использовать проводник типа J размером 0,063 дюйма либо многоцелевой катетер-интрадюсер с проводником типа J размером 0,035 дюйма. Крайняя осторожность необходима при установке дистального кон-
549
чика катетера-гида в устьях венечных артерий во избежание глубокого проникновения его в сосуд или диссекции устья артерии. Затем следует провести проводник в венечный сосуд дистальнее его стеноза. Катетер для ТЭЭ проводят по проводнику, и его «головку» устанавливают на несколько миллиметров проксимальнее повреждения сосуда. Во избежание спазма венечной артерии в нее вводят от 100 до 300 мкг нитроглицерина. После этого включают моторчик и плавно продвигают дистальный кончик катетера с режущим устройством вперед. Как правило, для получения адекватного просвета необходимо от одного до трех прохождений режущего устройства сквозь стенозированный участок. При иссечении бляшки необходимо постоянно контролировать поступление крови в вакуумный цилиндр, что будет свидетельствовать о нахождении режущего устройства в просвете сосуда и предупреждать о возможной перфорации его стенки. Содержимое вакуумного цилиндра можно подвергнуть гистологическому изучению для определения состава иссеченного материала.
К 1991 г. в США было выполнено около 1500 процедур ТЭЭ. Процедуру примерно одинаково часто выполняли в венечных артериях и аортокоронарных шунтах. Ангиографи-ческий эффект, т. е. уменьшение стенозирующего поражения стенки венечной артерии по меньшей мере на 20%, при условии, что оно не превышало 50%, наблюдали в 93% случаев. При оценке результатов ТЭЭ раздельно в венечных артериях и шунтах установлено, что в венечных артериях эффект получен у 91% больных, у 5,9% возникли тяжелые осложнения; у 1,2%—нефатальный ОИМ и у 1,6%—летальный исход. Следует отметить, что 41% летальных исходов был в группе пациентов, доставленных на процедуру с диагнозом ОИМ. Успех процедуры ТЭЭ в аортокоронарных шунтах составил 93%. Особенно эффективной была процедура при поражении устьев венечных артерий—97%, тогда как при ТЭЭ при тромбозе венечных артерий эффективность составила 90%. Серьезные осложнения наблюдали в 4,3% случаев, при этом частота нефатального ОИМ составила 0,7%. Острая окклюзия сосуда в процессе ТЭЭ возникла в 2,9%. Летальность составила 2,2%. Одним из самых нежелательных осложнений ТЭЭ является рестеноз, который наблюдали в 45% [Califf R. M. et al, 1991]. Однако последние наблюдения, проведенные некоторыми исследователями, показали, что частоту рестеноза возможно существенно снизить за счет уменьшения резидуального стеноза при ТЭЭ [Sketch et al., 1992].
Таким образом, результаты процедуры транслюминаль-ной экстракционной эндартерэктомии вполне сопоставимы с таковыми при ТБАВА, а в некоторых случаях (поражение устьев венечных артерий, тромбированная бляшка, дегенеративно измененный аортокоронарный шунт) транслюми-нальная экстракционная эндартерэктомия имеет существенное преимущество перед ТБАВА.
Внедрение в широкую практику препаратов, блокирующих Р-адренергические рецепторы, пролонгированных нитратов и антагонистов кальция значительно изменило прогноз жизни больных ИБС. Так, по данным Н. Mclntosch, J. Garcia (1978), при поражении одного венечного сосуда выживаемость больных ИБС спустя 7 лет составила 78,9%, при стенозе двух сосудов—51,5%, а трех сосудов—37%. Аналогичные данные приводят J. Norman и соавт. (1975). В зависимости от тяжести поражения коронарных артерий
и функциональной способности миокарда авторы выделили две группы больных: первая—больные с «низким» риском и вторая—больные с «высоким» риском. Оказалось, что в первой группе смертность за 5 лет составила 6%, тогда как во второй группе только за первый год—25%, а к концу 4-го года—67%.
В заключение следует отметить, что смертность больных ИБС в 2—3 раза выше, чем лиц данной возрастной группы, не страдающих ИБС.
История разработки хирургических методов лечения ише-мической болезни сердца. Идея создать обходной шунт между аортой или системной артерией и коронарным сосудом в обход пораженного и суженного атеросклерозом участка клинически была реализована Рене Фавалоро в 1967 г. Ранее, в 1962 г., Дэвид Сабистон (Дьюкский университет), используя в качестве сосудистого протеза большую подкожную вену, наложил шунт между аортой и коронарной артерией. Однако сообщение об этой операции появилось в 1973 г., т. е. через 9 лет.
В 1964 г. ленинградский хирург В. И. Колесов создал анастомоз между внутренней грудной артерией и левой коронарной артерией.
Операция аортокоронарного шунтирования стала логичным завершением многочисленных экспериментальных и клинических исследований по изучению патологии и диагностике ИБС.
Поэтому прежде чем перейти к описанию операции аортокоронарного шунтирования, целесообразно остановиться на основных исторических моментах развития хирургических методов лечения ИБС.
Операции, направленные на устранение стенокардии, были сделаны в начальном периоде развития коронарной хирургии. Авторы ставили цель — устранить болевой синдром воздействием на афферентные нервные пути сердца: удаление симпатических узлов — Т. Jonnesco (1916), пересечение задних корешков спинного мозга, периартсриальная сим-патэктомия коронарных артерий — М. Fauteux (1946).
Операции на симпатическом отделе нервной системы при стенокардии реализуют свое действие тремя возможными путями: а) блокадой передачи сосудосуживающих импульсов по вазомоторным нервам; б) перерывом передачи кар-диопрессорных рефлексов и снижением в результате этого работы миокарда; в) блокадой эфферентных импульсов [Ploz М„ 1957].
Н. Blumgart в 1933 г., а затем А. П. Герцен использовали тиреоидэктомию для лечения стенокардии, сочетая ее с шейной симпатэктомией. Считалось, что эта операция позволяет снизить метаболизм миокарда, а следовательно, и уменьшить его работу.
Однако указанный подход не дал удовлетворительных результатов при лечении стенокардии.
Исходя из представления о необходимости создания дополнительного источника кровоснабжения миокарда, С. Hudson в 1932 г. предложил использовать перикард. С. Beck в 1935 г. первым произвел скарификацию эпикарда, полагая, что в результате образования сращений между перикардом и эпикардом произойдет прорастание эпикарди-альных сосудов в миокард. В 1935 г. наибольшее распространение получил метод Томпсона [Thompson S., 1939]. названный кардиоперикардиопексией (распыление талька в полости перикарда). Были использованы сочетанные операции, например комбинация методов Фиески и Томпсона.
Слабая васкуляризация развивающихся спаек и сомнительные результаты кардиоперикардиопексии привели в дальнейшем к отказу от этого вмешательства.
В 1937 г. L. O'Shaughnessy впервые использовал тканевый трансплантат для реваскуляризации миокарда. Он подшил к эпикарду лоскут сальника на ножке. С этой же целью хирурги использовали: ткань легкого, грудные мышцы, ме-диастинальный жир, кожный лоскут и даже участок тонкой кишки.
Другим методом стимуляции окольного кровообращения в миокарде была операция перевязки внутренних грудных
550
артерий, предложенная итальянским хирургом D. Fieschi в 1939 г. L. Coob и соавт. (1959), D. G. Dimond и соавт. (1960) показали, что положительные результаты операции обусловлены эффектом плацебо.
Неудачи всех перечисленных методов реваскуляризации миокарда, по мнению R. Gorlin (1978), обусловлены тем, что авторы «не учитывали размеров дефицита кровотока при коронарной болезни, строгой локализованности этого дефицита, а также того факта, что уменьшение перфузии наблюдается главным образом в глубоких, а не в поверхностных слоях миокарда [Gorlin R., 1978].
Для улучшения васкуляризации миокарда были предложены различные методы сужения коронарного синуса. С. Beck (1948) описал операцию сужения коронарного синуса с одновременным нанесением насечек на эпикард, распылением талька в полости сердечной сорочки и введением в перикард медиастинального жира. A. Bakst и соавт. (1955) доказали неэффективность этой операции.
В 1948 г. С. Beck предложил операцию артериализации коронарного синуса, получившую впоследствии его имя (Бек-П). Операция выполнялась в 2 этапа, при первом накладывался аутовенозный шунт или прямой анастомоз между аортой и коронарным синусом, а при втором производилось сужение коронарного синуса. Операция была вскоре оставлена, в том числе и самим Беком, так как она давала плохие результаты и сопровождалась высокой летальностью.
Прямой реваскуляризации миокарда предшествовала операция, предложенная М. Vieneberg,— имплантация внутренней грудной артерии в толщу миокарда. Однако эта операция также не получила широкого распространения из-за травматичности и отсутствия немедленного эффекта.
Прямая реваскуляризация миокарда. Одновременно с разработкой методов непрямой реваскуляризации миокарда были разработаны и применены методы прямого восстановления кровотока в пораженных атеросклерозом коронарных артериях. Впервые Бейли выполнил эндартерэк-томию из коронарной артерии [Bailey С. et al., 1957]. W. Longmire (1958) модифицировал метод, A. Senning (1962) и D. Effler (1964) дополнили эндартерэктомию аутовенозной и аутоперикардиальной пластикой. Операции давали плохие результаты и высокий процент летальности. Точная диагностика локализации коронарного атеросклероза и соответственно целенаправленное хирургическое вмешательство стали возможными только после разработки метода селективной коронарографии.
В 1962 г. D. Sabiston выполняет, по-видимому, первое обходное аутовенозное шунтирование коронарной артерии у человека, при этом проксимальный анастомоз был наложен с восходящей частью аорты, а дистальный — конец в конец с правой венечной артерией. Больной умер в результате нарушения мозгового кровообращения.
В 1964 г. М. DeBakey выполнил успешное аортокоронар-ное шунтирование сегментом большой подкожной вены. Сообщение об этой операции было опубликовано в 1967 г. [DeBakey M. et al., 1967]. R. Favaloro выполнил первую операцию в 1967 г., и с этого времени он начинает систематически осуществлять аортокоронарное шунтирование [Favaloro R., 1970]. Вслед за ним W. Johnson (1970) пропагандирует операцию, используя множественное шунтирование.
Эффективным методом прямой реваскуляризации миокарда является маммарно-коронарный анастомоз. В. И. Коле-сов впервые в мире наложил маммарно-коронарный анастомоз у человека в 1964 г. Доступ к работающему сердцу осуществлен посредством левосторонней торакотомии.
В нашей стране первые операции аортокоронарно1 о ауто-венозного шунтирования были выполнены в 1970 г. во Всесоюзном научном центре хирургии [Князев М. Д., 1971] и в ИССХ им. А. Н. Бакулева [Бураковский В. И., Покровский А. В., 1971].
Показания к хирургическому лечению. Показания к аорто-коронарному шунтированию за последнее десятилетие претерпели определенную эволюцию. При рассмотрении рева-
скуляризации миокарда в историческом аспекте видно, что первые операции выполнялись при поражении только одного коронарного сосуда. Шунтированию или эндартерэкто-мии подвергались обычно правая коронарная артерия и передняя межжелудочковая ветвь, значительно реже огибающая ветвь ЛКА. С 1971 г., когда W. Johnson, D. Lepley предложили «агрессивный подход» к хирургии больных ИБС, имея в виду необходимость шунтирования всех пораженных коронарных артерий, ситуация изменилась и показания к операции были расширены главным образом за счет применения множественного шунтирования.
В настоящее время основой для определения показаний к хирургическому лечению являются следующие факторы.
Клиника заболевания, т. е. выраженность стенокардии, ее устойчивость к лекарственной терапии.
Анатомия поражения коронарного русла: степень и ло кализация поражения коронарных артерий, количество по раженных сосудов, тип коронарного кровоснабжения.
Сократительная функция миокарда.
Этими факторами, из которых два последних имеют особо важное значение, определяется прогноз заболевания при естественном течении и лекарственной терапии и степень операционного риска. На основании оценки данных факторов ставятся показания и противопоказания к операции аортокоронарного шунтирования.
Клинические факторы. В настоящее время большинство авторов считают показанием к операции стенокардию покоя и напряжения, резистентную или плохо поддающуюся лекарственной терапии.
Признаки ишемии миокарда могут обнаруживаться в покое, но вероятность их выявления значительно повышается при воздействиях, вызывающих функциональное напряжение. Такими воздействиями могут быть физическая нагрузка, тахикардия, вызванная искусственной стимуляцией или катехоламинами.
Положительная проба с физической нагрузкой и низкая толерантность к нагрузке (менее 50 Вт) указывают на низкий коронарный резерв и являются объективным критерием тяжести стенокардии.
Наряду с этим следует иметь в виду эффективность и целенаправленность лекарственной терапии. Несмотря на то что в настоящее время у большинства больных с помощью современных антиангинальных средств удается уменьшить интенсивность стенокардии, необходимость постоянного приема больших доз препаратов, обладающих побочным действием, создает дополнительный дискомфорт для больных.
Поражение венечных артерий по данным коронарографии является показанием к хирургическому лечению при проксимально расположенных стенозах коронарных артерий с сужением 75% и более просвета и проходимым дистальным руслом.
Сравнение отдаленных показателей выживаемости при лекарственном и хирургическом лечении ИБС показало, что у больных с поражением ствола левой коронарной артерии и трехсосудистым поражением результаты консервативного лечения значительно хуже, чем результаты хирургической реваскуляризации миокарда (рис. 5.14). При двухсосудистом поражении эти показатели различаются несколько меньше [Takaro Т. et al., 1982].
Наиболее дискутабельным остается вопрос о целесообраз-
557
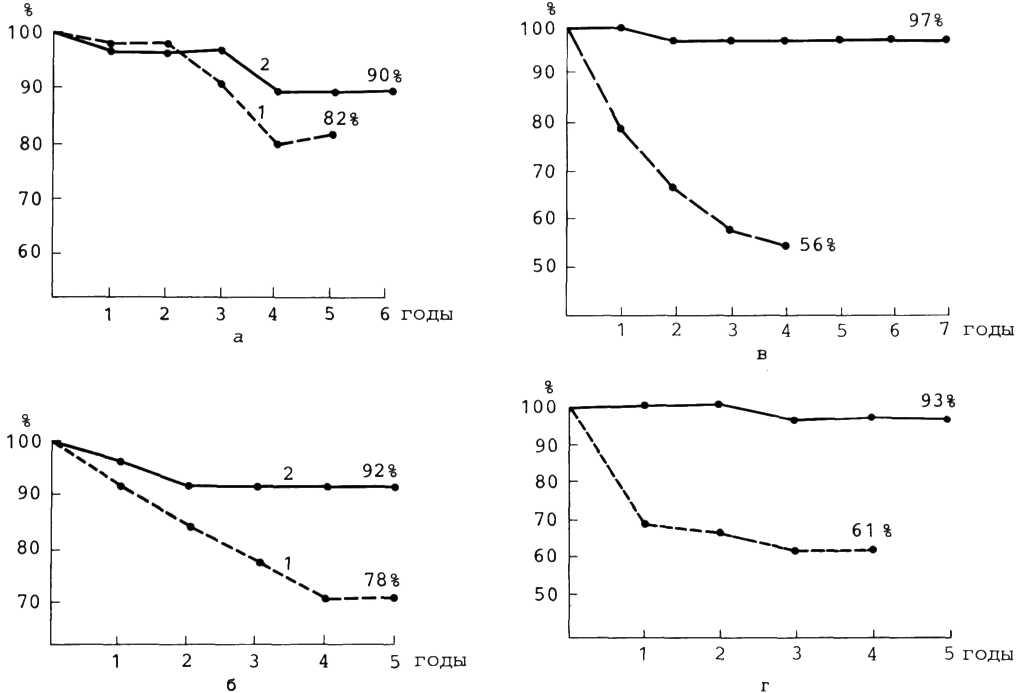
ности операции при поражении одного сосуда. При односо-судистом поражении большинство авторов не находят разницы, в отдаленных показателях выживаемости при лекарственном и хирургическом лечении больных.
Однако нельзя объединять и рассматривать как равноценные группы больных с одиночным поражением каждой из коронарных артерий. При однососудистом поражении необходимо в первую очередь выделить группу больных, имеющих критический стеноз передней межжелудочковой ветви левой коронарной артерии выше отхождения первой перегородочной ветви. Развитие тромбоза в этой области часто ведет к обширному инфаркту миокарда, нередко с образованием аневризмы, фибрилляцией желудочков, и может заканчиваться смертью больных. Поэтому изолированное поражение передней межжелудочковой ветви левой коронарной артерии в проксимальной трети должно служить показанием к операции, которая у этих больных проста и безопасна и дает хороший результат.
Больные с изолированным поражением правой коронарной артерии, как правило, могут получать лекарственную
терапию, если она эффективна. Однако нередко, особенно при правом типе коронарного кровоснабжения и мощно выраженной правой коронарной артерии с резким сужением, может развиться обширный инфаркт миокарда с нарушениями ритма и проводимости. Поэтому показания к операции в этой группе больных должны быть строго индивидуализированы с учетом клинической картины заболевания и анатомической выраженности правой коронарной артерии.
При изолированном поражении огибающей ветви левой коронарной артерии, которое само по себе встречается относительно редко, показания к хирургическому лечению также определяются строго индивидуально. Они зависят главным образом от типа коронарного кровоснабжения и выраженности ветвей огибающей артерии.
Большинство авторов согласны с тем, что если операция у больных с однососудистым поражением не всегда улучшает прогноз жизни, то «качество жизни» улучшается в большинстве случаев. Операция нередко полностью избавляет больного от приступов стенокардии и необходимости постоянного приема антиангинальных средств [Работников В. С. и др., 1983].
С учетом имеющейся информации о естественном течении коронарной болезни в зависимости от локализации и распространенности поражения целесообразно ввести понятие «прогностически неблагоприятный характер поражения коронарного русла». Этому понятию отвечают следующие локализации стенозов коронарных сосудов.
552
1. Поражение ствола левой венечной артерии встречается у 8% больных и сужение его просвета более 75% приводит к смерти при естественном течении у 64% за 10 лет наблюде ния [Hurst J.W, 1980].
Кроме того, при развитии инфаркта миокарда у больных с поражением основного ствола левой коронарной артерии поражение обычно занимает очень большую площадь с частым формированием постинфарктной аневризмы левого желудочка и развитием застойной сердечной недостаточности, быстро прогрессирующей и приводящей к смерти. В большинстве случаев больные с поражением ствола левой коронарной артерии умирают в остром периоде инфаркта миокарда в результате критического снижения контрактильной функции левого желудочка и развития кардиогенного шока.
Перечисленные факторы, а также сравнение результатов лекарственного и хирургического лечения при поражении ствола левой коронарной артерии в рандомизированных группах больных показывают, что поражение ствола левой коронарной артерии является одним из важнейших показаний к проведению оперативного лечения.
Многие авторы считают необходимым оперировать больных с поражением ствола левой коронарной артерии менее чем на 50% [Fabian J. et al., 1982].
Больным без симптомов стенокардии, но с ангиографиче-ски выявленным стенозом ствола левой коронарной артерии также рекомендуется реваскуляризация миокарда [Favaloro R., 1979].
2. У 85% больных наблюдается множественное поражение венечных сосудов как при хроническом течении, так и при острых расстройствах коронарного кровообращения. Выжи ваемость больных с многососудистым поражением за 4-летний период наблюдения составляет 50% [Hurst J. W., 1980]. У большинства больных с трехсосудистым поражени ем коронарных артерий имеются выраженные клинические признаки ИБС и низкий порог толерантности к физической нагрузке [Думчюс А. С. и др., 1985].
Сравнение результатов лекарственного и хирургического лечения в этой группе больных показало, что операция аортокоронарного шунтирования в значительной степени улучшает прогноз [Hurst J. W., 1980].
3. Высокое изолированное поражение передней межжелу дочковой ветви не все авторы рассматривают как прогно стически неблагоприятное.
Мнения о необходимости хирургического лечения в данной группе больных расходятся, однако, по-видимому, высокий риск развития инфаркта миокарда и аневризмы левого желудочка у этих больных должен служить показанием к хирургическому лечению. Следует еще иметь в виду, что операция избавляет больных от приступов стенокардии, нередко очень тяжелой, и практически не дает летальных исходов [Работников В. С. и др., 1983].
Фактор проходимости дистального коронарного русла является решающим при определении показаний к хирургическому лечению. При этом основным условием возможности успешного выполнения операции являются проходимость коронарной артерии дистальнее участка обструкции и ее диаметр, который должен составлять не менее 1,5 мм [Lesperance J. et al., 1972]. В зависимости от состояния дистального коронарного русла можно выделить три группы больных: а) «идеальные кандидаты» на реваскуляриза-цию—с локализованным проксимальным стенозом и сво-
бодным неизмененным дистальным руслом; б) условно операбельные больные—с проксимальным стенозом и изменениями в дистальном отделе сосуда; в) неоперабельные больные, у которых имеет место диффузное далеко зашедшее поражение дистального русла (рис. 5.15).
Однако в связи с тем, что за последние годы в клиническую практику все более широко внедряется эндартерэктомия из коронарных артерий с последующим наложением аортокоронарного шунта, четкая дифференциация больных по состоянию дистального русла затруднительна.
Оценка состояния дистального русла затруднена у больных, имеющих полную окклюзию коронарных артерий. Развитие коллатерального кровообращения, от которого зависит степень заполнения периферических отделов сосуда, не всегда позволяет достоверно определить состояние дистального русла [Cohn P., Braunwald E., 1984].
Вопрос о показаниях к реваскуляризации миокарда у больных с окклюзией коронарных артерий занимает особое место. Наличие трансмурального рубца в зоне кровоснабжения окклюзированной артерии в большинстве случаев является противопоказанием к реваскуляризации этого бассейна. Нетрансмуральные рубцовые изменения, а тем более наличие ишемической дисфункции миокарда в этом месте требуют осуществления реваскуляризации.
Калышноз коронарных артерий не является противопоказанием к операции, поскольку он распространяется в дистальном направлении не на всем протяжении артерии. Кроме того, участки передней стенки сосуда часто остаются свободными от включений кальция.
Сократительная функция (контрактильность) миокарда. Функциональное состояние миокарда левого желудочка имеет решающее значение для определения показаний к хирургическому лечению. Интегральным показателем, характеризующим сократительную функцию миокарда, является фракция изгнания левого желудочка, наиболее достоверно определяемая контрастной вентрикулографией. Увеличение конечного диастолического давления и конечного диастоли-ческого объема также является важным показателем снижения контрактильности левого желудочка.
В ранних работах, посвященных риску операций на открытом сердце, было показано, что фракция изгнания является основным фактором, определяющим послеоперационную летальность и частоту развития послеоперационной острой левожелудочковой недостаточности [Cohn P. et al., 1974]. В то же время сниженная фракция изгнания является плохим прогностическим признаком при естественном течении ИБС.
Снижение фракции изгнания может быть обусловлено двумя основными причинами: 1) Рубцовыми изменениями миокарда—постинфарктным или атеросклеротическим кардиосклерозом; 2) ишемической дисфункцией миокарда, выражающейся асинергией, акинезией или дискинезией.
Общепризнано, что уменьшение фракции изгнания ниже 40% резко увеличивает риск развития послеоперационной сердечной недостаточности и операционную летальность.
Однако если снижение контрактильности миокарда обусловлено главным образом ишемической дисфункцией, то адекватная реваскуляризация должна привести к повышению сократительной способности левого желудочка. В этой связи очень важную проблему представляет дооперационная дифференциация ишемической дисфункции миокарда от его рубцового поражения. При этом важнейшими критериями
553
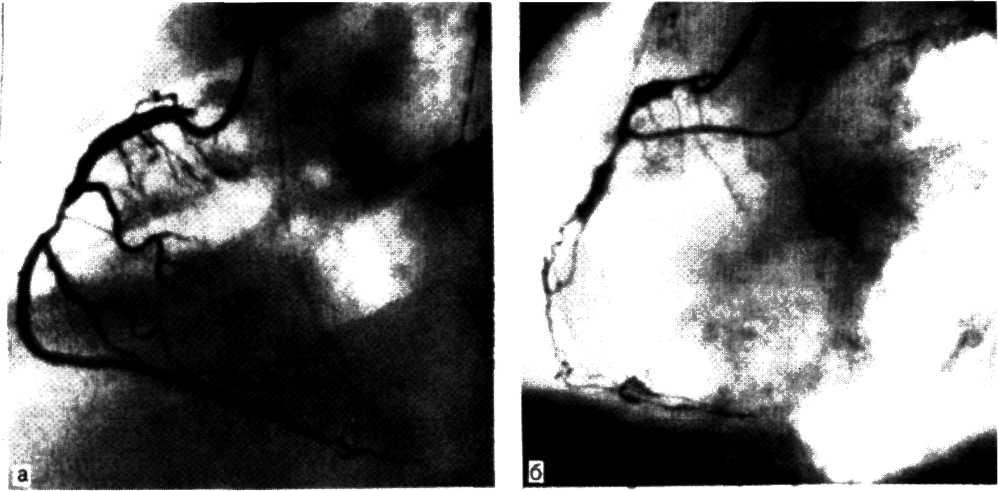
дистального венечного русла.
а — стеноз правой венечной артерии с проходимым дисталь-
ным руслом; 6 — поражение правой венечной артерии на всем
протяжении.
являются: 1) наличие или отсутствие рубцовых изменений на ЭКГ; 2) результаты контрастной вентрикулографии или эхокардиографического исследования с нитроглицериновой пробой [Pine R. et al., 1973]; 3) результаты сцинтиграфии миокарда, особенно в условиях физической нагрузки.
Больным с хорошим контрактильным резервом, у которых снижение контрактильности миокарда обусловлено преимущественно ишемической дисфункцией, реваскуляризация показана даже при наличии застойной сердечной недостаточности, несмотря на высокий риск хирургического вмешательства, так как отдаленный прогноз для жизни у них очень плохой [Spenser F. et al., 1971; Nesto K. et al., 1982].
He всегда имеется корреляция между снижением контрактильности миокарда левого желудочка и клиническими проявлениями сердечной недостаточности. Нередко у больных со снижением фракции изгнания не отмечается признаков сердечной недостаточности и не снижается сердечный выброс. Это особенно характерно для больных с крупноочаговыми Рубцовыми изменениями миокарда и с наличием сегмента акинезии на вентрикулограмме, поскольку до определенного предела изменения локальной контрактильности не влияют на системную гемодинамику благодаря компенсаторному удлинению волокон непораженного миокарда и увеличению силы его сокращений. Расчеты показали, что при площади рубцового поля до 22% от всей площади миокарда левого желудочка, несмотря на снижение фракции изгнания и появление зоны акинезии на вентрикулограмме, системная гемодинамика не нарушается и признаков сердечной недостаточности не наблюдается [Reddy S., Cooley D. et al., 1981].
Однако такая компенсация имеется обычно только в спокойном состоянии. Для выявления скрытой сердечной недостаточности большое значение имеет исследование в условиях физической нагрузки. Нагрузка приводит к срыву компенсации, в результате чего могут появляться клинические признаки сердечной недостаточности (одышка, застойные хрипы в легких и др.).
Левая вентрикулография в условиях тахикардии, вызванной искусственной стимуляцией, которая в определенной степени является аналогом нагрузки, может показать значительное снижение фракции изгнания, свидетельствующее о наличии скрытой сердечной недостаточности [Gorlin R., 1976].
К клиническим факторам, влияющим на показания к хирургическому лечению ИБС, следует отнести: 1) наличие инфаркта миокарда в анамнезе; 2) застойную сердечную недостаточность (ишемическую кардиопатию); 3) нарушения ритма сердца.
Инфаркт миокарда. Более половины больных со стабильной стенокардией, которым показано хирургическое лечение, перенесли в прошлом инфаркт миокарда [McNeer J. et al., 1974], однако у ряда больных с инфарктом миокарда в анамнезе не отмечалось стенокардии. Наличие в прошлом инфаркта миокарда является показанием к коронарографии. При обнаружении прогностически неблагоприятных поражений коронарных артерий показана операция.
Застойная сердечная недостаточность. Термин «ишемиче-ская кардиопатия» был введен G. Burch и соавт. (1970) для обозначения выраженной дисфункции миокарда, сопровождающейся сердечной недостаточностью, которую иногда трудно отличить от истинной кардиомиопатии. При этом нередко стенокардия отсутствует или нерезко выражена. Больным, у которых причина развивающейся сердечной недостаточности неясна, показано коронарографическое исследование для выявления возможного коронарогенного происхождения дисфункции миокарда. Если эта дисфункция
554
носит преимущественно ишемический характер и потенциально обратима, то больным показано аортокоронарное шунтирование [Nesto К. et al., 1982].
Нарушения ритма сердца. Нарушения ритма сердца даже без стенокардии могут быть следствием поражения коронарных артерий. При наличии у больного аритмии, генез которой неясен, наряду с электрофизиологическим исследованием показано детальное обследование, включая коронарогра-фию, с целью выявления или исключения коронарного генеза аритмии.
Ряд авторов указывают, что больным, перенесшим в прошлом фибрилляцию желудочков и успешно реанимированным, необходима коронарография, так как у них высокая вероятность развития прогностически неблагоприятных поражений коронарого русла.
Показания к хирургическому лечению у больных без клинических проявлении поражения коронарных сосудов. Этот вопрос до настоящего времени является дискутабельным. В ряде работ показано, что при асимптомном течении болезни прогноз лучше, чем у больных с приступами стенокардии и таком же анатомическом поражении коронарных артерий [Cohn P. et al., 1981 ]. Однако ряд авторов признают, что при наличии прогностически неблагоприятных анатомических поражений коронарных сосудов (многососудистое поражение, поражение ствола левой коронарной артерии) показано оперативное лечение.
Общее состояние здоровья больного следует иметь в виду при решении вопроса о хирургическом лечении. Так как коронарная болезнь нередко наблюдается в пожилом возрасте, то естественно, что у многих больных имеются сопутствующие заболевания. Эти заболевания могут служить противопоказанием к операции, так как в значительной степени увеличивают риск ее проведения в условиях общей анестезии и ИК [Ehrlich J., 1975].
Основными сопутствующими заболеваниями, которые определяют противопоказания к аортокоронарному шунтированию, являются следующие.
Хронические неспецифические заболевания легких (хро ническая пневмония, пневмосклероз, эмфизема легких). Искусственная вентиляция легких и коллабирование их во время ИК создают ряд проблем у таких больных: ателектазы, гипоксемию, что может значительно ухуд шить прогноз.
Заболевания печени (цирроз печени, хронический гепатит, дистрофические процессы в печени) приводят к наруше нию функций печени и снижению толерантности организ ма к большинству анестетиков, что значительно увеличи вает риск операции.
Почечная недостаточность, которая может быть обус ловлена хроническим гломерулонефритом и пиелонефри том, нефросклерозом, является также фактором, резко повышающим риск аортокоронарного шунтирования.
Неконтролируемая артериальная гипертензия. Помимо того что тяжелая артериальная гипертензия усложняет ведение операции и послеоперационного периода, была показана значительно более высокая частота ранних ок клюзии аортокоронарных шунтов у больных гипертензи- ей. Таким образом, неконтролируемая артериальная ги пертензия может служить относительным противопоказа нием к операции.
Являясь системным заболеванием артерий, атеросклероз может поражать одновременно несколько сосудистых бассейнов. Лечебная тактика при сочетанных поражениях требует специального обсуждения и будет рассмотрена ниже.
Возраст больных сам по себе не может служить противопоказанием к аортокоронарному шунтированию при отсутствии тяжелых сопутствующих заболеваний. При правильном отборе больных можно достигнуть увеличения продолжительности жизни и ликвидациии симптомов заболевания.
Степень операционного риска. Любой хирургический метод оправдан в том случае, если он имеет преимущества по сравнению с лекарственным лечением, и риск операции может быть сведен к минимуму.
R. Favaloro считает, что при хирургическом лечении коронарной болезни послеоперационная летальность не должна превышать 2%. Однако, как указывает автор, существуют группы больных, у которых этот показатель значительно выше [Favaloro R., 1979].
Поэтому при определении показаний к хирургическому лечению важно рассмотреть для каждой группы больных факторы операционного риска. Перечисленные выше показания и противопоказания к операции следует рассматривать комплексно. Взаимосвязь этих факторов имеет решающее значение, и целесообразно ввести понятие «степень операционного риска», включающее в себя сведения о локализации поражений коронарных артерий, состоянии дистального русла, сократительной функции миокарда, а также тяжести клинической картины и наличии тяжелых сопутствующих заболеваний для отдельных групп больных.
Известно, что риск хирургического вмешательства значительно выше, чем в общей группе больных, у пациентов с поражением ствола левой коронарной артерии, с выраженным снижением контрактильной способности левого желудочка, с относительно «плохим» дистальным руслом, при выраженной стенокардии или клинике сердечной недостаточности и сопутствующих поражениях легких, печени, почек.
У каждого пациента следует тщательно оценить все указанные параметры и «взвесить» все «за» и «против» операции, прежде чем рекомендовать ее (табл. 5.2).
В целом степень операционного риска не должна превышать риск при естественном течении и лекарственной терапии.
Повторные операции аортокоронарного шунтирования при ишемической болезни сердца. Известно, что частота избавления от симптомов стенокардии при первичных операциях аортокоронарного шунтирования достигает 90%.
У части больных возникают показания к повторной операции. Повторная операция необходима или оправдана при: 1) отсутствии эффекта от аортокоронарного шунтирования вследствие тромбоза шунта (из-за технических ошибок), прогрессирования атеросклероза в шунтированном сосуде или поздней окклюзии шунта; 2) прогрессировании атеросклероза в нешунтированных сосудах; 3) комбинации первых двух причин.
Независимо от причин, перечисленных выше, основным показанием к повторной операции является тяжелая стенокардия, плохо поддающаяся лекарственному лечению, при операбельном поражении коронарных артерий и удовлетво-
555
Таблица 5.2. Определение показаний к операции при стабильной стенокардии в зависимости от клинических (I) и анатомических (II) факторов и контрак-тильной функции миокарда
|
Факторы |
Показана |
Не показана |
|
I. Тяжесть стено- |
Средней тяжести, |
Легкая, отсутст- |
|
кардии |
тяжелая |
вует |
|
Устойчивость к |
Резистентная или |
Хорошо поддаю- |
|
лекарственной |
плохо поддающая- |
щаяся |
|
терапии |
ся |
|
|
II. Степень пора- |
75% и более |
50% и менее |
|
жения |
|
|
|
Локализация и |
Проксимальные |
Дистальные отде- |
|
количество по- |
отделы сосудов, |
лы сосудов, одно- |
|
раженных арте- |
ствол ЛКА, двух- |
сосудистое пора- |
|
рий |
и трехсосудистое |
жение (кроме высо- |
|
|
поражение, высо- |
кого поражения |
|
|
кое поражение |
ПМЖВ) |
|
|
ПМЖВ |
|
|
Состояние ди- |
Проходимость |
Поражение диа- |
|
стального рус- |
диаметром не ме- |
метром менее |
|
ла |
нее 1,5 мм |
1 мм |
|
III. Фракция изгна- |
Более 30% |
Менее 30% |
|
ния ЛЖ |
|
|
|
Конечное диа- |
Менее 16 ммрт.ст. |
Более 20 мм рт. ст. |
|
столическое да- |
|
|
|
вление |
|
|
|
Характер пора- |
Ишемическая дис- |
Диффузное рубцо- |
|
жения |
функция |
вое поражение |
рительной сократительной функции миокарда левого желудочка.
Большинство больных (62%) подвергаются повторной операции в связи с тромбозом шунта после первичной операции, 11%—в связи с резко выраженным поражением коронарных артерий, в которых ранее не было выявлено ате-росклеротического поражения, и 27%—при сочетании этих причин [Fbrster D. et al., 1984].
Обычно средний интервал между первичной и повторной операцией составляет около 3 лет.
После повторных операций у 80% больных наблюдается улучшение или исчезают приступы стенокардии [Keon W. et al., 1984].
Хирургическое лечение ишемической болезни сердца. Для обеспечения хороших результатов хирургического лечения и снижения частоты тромбозов необходимы стандартизация техники операции, определенный набор инструментов и шовного материала.
Наряду с обычными инструментами, применяемыми в сердечно-сосудистой хирургии для выполнения операций в условиях ИК, используют специальные инструменты. К ним относятся: узкий коронарный скальпель или бритво-держатель, в который закрепляется режущая часть бритвы для выделения и вскрытия коронарной артерии: угловые и обратные угловые ножницы для продольного рассечения передней стенки коронарного сосуда; коронарные бужи различных диаметров, в частности желобоватые бужи, облегчающие наложение анастомозов и служащие для проверки их проходимости; пинцеты и иглодержатели, позволяющие работать с небольшой атравматической иглой.
В качестве шовного материала используют монолитные синтетические нити (полипропилен, пролен) с атравматической иглой. Для наложения дистальных анастомозов с коро-
нарными артериями применяют проленовые нити 6/0 и 7/0. Для наложения проксимальных анастомозов наиболее удобны нити 5/0.
Операцию необходимо выполнять в условиях хорошего освещения операционного поля. Наиболее удобны при этом бестеневые лампы, которые не согревают операционного поля, или налобная лампа-осветитель.
Для улучшения качества анастомозов используют оптику с увеличением в 2'/2—4 раза. Применяют различные модификации очков, некоторые из них комбинируют с источником освещения, например отечественную бинокулярную лупу с осветителем.
В настоящее время наиболее широко используют два метода операций на коронарных артериях: перемежающееся пережатие восходящей части аорты в сочетании с локальной гипотермией и кардиоплегическую технику. Ряд исследований, посвященных сравнительной оценке этих методов, показал, что оба дают хорошие результаты, но кардиоплегиче-ская техника имеет некоторые преимущества [Sanders J. et al, 1980; Flameng W. et al., 1984].
Техника аортокоронарного шунтирования. Операцию осуществляют в несколько этапов: 1) доступ к сердцу, осуществляемый обычно путем срединной стернотомии; 2) забор аутовенозных трансплантантов, выполняемый другой бригадой хирургов одновременно с производством стернотомии; 3) канюляция восходящей части аорты и полых вен и подключение ИК; 4) пережатие восходящей части аорты с кардиоплегической остановкой сердца; 5) наложение дистальных анастомозов с коронарными артериями; 6) снятие зажима с восходящей части аорты; 7) профилактика воздушной эмболии; 8) восстановление сердечной деятельности; 9) наложение проксимальных анастомозов; 10) отключение ИК; 11) деканюляция; 12) ушивание стернотоми-ческого разреза с дренированием полости перикарда.
В последовательности указанных этапов могут быть некоторые изменения. Так, например, ряд хирургов предпочитают накладывать проксимальные анастомозы до начала ИК. Это несколько сокращает время ИК.
Некоторые хирурги накладывают проксимальные анастомозы с восходящей частью аорты до восстановления сердечной деятельности в условиях поперечного пережатия аорты и кардиоплегии.
Возможны также вариации в технике подключения ИК (одна венозная канюля, канюляция бедренной артерии).
Остановимся на некоторых особенностях проведения операции.
Восходящую часть аорты необходимо выделить до места отхождения плечеголовного ствола, чтобы обеспечить максимально большую площадь передней стенки аорты для последующего наложения проксимальных анастомозов с шунтами.
В качестве трансплантата для аортокоронарного шунтирования следует использовать большую подкожную вену бедра или вены голени.
Аутовену забирают из отдельных разрезов с небольшими кожными мостиками между ними (рис. 5.16). После обнажения в перивазальную клетчатку для предупреждения спазма сосуда вводят слабый раствор папаверина гидрохлорида.
Затем тщательно перевязывают все впадающие ветви на расстоянии 1 мм от стенки вены, чтобы не деформировать ее просвет. После полной мобилизации ствол вены пересека-
556
а—разрезы на голени для выделения вены; б—правильно наложенная лигатура на боковую ветвь вены; в — неправильно наложенная лигатура, суживающая просвет вены; г — неправильно ушитое отверстие в стенке вены, вызвавшее ее сужение; д — стандартная техника ушивания стенки вены при отрыве боковой ветви.
5.18. Метод подготовки дисталыюго конца анастомоза (а-д), которым служит проксимальный конец аутовены.
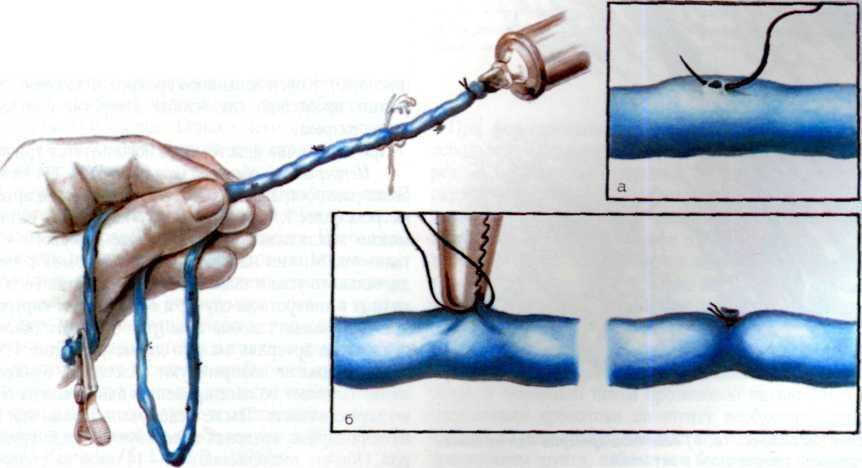
5.17. Подготовка аутовены для аортокоронарного шунтирования и выявление в ней дефектов, устраняемых путем наложения шва с использованием атравматической иглы (а). Внизу представлен метод, которым не рекомендуется пользоваться при устранении дефектов в стенке вены (б).
557
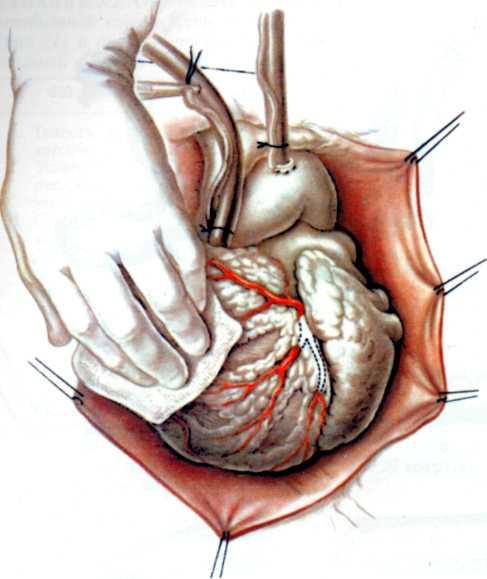
5.19. Доступ к венечным артериям, расположенным на задней поверхности сердца.

5.20. Этапы подготовки (а, б) венечной артерии для наложения дистального анастомоза с шунтом.
ют прокхимально и дистально. Изолированную вену промывают под давлением 120—150 мм рт. ст. охлажденной гепа-ринизированной кровью для выявления дефектов в ней и растяжения суженных участков (рис. 5.17). При наличии дефектов в стенке вены их ушивают атравматической нитью, причем стежки проводят в продольном направлении, чтобы не сузить просвет сосуда. Проксимальный конец вены, который будет служить дистальным концом аортокоронарного шунта, помечают (рис. 5.18).
И К осуществляют по обычному методу. Температуру тела больного снижают до 28—30 С, пережимают аорту, производят сочетанную фармакохолодовую кардиоплегию и дренируют левый желудочек.
При наложении анастомоза с передней межжелудочковой ветвью сердце «вывихивают» в рану путем подкладывания под его заднюю поверхность больших салфеток, смоченных холодным изотоническим раствором хлорида натрия. Обычно удается добиться того, чтобы все сердце находилось в холодном растворе, за исключением небольшого участка передней стенки, на котором выделяют артерию.
Доступ к венечным артериям, расположенным на задней поверхности сердца (рис. 5.19). На задней поверхности сердца расположены ветви огибающей артерии, а при правом типе венечного кровообращения — задняя межжелудочковая ветвь, отходящая от правой венечной артерии. Обычно имеется три крупные ветви огибающей артерии: ветвь тупого края, заднебоковая и задняя межжелудочковая ветвь. Для обеспечения доступа к этим ветвям сердце необходимо «вывихнуть» из полости перикарда так, чтобы верхушка его была обращена вправо и краниально. Удержать сердце в таком положении может ассистент рукой или специальной сеткой, свободные концы которой проводят позади нижней полой вены и через поперечный синус. Для облегчения манипуляций на задней поверхности сердца операционный стол слегка наклоняют в сторону хирурга.
Техника наложения дистальных анастомозов. Артерию выделяют в удобном для наложения анастомоза месте и обнажают ее переднюю стенку на протяжении 1,5 см. Артерию вскрывают коронарным скальпелем или бритвой, фиксированной в иглодержателе (бритводержате-ле). Разрез удлиняют до 6—10 мм в проксимальном и ди-стальном направлениях с помощью угловых ножниц (рис. 5.20). Конец вены косо срезают и заднюю стенку надсекают продольно так, чтобы отверстие соответствовало длине разреза.
При наложении анастомозов используется три вида швов.
Непрерывный обвивной шов (рис. 5.21). Он является наи более распространенным. Шов используют на артериях диа метром более 1,5 мм. Техника его наложения различна: шов можно накладывать с завязыванием первого узла и без такового. Можно начинать шить анастомоз с «пятки» или дистального угла в зависимости от удобства того или иного метода в конкретном случае и от привычек хирурга.
Отдельные узловые швы (рис. 5.22). Их обычно накла дывают на артериях малого диаметра (менее 1,5 мм). От дельные швы не деформируют анастомоз, однако их нало жение занимает больше времени и они не всегда обеспечива ют герметичность. Тем не менее узловые швы при операциях на коронарных артериях используют в ряде крупных цент ров. Обычно накладывают 12—14 швов на стенку артерии.
558
затем концами нитей прошивают соответствующие участки стенки вены. Вену прикладывают к артерии и узлы завязывают. Вколы иглы производят со стороны просвета сосуда как при прошивании артерии, так и при прошивании вены.
3. Комбинация узловых и непрерывного швов. При использовании этого метода узловые швы накладывают на наиболее «ответственную» часть анастомоза: обычно 2— 3 узловых шва на дистальный и проксимальный углы. По обеим полуокружностям накладывают непрерывный шов [Stiles Q., 1976].
При всех видах швов следует придерживаться общих хирургических принципов: 1) вкол иглы в артерию следует производить со стороны внутренней стенки сосуда, так как при обратном движении иглы может произойти отслоение склерозированной внутренней оболочки; 2) расстояние между стежками должно быть около 1 мм и стежки должны накладываться через равные промежутки; 3) глубина вкола иглы в стенку артерии зависит от диаметра сосуда и составляет обычно около 1,5 мм; 4) не следует создавать толстый «валик» из швов, так как это может привести к деформации анастомоза [Ochsner J., Mills N., 1978].
Большинство хирургов не выделяют коронарную артерию из эпикарда, за исключением участков передней стенки. При наложении швов ряд хирургов обязательно подхватывают эпикард (особенно при анастомозировании с ветвями левой коронарной артерии). Другие предпочитают прошивать только артериальную стенку.
При завязывании нитей непрерывного шва следует иметь в виду возможность эффекта «кисета». Для профилактики деформации анастомоза в результате этого эффекта рекомендуют завязывать узел на буже, выведенном в анастомоз через свободный конец аутовены. Проходимость анастомоза проверяют бужом, а герметичность—путем введения гепа-ринизированной крови. При наличии дефектов анастомоза накладывают дополнительные швы.
При наложении последнего дистального анастомоза начинают согревать больного. Отверстие, через которое вводят кардиоплегический раствор, используют для удаления воздуха из аорты и полостей сердца и для дренирования левых отделов. Только после тщательного проведения мер профилактики воздушной эмболии восстанавливают сердечную деятельность.
Наложение проксимальных анастомозов. Проксимальные анастомозы накладывают обычно на пристеночно отжатой восходящей части аорты при работающем или фибриллирующем сердце. Однако некоторые хирурги накладывают их до снятия зажима с восходящей части аорты на фоне кардиоплегии.
Проксимальные анастомозы с шунтами к системе левой коронарной артерии накладывают на левой полуокружности аорты, к правой—на правой ее полуокружности. Необходимо до наложения проксимального анастомоза точно оценить нужную длину шунта. Шунты к системе левой коронарной артерии должны отходить под прямым или даже тупым открытым книзу углом по отношению к продольной оси аорты и лежать на передней стенке легочного ствола. При слишком коротком шунте к системе огибающей артерии во избежание натяжения шунт можно провести через поперечный синус перикарда. В этом случае проксимальный анастомоз накладывают на правой полуокружности аорты, ближе к задней стенке [Grondin С, Limet R., 1976].
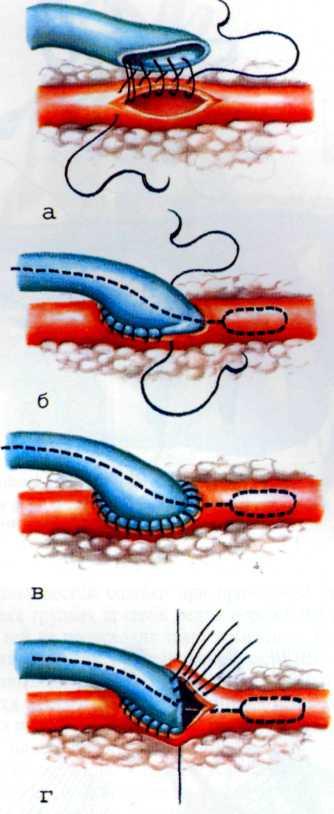
5.21. Различные модификации наложения анастомоза шунта С венечной артерией.
и. 6. в— непрерывный обвивной шов; г — комбинированный непрерывный и узловой шов. Отдельные узловые швы накладывают на диетальпый угол анаетомоза.
При формировании проксимального анастомоза можно использовать три вида отверстий в аорте: 1) линейный разрез; 2) треугольное отверстие; 3) отверстие овальной или округлой формы. Для создания отверстия пользуются обычными инструментами или специальным «выкусывателем». Наиболее удобно треугольное отверстие, острый конец которого должен быть обращен к задней стенке аорты. Необходимо следить, чтобы размеры аортального отверстия соответствовали срезу вены. При слишком большом отверстии в аорте вена может быть «втянута» в анастомоз, что ухудшает гемодинамические характеристики шунта.
Проксимальный анастомоз накладывают обычно непрерывным обвивным швом проленовой нитью 5/0. При восстановлении кровотока по шунту необходимо тщательно удалить из него воздух, что достигается либо ретроградным заполнением шунта, либо путем пункции его тонкой иглой.
559
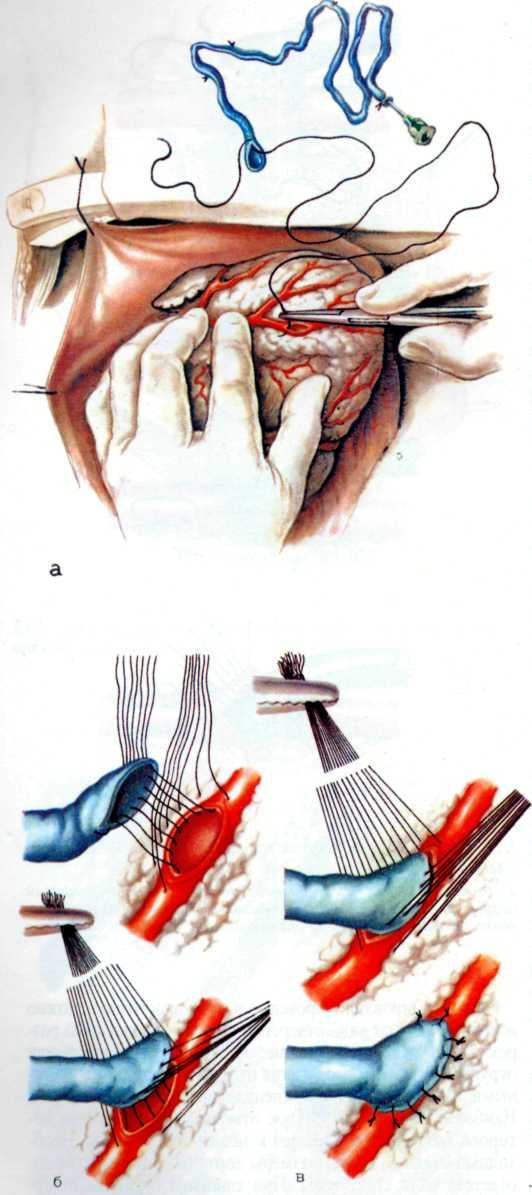
Интраопераиионная оценка эффективности наложенных аортокоронарных шунтов. Существует несколько методов интраоперационной оценки функции наложенного аортоко-ронарного шунта.
О функции шунта можно судить по результатам «сце живания» крови из него. Для этого пальцами левой руки шунт пережимают в проксимальном отделе, а пальцами правой руки кровь из него «сцеживают» в дистальном на правлении. Если кровь «сцеживается» свободно и выражен ного сопротивления не отмечается, это свидетельствует о проходимости дистального анастомоза и наличии удовле творительного периферического русла.
Изменения эпикардиальной электрограммы до и после шунтирования также позволяют дать оценку качества шун та. Исчезновение или уменьшение ишемических изменений в зоне шунтированной артерии после наложения шунта сви детельствует о хорошей его функции.
Наиболее точным методом, позволяющим судить о функциональном состоянии аоргокоронарного шунта, яв ляется интраоперационная флуометрия (электромагнитная или ультразвуковая). Обычно объемный кровоток по аорто- коронарному шунту составляет 50—130 мл/мин. При этом отмечено, что чем проксимальнее наложен шунт, тем боль ше кровоток.
Для оценки функции шунта и определения вероятности тромбоза его в послеоперационном периоде используют также функциональные тесты (пробы с реактивной гипере мией и с введением в шунт вазодилататоров).
При проведении пробы с реактивной гиперемией выполняют флоуметрию, затем шунт пережимают на 10—20 с; после снятия зажима вновь производят флоуметрию. Увеличение кровотока по шунту после временной окклюзии его свидетельствует о наличии хорошего дистального русла и высокой вероятности того, что шунт будет проходим в отдаленном периоде.
Установлено, что прямое введение папаверина гидрохлорида в аортокоронарный шунт может приводить к увеличению объемного кровотока в 1 '/а—2 раза и что степень увеличения этого кровотока коррелирует с частотой проходимости шунта в отдаленном послеоперационном периоде [Grondin С. et al., 1971 ].
Технические варианты аорюкоронарною шунтирования.
Ряд авторов предложили технические модификации аорто-коронарного шунтирования. Некоторые из этих модификаций приобрели принципиальное значение.
«Прыгающий» шунт (skip graft, jamped graft). Использу ют при поражениях одной коронарной артерии на двух уровнях. Посредством венозного трансплантата обходят верхнее сужение анастомозом бок в бок между веной и ар терией, а более дистально расположенное сужение — тем же трансплантатом с анастомозом конец в бок.
«Змеевидный», «мостовидный», или секвенциальный, шунт, или шунт с последовательными анастомозами (snake graft, bridge graft). Применен в 1970 г. Th. Bartley. J. Bigelow. Идея операции заключается в том, что посредством одного венозного трансплантата осуществляют рсваскуляризацию сразу нескольких коронарных артерий. При этом наклады вают последовательные анастомозы бок в бок между транс плантатом и реваскуляризусмыми коронарными артериями и один дистальный анатомоз конец в бок (рис. 5.23). Приме нение этой техники сыграло принципиальную роль при опе рациях множественного аортокоронарного шунтирования, поскольку резко возросла скорость объемного кровотока по такому шунту с множественными боковыми анастомозами. Это в свою очередь привело к улучшению отдаленных ре-
560
зультатов и повышению проходимости шунтов. Было показано, что секвенциальные шунты имеют более высокую проходимость по сравнению с обычными отдельными шунтами— 87% против 80% за 5-летний период наблюдения [Grondin С. etal., I978].
Секвенциальное шунтирование имеет и другие преимущества: уменьшается время операции за счет наложения только одного проксимальною анастомоза, сокращается и суммарное время наложения анастомозов (пережатия восходящей части аорты), поскольку анастомозы бок в бок накладывают быстрее, чем анастомозы конец в бок.
Вместе с тем возникают и технические сложности, связанные с необходимостью правильного подбора длины трансплантата между анастомозами и с возможностью перекрутя шунта. Чтобы избежать этих осложнений, целесообразно маркировать переднюю стенку трансплантата, а также тщательно определять расстояние между анастомозами.
Принципиально важно, накладывая «змеевидный» шунт, выполнять конечный анастомоз шунта с наиболее крупной венечной артерией.
Th. Bartlcy и соавт. (1972) сообщают о применении так называемого циркулярного шунта, снабжающего кровью одновременно все пораженные коронарные артерии; однако целесообразнее накладывать полуциркулярные шунты, каждый из которых снабжает кровью 2—3 артерии.
Наиболее частым вариантом секвенциального шунтирования является реваекуляризация одним трансплантатом передней межжелудочковой и диагональной ветвей, ветвей системы огибающей артерии (ветви тупого края и задней межжелудочковой ветви), правой венечной артерии и задней межжелудочковой ветви от левой венечной артерии. Ди-стальные анастомозы обычно накладывают с передней .межжелудочковой и правой коронарной артериями. Циркулярные шунты окружают сердце в направлении справа налево, первый анастомоз накладывают с правой венечной артерией, последующие—с ветвями огибающей артерии и ди-стальный — с передней межжедулочковой ветвью.
Шунт \-образный, ветвистый fY-graft, branched graft). Этот тип шунтов может быть использован, в частности, при значительном истончении стенки восходящей части аорты или при небольшой площади аорты и большом количестве реваскуляризуемых сосудов. Было показано, что Y-образ- ные шунты чаще тромбируются в отдаленном периоде, чем обычные одиночные шунты, хотя высказывались и проти воположные мнения.
«Подковообразный» шунт с одним аортальным анасто мозом и двумя коленами, идущими к венечным артериям. Наложение такого шунта возможно лишь в том случае, если одно из колен венозного трансплантата не содержит клапа нов или они разрушены.
Маммарно-коронариый анастомоз. В. И. Колесов впервые применил маммарно-коронарный анастомоз в клинической практике в 1964 г. Первый больной, оперированный в Ленинграде, хорошо себя чувствовал после операции в течение нескольких лет [Колесов В. И.. 1977].
В настоящее время применение маммарно-коронарного анастомоза для реваскуляризации миокарда является общепринятым методом, однако он имеет положительные и отрицательные стороны.
Преимущества метода: а) большее соответствие диаметров внутренней грудной и коронарной артерии; б) анастомоз накладывают между однородными артериальными тканями; в) вследствие небольшого диаметра внутренней грудной артерии объемный кровоток по ней меньше, чем по аутовенозному шунту, но линейная скорость кровотока больше, что теоретически должно снизить частоту тромбозов; г) нужно накладывать только один анастомоз, поэтому отпадает необходимость наложения проксимального анастомоза, что сокращает время операции и уменьшает ве-
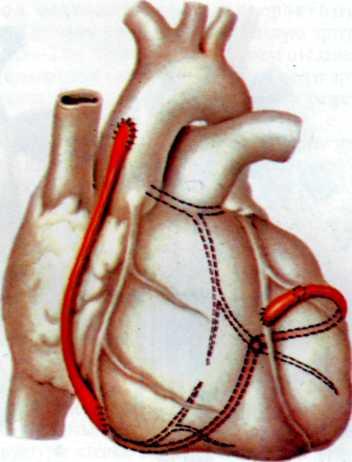
5.23. Змеевидный (мааповиднып. секвенциальный) шунт.
Использован один шунт для наложения анастомозов четырьмя венечными артериями.
роятность технической ошибки при проведении операции; д) внутренняя грудная артерия редко поражается атеросклерозом; в ней не происходит таких изменений, как субин-тимальная гиперплазия, которая весьма часто наблюдается в аутовенозных шунтах; е) в аутовенозных шунтах часто наблюдаются флебит и тромбоз при развитии у больного перикардита и медиастинита, тогда как внутренняя грудная артерия не подвергается таким изменениям. Существуют определенные ограничения к применению маммарно-коронарного анастомоза: а) если диаметр правой внутренней грудной артерии значительно меньше, чем правой коронарной артерии, а диаметр левой внутренней грудной артерии меньше, чем передней межжелудочковой ветви левой коронарной артерии; б) имеются только две внутренние грудные артерии, что ограничивает возможность реваскуляризации нескольких артерий; в) выделение внутренней грудной артерии является более сложной процедурой, чем забор аутове-ны. производящийся одновременно с торакотомией. Технически наложение анастомоза внутренней грудной артерии с венечной артерией более сложно, чем аутовены с венечной артерией из-за меньшего диаметра и тонкой стенки внутренней грудной артерии [Mills N.. 1984].
В настоящее время разработаны следующие методы наложения маммарно-коронарного анастомоза: 1) антеградный; 2) ретроградный; 3) использование внутренней грудной артерии в качестве «прыгающего» шунта.
Оперативная техника на. ю.жения маммарно-коронарного анастомоза (рис. 5.24). После срединной стернотомии выделяют внутреннюю грудную артерию от уровня шестого или пятого межреберья. почти до места ее отхождения от подключичной артерии. 1де диаметр артерии нередко составляет 2—2.5 мм. Не следует выделять артерию непосредственно до устья, так как в дальнейшем она может перегнуться у места отхождения. Артерию выделяют вместе с венами и подкожной клетчаткой. Боковые ветви перевязывают.
567
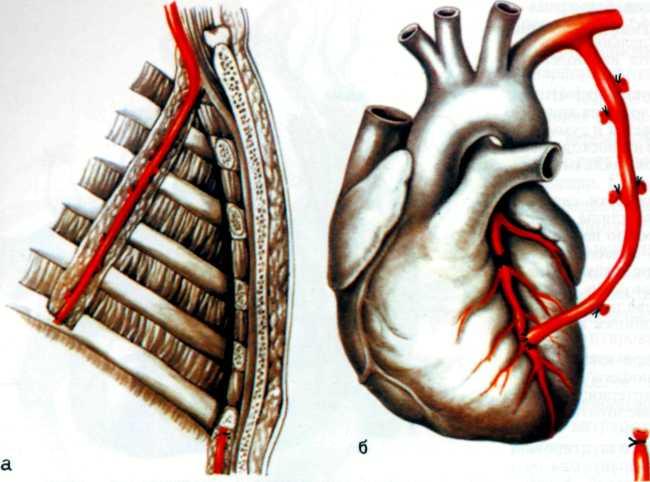
С целью облегчения выделения артерии R. Favaloro предложил специальный ретрактор.
Во избежание развития спазма внутренней грудной артерии ее пережимают у места отхождения. в пересеченный дистальный конец вводят слабый раствор папаверина гидрохлорида. Затем измеряют путем кровопускания свободный кровоток по внутренней грудной артерии, отмечая время. Он должен составлять не менее 100—120 мл/мин для обеспечения проходимости анастомоза [Mills N.. Вагпсг Н.. 1984].
До начала ИК необходимо определить, соответствует ли длина трансплантата месту наложения анастомоза.
Левую внутреннюю грудную артерию используют для наложения анастомоза с левой венечной артерией, а правую— для реваскуляризации правой венечной артерии. Однако нередко правую внутреннюю грудную артерию, используют для реваскуляризации передней межжелудочковой артерии, тогда как левую анастомозируют с огибающей артерией [Jahnke E. et al., 1976].
Анастомозируемый конец внутренней грудной артерии на протяжении 1,5—2 см освобождают от окружающих тканей и наружной оболочки. Венечную артерию вскрывают по передней стенке продольно на 4—8 мм. Анастомоз накладывают отдельными узловыми швами или непрерывным швом. Большинство авторов накладывают несколько узловых швов по углам анастомоза и затем сшивают полуокружности анастомозирующих сосудов непрерывным швом. Рекомендуется фиксировать внутреннюю грудную артерию за окружающие ее ткани к эпикарду для предупреждения перегиба артерии и натяжения анастомоза [Suzuki A., 1973].
При окклюзии коронарной артерии маммарно-коронар-ный анастомоз может быть наложен конец в конец с коронарной артерией, благодаря чему при пересечении венечной артерии значительно облегчается выполнение операции на работающем сердце. Этот метод рекомендует В. И. Колосов.
Ретроградный маммарно-коронарный анастомоз (рис. 5.25). В ряде случаев при мобилизации внутренней грудной артерии выявляется, что на уровне пятого— шестого межреберья диаметр ее слишком мал и она непригодна для анастомозирования с коронарной артерией. В этих случаях можно использовать метод ретроградного маммарно-коронарного анастомоза. Мобилизованную ар-
терию пересекают у места ее отхождения от подключичной артерии, где диаметр ее составляет 2—2.5 мм. Дистальный конец анастомозируют с коронарной артерией по методу конец в бок или конец в конец.
Ретроградный кровоток по внутренней грудной артерии значительно ниже антеградного. однако при полной окклюзии коронарной артерии он может быть вполне достаточным для перфузии ишемизированного миокарда.
В. И. Колесов (1977) считает, что лучше наложить достаточно широкий ретроградный, чем слишком узкий антеград-ный. маммарно-коронарный анастомоз.
Маммарно-коронарный анастомоз по типу «прыгающего» шунта. В последнее время внутреннюю грудную артерию используют не только для шунтирования одной коронарной артерии, но и в качестве секвенциальных шунтов для двух коронарных артерий. В этих случаях чаше всего одной внутренней грудной артерией шунтируют переднюю межжелудочковую и диагональную ветви или две ветви огибающей артерии [Kabbani S., 1983; McBridge L, 1983].
Противопоказания к на.южению маммарно-коронарного анастомоза: 1) поражение начального отдела подключичной артерии; 2) снижение артериального давления на руке; 3) выраженная эмфизема легких, затрудняющая выделение внутренней грудной артерии.
В ряде случаев, для того чтобы выработать обоснованные показания к применению внутренней грудной артерии для реваскуляризации миокарда и избежать опасности осложнений, целесообразно сделать ангиографию подключичной артерии.
В заключение следует сказать, что специальные показания к применению маммарно-коронарного анастомоза имеются у больных с ранее произведенной флебэктомией. с выраженным варикозным расширением вен. при повторных операциях реваскуляризации миокарда, при тромбозе ранее наложенных коронарных шунтов.
Широко распространены комбинированные процедуры.
562
когда множественная реваскуляризапия миокарда осуществляется у одного больного посредством как аутовенозного шунта, так и маммарно-коронарного анастомоза.
Эндартерэктомия из венечных артерий. Впервые коронарная эндартерэктомия была произведена в клинике Бейли в 1956 г. [BayleyС.etа!.. 1957].
Механическая эндартерэктомия сопровождалась частыми осложнениями и высоким процентом летальности.
В связи с этим эндартерэктомию как самостоятельную операцию перестали использовать, ее выполняют лишь в сочетании с аортокоронарным шунтированием.
С целью более полного очищения сосуда от атеросклеро-тического слепка В. Sobel в 1966 г. предложил метод газовой эндартерэктомии.
На коронарных артериях газовая эндартерэктомия была впервые выполнена в клинике P. Sawyer в 1967 г. В нашей стране газовая эндартерэктомия впервые была произведена в ИССХ им. А. Н. Бакулева АМН СССР в 1977 г. Показания к плановой эндартерэктомии но ангиографическим критериям: 1) полная окклюзия сосуда с контрастированием его дистальных отделов через коллатерали; 2) окклюзия сосуда с резко измененными дистальными отделами из-заатеросклеротических бляшек; 3) диффузные изменения с резким сужением просвета до концевых отделов сосуда.
Кроме плановой эндартерэктомии. необходимость в этом вмешательстве может возникнуть во время операции после интраоперационной оценки сосуда и в тех неожиданных ситуациях, которые возникают после того, как сделана ар-териотомия.
Такого рода незапланированная эндартерэктомия может потребоваться вследствие: а) недооценки ангиографических изменений; б) при расслоении стенки коронарной артерии или отслоении бляшек в области артериотомии: в) при обнаружении резких изменений дистального русла сосуда.
Наиболее частым объектом применения механической и газовой эндартерэктомии является поражение правой коронарной артерии. Более редко эндартерэктомию выполняют на ветвях левой коронарной артерии. В некоторых центрах одновременно выполняют эндартерэктомию из всех пораженных артерий [KeonW.S.etal., 1975:CheanvechaiL,1985].
Метод механической эндартерэктомии. После выделения артерии производят продольную артериотомию длиной 1,5—2 см. Циркулярно шпателем отслаивают внутренний измененный слой сосуда по ходу всего артериотом-ного разреза. Далее у проксимальной части разреза отсекают отслоенную интиму.
В дистальном направлении этот цилиндр отслаивают шпателем или петлей, одновременно потягивая на себя утолщенную внутреннюю оболочку. После удаления слепка его тщательно осматривают, если обнаруживается обрыв внутренней оболочки у дистального конца, необходимо продлить аргериотомический разрез до участка обрыва, затем,очистив дистальное русло, на всем его протяжении пришивают аутовенозный трансплантат.
В ряде случаев длина такого анастомоза может составить 5—6 см. Для очищения дистального русла от обрывков интимы предложены специальные щеточки.
Метод газовой венечной эндартерэктомии. Обоснованием для применения газовой эндартерэктомиипослужили работы, посвященные изучению физико-химической структуры стенки коронарной артерии при ее атеросклерозе. Эта стенка представлена несколькими слоями с достаточно свободной матрицей, состоящей на 66% из свободного пространства. Углекислый газ при введении в толщу стенки сосуда легко продвигается по ходу свободного пространства, отслаивая пораженную часть сосуда, и далеепрорывается в просвет артерии. Молекулы углекислого газа не вызывают отечности тканей, не вызывают эмболии, так как углекислый газ быстро растворяется в крови.
Разработанная техника включает следующие этапы: экспозиция коронарной артерии и введение газа под наружную оболочку сосуда путем нескольких проколов иглой. Через иглу углекислый газ под давлением 300—400 мм рт. ст. со скоростью 15—20 л/мин, попадая между слоями пораженной артерии, отслаивает наружную оболочку сосуда и проходит в дистальном направлении. Затем рассекают наружный слой сосуда продольным разрезом и в образовавшуюся щель между слоями артерии вводят шпатель для подачи углекислого газа. Шпатель проводят дистально. непосредственно под артериотомическим разрезом. Артерию берут на турникет и пережимают ее вместе со шпателем. Благодаря затянутому турникету газ не уходит наружу, а распростра-
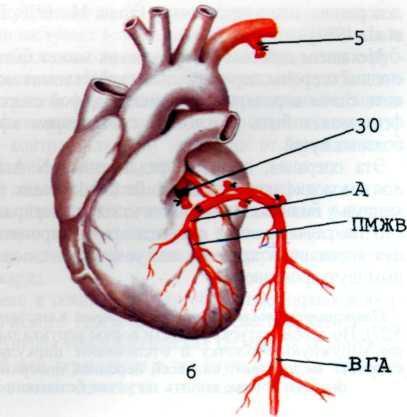
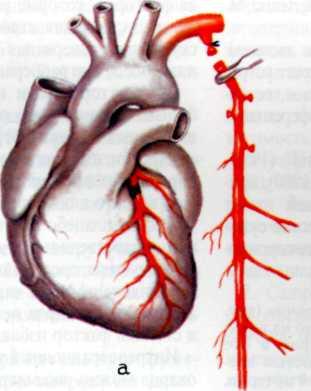
а—пересечение внутренней грудной артерии (В ГА) у места от-хождения от подключичной артерии; 6— сформирован ретроградный маммарно-коронарный анастомоз с передней межжелудочковой ветвью (ПМЖВ) левой венечной артерии; ЗО — юна окклюзии; А — анастомоз.
563
5.26. Удаленный из венечной артерии атеросклеротичеекий слепок после газовой эндартерэктомии.
нястся дистально и отслаивает внутренние слои до того места, где заканчивается атеросклеротически измененный участок сосуда. Необходимо через шпатель 2—3 раза ввести газ по передней и задней стенкам сосуда, после этого шпатель удаляют. Если извлечь слепок не удается, повторяют введение углекислого газа.
О правильно выполненной эндартерэктомии свидетельствует наличие конических, сходящих на нет концов слепка и его ветвей (рис. 5.26). При газовой эндартерэктомии длина удаленных слепков может составлять 6—10 см, тогда как при механической эндартерэктомии она значительно меньше.
Периаортальная нейрэктомия, или плексэктомия, в сочетании с аортокоронарным шунтированием. Для лечения больных ИБС, у которых доминируют проявления спазма коронарных артерий в сочетании со стенозирующим атеросклерозом, в течение ряда лет применяется периаортальная денервация, или плексэктомия [Vrana M.. 1976; Bertrand M. etal., 1980].
Механизм действия этой операции может быть двояким: с одной стороны, периаортальная нейрэктомия может устранить спазм коронарной артерии, с другой стороны, ее эффект может быть обусловлен пересечением афферентных болевых путей.
Эта операция, впервые предложенная N. Arnulf (1958), а затем модифицированная М. Bertrand и соавт. (1980). применима у больных с вазоспастической стенокардией.
В тех случаях, когда имеются атеросклеротические сужения коронарных артерий, она сочетается с аортокоронарным шунтированием.
Оперативная техники периаортальной плексэктомии (рис. 5.27). По левой полуокружности аорты вертикально надсекают наружную оболочку и отслаивают циркулярно в обе стороны. Ее удаляют над всей передней поверхностью восходящей части аорты, вплоть до устья безымянной артерии.
При угом пересекают все правые сердечные нервы. Для удаления ветвей сплетения, расположенных между аортой и легочной артерией, продольным разрезом надсекают наружную оболочку над передней стенкой легочного ствола и удаляют ее вместе с клетчаткой как можно дальше по направлению к задней стенке легочного ствола. До выполнения периаортальной плексэктомии в условиях ИК по описанному методу накладывают дистальные анастомозы ауто-венозных трансплантатов с коронарными артериями, а после окончания нейрэктомии— проксимальные анастомозы шунтов с аортой [Cooley D., 1984]. Для выполнения проксимальных анастомозов в связи с обширным удалением наружной оболочки возникает опасность прорезывания стенки аорты, поэтому целесообразно на восходящей части аорты оставить островки адвентициальной ткани, в области которых и накладывают анастомозы.
Отдаленные результаты операции аортокоронарного шунтирования. Оценка отдаленных результатов аортокоронарного шунтирования и роль этой операции в лечении ИБС были предметом многочисленных исследований. В этих исследованиях проведено сравнение лекарственного и хирургического лечения больных в рандомизированных и нерандомизированных группах. При оценке операции аортокоронарного шунтирования наиболее важными факторами являются: 1) влияние операции на стенокардию, ЭКГ и толерантность к физической нагрузке; 2) влияние операции на сократительную функцию миокарда и гемодинамику в условиях покоя и нагрузки; 3) предупреждение инфаркта миокарда путем операции; 4) увеличение продолжительности жизни и улучшение ее качества; 5) функция аортокоронар-ных шунтов в послеоперационном периоде.
Влияние аортокоронарного шунтирования на стенокардию. Результаты большинства исследований показали, что уменьшение приступов или полное исчезновение стенокардии наблюдается у 75—95% оперированных больных. По данным F. Loop и соавт. (1981). обобщивших наибольший опыт хирургического лечения ИБС в одной клинике, у 87% больных после операции исчезли приступы стенокардии. Стабильность клинического улучшения больных после операции связана с двумя факторами: проходимостью шунтов и полнотой реваскуляризации.
Несмотря на очевидные доказательства того, что аортоко-ронарное шунтирование устраняет стенокардию благодаря улучшению перфузии миокарда, были высказаны критические суждения о механизмах воздействия операции. В качестве факторов, которые рассматривали как возможные механизмы устранения стенокардии, были изучены, 1) перива-скулярная денервация коронарных артерий; 2) эффект плацебо; 3) интраоперационный инфаркт миокарда.
Эти факторы были изучены в связи с тем, что у ряда больных, несмотря на окклюзию шунтов, сохранялся положительный эффект операции. При последовательном рассмотрении этих факторов было установлено, что денервация коронарных артерий в процессе операции не оказывает существенного влияния на клинические результаты.
Эффект плацебо был получен у ряда коронарных больных при лекарственном лечении. Однако он был непродолжительным и на протяжении 6 мес полностью исчезал. Поэтому влияние эффекта «плацебо» при хирургической реваскуляризации миокарда нельзя рассматривать как длительный и стойкий фактор избавления от стенокардии.
Интраоперационный и послеоперационный инфаркты миокарда можно рассматривать как возможный механизм из-
564
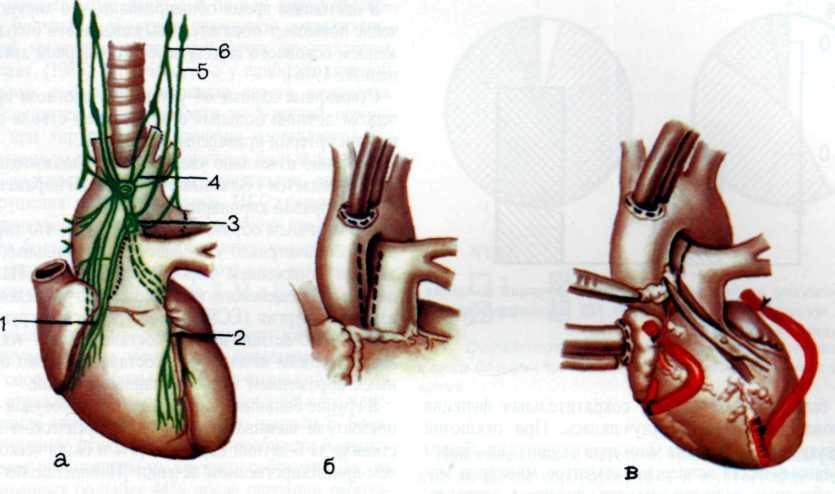
томии.
а—схема иннервации сердца; б— на передней поверхности
аорты и легочном стволе удаляют сердечные сплетения
(п.кксэктомия); в — на.южение анастомозов.
1—правые сердечные нервы; 2 — левые сердечные нервы: 3 —
поверхностные сердечные сплетения; 4 — глубокое сердечное
сплетение; 5 — блуждающий нерв; 6 — верхний шейный узел.
бавления от стенокардии. Однако необходимо иметь в виду, что частота интраоперационных и послеоперационных инфарктов миокарда составляет 4—6%, тогда как «избавление» от стенокардии наступает в 95% случаев. Рецидив стенокардии у оперированных больных составляет 3,5% в год и, по имеющимся данным, тесно связан с двумя факторами: 1) сужением или закрытием шунта; 2) ирогрес-сированием атеросклероза как в шунтированных, так и в не-шунтированных артериях или с сочетанием этих факторов [RoskammH. etal., 1984].
Основным механизмом, вызывающим устранение стенокардии или значительное уменьшение ее тяжести, является улучшение перфузии миокарда. Об этом свидетельствуют исследования перфузии миокарда с 201 Т1 в условиях покоя и нагрузки [Pitt В. et al., 1983].
Улучшение состояния оперированных больных имеет высокую корреляцию с изменением ЭКГ во время нагрузочных тестов. Сравнение результатов дооперационной и послеоперационной велоэргометрии показало, что у 80% больных увеличивается толерантность к физической нагрузке [Amsterdam Е., 1980].
Выявлена прямая корреляция между нагрузочными тестами и проходимостью шунтов. При окклюзии шунтов толерантность к физической нагрузке снижается; во время пробы наблюдаются ишемические изменения ЭКГ и возникает боль.
Влияние операции на сократительную функцию миокарда. Изучение фракции выброса как интег-
рального показателя общей систолической функции левого желудочка является наиболее распространенным методом оценки влияния аортокоронарного шунтирования на сократительную функцию миокарда [Hammermeister К„ 1983]. При рассмотрении имеющихся в настоящее время данных следует выделить несколько групп больных: 1) больные с нормальной функцией миокарда до операции; 2) больные со сниженной функцией миокарда вследствие его ишемиче-ской дисфункции и рубцовых изменений; 3) больные с сердечной недостаточностью.
В группе больных с ишемической дисфункцией миокарда отмечается улучшение показателей сердечного и ударного индексов, снижается конечное диастолическое давление в левом желудочке и повышается фракция выброса (рис. 5.28).
У 53% больных с сердечной недостаточностью смешанного генеза (диффузные рубцовые изменения в сочетании с ишемической дисфункцией) отмечается увеличение фракции выброса после аортокоронарного шунтирования. Таким образом, улучшение сократительной функции миокарда после операции наступает в том случае, если исходное снижение фракции выброса связано с ишемией миокарда, а не с руб-цовым поражением. Изучение контрактильной функции миокарда в условиях физической нагрузки не выявило определенных закономерностей, но была установлена четкая зависимость контрактильности миокарда от проходимости шунтов [Hammermeister К., 1983].
Изучение сегментарной контрактильности до и после операции было проведено с помощью различных методов, включая левую вентрикулографию, подшивание рентгено-контрастных или ультразвуковых маркеров в различных зонах миокарда.
L. Campeau и соавт. показали, что сегментарная асинергия ишемического генеза исчезает после операции в 73% случаев. Функция гипокинетических сегментов остается неизмененной или ухудшается в тех случаях, когда кровоток по шунту к этим сегментам составляет 40 мл/мин. Если
565
5.28. Графическое изображение изменения фракции изгнания из левого желудочка до (1) и после (2) аортокоронарного шунтирования (в процентах).
кровоток был выше 60 мл/мин, сократительная функция ишемизированных сегментов улучшалась. При окклюзии шунтов сегментарная функция миокарда ухудшалась. Таким образом, динамическая асинергия сегментов миокарда может быть обратима, если эти сегменты содержат достаточное количество сохранного миокарда и кровоток по шунтуобеспечивает нормальную перфузию этого миокарда.
Отсутствие эффекта от реваскуляризации связано с: 1) увеличением рубцовой ткани в зоне реваскуляризации; 2) низким кровотоком по шунту; 3) окклюзией шунта; 4) перенесенным инфарктом миокарда в этой области.
Предупреждение инфаркта миокарда. Известно, что при стабильной стенокардии у 8% больных ежегодно возникает инфаркт миокарда. Частота инфаркта миокарда после аортокоронарного шунтирования в сроки до 5 лет составила менее 1 % в год. Послеоперационный инфаркт, как правило, возникал в первый год после операции [SprayТ..1977; Kouchoukos К, 1980].
Развитие инфаркта миокарда в послеоперационном периоде связано в первую очередь с проходимостью шунтов. В многочисленных исследованиях было показано, что у большинства больных тромбоз или закрытие шунта происходит в течение первого года после операции. Фатальные инфаркты миокарда в послеоперационном периоде составляют 1,7% в год. Таким образом, операция аортокоронарного шунтирования является профилактической процедурой, снижающей риск развития острого инфаркта миокарда и особенно фатального инфаркта. Поздние инфаркты миокарда после операции аортокоронарного шунтирования с летальным исходом наблюдаются с частотой менее 1% в год за 5-летний период наблюдения.
Продолжительность жизни и улучшение ее качества. Наиболее дискуссионным вопросом в литературе последних лет оказался вопрос о том, увеличивает ли операция аортокоронарного шунтирования продолжительность жизни.
Основное внимание было направлено на решение именно этого вопроса. Как уже было отмечено, решающим критерием эффективности операции стала не столько ее роль в устранении стенокардии, что уже доказано, сколько оценка того, в каких группах больных хирургическое лечение может увеличить продолжительность жизни по сравнению с лекарственной терапией.
В настоящее время общепризнано, что хирургическое лечение повышает показатели выживаемости больных с поражением основного ствола левой коронарной артерии [Ober-manA., 1976].
Суммарные данные об улучшении прогноза при хирургическом лечении больных с поражением ствола левой коронарной артерии приведены в табл. 5.3.
Особенно отчетливо увеличение продолжительности жизни наблюдается у больных с сочетанным поражением ствола левой и правой коронарных артерий.
Аналогичным образом было доказано, что хирургическое лечение значительно улучшает прогноз больных с трехсосу-дистым поражением коронарных артерий. Например, по данным Европейского кооперативного исследования коронарной хирургии (ECSS), в хирургической группе выживаемость за 5-летний период составила 96%, тогда как при лекарственном лечении она составила только 60% у больных с поражением трех коронарных артерий.
В группе больных с поражением двух сосудов отдаленные показатели выживаемости при хирургическом лечении составили за 6-летний период 94,6% и были несколько выше, чем при лекарственном лечении [Hammermeister К., 1983].
Таблица 5.3. Выживаемость больных с поражением основного ствола левой венечной артерии при хирургическом (I) и лекарственном (II) лечении

При лечении одного сосуда хирургическое лечение дает отличные результаты, так как послеоперационная летальность равна нулю, однако отдаленные показатели при лекарственном лечении близки к результатам хирургического лечения [Hammermeister К., 1983; Spampinato N. et al., 1984].
Увеличение продолжительности жизни при многососудистом поражении тесно связано с полнотой реваскуляризации. При полной или, что более точно, удовлетворительной реваскуляризации показатель выживаемости в течение 6 лет наблюдения составил 94% с годовой летальностью 0,8%, тогда как при неполной реваскуляризации этот показатель в течение 6 лет составил 88,4% при годовой летальности 1,4% [HammermeisterК., 1983].
Следующим фактором, влияющим на продолжительность жизни при хирургической реваскуляризации, является нарушение контрактильной функции миокарда.
При нормальной исходной контрактильной функции левого желудочка отдаленные показатели выживаемости после операции составляют 92%, а при сниженной контрактильной функции—78% и менее [Kouchoukos N., 1980].
566
Особенно убедительные данные в пользу хирургического лечения у больных с обратимо сниженной сократительной функцией миокарда левого желудочка представлены J. Pigott и соавт. (1985). Отмечено, что у наиболее тяжелой группы больных с фракцией изгнания левого желудочка около 25% показатель выживаемости за 7-летний период наблюдения при хирургическом лечении составляет 64%, а при лекарственном лечении аналогичных больных—36%.
Наиболее прогностически неблагоприятными являются тяжелые нарушения ритма у больных ИБС, главным образом желудочковая экстрасистолия высокой градации по Лауну. У этих больных хирургическое лечение способствует повышению процента выживаемости почти в 2 раза по сравнению с лекарственным [Фитилева Л. М., Бадалян Е. А., 1984].
Наряду с увеличением продолжительности жизни аорто-коронарное шунтирование обеспечивает повышенную функциональную способность больного. В значительной степени это находит отражение в изменении функционального класса больных после операции (рис. 5.29). По данным F. Spenser (1971), улучшение функциональной способности больных сопровождается повышением их трудоспособности. Так, из 1117 оперированных больных 44% после операции работают полный рабочий день, 6% имеют ограниченный рабочий день, 30% больных ушли на пенсию еще до операции и не работают после операции.
Улучшение состояния больных и отказ от лекарственного лечения влияют на социальное положение больных, снижают частоту повторных госпитализаций на 25% [Hamilton A. etal., 1983].
В какой степени аортокоронарное шунтирование способствует возврату больных к работе, точно определить в настоящее время еще трудно. Данные, имеющиеся на этот счет, представлены в табл. 5.4.
Таблица 5.4. Возвращение к трудовой деятельности больных ИБС после аортокоронарного шунтирования
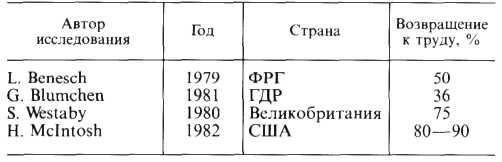
Функция аортокоронарных шунтов в послеоперационном периоде. Длительная функция аортокоронарного шунта является основным фактором, определяющим эффективность операции.
Для оценки функции шунта используют инвазивные и не-инвазивные методы. К числу неинвазивных методов, позволяющих косвенно судить о функции шунта, относятся нагрузочные пробы. Велоэргометрия, выполненная до и после операции, дает возможность оценить перфузию различных зон миокарда, на основании чего можно предположительно судить о наличии функционирующего шунта. К неинвазив-ным методам оценки функции шунта относится также сцин-гиграфия в условиях физической нагрузки, допплерография, компьютерная томография [Albrechtsson U. et al., 1981].
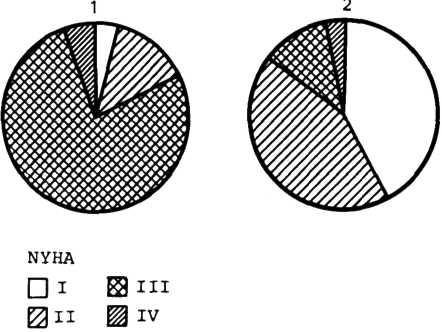
5.29. Графическое изображение изменений функционального класса больных по NYHA после аортокоронарного шунтирования.
Наиболее точным методом, контролирующим работу шунта, являются коронарография и шунтография в послеоперационном периоде.
В. С. Работников и соавт. (1985), В. Bulkley (1980) показали, что в сроки от 6 до 12 мес основной причиной закрытия шунта являются технические ошибки,^допущенные во время операции. В большинстве случаев шунты закрываются в течение первых 6—12 мес после операции вследствие тромбоза. В последующем причинами закрытия шунта могут быть: а) фиброзная пролиферация внутренней оболочки; б) про-грессирование атеросклероза в сосуде дистальнее шунта; в) атеросклеротические изменения в самом шунте [Bulkley В., 1980].
Выявлена взаимосвязь между частотой окклюзии шунта и объемным кровотоком по шунту, измеренным во время операции. В шунтах, по которым кровоток составлял 30 мл/мин и менее, быстро возникает тромбоз.
КЛАССИФИКАЦИЯ ПРИЧИН ТРОМБОЗА АОРТОКОРОНАРНЫХ ШУНТОВ
/. Технические ошибки.
Повреждение стенки трансплантата при заборе и об работке.
Сужение или ушивание анастомоза.
Чрезмерная длина трансплантата и перегиб шунта.
Перекрут шунта по оси.
Натяжение шунта из-за его недостаточной длины.
Деформация трансплантата при перевязке боковых ветвей.
Сужение просвета артерии обрывками внутренней оболочки после эндартерэктомии.
Неправильный выбор места наложения дистального анастомоза.
2. Анатомические факторы.
Малый диаметр артерии.
Выраженный стенозирующий атеросклероз артерии на всем ее протяжении.
Крупноочаговый постинфарктный кардиосклероз.
Аневризма или острый инфаркт миокарда в бассейне шунтированной артерии.
Несоответствие диаметров просвета трансплантата и вены.
Аномалия клапанного аппарата венозного трансплан тата.
567
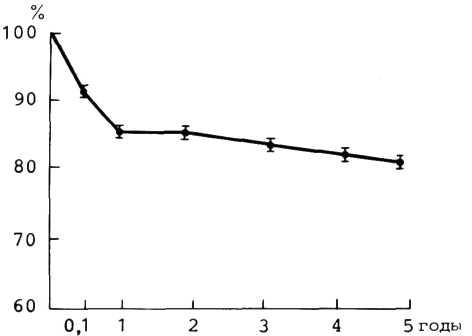
5.30. Графическое изображение проходимости аортокоронар-ных шунтов в отдаленные сроки после операции, по данным шунтографии [Tyras J. et al., 1979].
По оси абсцисс — годы после операции; по оси ординат — проходимость шунтов в процентах по отношению к общему количеству наложенных шунтов.
3. Общие факторы.
Нестабильность общей гемодинамики.
Низкая объемная скорость кровотока по шунту.
Перифлебит и флебит аутовенозного трансплантата вследствие медиастинита или перикардита.
Массивные сращения в полости перикарда.
Гиперкоагуляция крови.
За последнее десятилетие отдаленные показатели проходимости шунтов значительно улучшились в результате совершенствования техники наложения анастомозов. Для передней межжелудочковой ветви проходимость аортокоро-нарных шунтов составляет 92%, правой коронарной артерии— 80%, проходимость шунтов к системе огибающей артерии составляет 70% в течение года наблюдения [Сат-peau L. et al., 1978]. Суммарные данные о проходимости шунтов к 5 годам после операции составляют 80% (рис. 5.30).
Отмечена лучшая проходимость маммарно-коронарных анастомозов в серии длительных наблюдений—95% [Lid-die Н. et al., 1984; Lytle В. et al., 1985].
Проходимость секвенциальных шунтов по сравнению с отдельными шунтами к каждой коронарной артерии также оказалась хорошей [Grondin С. et al., 1978].
Поскольку закрытие шунта в поздние сроки обусловлено фиброзной пролиферацией внутренней оболочки, то можно предположить, что усовершенствование техники забора и подготовки шунта, уменьшение травмы будут способствовать сохранению его функции более длительное время.
Для предупреждения тромбоза шунта в послеоперационном периоде целесообразно назначать гепарин, однако, как показали исследования ряда авторов, дипиридамол, ацетилсалициловая кислота или другие антиагреганты уже в первые сутки после операции снижают частоту окклюзии шунтов в течение первых 4 мес [Chesebro J. et al., 1982].
Изменения в коронарных артериях после аортокоронарного шунтирования. После включения кровотока по шунту в коронарных артериях наблюдается два типа изменений: 1) прогрессирование атероскле-
ротического процесса в шунтированных артериях; 2) регресс атеросклеротических изменений в шунтированных сосудах.
Второй тип изменений наблюдается в сосудах после эн-дартерэктомии, сохранивших проходимость в отдаленном периоде наблюдения за больными. В шунтированных сосудах прогрессирование атеросклероза наблюдается чаще в проксимальных отделах по отношению к шунту и реже в области самого анастомоза и дистальнее его.
Как показали R. Palac и соавт. (1981), развитие атеросклероза дистальнее шунта за 5 лет не так значительно, как в проксимальных по отношению к шунту отделах артерии. В тех случаях, когда атеросклеротический процесс дистальнее аностомоза быстро прогрессирует, наступает рецидив стенокардии и может потребоваться повторная операция [CampeauL et al., 1979].
5.2. НЕСТАБИЛЬНАЯ СТЕНОКАРДИЯ
В настоящее время нет общепринятого определения понятия «нестабильная стенокардия». Между тем с каждым годом растет количество публикаций о больных с острыми расстройствами коронарного кровообращения, которых известный кардиолог С. Conti (1977) объединил в группу больных с нестабильной стенокардией.
Ранее в отношении больных с этим синдромом использовали самые разные определения, в том числе такие, как «прединфарктная стенокардия», «угрожающий инфаркт миокарда», «промежуточный синдром», «острая коронарная недостаточность» и т. д.
Нестабильная стенокардия—это временное клиническое состояние, заключающееся в появлении приступов стенокардии у лиц, не страдавших ранее ИБС, или же ухудшении их состояния с предшествующей стабильной стенокардией. Ранний возраст приступов стенокардии у больных с острым инфарктом миокарда также следует рассматривать как нестабильное состояние. Нестабильная стенокардия может завершиться полным выздоровлением больного, переходом в стабильную стенокардию, развитием острого инфаркта миокарда и внезапной смертью от острой коронарной недостаточности.
Патогенез нестабильной стенокардии до настоящего времени является предметом интенсивных споров и разногласий, что объясняется отсутствием четких, присущих только этому синдрому патогномоничных признаков. Доказано, что анатомической основой нестабильной стенокардии, как и стабильной, является стенозирующий атеросклероз венечных артерий сердца, который, по данным разных авторов, наблюдается при этом синдроме в 90—95% случаев [Adelman E. et al., 1981; Balakumar К. et al., 1981]. Однако характер и тяжесть поражения коронарных сосудов у больных с нестабильной и стабильной стенокардией могут быть идентичными. При нестабильной стенокардии могут быть множественные тяжелые поражения практически всех основных венечных артерий, но у некоторых больных существенных изменений коронарных сосудов не наблюдается. По нашим данным, основанным на наблюдении более чем 400 больных с нестабильной стенокардией, у 6% венечные сосуды не были поражены атеросклерозом, у 25% было поражение одной венечной артерии сердца, у 37%—двух сосудов и у 32%—трех венечных сосудов и более. У 7—10% больных при нестабильной стенокардии наблюдалось поражение ствола левой коронарной артерии. Частота и степень поражения отдельных венечных артерий при нестабильной стено-
568
[ кардии примерно такие же, как и при других формах хрони-
ческой ИБС.
Таким образом, в настоящее время нет оснований говорить о каких-либо характерных особенностях поражения коронарных сосудов при этом синдроме. Правда, некоторые авторы считают, что у больных с нестабильной стенокардией поражение венечных артерий локализуется проксималь-нее, а площадь стенозирующего атеросклеротического поражения значительно превышает таковую у больных со стабильной стенокардией [Roberts W. et al., 1981]. Другие авторы важную роль в патогенезе нестабильной стенокардии отводят функциональной неполноценности компенсаторного коллатерального кровообращения в ответ на прогрессирующий стенозирующий атеросклеротический процесс [Blumgart H. et al., 1973]. Существенное значение в патогенезе нестабильной стенокардии имеет также спазм венечных артерий. Подтверждением сказанному может служить исследование A. Maseri и соавт. (1982), которые показали, что спонтанные приступы стенокардии, весьма характерные для нестабильной стенокардии, часто не обусловлены повышением «метаболических запросов» миокарда, превышающих возможности коронарного резерва; кроме того, порой эти приступы возникают у больных без ангиографически видимых поражений коронарных артерий. В этих случаях причиной приступа стенокардии, по мнению авторов, может быть спазм венечных артерий, который изменяет потребность миокарда в кислороде и возможность доставки крови к мышце сердца. Спазм венечных артерий может возникать как в значительно пораженных коронарных сосудах, так и в нормальных.
Таким образом, можно считать, что в основе развития нестабильной стенокардии важную роль играют те же факторы, что и при хронической ИБС, а именно: 1) стенозирующий атеросклероз коронарных артерий; 2) спазм венечных сосудов сердца; 3) отсутствие или функциональная неполноценность компенсаторного коллатерального кровообращения в ответ на стенозирующий атеросклеротический процесс в коронарных артериях.
Классификация. В настоящее время нет общепринятой классификации нестабильной стенокардии. Это в значительной степени усложняет интерпретацию данных разных авторов, посвященных этому синдрому. Из множества предложенных классификаций наибольшее распространение получили классификации Паркера (1976) и Конти (1977), включающие следующие формы: 1) впервые или вновь возникшая стенокардия; 2) стенокардия напряжения с тенденцией к прогрессированию заболевания (crescendo); 3) стенокардия покоя; 4) постинфарктная стенокардия.
Наиболее целесообразным является выделение тех форм нестабильной стенокардии, которые в значительной степени различаются между собой по клиническому течению и прогнозу, но схожи тем, что у всех имеется обострение ИБС. Руководствуясь этим положением, мы выделяем три формы нестабильной стенокардии: 1) впервые или вновь возникшая стенокардия, т. е. появление признаков стенокардии с тенденцией к прогрессированию у больных без предшествующего анамнеза стенокардии или длительного ее отсутствия; 2) прогрессирующая стенокардия, т, е. значительное ухудшение клинического состояния больных ИБС (учащение приступов стенокардии, изменения их характера и ответа на прием нитроглицерина); 3) постинфарктная стенокардия, т. е. возобновление приступов стенокардии в ближайшие дни или недели после острого инфаркта миокарда.
Постановка диагноза нестабильной стенокардии, по мнению большинства авторов, является правомерным в течение первых двух месяцев после появления вышеназванных признаков.
Клиника. В клинике нестабильной стенокардии, как
и обычной стабильной стенокардии, основным является болевой синдром. Меняются лишь интенсивность и характер его, так же как и реакция на коронароактивные препараты. Как правило, при нестабильной стенокардии наблюдаются тяжелые приступы стенокардии напряжения и покоя, особенно у лиц с хронической ИБС. Они могут носить нарастающий характер по интенсивности, частоте и длительности с расширением областей иррадиации боли. Коронароактивные препараты не всегда оказывают купирующее действие, в то время как до обострения они были эффективными в большинстве случаев. Некоторые авторы указывают на волнообразный характер болевого синдрома, т. е. приступ стенокардии с кратковременными (2—5 мин) ослаблениями боли продолжается l'/г—2 ч.
При нестабильной стенокардии наблюдаются приступы стенокардии напряжения и покоя, кроме того, характерно расширение зоны иррадиации боли. Для больных с впервые возникшей стенокардией характерны интенсивность, упорство и длительность приступов с первых дней.
У многих больных непосредственной причиной, провоцирующей нестабильную стенокардию, является нервно-психическое или физическое перенапряжение. Нередко возникновению нестабильной стенокардии способствуют обострения сопутствующих заболеваний (грипп, ангина, респираторные заболевания и др.). Большое значение в возникновении продромальных состояний имеет внезапное и резкое увеличение физической или умственной нагрузки.
Диагностика. При постановке диагноза следует помнить, что нестабильная стенокардия—это исключительно клинический синдром без каких-либо четких патогномоничных лабораторно-инструментальных признаков. Следовательно, именно клиническое состояние больных должно определять диагноз нестабильной стенокардии, все остальные методы диагностики должны играть лишь дополняющую роль.
При установлении диагноза нестабильной стенокардии важное значение имеет тщательно собранный анамнез. Целенаправленный опрос больного позволяет в большинстве случаев не только поставить диагноз нестабильной стенокардии, но и определить ее тип. Важное значение в диагностике имеет изучение продолжительности приступа стенокардии. Если обычный приступ стенокардии, как правило, длится недолго и проходит сразу же после приема нитроглицерина, то при нестабильной стенокардии часто имеет место длительный и порой не купирующийся нитроглицерином приступ [Conti С. et al., 1973]. При нестабильной стенокардии меняются также характер и частота приступов стенокардии.
Электрокардиографическая диагностика при нестабильной стенокардии позволяет у большей части больных выявить усугубление признаков гипоксии миокарда, появление новых участков ишемии, нередко нарушения ритма. Однако у части больных отсутствуют изменения на ЭКГ в покое, и признаки гипоксии миокарда могут появляться лишь при приступах или фармакологических пробах. Метод суточного мониторирования ЭКГ может оказать существенную помощь в диагностике нестабильной стенокардии и оценке тяжести клинического состояния больного. Он позволяет регистрировать частоту и выраженность смещения сегмента ST от электрической изолинии, т. е. помогает выявлять транзиторные электрокардиографические признаки гипоксии миокарда, регистрировать нарушения ритма и проводи-
569
мости, оценить их выраженность и характер. Метод также важен для оценки результатов лечения нестабильной стенокардии.
Вопрос об электокардиографическом исследовании с использованием фармакологических и нагрузочных проб в диагностике нестабильной стенокардии является спорным. Некоторые авторы используют велоэргометрию при нестабильной стенокардии для выявления электрокардиографических признаков гипоксии миокарда и изучения резервных возможностей коронарного кровообращения, а эргоновино-вую пробу—для изучения роли спазма сосудов в этиологии приступов стенокардии. Однако к указанным выше исследованиям не следует прибегать в тех случаях, когда диагноз нестабильной стенокардии не вызывает сомнений. Их можно рекомендовать лишь для дифференциальной диагностики.
Применение радионуклидной томографии сердца с использованием Т1 и вращающейся гамма-камеры увеличивает разрешающую способность сцинтиграфии миокарда в выявлении дефектов перфузии при нестабильной стенокардии. Методы радионуклидной диагностики необходимы также для проведения дифференциальной диагностики между нестабильной стенокардией и острым инфарктом миокарда. Использование для этих целей 99m Tc-Sn позволяет диагностировать свежие очаговые повреждения миокарда [Bala-kumar К. et al, 1981]. Радионуклидная вентрикулография позволяет оценить функциональное состояние левого желудочка путем изучения фракции выброса левого желудочка.
Эхокардиография позволяет оценить сократительную функцию левого желудочка при нестабильной стенокардии, а также транзиторные нарушения регионарной сократимости миокарда, которые могут сопровождать приступ стенокардии.
Биохимические исследования позволяют выявлять повышенную активность ряда ферментов в крови, в частности креатинфосфокиназы, лактатдегидрогеназы и их изофермен-тов, что свидетельствует о необратимых изменениях в миокарде. Следовательно, эти исследования необходимы для проведения дифференциального диагноза между нестабильной стенокардией и острым инфарктом миокарда. Следует помнить, что для выявления повышенной активности ферментов однократных исследований крови недостаточно, и лишь серийные анализы являются адекватными для точной диагностики повреждения миокарда. Они выявляют повышение активности ферментов на 19% чаще, чем однократные заборы крови.
Ангиография венечных артерий сердца и левая вентрикулография при нестабильной стенокардии преследуют цель— изучение степени и характера поражения венечного русла, изучение функционального состояния коронарного кровообращения и левого желудочка. У части больных, которая, по мнению авторов, составляет 5—10% [Hecht H. et al., 1982], отсутствует ангиографическая картина поражения коронарных артерий. В таких случаях для уточнения патогенетических механизмов стенокардии целесообразно выполнять ангиографию в сочетании с эргоновиновой пробой. В результате этого исследования можно доказать наличие спазма венечных артерий и его роль в возникновении гипоксии миокарда и приступов стенокардии. Спазм венечных артерий у больных с нестабильной стенокардией может возникать как в пораженных, так и в здоровых участках коро-
нарных артерий [Kronzon J. et al., 1982]. Оценка данных ангиографии при нестабильной стенокардии производится таким же образом, как и при других формах ИБС.
Левая вентрикулография при нестабильной стенокардии позволяет оценить как общую, так и регионарную сократительную функцию миокарда левого желудочка. С целью определения нарушений кинетики стенок левого желудочка следует широко использовать данные левой вентрикулогра-фии до и после назначения нитроглицерина и других коро-нароактивных препаратов. Исчезновение или значительное уменьшение асинергии стенок левого желудочка после приема нитроглицерина может указывать на обратимый гипок-сический характер повреждения функции миокарда.
Показания к коронарографии и левой вентрикулографии при нестабильной стенокардии те же, что и при хронических формах ИБС. Остается лишь спорным вопрос о сроках выполнения исследования после возникновения синдрома. Учитывая, что примерно у 80% больных с нестабильной стенокардией удается при консервативной терапии стабилизировать состояние, целесообразно дождаться относительной стабилизации состояния и лишь после этого выполнить ангиографию венечных артерий и левую вентрикулографию. Однако в тех случаях, когда, несмотря на проводимую интенсивную лекарственную терапию, состояние больного не улучшается или же быстро ухудшается, целесообразно сделать ургентную коронарографию и левую вентрикулографию, не дожидаясь стабилизации процесса. Исследования необходимо выполнять при полной готовности к проведению экстренной операции аортокоронарного шунтирования. При тяжелых затяжных приступах стенокардии с нарушением внутрисердечной гемодинамики и функциональной способности левого желудочка коронарографию и левую вентрикулографию целесообразно сочетать с внутриаортальной контрпульсацией.
Современные принципы лекарственной терапии нестабильной стенокардии. При выборе тактики лечения больных с нестабильной стенокардией надо учитывать ряд факторов, среди которых наиболее важными являются возраст, пол, общее состояние больных, сопутствующие заболевания, функциональное и органическое состояние левого желудочка и коронарного кровообращения. Все это приобрело особо важное значение с тех пор, как получили широкое распространение коронарная хирургия, транслюминальная ангиопластика коронарных артерий, внутриаортальная контрпульсация и др. Это поставило кардиологов перед сложной задачей выбора наиболее адекватного метода лечения в каждом отдельном случае на самых ранних этапах заболевания. Сам факт выделения синдрома нестабильной стенокардии из общей нозологии больных ИБС был продиктован необходимостью особо интенсивного наблюдения и лечения этих больных. Существует множество схем лечения больных с нестабильной стенокардией. В ИССХ им. А. Н. Бакулева АМН СССР разработана определенная тактика лечебно-диагностических мероприятий при нестабильной стенокардии (схема 5.1).
Как видно из этой схемы, больных с диагнозом нестабильной стенокардии следует госпитализировать в палаты интенсивной терапии, где проводят тщательное электрокардиографическое, биохимическое и гемодинамическое наблюдение и подбор оптимальной терапии. Лекарственная терапия должна начинаться с пролонгированных нитратов и препа-
570
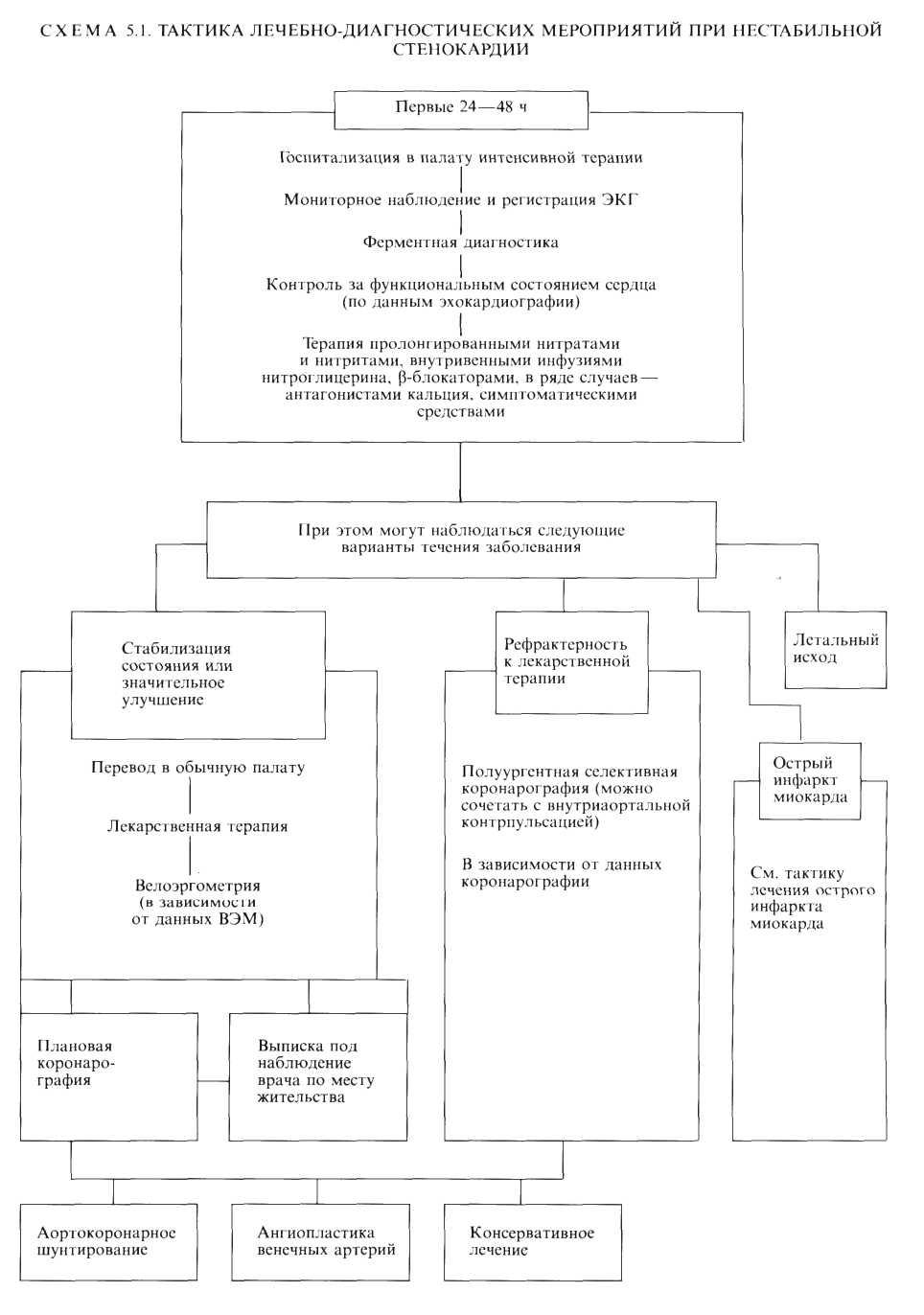
577
ратов, блокирующих В-адренергические рецепторы (при этом следует помнить, что нежелательно допускать уреже-ние пульса ниже 50 в минуту, снижение артериального давления у нормотоников ниже 100 мм рт. ст., а у больных с артериальной гипертонией—ниже чем на 20—30 мм рт. ст. от исходного). При подозрении на наличие у больного спастического компонента венечных артерий к проводимой терапии следует добавить антагонисты кальция. В случае отсутствия желаемого эффекта при пероральной терапии к проводимой терапии следует добавить внутривенную ин-фузию нитроглицерина начиная с 4 мг/ч. При инфузии этого препарата в тех или иных дозах в большинстве случаев прекращаются приступы стенокардии.
При лечении нестабильной стенокардии таблетированны-ми нитратами, блокаторами В-адренергических рецепторов удается достичь стабилизации состояния у 45% больных, а при добавлении к терапии внутривенных вливаний нитроглицерина и антагонистов кальция число таких больных увеличивается до 80%. После улучшения состояния больных терапевтическая тактика такая же, как и при стабильной стенокардии.
Примерно у 20% больных с нестабильной стенокардией, несмотря на проводимую интенсивную лекарственную терапию, не удается достичь стабилизации состояния. В этих случаях целесообразно использовать такие инвазивные методы, как внутриаортальная контрпульсация, ангиопластика венечных артерий и т. д.
Использование внутриаортальной контрпульсации при нестабильной стенокардии позволяет улучшить перфузию коронарных артерий и снизить постнагрузку на сердце [Nichols A. etal., 1975; Adelman E. et al., 1981]. Примерно у 65% больных с нестабильной стенокардией, рефрактерной к лекарственной терапии, удается добиться положительных результатов при использовании внутриаортальной контрпульсации. Однако эффект внутриаортальной контрпульсации в большинстве случаев нестойкий и прекращается после завершения процедуры. В связи с этим целесообразно использовать ее как промежуточный этап лечения перед аортокоронарным шунтированием. Внутриаортральная контрпульсация рекомендуется в тех случаях, когда больные не переносят те или иные необходимые для лечения стенокардии препараты [Adelman E. et al., 1981 ].
Если перечисленные выше мероприятия не приводят к желаемому результату и у больных прогрессивно ухудшается состояние, то необходимо сделать коронарографию для решения вопроса о возможности выполнения аортокоронар-ного шунтирования, а также транслюминальной ангиопластики венечных артерий. По мнению R. Mayer и соавт. (1982), при нестабильной стенокардии чаще, чем при стабильной стенокардии, имеются условия для успешного выполнения ангиопластики венечных артерий, так как при этом синдроме, особенно при впервые возникшей форме, атеро-склеротический процесс начал развиваться сравнительно недавно и имеется меньшая вероятность кальциноза и ригидности бляшки. По мнению этих авторов, транслюминальная ангиопластика венечных артерий при нестабильной стенокардии в 83% случаев дает положительный эффект с хорошими отдаленными результатами. Однако в ряде случаев при этой лечебной процедуре могут наблюдаться такие серьезные осложнения, как острая коронарная недостаточность, острый инфаркт миокарда и т. д. В связи с этим ангио-
пластику венечных артерий рекомендуется выполнять в тех центрах, где имеются все условия для ургентных операций аортокоронарного шунтирования [Maseri A., 1981].
Прогноз при консервативном лечении нестабильной стенокардии. При лекарственной терапии удается достичь относительной или полной стабилизации у 70—80% больных с нестабильной стенокардией в период стационарного лечения. У 7—38% больных, несмотря на интенсивную лекарственную терапию, не удается стабилизировать состояние и у них развивается острый инфаркт миокарда [Norman J. et al., 1976; Adelman E. et al., 1981 ]. В период стационарного лечения также наблюдается высокий процент летальности (7— 46%). У больных с нестабильной стенокардией острый инфаркт миокарда в течение первого года развивается у 32% больных, наступает смерть у 14%. В дальнейшем судьба больных с нестабильной стенокардией существенно такая же, как и у больных с другими формами хронической ИБС.
Транслюминальная баллонная ангиопластика венечных артерий при нестабильной стенокардии. Известно, что анатомической основой нестабильной стенокардии, так же как и других форм ИБС, в подавляющем большинстве случаев является стенозирующе-окклюзирующий атеросклероз по меньшей мере одной венечной артерии сердца. Следовательно, селективная коронарография и в случае необходимости эндоваскулярные процедуры, направленные на реваскуляри-зацию миокарда, должны быть включены в список диагностических и лечебных процедур, проводимых у большинства этих больных при отсутствии четких противопоказаний. Следует отметить, что 50% всех эндоваскулярных процедур, осуществляемых при ИБС, выполняют у пациентов с нестабильной стенокардией. Хотя у значительной части этих больных ТБАВА проходит успешно и без осложнений, частота тяжелых осложнений при выполнении процедуры, а также после нее у них более высокая, чем у пациентов со стабильной стенокардией [Myler R. et al., 1990; Rupprecht H. et al., 1990]. Это во многом обусловлено состоянием венечного русла при нестабильной стенокардии и особенно возможным наличием в венечной артерии неокклюзирующего тромба, так же как и выраженной предрасположенностью артериального русла к спастическим реакциям. Некоторые авторы указывают также на наличие при нестабильной стенокардии изъязвленных бляшек, нарушенного фибринолиза, оголения эндотелия, локальной травмы сосуда, что, безусловно, влияет на прогноз при нестабильной стенокардии вообще и ТБАВА в частности [Bengston J., Wilson J., 1994]. Основываясь на приведенных выше данных, исследователи пришли к выводу, что ТБАВА при нестабильной стенокардии следует выполнять после максимальной стабилизации состояния и коррекции реологических свойств крови.
В НЦССХ им. А. Н. Бакулева РАМН с 1991 по 1994 г. ТБАВА была проведена 76 больным с нестабильной стенокардией. Показанием к выполнению процедуры служили: а) приступы стенокардии покоя и/или напряжения и результаты лабораторных исследований, свидетельствовавшие о транзиторных нарушениях васкуляризации миокарда в покое и при стрессовых ситуациях; б) относительная рефрак-терность к медикаментозной терапии; в) поражение по меньшей мере одной венечной артерии сердца. У большинства больных с нестабильной стенокардией процедура была выполнена после медикаментозной стабилизации состояния. Это является одним из важных условий, полученных при
572
разработке показаний. Лишь у 5 (6,8%) больных ТБАВА была произведена на фоне нестабильного состояния и продолжающихся приступов стенокардии. При выполнении процедуры у них развилась острая коронарная недостаточность в связи с острой окклюзией дилатируемого сосуда, в результате чего 1 больной умер. Еще 2 больных были оперированы с хорошим исходом, а 2 отказались от операции и у них развился ОИМ: один из этих больных умер во время лечения в стационаре. На возможность развития осложнений при выполнении ТБАВА на фоне нестабильного состояния указывают и другие исследователи. Частота ан-гиографических и ишемических осложнений при выполнении ТБАВА у больных с нестабильным состоянием была соответственно 36 и 25%, тогда как в случаях проведения процедуры после его стабилизации эти показатели составили соответственно 8 и 0% [Torre S. et al., 1992]. Достоверно чаще осложнения наблюдались у больных, которым ТБАВА выполняли в пределах 48 ч после возникновения нестабильности состояния, чем у тех, кому она была произведена в более поздние сроки [Myler R. et al., 1990].
Техника ТБАВА. Процедуру выполняли по обычной методике. Медикаментозная терапия, которую проводили после процедуры, включала в себя внутривенную капельную инфузию гепарина из расчета 24000 ЕД в 1-е сутки (с последующим переходом на 100 мг аспирина в сутки) и введение курантила (дипиридамол) в дозе 75 мг/сут (в течение первых 3 мес).
Непосредственный эффект ТБАВА у больных с нестабильной стенокардией, по данным большинства авторов, превышал 90%, и этот показатель с каждым годом растет по мере внедрения в клиническую практику новых технологий и улучшения техники самой процедуры. ОИМ наблюдали у 0,9—4,2% больных. Частота ургентных операций прямой реваскуляризации миокарда колебалась от 1,8 до 3,6%. Летальность составила примерно 1,2%. Тяжелые осложнения чаще возникают у больных с нестабильной стенокардией, чем у находящихся в стабильном состоянии [Mangin E. et al., 1992]. У большинства (78,3%) больных с нестабильной стенокардией после ТБАВА приступы стенокардии отсутствовали. У остальных стенокардия сохранялась, но приступы возникали значительно реже. Подавляющее большинство (90,9%) больных, у которых сохранялись приступы стенокардии, составляли те, кому по тем или иным причинам была произведена неполная реваскуляризация миокарда. Велоэр-гометрическая проба, проведенная у 65 больных перед выпиской из стационара, у 55 (84,1%) была отрицательной. Пороговая мощность нагрузки составила в среднем 104,6+20,6 Вт. Десяти (15,9%) больным, у которых велоэр-гометрическая проба была положительной, произведена неполная реваскуляризация миокарда. На целесообразность выполнения полной реваскуляризации миокарда при ТБАВА у больных с нестабильной стенокардией указывают и другие авторы [Sharrna В. et al., 1988; Berger P. et al., 1992]. Отмечена тенденция к увеличению общей ФВ ЛЖ после ТБАВА в среднем с 52,0 до 58,4+3,6%.
Рестеноз дилатированной артерии чаше наблюдали у больных, которым ТБАВА была выполнена в состоянии нестабильности (60%). В группе пациентов, которым ТБАВА была произведена после стабилизации состояния, этот показатель равнялся 21%. Отдаленные (в среднем 23,6+4,4 мес) результаты удалось изучить у 61 больного. За этот
период 1 больной умер от сердечной недостаточности и еще 1 — от рака желудка. Общая летальность составила 3,3%, частота летальных исходов от заболевания сердца—1,6%. Еще 1 (1,6%) больной перенес нефатальный ОИМ. Приступы стенокардии отсутствовали у 36 (61,1%) больных. Вело-эргометрическая проба была выполнена у 54 больных, из них у 38 (70,3%) она была отрицательной. Пороговая мощность нагрузки составила в среднем 99,5+6,8 Вт. Контрольную коронароангиографию выполняли при условии сохранения приступов стенокардии. Из 20 обследованных больных у 13 (65%) отмечен рестеноз дилатированной артерии, еще у 4 (20%) наблюдали прогрессирование стенозирующего атеросклеротического процесса в нативной венечной артерии. У 3 (15%) больных эффект ТБАВА сохранялся, у них также не наблюдалось прогрессирования стенозирующего процесса и в других венечных артериях. ФВ ЛЖ составила в среднем 59,8+4,5%.
Данные литературы, так же как и собственные наблюдения, позволяют считать, что у больных с нестабильной стенокардией выполнение ТБАВА до относительной медикаментозной стабилизации состояния часто приводит к тяжелым осложнениям (острая окклюзия дилатируемого сосуда, ОИМ) и смертельному исходу. Это объясняется, по всей вероятности, повышенной склонностью больных с нестабильной стенокардией к спастическим реакциям венечных сосудов и их гипертонусом. Не исключено, также, что у этих больных имеется склонность к повышению свертываемости и вязкости крови. Следовательно, одним из важных условий эффективности ТБАВА у больных с нестабильной стенокардией является максимальная медикаментозная стабилизация их состояния перед выполнением процедуры. Лекарственная терапия должна включать в себя широкое использование антагонистов кальция, пролонгированных нитратов и дезаг-регантов. Только после получения клинико-лабораторных данных, свидетельствующих о стабилизации состояния больных, можно выполнять ТБАВА. В тех редких случаях, когда с помощью медикаментозной терапии не удается достичь стабилизации состояния, процедуру ТБАВА можно выполнить при наличии готовой операционной и хирургической бригады.
Хирургическое лечение нестабильной стенокардии. Поскольку нестабильная стенокардия представляет собой переходную форму между стабильной стенокардией и острым инфарктом миокарда, применение аортокоронарного шунтирования, направленного на улучшение кровообращения миокарда, должно улучшить прогноз. Однако на протяжении 15 лет с момента выполнения первой реваскуляризации миокарда при нестабильной стенокардии [Hall D., 1970] вопрос о необходимости хирургического лечения и показаниях к операции остается дискутабельным. Это обусловлено рядом факторов.
Прежде всего следует указать, что в ранний период развития хирургического лечения нестабильной стенокардии большинство операций выполнялось в ургентном порядке на фоне резко нарушенного коронарного кровообращения и тяжелой ишемии миокарда, что приводило к частому развитию послеоперационных инфарктов и смерти—10— 20% [Conti С. et al., 1973].
Усовершенствование методов лекарственной терапии значительно улучшило прогноз при консервативном лечении, в связи с чем операции у большинства больных стали про-
573
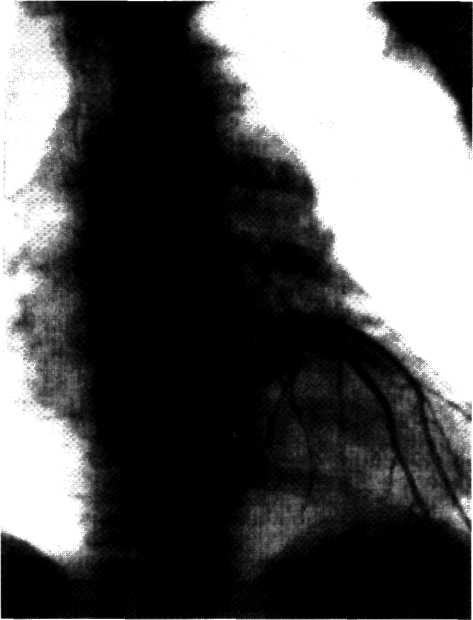
5.31. Коронарограмма больного с резким стенозом ствола левой венечной артерии.
Виден стеноз более 75% в проксимальной трети левой коронарной артерии.
водить после относительной стабилизации коронарного кровообращения, т. е. в «холодном» периоде. При этом некоторые авторы рекомендуют выписывать больных из стационара после стабилизации их состояния на фоне лекарственной терапии и оперировать лишь в том случае, если стенокардия рецидивирует [Braunwald E., 1984].
Необходимо также отметить, что группа больных с нестабильной стенокардией неоднородна и состоит из лиц с различными клиническими формами заболевания (впервые возникшая стенокардия, прогрессирующая стенокардия, постинфарктная нестабильная стенокардия) и неодинаковыми изменениями в коронарных артериях, что и определяет различный прогноз при лекарственном и хирургическом лечении.
В связи с наличием перечисленных выше факторов, затрудняющих анализ результатов хирургического и лекарственного лечения нестабильной стенокардии, возникла необходимость в выделении групп больных с плохим прогнозом при консервативном лечении для выполнения у них реваску-ляризации миокарда.
Показания и выбор срока хирургического вмешательства. Показания к хирургическому лечению при нестабильной стенокардии и выбор срока операции определяют такие факторы, как 1) эффективность лекарственной терапии и 2) тяжесть поражения коронарных сосудов.
Оба фактора в известной мере взаимосвязаны, так как именно тяжесть поражения коронарных артерий в значи-
тельной части случаев определяет тяжесть клинического течения нестабильной стенокардии и резистентность ее к консервативной терапии.
У большинства больных с нестабильной стенокардией на фоне оптимальной лекарственной терапии удается добиться стабилизации состояния и прекращения болей. Однако часть больных остается резистентной к проводимому лечению и в этих случаях может возникнуть необходимость в применении внутриаортальной баллонной контрпульсации, которая в большинстве случаев купирует болевой синдром. Применение контрпульсации для стабилизации состояния больного обусловливает в свою очередь необходимость экстренной коронарографии для решения вопроса об операции, так как у таких больных после прекращения контрпульсации возникает рецидив болей. Если у такого больного выявлено операбельное поражение коронарных артерий, то необходима экстренная реваскуляризация миокарда.
В других случаях на фоне максимальной лекарственной терапии удается добиться лишь частичной стабилизации состояния: сохраняется значительное количество болевых приступов, на ЭКГ часто отмечаются признаки острой ишемии миокарда. Таким больным показаны коронарография сразу же после относительной стабилизации состояния и при наличии операбельного поражения коронарных артерий срочная реваскуляризация миокарда.
Еще одну группу больных представляют собой больные, у которых на фоне лекарственной терапии удается добиться стабилизации состояния и прекращения болей. Таким больным показано коронарографическое исследование в течение 1—2 нед после поступления в стационар. При операбельном поражении коронарных сосудов можно сделать операцию в плановом порядке.
В период ремиссии процесса и исчезновения симптомов больных можно выписать из стационара и оперировать при рецидиве стенокардии.
Характер поражения коронарных артерий у больных с нестабильной стенокардией имеет большое значение для прогноза.
Наиболее тяжелую группу представляют собой больные с нестабильной стенокардией, у которых выявлено гемо-динамически значимое (более 50%) поражение основного ствола левой коронарной артерии. Это является показанием к немедленной операции независимо от типа нестабильной стенокардии как в период нестабильного состояния, так и после стабилизации процесса на фоне лекарственной терапии.
Более того, задержка с операцией у больного с нестабильной стенокардией и поражением основного ствола левой коронарной артерии может привести к гибели больного [Cohn P., Braunwald E., 1984].
Указанные факты можно проиллюстрировать клиническим примером.
Больной М., 48 лет, поступил в институт с приступом сильных впервые возникших загрудинных болей, не купирующихся нитроглицерином. На ЭКГ выявлены признаки ишемии в области всей переднебоковой стенки левого желудочка. Диагноз: нестабильная стенокардия. На фоне максимальной лекарственной терапии, включавшей внутривенное капельное введение нитроглицерина, прием R-блокато-ров и антагонистов кальция, состояние больного стабилизировалось, болевой приступ был купирован. На 4-е сутки после поступления выполнены селективная коронаро-
574
графия и левая вентрикулография (рис. 5.31). Выявлен стеноз более 75% основного ствола левой коронарной артерии с удовлетворительной сократительной функцией левого желудочка (фракция выброса 52%).
В связи с тем что состояние больного было стабильным, операция отложена на следующий день. Ночью у больного возник приступ интенсивных загрудинных болей, не купирующийся лекарственными средствами, обнаружена выраженная ишемия переднебоковой стенки на ЭКГ, а затем фибрилляция желудочков сердца. Реанимационные мероприятия не были эффективными.
Больной Г., 65 лет, поступил в институт с клинической картиной нестабильной стенокардии. На фоне интенсивной лекарственной терапии болевой синдром удалось купировать и больному была сделана срочная коронарография (на следующие сутки после поступления), выявившая резкое поражение основного ствола левой коронарной артерии и критический стеноз правой коронарной артерии (рис. 5.32). Решено экстренно оперировать больного. После вскрытия полости перикарда возникли нарушения ритма и фибрилляция желудочков сердца. Произведена экстренная канюля-ция правого предсердия и восходящей части аорты на фоне прямого массажа сердца, продолжавшегося 15 мин. Операция выполнялась в условиях ИК, фармакохолодовой кар-диоплегии.
Произведено аортокоронарное шунтирование четырех коронарных артерий — передней межжелудочковой, диагональной, ветви тупого края огибающей артерии, правой коронарной артерии.
Сердечная деятельность восстановлена. Послеоперационное течение без осложнений. Больной выписан из стационара в удовлетворительном состоянии без приступов стенокардии.
При наблюдении в течение 5 лет отмечено хорошее самочувствие; стенокардии нет.
Приведенные клинические примеры иллюстрируют плохой прогноз болезни, при которой наблюдалось поражение ствола левой венечной артерии и возникли приступы нестабильной стенокардии; реваскуляризация миокарда оказалась эффективной.
Другую группу больных, у которых прогноз болезни при лекарственном лечении также плохой, представляют собой больные с ангиографически доказанным субкритическим стенозом крупной коронарной артерии, кровоснабжающей значительную массу миокарда. Полная окклюзия артерии в этом случае приводит к развитию массивного некроза миокарда, который может оказаться фатальным. Наиболее опасно проксимальное сужение передней межжелудочковой ветви левой коронарной артерии. Таким больным также показано срочное хирургическое лечение для предупреждения осложнений.
Поражение многих коронарных артерий у больного с нестабильной стенокардией также является прогностически неблагоприятным. При обнаружении значительного поражения трех коронарных артерий и более, ухудшающего гемодинамику, показано хирургическое лечение в течение первых 7 дней, несмотря на полное исчезновение болей на фоне массивной лекарственной терапии.
Коронарография позволяет выделить две дополнительные группы среди больных с нестабильной стенокардией, не подлежащих хирургическому лечению. Одна из них—это больные, у которых при ангиографическом исследовании не выявляется выраженных изменений коронарных артерий (около 5% среди всех больных с нестабильной стенокардией). Клиническая картина болезни обусловлена спазмом коронарной артерии, что можно подтвердить эргоновиновой пробой во время коронарографии.
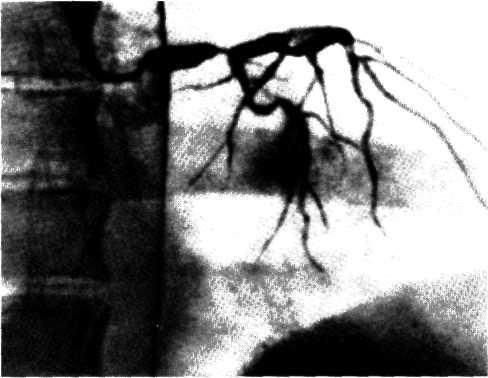
5.32. Коронарограмма другого больного с резким стенозом ствола левой венечной артерии.
К другой группе больных, не подлежащих хирургическому лечению, относятся больные с распространенным дисталь-ным поражением коронарных артерий; операция невозможна (10-25%) [Alison H. ct al., 1978].
Ряд специальных исследований позволил установить, что прогноз болезни при лекарственном лечении во многом зависит от клинической формы нестабильной стенокардии, а отдельные формы различаются между собой по частоте развития инфарктов миокарда, госпитальной летальности, отдаленному прогнозу и др.
В связи с этим целесообразно дифференцированно рассмотреть показания к хирургическому лечению при различных клинических формах нестабильной стенокардии.
1. Впервые возникшая стенокардия. У больных с этой формой болезни стенокардия возникает не ранее чем в течение трех предшествующих месяцев. Среди них целесо образно выделить больных с резко сниженной физической активностью или с относительно сохраненной физической активностью: прогноз болезни бывает разным [Favaloro R.. 1979].
На ашиограммах в первой группе обычно выявляется множественное поражение коронарных артерий; госпитальная летальность при лекарственном лечении составляет 19%, тогда как во второй группе—13%. В связи с этим больные с впервые возникшей стенокардией и резким снижением физической активности должны рассматриваться как «кандидаты» на хирургическое лечение после стабилизации их состояния.
Прогрессирующая стенокардия. Больным с этой формой болезни показано хирургическое лечение при рецидивах стенокардии на фоне проводимой лекарственной терапии или при наличии «острой персистирующей ишемии» миокарда, по определению R. Favaloro.
Постинфарктная стенокардия. В эту группу входят больные, у которых стенокардия возникает или реци дивирует в течение 30 дней после острого инфаркта миокар да. Особенностью этой группы является наличие некроза со значительной зоной периинфарктной ишемии, перфузируе- мой критически суженной коронарной артерией. Около 60%
575
больных с постинфарктной нестабильной стенокардией являются «кандидатами» на операцию реваскуляризации миокарда по состоянию периферического коронарного русла.
Больные с постинфарктной нестабильной стенокардией обычно плохо поддаются лекарственному лечению, и у них наблюдается высокий процент госпитальной летальности и отдаленных осложнений [Krauss К., 1972; Hammermeis-ter К., 1983].
Так, например, Т. Bianchi и соавт. (1984) приводят следующие сравнительные данные о результатах лекарственного и хирургического лечения этой группы больных (табл. 5.5).
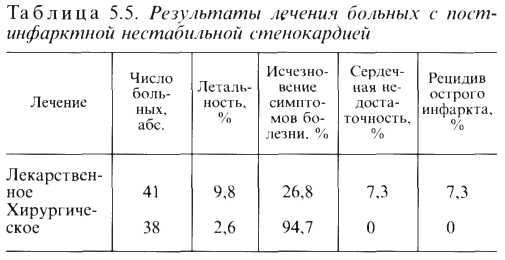
У больных с постинфарктной нестабильной стенокардией операция позволяет предупредить рецидивы инфаркта миокарда и стенокардию в отдаленном периоде наблюдения.
Хирургическое лечение не показано больным при эффективности лекарственного лечения, быстром исчезновении симптомов болезни и нерезко выраженном поражении коронарных сосудов.
Количество пораженных сосудов у больных с нестабильной стенокардией не является критерием для определения показаний кооперативному лечению.
Необходимо отметить, что при впервые возникшей стенокардии практически отсутствует коллатеральное кровообращение в миокарде при наличии резких сужений коронарных артерий, тогда как при прогрессирующей стенокардииколлатерали бывают хорошо развиты почти у половины больных. Эти факторы также следует учитывать при определении показаний к хирургическому лечению.
Суммируя показания к хирургическому лечению больных с нестабильной стенокардией, необходимо еще раз отметить, что аортокоронарное шунтирование необходимо при отсутствии эффекта от интенсивной лекарственной терапии и при наличии операбельного поражения коронарных артерий.
Факторы операционного риска. При определении показаний к хирургическому лечению больных с нестабильной стенокардией необходимо также учитывать факторы операционного риска.
Предложена специальная формула, разработанная на основе мультивариантного анализа и математической модели[Wfeifel R. et al., 1979].
В эту формулу включены факторы, которые могут влиять на частоту развития инфаркта миокарда как при лекарственном, так и при хирургическом лечении: 1) клиническая форма нестабильной стенокардии; 2) функциональный класс по классификации Нью-йоркской ассоциации кардиологов;
3) индекс поражения коронарного русла; 4) индекс поражения сократительной функции миокарда левого желудочка; 5) время ИК.
Эта формула выглядит следующим образом:
1§(р)-степени ишемии миокарда+0,23 (индекс поражения венечных артерий—индекс снижения функции левого желудочка) + функциональный класс поNYHA+0,02 (время ИК).
Для примера автор приводит следующий расчет: у больного с острой ишемией миокарда индекс поражения венечных артерий 9, IV степень нарушения сократительной функции левого желудочка, IV функциональный класс по классификации NYHA. Для такого больного может потребоваться во время операции 140 мин ИК. При подсчете по формуле риск развития инфаркта миокарда для данного больного составит 76%. Поэтому в связи с высокой степенью операционного риска не следует рекомендовать больному хирургическое лечение.
Результаты хирургического лечения. Хирургические вмешательства при нестабильной стенокардии принципиально не отличаются от таковых при стабильной стенокардии. Однако существует ряд факторов, которые определяют особенности течения нестабильной стенокардии.
К числу этих факторов относятся: характер предоперационной лекарственной терапии, заключающейся в применении больших доз р-блокаторов и нитроглицерина; выраженная ишемия миокарда или инфаркт миокарда (при постинфарктной нестабильной стенокардии) у значительной части больных к моменту операции; применение предоперационной контрпульсации внутриаортальным баллоном.
Интра- и послеоперационный инфаркт миокарда является основным и наиболее тяжелым осложнением операций при нестабильной стенокардии. Развитие интра- и послеоперационного инфаркта миокарда связано с исходной ишемиеймиокарда и трансформацией ее в некроз.
В первых опубликованных сериях операций интраопераци-онный инфаркт миокарда встречался с частотой до 45%. Запоследнее пятилетие частота послеоперационного инфаркта миокарда у больных с нестабильной стенокардией снизилась до 6%, а по некоторым данным—до 4% [Burton J., 1981 ]. Выявлена зависимость частоты развития инфаркта миокарда от времени операции и предшествовавшей лекарственной терапии.
Так, в группе больных без предшествовавшего лекарственного лечения частота инфаркта миокарда составила 7,5%, а при лекарственной терапии—около 4% [Cohn P., Cohn L, 1979]. Интра- и послеоперационный инфаркт миокарда с развитием острой сердечной недостаточности служил причиной летальных исходов у 6,9% больных [Cohn P., Cohn L, 1979].
Применение больших доз р-блокаторов ранее рассматривалось как одна из возможных причин депрессии функции левого желудочка в послеоперационном периоде, поэтомуклиницисты рекомендовали отменять или снижать дозу препарата за 24—48 ч до операции. В настоящее время нет оснований для отмены Р-блокаторов, так как послеоперационное применение допамина и контрпульсации внутриаортальным баллоном снижает риск развития тяжелой сердечной недостаточности, обусловленной депрессией функции миокарда на фоне Р-блокаторов.
Оценка результатов хирургического лечения нестабильной стенокардии проводилась в ряде центров в различные перио-
576
ды изучения этой проблемы (рис. 5.33). Для правильной оценки результатов необходимо точно знать в первую очередь критерии отбора в группу больных с нестабильной стенокардией, а также сроки выполнения операции.
В настоящее время летальность при экстренных операциях, по данным CASS, составляет при неотложных операциях 10,9%, а при экстренных вмешательствах у больных с выраженным поражением основного ствола левой венечной артерии—40%, тогда как операционная летальность у больных с поражением основного ствола левой венечной артерии при операциях, выполненных в плановом порядке, составляет 4,4%.
Высокий процент летальности при экстренной операции обусловлен резкой ишемией миокарда, возможностью быстрой трансформации ее в инфаркт во время операции до начала ИК, а также неадекватной кардиоплегией в связи с недостаточной перфузией миокарда кардиоплегическим раствором в результате резкого поражения коронарных сосудов у больных.
Следует отметить, что хотя, по данным большинства рандомизированных исследований, процент операционной и госпитальной летальности при хирургическом и лекарственном лечении нестабильной стенокардии приблизительно одинаковый, отдаленные показатели выживаемости и осложнений значительно ниже в группе оперированных больных (рис. 5.34).
В настоящее время можно сделать определенные выводы о хирургическом лечении больных с нестабильной стенокардией.
Операции, выполненные в течение первых 24 ч после поступления больных, сопровождаются более высоким про центом летальности и развитием периоперационного инфар кта миокарда, чем операции, выполненные в более отдален ные сроки [Scanlon P., 1981].
Показатели госпитальной летальности больных, опери рованных в ранние сроки после поступления (в течение 1—2 нед), соответствуют таковым при лечении лекарствен ными средствами.
После хирургического лечения отдаленный прогноз луч ше (исчезают симптомы болезни, выше показатели выжива емости), чем в результате только лекарственной терапии.
У большинства больных, получавших лекарственную терапию, в дальнейшем возникает необходимость в хирур гическом лечении из-за развития повторных приступов не стабильной стенокардии [Cohn P., Braunwald E., 1981].
5.3. ОСТРЫЙ ИНФАРКТ МИОКАРДА
Инфаркт миокарда представляет собой ишемический некроз определенного участка мышцы сердца. По распространенности процесса выделяют два типа инфаркта миокарда: 1) трансмуральный и 2) субэндокардиальный, или инт-рамуральный.
По клиническому течению различают неосложнен-ный и осложненный инфаркт миокарда. Под неосложнен-ным подразумевают «гладкое» течение болезни—отсутствие рецидивирующих приступов стенокардии, тяжелых нарушений ритма, выраженных признаков сердечной недостаточности.
Основными факторами, определяющими клиническую
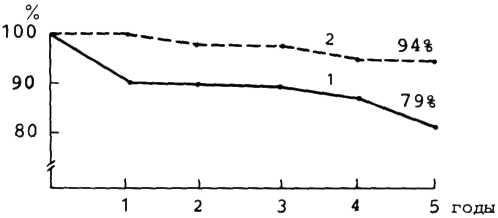
5.33. Актуарные кривые выживаемости больных с нестабильной стенокардией при лекарственном (1) и хирургическом (2) лечении.
По оси абсцисс — годы наблюдения; по оси ординат — выживаемость в процентах.
5.34. Госпитальная (I) и отдаленная (II) летальность при лекарственном и хирургическом лечении больных с нестабильной стенокардией (данные кооперативного исследования по коронарной хирургии в CHIA — CASS) [Russel R. et al, 1978]. Поражение: а — одного сосуда; б—двух сосудов; в — трех сосудов. По оси ординат — летальность в процентах.
картину острого инфаркта миокарда, являются степень и характер окклюзирующего поражения венечных артерий и выраженность коллатерального кровообращения, от чего во многом зависят обширность и локализация повреждения мышцы сердца. По локализации острого инфаркта миокарда различают передний, перегородочный, боковой и задний.
Изменения гемодинамики. На основании наблюдения за внутрисердечной гемодинамикой W. Rodgers и соавт. (1982) выделяют три группы больных с различным течением заболевания и прогнозом.
Первая группа: конечно-диастолическое давление в легочной артерии 12 мм рт. ст., небольшой участок инфаркта миокарда (по данным определения содержания креатинки-назы в крови), функция сердца не нарушена. Госпитальная летальность 5%.
Вторая группа: конечно-диастолическое давление в легочной артерии 12—20 мм рт. ст., слегка снижены сердечный индекс и индекс ударной работы левого желудочка; средних размеров инфаркт миокарда. Госпитальная летальность 21%.
Третья группа: конечно-диастолическое давление в легочной артерии 20 мм рт. ст., значительно снижены показатели сердечного индекса и индекса ударной работы левого желу-
577
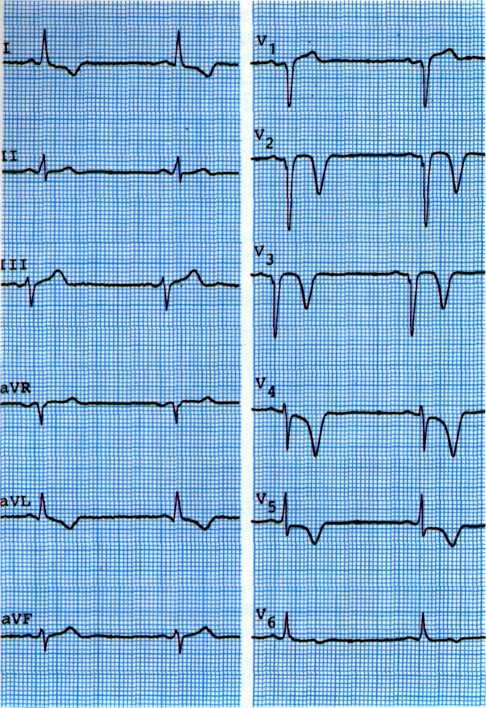
5.35. Электрокардиограмма больного с острым инфарктом миокарда переднеперегородочной области левого желудочка. Видны характерные признаки: патологический зубец Q в левых грудных отведениях, отрицательный зубец Т и умеренный подъем сегмента ST вверх от изоэлектрической линии в I, aVL и левых грудных отведениях.
дочка; обширный инфаркт миокарда. Госпитальная летальность 60%.
Диагностика. Диагноз острого инфаркта миокарда основывается на совокупности данных анамнеза и клинико-лабо-раторных исследований. Электрокардиография является незаменимым методом диагностики острого инфаркта миокарда. В зависимости от продолжительности, локализации и обширности повреждения миокарда на ЭКГ выявляются разнообразные изменения комплексов QRS и 57"— Т.
При трансмуральном инфаркте на ЭКГ появляются патологический зубец Q и соответствующие изменения комплекса ST— Т (рис. 5.35). Патологический (инфарктный) зубец Q в отличие от непатологического имеет продолжительность 0,04 с или более и соответствует по глубине 25% величины зубца R в этом же отведении.
Патологическим можно считать зубец Q в отведениях: 1)У1илиУ1иУ2;2)Уз-У6;3)аУЬ.
Важным электрокардиографическим признаком острого инфаркта миокарда является реципрокность изменения сегмента ST в разных отведениях. При инфаркте миокарда передней стенки левого желудочка наряду с повышением
сегмента ST выше изоэлектрической линии в отведениях I, aVL, V, —V6 имеется депрессия сегмента ST в отведениях II, III и aVF. Наоборот, при остром инфаркте миокарда задней стенки левого желудочка, когда в отведениях II, III и aVL имеется повышение сегмента ST выше изоэлектрической линии, отмечается реципрокная депрессия сегмента ST в отведениях I, aVL и Vt—V6.
Если подъем сегмента ST выше изоэлектрической линии наблюдается длительное время (несколько недель и более), можно предполагать развитие постинфарктной аневризмы левого желудочка.
Интрамуральный, или субэндокардиальный, инфаркт миокарда, не влияя на процессы деполяризации, нарушает реполяризацию миокарда, что на ЭКГ отражается в виде депрессии сегмента и глубокой инверсии зубца Т.
Ферментная диагностика. При некрозе мышцы сердца миокардиальные ферменты высвобождаются и попадают в кровеносное русло. Количественный анализ этих ферментов в сыворотке крови позволяет поставить диагноз и определить степень повреждения мышцы сердца. Наиболее часто определяют содержание креатинкиназы (КФК), аспартат-аминотрансферазы (ACT), лактатдегидрогеназы (ЛДГ).
В диагностических целях определяют в сыворотке крови миокардиальную функцию изофермента КФК, который является высокоспецифичным для миокардиальной клетки. В норме его активность в сыворотке составляет 2—3% от общей фракции. При инфаркте миокарда повышается активность миокардиальной фракции до 20%.
Радиоизотопную диагностику острого инфаркта миокарда осуществляют двумя способами.
При первом способе используют 9)тТс, который имеет свойство накапливаться в некротизированном участке миокарда, создавая тем самым очаг повышенной радиоактивности («горячее пятно»). «Горячие пятна» появляются спустя 24—28 ч после развития заболевания.
При втором способе используют 20|Т1, который не накапливается в некротизированном участке миокарда, в связи с чем образуются так называемые холодные пятна. Такая картина наблюдается при радиоизотопном исследовании в первые 24 ч после развития острого инфаркта миокарда.
Значение других методов исследования в диагностике острого инфаркта миокарда. Для инфаркта миокарда характерен «перекрест» между количеством лейкоцитов и величиной СОЭ, который заключается в снижении лейкоцитоза и возрастании СОЭ. Такая картина наблюдается к концу 1-й недели.
Диагностическое значение может иметь повышение содержания миоглобина в сыворотке крови в течение первых 4 ч острого инфаркта миокарда.
Рентгенологическая диагностика позволяет в некоторых случаях выявить по контуру тени левого желудочка сердца в прямой или в левой косой проекции участки гипокинезии, акинезии или дискинезии миокарда. Рентгено- и электроки-мография способствуют также выявлению участков сниженной кинетики стенок левого желудочка.
Метод э.хокардиографии имеет важное значение в диагностике острого инфаркта миокарда. Хотя и не существует патогномоничных эхокардиографических признаков острого инфаркта миокарда, однако с помощью этого метода можно изучить функциональное состояние левого желудочка, выявить нарушения кинетики его стенок и обширность пора-
578
жения, как и обратимость нарушений контрактильности (нитроглицериновые пробы и наблюдение в динамике). Эхокар-диография позволяет также диагностировать постинфарктные осложнения.
Селективную коронарографию целесообразно проводить для получения истинной картины коронарного кровообращения при внутривенном капельном введении нитроглицерина.
Характерной ангиографической картиной при остром инфаркте миокарда (особенно при трансмуральном) является культя сосуда, васкуляризующего инфарцированную область (рис. 5.36). Для проведения дифференциальной диагностики между спазмом и тромбозом коронарной артерии следует интракоронарно струйно ввести 200 мкг нитроглицерина. Если после этого не открывается просвет сосуда, то необходима интракоронарная тромболитическая терапия.
Левая вентрику.юграфия при остром инфаркте миокарда позволяет выявить асинергию стенок левого желудочка, определить его объемы и фракцию изгнания.
По данным R. Ideker и соавт. (1978), при повреждении не более 0,4% миокарда левого желудочка кинетика стенок не нарушается, при повреждении 6,3% миокарда отмечается гипокинезия, при некрозе до 14,3% миокарда в большинстве случаев может быть акинезия стенок левого желудочка, а при поражении более 30,1 % практически всегда наблюдается дискинезия, т. е. парадоксальная пульсация левого желудочка.
Современные принципы лечения. Лечебные мероприятия при остром инфаркте миокарда должны быть направлены на поддержание сердечной деятельности и кровообращения, профилактику осложнений, ограничение зоны повреждения и сохранение большей части жизнеспособного миокарда.
Больных с острым инфарктом миокарда госпитализируют в палаты интенсивной терапии кардиологических отделений, где они должны находиться до полной стабилизации состояния. В палатах интенсивной терапии больным следует сделать все лечебные и диагностические процедуры.
Терапию начинают с купирования болевого приступа. С этой целью можно назначить наркотические анальгетики (морфин, пантопон, омнопон) или синтетические препараты (промедол). В настоящее время для обезболивания при инфаркте миокарда широко используется нейролептаналгезия, которая осуществляется комбинированным введением мощного синтетического анальгетика фентанила в дозе 0,05— 0,1 мг и нейролептика дроперидола в дозе 5 мг. Эти препараты в большинстве случаев снимают ангинозный приступ. При наиболее тяжелых и стойких ангинозных приступах можно использовать наркоз смесью закиси азота (80%) и кислорода (20%). По мере достижения эффекта снижают концентрацию закиси азота и увеличивают содержание кислорода.
Оксигенотерапия осуществляется подачей кислорода через носовой катетер в количестве 6—8 л/мин. Терапия должна продолжаться в течение 24—28 ч после начала ангинозного приступа.
Важное место в лечении острого инфаркта миокарда должны занимать мероприятия, направленные на ограничение зоны повреждения. В зависимости от механизма действия их делят на две группы: 1) улучшающие коронарную перфузию инфарцированной и периинфарктной зон и 2) снижающие потребность миокарда в кислороде.
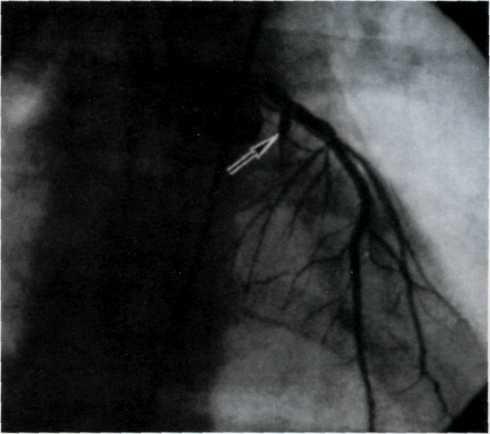
5.36. Прижизненная ангиограмма венечного сосуда, васкуляризующего инфарцированную область при остром инфаркте миокарда.
Стрелкой указана окклюзировсшная огибающая ветвь левой венечной артерии при заднебоковом инфаркте миокарда. Сосуд представлен в виде культи.
Улучшения перфузии инфарцированной области можно достичь медикаментозным, эндоваскулярным (инвазивным) и хирургическим путем.
Для улучшения перфузии инфарцированной и периинфарктной зоны назначают препараты антиспастического действия или уменьшающие агрегацию форменных элементов крови.
При непрекращающихся приступах стенокардии, застойной сердечной недостаточности, повышенном артериальном давлении и признаках расширения зоны повреждения необходимо применять нитроглицерин как в таблетках, так и внутривенно капельно.
Внутривенную капельную инфузию нитроглицерина следует проводить из расчета 4 мг/ч. При этом нельзя допускать снижения артериального давления ниже 100—110 мм рт. ст. Дозы таблетированных нитратов и нитритов должны быть такие же, как и при других формах ИБС.
При терапии острого инфаркта миокарда препаратами, блокирующими Р-адренергические рецепторы, необходим постоянный гемодинамическии и мониторныи контроль для своевременного предупреждения таких осложнений, как застойная сердечная недостаточность, синусовая брадикардия и атриовентрикулярная блокада.
Ограничения зоны некроза при остром инфаркте миокарда можно достичь при использовании антагонистов кальция [Snyder D., 1984]. Эти свойства послужили основанием для использования антагонистов кальция (нифедипин, верапа-мил, коринфар, изоптин, сензит) в лечении острого инфаркта миокарда. Посредством этих препаратов можно достичь вазодилататорного эффекта, улучшения функции левого желудочка и толерантности к нагрузке за счет уменьшения постнагрузки и изменения соотношения «доза—запрос кис-
579
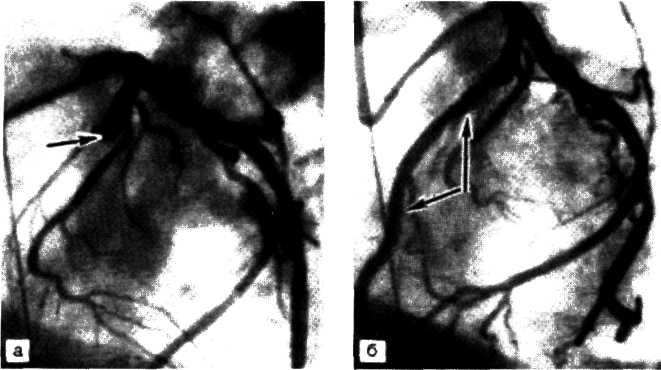
лорода», а также ограничения проникновения кальция в мио-кардиальную клетку.
Наряду с консервативной терапией существует ряд эн-доваскулярных и хирургических методов восстановления нарушенного коронарного кровотока в инфарцированной области и ограничения размеров повреждения сердечной мышцы. Среди них наиболее эффективными являются внутрикоронарная тромболитическая терапия, внутриаор-тальная контрпульсация и аортокоронарное шунтирование.
Первое сообщение об использовании внутрикоронарного введения тромболитических препаратов принадлежит Е. И. Чазову и др. (1975). Эта лечебная процедура направлена на реканализацию тромбированного венечного сосуда, восстановление кровотока в нем, ограничение зоны повреждения, сохранение жизнеспособности периинфарктной ише-мизированной области миокарда и снижение летальности от острого инфаркта миокарда. Успешно выполненная интра-коронарная тромболитическая процедура в первые 6 ч заболевания снижает летальность, ограничивает зону повреждения и улучшает функциональную способность левого желудочка по сравнению с контрольной группой больных, которым не выполнялась внутрикоронарная тромболитическая терапия [Ganz W. et al., 1961; Rentrop P. et al., 1981].
Показаниями к выполнению внутрикоронарной тромболитической процедуры служат крупноочаговый острый инфаркт миокарда (развивается в течение 6 ч после ангинозного статуса), продолжающиеся приступы стенокардии, рефрактерные к лекарственной терапии, стойкое повышение сегмента ST на ЭКГ выше изоэлектрической линии, акинезия стенки левого желудочка в области инфаркта миокарда по данным двухмерной эхокардиографии [Rutsch W. et al., 1983].
Противопоказаниями к выполнению внутрикоронарной тромболитической процедуры являются повторный инфаркт миокарда в области постинфарктного рубца, возраст больного старше 70 лет, непереносимость больным тромболитических препаратов (стрептаза, авелизин, стрептодеказа и др.), тяжелое поражение периферических артериальных сосудов [Rentrop P. et al., 1981; Rutsch W. et al., 1983].
Подготовительный период должен включать активную лекарственную терапию с целью ликвидации нарушений
ритма и коррекции нарушения внутрисердечной гемодинамики. У больных с выраженными признаками сердечной недостаточности внутрикоронарную тромболитическую терапию можно выполнять на фоне внутриаортальной контрпульсации.
Перед процедурой желательно назначить больному антагонисты кальция для ликвидации или профилактики спазма венечных сосудов. Внутривенная кортикостероидная терапия позволяет снять аллергическую реакцию на тромбо-литические препараты. Гепарин в дозе 7500 ЕД вводят внутривенно для предотвращения тромбообразования на поверхности ангиографических катетеров.
При выявлении ангиографической картины острой окклюзии венечного сосуда, которая имеет характерную форму в виде культи, следует ввести внутрикоронарно 0,1 мг нитроглицерина с целью проведения дифференциальной диагностики между спазмом и тромботической окклюзией сосуда. Если после введения нитроглицерина не раскрывается просвет сосуда, приступают к интракоронарной тромболитической терапии. Для этого к окклюзированному венечному сосуду посредством мягкого проводника подводят ан-гиографический катетер (2F). Через этот катетер вводят тромболитические препараты (стрептаза, авелизин) в дозе 20000—40000 ЕД, затем капельно из расчета 2000— 6000 ЕД/мин таким образом, чтобы суммарная доза препарата не превышала 200 000—240 000 ЕД. Вся процедура занимает примерно 1 ч.
Тромболитическая терапия в первые 6 ч после начала инфаркта позволяет примерно в 75—80% достичь реканализа-ции окклюзированного сосуда (рис. 5.37). Восстановление кровотока в венечной артерии, васкуляризующей инфарци-рованную область, сопровождается ограничением зоны некроза, улучшением функциональной способности левого желудочка и уменьшением рецидивов инфаркта миокарда [Rentrop P. et al, 1979].
После успешной тромболитической терапии длительное время (до 2—3 мес) проводят лечение антикоагулянтами.
Из осложнений следует отметить нарушения ритма сердца, которые сопровождают реперфузию инфарцированной области. Возможно возникновение фибрилляции желудочков, которая купируется электрической дефибрилляцией.
580
Крайне редко при этой процедуре наступает летальный исход.
Как правило, он наблюдается у больных с тяжелой сердечной недостаточностью и рефрактерной к терапии аритмией.
После успешной тромболитической терапии, заключающейся в реперфузии инфарцированной области, практически всегда наблюдается «резидуальный» стеноз венечных артерий, который обусловлен атеросклеротическими бляшками или неполным лизированием тромба. Возможна комбинация этих двух факторов. Для более полного восстановления кровотока в венечных артериях эту процедуру сочетают с ангиопластикой коронарных артерий или аор-токоронарным шунтированием. Это необходимо больным с продолжающимися приступами стенокардии, признаками расширения зоны повреждения, рецидивами острого инфаркта миокарда, низкой толерантностью к физической нагрузке и т. д.
Во многих кардиологических клиниках с целью ограничения зоны некроза при остром инфаркте миокарда широко используют внутривенное введение тромболитических препаратов. Наиболее часто применяют активатор фибриноли-за стрептокиназу. Препарат вводят внутривенно капельно в количестве 250000 ЕД в 20 мл изотонического раствора хлорида натрия в течение 15 мин. В дальнейшем стрептокиназу вводят внутривенно капельно со скоростью около 100000 ЕД/ч. Лечение продолжают в течение 12—16 ч. По окончании введения стрептокиназы продолжают антикоагу-лянтную терапию гепарином по обычной схеме. Своевременно начатая фибринолитическая терапия у больных с острым инфарктом миокарда дает хорошие результаты. Отмечаются уменьшение интенсивности болевого синдрома, более быстрая динамика ЭКГ, меньшее повышение активности трансфераз в крови. Летальность больных, получавших лизирующие препараты, по мнению некоторых авторов, почти в 2 раза меньше, чем в контрольной группе [Чазов Е. И. и др., 1964].
Остается спорным вопрос о роли антикоагулянтной терапии при лечении острого инфаркта миокарда, о ее влиянии на ограничение зоны повреждения мышцы сердца. Основными показаниями к применению антикоагулянтов при остром инфаркте миокарда являются гиперкоагуляция крови, частый тромбоз венечных артерий и пристеночный тромбоз в полостях сердца, тромбоэмболии периферических и легочных артерий.
Имеются определенные противопоказания к проведению антикоагулянтной терапии при остром инфаркте миокарда: сопутствующая язвенная болезнь и другие процессы с наклонностью к кровотечениям, болезни почек и печени, крови и т. д.
Более полную информацию о борьбе с этими осложнениями можно получить в работах, посвященных инфаркту миокарда [Чазов Е. И., 1982; Braunwald E., 1984]. Основной причиной остановки сердца при остром инфаркте миокарда является фибрилляция желудочков. В этих случаях необходима немедленная электрическая дефибрилляция сердца. Если причиной остановки сердца явилась асистолия, следует выполнять чрезгрудинную или трансвенозную электрокардиостимуляцию.
Лечение гемодннамнческнх нарушений при остром инфаркте миокарда. У больных с острым инфарктом миокарда могут наблюдаться следующие варианты гемодинамики; 1) нор-
мальная гемодинамика; 2) гипердинамическое состояние кровообращения; 3) гиповолемическая гипотония; 4) лево-желудочковая недостаточность; 5) кардиогенный шок. Терапия нарушений гемодинамики и «поддержка» сердечной деятельности определяются в зависимости от типа гемодинамики. В табл. 5.6 приведены основные терапевтические мероприятия в зависимости от состояния гемодинамики больных с острым инфарктом миокарда [Braunwald E., 1984]. Эта схема применима лишь в тех случаях, когда осуществляется мониторное наблюдение. Вопрос о том, у каких больных следует выполнять мониторное наблюдение за гемодинамикой, решается на основании тщательного анализа клинико-инструментальных данных.
Прогноз при консервативном лечении острого инфаркта миокарда. Летальность при остром инфаркте миокарда, по данным разных авторов, составляет 18,5—40%. По данным W. Rudolph и соавт. (1981), в ближайшие часы острого инфаркта миокарда на догоспитальном этапе погибает 20%, 15% умирают в период стационарного лечения и 10% — вскоре после выписки из стационара (в пределах первых 6 мес). В дальнейшем ежегодная смертность больных составляет 3—6%, т. е. как и при хронической стадии.
Однако следует помнить, что прогноз при остром инфаркте миокарда как в период стационарного лечения, так и на внебольничном этапе зависит от множества факторов. Так, например, госпитальная летальность при кардиогенном шоке и тяжелых формах сердечной недостаточности достигает 80%, тогда как при интрамуральных и субэндокардиальных повреждениях миокарда не превышает 5—8%.
Транслюминальная баллонная ангиопластика у больных острым инфарктом миокарда. У исследователей до настоящего времени нет единого мнения об эффективности ТБАВА у больных с острыми расстройствами коронарного кровообращения вообще и острым инфарктом миокарда в частности. Некоторые авторы считают методы прямой реваскуляризации миокарда эффективными у этих больных [Holmes D. et al., 1989; Kander N. et al., 1989; Iosseliani D. et al., 1993], однако другие не разделяют эту точку зрения [Raizner A. et al, 1985; Topol E. et al, 1987; The TIMI Research Group, 1988], а третьи считают эти процедуры вредными, поскольку в результате расширяется зона некроза вследствие реперфузионных геморрагических повреждений миокарда [Marroko P. et al, 1981; Reimer К. ct al, 1981 ]. Тем не менее с каждым годом увеличивается количество производимых процедур эндоваскулярной реваскуляризации инфарктзависимой артерии (ИЗА) с хорошими ближайшими и отдаленными результатами. Показанием к выполнению ТБАВА ИЗА служит ангиографическая картина ее острой окклюзии либо резчайший «резидуальный» стеноз после успешной внутрикоронарной тромболитической терапии.
Техника ТБАВА при ОИМ. Перед ТБАВА пациентам следует ввести внутривенно болюсно 10000 ЕД гепарина. Вместе с тем желательно производить внутривенную капельную инфузию адалата (0,5 мг/ч) и нитроглицерина (3 мг/ч). После катетеризации магистральной вены (как правило, левая или правая бедренная вена) больным в правый желудочек вводят электродный катетер для выполнения в случае необходимости электрокардиостимуляции. Диагностическую процедуру следует начинать с выполнения левой вентрикулографии в переднеправой косой проекции 30°. Ангиографию венечных артерий выполняют в нескольких
587
Таблица 5.6. Терапевтические мероприятия при разных гемодинамических вариантах острого инфаркта миокарда
|
Вариант гемодинамики |
ЛАЛ |
ЛАДЗК |
СИ |
Лечебные мероприятия |
Замечания |
|
Нормальная |
15 |
12 |
2,7—3,5 |
Не требуются |
Можно использовать Р-блока-торы |
|
Гйподинамическое состояние |
15 |
12 |
3,0 |
Р-Блокаторы |
Для этой группы характерна тахикардия |
|
Гиповолемическая гипотония |
15 |
9 |
2,7 |
Восполнение сосудистого русла жидкостью |
После введения жидкости увеличивается ЛАД до 14—18 мм рт. ст., затем следует вновь оценить вариант гемодинамики |
|
Умеренная левожелу-дочковая недостаточность |
22 |
18—22 |
2,5 |
Мочегонные |
Одышка, гипоксемия, умеренный венозный застой в легких |
|
Выраженная левожелу-дочковая недостаточность |
25 |
22 |
1,8 |
Вазодилататоры + мочегонные |
Венозный застой и отек легких. Можно использовать сердечные гликозиды, ИВЛ с положительным давлением или вспомогательное кровообращение |
|
Кардиогенный шок |
22 |
18 |
1,8 |
Вспомогательное кровообращение |
Можно использовать симптоматические препараты с положительным инотропным эффектом (допамин или добутамин) |
Примечание. ЛАЛ — в легочных капиллярах, мм
среднее давление в легочной артерии, мм рт. ст.; ЛАД„ — среднее давление «заклинивания» рт. ст.; СИ — сердечный индекс, л/(мин м2).
проекциях, включая краниокаудальные. Острую окклюзию ИЗА диагностируют при выявлении ангиографической картины сосуда в виде культи, без антеградного и ретроградного контрастирования его дистальных отделов. Для дифференциальной диагностики спазма и тромботической окклюзии сосуда следует внутрикоронарно болюсно ввести 200 мкг нитроглицерина. При сохранении окклюзии сосуда для его реканализации нужно провести внутрикоронарнуютромболитическую терапию (болюсно внутрикоронарно вводят 25 000 ЕД стрептазы с последующим дозированнымкапельным введением того же препарата внутрикоронарно из расчета 225000 ЕД в течение 1 ч) либо механическую реканализацию сосуда с помощью проводников размером от 0,012 до 0,018. После завершения процедуры выполняют контрольную ангиографию сосуда и в зависимости от еерезультатов определяют дальнейшую тактику лечебных мероприятий.
Как правило, при реканализации ИЗА после внутрикоро-нарного тромболизиса или механической реканализации наблюдают «резидуальный» стеноз сосуда, превышающий 50% просвета сосуда. В этих случаях следующим этапом выполняют ТБАВА ИЗА с помощью катетеров-гидов размером 8 или 9 Fr и баллонных катетеров диаметром от 1,5 до 3,5 мм. Давление, используемое для раздувания баллона, может колебаться от 4 до 16 атм, время раздувания баллона—от 50 с до 3 мин. Перед контрольным введением контрастного вещества целесообразно внутрикоронарно ввести 0,2 мг нитроглицерина. Успешной можно считать процедуру при увеличении просвета сосуда более чем на 50% от его диаметра в месте дилатации (по результатам контрастного
исследования сосуда не менее чем в двух проекциях). В течение 1-х суток после завершения процедуры ТБАВА продолжают внутривенную капельную инфузию гепарина из расчета 1000 ЕД в 1 ч, а также внутривенную дозированную инфузию нитроглицерина (3 мг/ч) и адалата (0,5 мг/ч). В таблетированном виде больным назначают аспирин в дозе 100 мг и курантил (дипиридамол) в дозе 75 мг/сут. На следующий день желательно выполнить контрольную ангиографию дилатированной артерии. В случае рестеноза или реокклюзии можно произвести повторную процедуру ТБАВА.
Результаты лечения целесообразно оценивать по следующим критериям: отсутствие приступов стенокардии; рецидив или повторный ОИМ; выживаемость; толерантность к физической нагрузке; динамика ФВ ЛЖ.
Повторное обследование больных проводят не ранее чем спустя 6 мес после выписки из стационара. Повторную коронароангиографию следует выполнять при условии возобновления приступов стенокардии или других признаков гипоксии миокарда, а также при согласии пациентов даже в отсутствие признаков коронарной недостаточности.
Проведенные исследования позволяют считать, что у большинства больных в первые часы после развития ОИМ можно выполнить ТБАВА с низкими показателями летальности и частотой тяжелых осложнений. У значительной части больных эта процедура позволяет адекватно восстановить кровоток в ИЗА, и этот эффект сохраняется на госпитальном этапе у большинства больных. При успешном выполнении ТБАВА отмечаются достоверно более высокаявыживаемость и меньшее количество осложнений, чем
582
у больных, у которых не был восстановлен кровоток в ИЗА. Установлено также, что у большей части больных после успешной ТБАВА на госпитальном этапе отсутствуют приступы стенокардии и выявляется отрицательная проба с физической нагрузкой, а также отмечается тенденция к более существенному улучшению функциональной способности левого желудочка, чем у больных, у которых кровоток в ИЗА не был восстановлен. В исследовании также не выявлено выраженных различий в клиническом течении заболевания у больных, которым была выполнена только ТБАВА, и пациентов, которым были произведены ТБАВА и внутри-коронарный тромболизис [Gibbons R. et al., 1991; O'Neill W. etal., 1991; Grines C. et al., 1992].
Известно также, что успешная ТБАВА ИЗА благотворно влияет на клиническое течение заболевания и прогноз у больных с ОИМ и в отдаленные сроки. У больных со стойким эффектом ТБАВА значительно реже наблюдали приступы стенокардии и летальные исходы, чем у пациентов, которым не производили реканализацию ИЗА, так же как и у больных с рестенозом или реокклюзией ИЗА после успешной ТБАВА. У больных, у которых получен стойкий эффект ТБАВА, наблюдаются также более высокая толерантность к физической нагрузке и отрицательная велоэргомет-рическая проба по сравнению с пациентами, которым не производили реканализации ИЗА. Примерно у 2/з больных после ТБАВА сохраняется стойкий эффект процедуры. Следовательно, ее можно более широко рекомендовать больным с ОИМ для восстановления кровотока в ИЗА с целью улучшения перфузии периинфарктной зоны, предупреждения возникновения постинфарктной стенокардии и других осложнений постинфарктного периода, улучшения функциональной способности левого желудочка и повышения толерантности к физической нагрузке. Однако, для того чтобы сделать окончательные выводы, необходимо дальнейшее накопление опыта в этом направлении.
Хирургическое лечение. Со времени использования методов непрямой реваскуляризации для лечения ИБС эти операции были применены у больных с острым инфарктом миокарда. А. Н. Бакулев в начале 60-х годов в ИССХ АМН СССР ввел в практику операцию Фиески—Томпсона при остром инфаркте миокарда.
Ряд авторов попытались применить другие методы непрямой реваскуляризации и коронарной эндартерэктомии при остром инфаркте миокарда. В 1968 г. В. И. Колесов впервые в мире произвел успешную операцию прямой реваскуляризации миокарда при остром инфаркте миокарда. На работающем сердце без ИК был наложен маммарно-коронарный анастомоз с передней межжелудочковой ветвью левой коронарной артерии.
Послеоперационный период протекал гладко; в отдаленном периоде у больного не было приступов стенокардии и не отмечалось рецидивов инфаркта.
После использования в клинической практике методов маммарно-коронарного и аутовенозного аортокоронарного шунтирования при остром инфаркте миокарда метод прямой реваскуляризации у больных получил определенное развитие, однако не столь широкое, как можно ожидать, исходя из теоретических предпосылок.
Это обусловливалось такими факторами, как отсутствие четких показаний к аортокоронарному шунтированию у больных с острым инфарктом миокарда и адекватных
методов интраоперационной защиты миокарда. Это привело к тому, что операции сопровождались высоким процентом летальности и большим количеством осложнений.
В дальнейшем разработка показаний к операции и индивидуальный подход к больным с острым инфарктом миокарда, а также внедрение в клиническую практику метода калиевой кардиоплегии привели к значительному улучшению непосредственных и отдаленных результатов реваскуляризации миокарда при остром инфаркте.
Анализ данных литературы [Ким В. Ф., 1986] показал, что к концу 1984 г. в мире было выполнено 1679 операций аортокоронарного шунтирования при остром инфаркте миокарда в первые сутки от начала развития инфаркта. Операционная летальность среди больных, оперированных в течение 6 ч от начала приступа, составила 4,9%.
Патофизиологическим обоснованием операции реваскуляризации миокарда при остром инфаркте в настоящее время считают: 1) обратное развитие повреждения (если репер-фузия осуществляется в сроки до 6 ч от начала инфаркта); 2) улучшение кровоснабжения периинфарктной зоны (при операциях в более поздние сроки).
Показания к аортокоронарному шунтированию. Одной из наиболее важных проблем в хирургии острого инфаркта миокарда является проблема ранней госпитализации больных. Как известно, обратное развитие повреждения может произойти лишь при реперфузии в течение максимум 6 ч от начала приступа. Поэтому за такой короткий промежуток времени нужно доставить больного в специализированный центр, провести все необходимые исследования, включая коронарографию, и успеть подключить АИК, что практически трудно осуществить.
В настоящее время можно выделить ряд показаний к экстренному аортокоронарному шунтированию при остром инфаркте миокарда. К ним относятся: 1) тромбоз венечной артерии после коронарографии и транслюминальной ангиопластике, а также развитие острого инфаркта миокарда у больного, ожидающего плановой операции аортокоронарного шунтирования, которому ранее уже была сделана коро-нарография. В этих ситуациях требуется минимум времени, так как больной уже полностью обследован и можно ожидать хорошего эффекта от операции [Favaloro R. et al., 1971; Akins C. et al., 1983]; 2) выраженные гемодинамические нарушения и кардиогенный шок. Лекарственная терапия обычно не предупреждает очень высокую летальность больных, их оперируют вынужденно в связи с отсутствием перспектив при консервативном лечении [Работников В. С. и др., 1978]. В ряде работ сообщалось о достаточно высоком проценте выживаемости больных при экстренной реваскуляризации миокарда [Князев М. Д., 1975; Mundth E. et al., 1971 ]. На результатах операции больных сказываются сроки проведения хирургического вмешательства; 3) различные осложнения в раннем постинфарктном периоде (расширение зоны ишемии и некроза, проявляющееся рецидивом загрудинных болей, нарушениями ритма и проводимости, клиническими признаками постинфарктной нестабильной стенокардии, сочетанием указанных осложнений). У таких больных операция может предупредить и приостановить расширение зоны инфаркта и его рецидив, предотвратить сложные нарушения ритма [DeWood M. et al., 1984; Lindenau К. et al, 1983].
В литературе длительное время дискутируется вопрос о том, при каких формах инфаркта миокарда (крупноочаго-
583
Таблица 5.7. Показания
к аортокоронарному шунтированию
при остром инфаркте миокарда

В настоящее время установлено, что хирургическая реваскуляризация не показана больным с неосложненным течением трансмурального инфаркта миокарда [Sobel В., BraunwaldE., 1984]. При мелкоочаговом инфаркте миокарда, когда отмечается стеноз крупного венечного сосуда, снабжающего кровью значительную массу миокарда (особенно при поражении передней межжелудочковой ветви), реваскуляризация целесообразна для предупреждения расширения зоны инфаркта и его рецидивов [Loop F., 1974; Mills N. et al., 1975].
При трансмуральном инфаркте миокарда операцию нужно проводить только в ранние сроки (до 6 ч от момента развития приступа), когда еще возможно обратное развитиепроцесса повреждения миокарда. Операция в более поздние сроки оправдана лишь при возникновении серьезных осложнений.
Существует, однако, ряд трудностей при определении показаний к операции у больных с острым инфарктом миокарда. Прежде всего важно точно установить характер инфаркта миокарда до операции (трансмуральный, мелкоочаговый). Четкие электрокардиографические признаки трансмурального инфаркта (например, формирование зубца Q) обычно не успевают развиться в течение первых 6 ч от начала приступа. М. DeWood (1979), в частности, считает, что повышение сегмента S— Г на 2 мм выше изоэлектриче-ской линии свидетельствует о трансмуральном повреждении миокарда даже при нормальном комплексе QRS [DeWood M. et al., 1979]. Однако и такой подход позволяет отнести ряд больных с непроникающим инфарктом к числу больных с трансмуральным инфарктом.
К особой группе относятся больные с острым инфарктом миокарда, которым проведена успешная интракоронарная тромболитическая терапия. После лечения у них обычно сохраняется резидуальный стеноз сосуда (75% и более),снабжающего кровью зону инфаркта. При растворении тромба, открытий периферического русла и наличии признаков обратного развития процесса повреждения на ЭКГ необходимо окончательно нормализовать кровоток в коронарной артерии, чтобы избежать ретромбоза. По некоторым данным, частота ретромбоза составляет 30—70% в первые дни после тромболизиса [Rentrop P. et al., 1981]. Окончательную реваскуляризацию можно осуществить методом транслюминальной коронарной ангиопластики, а при ее неудаче—операцией аортокоронарного шунтирования [Krebber H. et al., 1982; Lollev D. et al., 1983].
Этот метод был впервые предложен в 1980 г. [Krebber H. et al., 1983].
Такой подход к реперфузии при остром инфаркте миокарда с теоретической точки зрения наиболее оправдан и дает хорошие результаты [LoitzК.etal., 1980]. Ниже представлены показания к хирургической реваскуляризации при остром инфаркте миокарда (табл. 5.7).
Результаты. В оценке результатов хирургического лечения острого инфаркта по-прежнему нет однозначных ответов на вопросы: 1) может ли операция улучшить результаты лечения острого инфаркта миокарда за счет ограничения зоны некроза; 2) улучшает ли операция отдаленные показатели выживаемости; 3) предотвращает ли операция рецидивыинфаркта миокарда?
Как указывают большинство авторов, снижение леталь-
ности является наиболее точным критерием достигнутого ограничения зоны некроза при хирургическом лечении острого инфаркта миокарда [DeWoodM., 1979]. В настоящеевремя летальность при операциях, выполненных в течение 6 ч от начала развития инфаркта, составляет 3,1%, а при операциях, сделанных в более поздние сроки,—10,3% [DeWood M. et al., 1979], причем в первом случае она значительно ниже, чем при лекарственном лечении, тогда как во втором такая же, как и при лекарственной терапии (рис. 5.38).
Летальность после операции зависит не только от сроков ее проведения, но и от характера инфаркта миокарда: при трансмуральном инфаркте она значительно выше, чем примелкоочаговом. Показатели выживаемости в отдаленные сроки гораздо выше у оперированных больных, чем у леченных лекарственными средствами. Так, по данным М. DeWood и соавт. (1979), летальность к 56-му месяцу после операции у хирургических больных составила 6%, тогда как после консервативного лечения—20,5%.
У оперированных больных значительно реже развиваются повторные инфаркты миокарда и стенокардии, чем у больных, леченных лекарственными средствами [Vermeulen F. et al., 1984.].
Данные литературы об ограничении зоны инфаркта миокарда (по данным ЭКГ), исчезновении зубца Q, особенностях сократительной функции миокарда, содержании ферментов в динамике и других показателях после реваскуляризации миокарда противоречивы и требуют дальнейшего анализа.
Хирургическая реваскуляризация миокарда после успеш-
584
ной внутрикоронарной тромболитической терапии сопровождается более низкой операционной летальностью, и результаты такого этапного хирургического метода лечения значительно лучше, чем только экстренной хирургической реваскуляризации без тромболизиса. Таким образом, можно сделать ряд конкретных выводов.
При остром инфаркте миокарда операция оправдана и показана в случае нетрансмурального инфаркта при пора жении крупной венечной артерии в сроки до 30 сут от начала его развития.
Операцию при трансмуральном инфаркте миокарда мо жно сделать не позднее чем через 6 ч от начала приступа, а в более поздние сроки—при появлении ранней пост инфарктной стенокардии и гемодинамических осложнений.
В настоящее время наиболее оправдано сочетанное при менение тромболитической терапии и ангиопластики или аортокоронарного шунтирования у больных с инфарктом миокарда, обусловленным тромбозом сосуда.
Больным с инфарктом миокарда, обусловленным толь ко стенозом сосуда, рекомендуется ангиопластика и аорто- коронарное шунтирование.
5.4. КАРДИОГЕННЫЙ ШОК
Кардиогенный шок—это клинический синдром острого расстройства кровообращения, когда сердце не в состоянии обеспечить минутный объем кровообращения, достаточный для адекватной перфузии органов и тканей.
Причины кардиогенного шока: 1) острое нарушение коронарного кровообращения с повреждением значительной массы миокарда; 2) нарушение механической функции сердца вследствие его наружного разрыва, разрыва межжелудочковой перегородки, возникновения острой митральной ре-гургитации или внезапной обструкции кровотока; 3) токсическое или тяжелое механическое повреждение миокарда, вызванное, например, операционной травмой; 4) конечная стадия кардиомиопатии с нарастанием сердечной недостаточности.
Кардиогенный шок при инфаркте миокарда, как правило, возникает вследствие острого нарушения коронарного кровообращения и выключения из насосной функции значительной массы миокарда. Эта форма кардиогенного шока встречается наиболее часто.
Частота. В специализированных отделениях кардиогенный шок наблюдается у 10—15% больных с инфарктом миокарда. Определение истинной частоты этого состояния, по-видимому, довольно затруднительно, так как исследователи нередко используют различные критерии для оценки этого состояния. Кроме того, определенное количество больных с инфарктом миокарда погибают от кардиогенного шока на догоспитальном этапе.
Летальность от кардиогенного шока составляет 80— 100% [Sobel В., 1984]. Применение адреномиметиков в сочетании с нитратами и препаратами, снижающими периферическое сопротивление, и особенно применение за последние 15 лет вспомогательного кровообращения в виде контрпульсации внутриаортальным баллоном позволило несколько снизить летальность.
Кроме того, значительное число больных, выведенных из состояния кардиогенного шока, погибают от осложнений.
Патогенез. Как показали многочисленные исследования, кардиогенный шок развивается при поражении более 40%
5.38. 1рафическое изображение летальности при лекарственном и хирургическом лечении больных с острым инфарктом миокарда [De Wood M. et ai, 1979].
а—зависимость летальности от сроков операции; б—летальность в отдаленном периоде после хирургического и лекарственного лечения. Летальность при выполнении операции: I—в первые б ч от начала инфаркта миокарда; II— через 6 ч от начала инфаркта миокарда; в отдаленные сроки: III—после хирургического лечения; IV—после лекарственного лечения. По оси ординат — летальность в процентах.
массы миокарда левого желудочка [Сметнев А. С, 1971; Иоселиани Д. Г., Мовелидзе Т. А., 1978; Allonso D. et al., 1973].
Выделяют три фазы (стадии) кардиогенного шока. Первая фаза — острая недостаточность левого желудочка—развивается вскоре после окклюзии коронарной артерии. Вторая фаза — фаза частичного восстановления гемодинамики за счет включения различных компенсаторных механизмов. Третья фаза—острая прогрессирующая недостаточность кровообращения в результате истощения механизмов компенсации и включения ряда дополнительных патологических механизмов.
В первой фазе наблюдается острая миокардиальная недостаточность, кроме того, возникают кардиогенные рефлексы, играющие компенсаторную роль.
Во время второй фазы компенсаторные механизмы позволяют в определенной степени восстановить контрактильную способность миокарда, улучшить коронарную перфузию и повысить артериальное давление. Это осуществляется благодаря повышению активности симпатической нервной системы, направленной на улучшение коронарной перфузии за счет стимуляции периферических а-рецепторов и соответственно вазоконстрикции, а также путем непосредственной стимуляции контрактильного статуса миокарда в результате воздействия на сердечные Р-рецепторы.
Повышение активности симпатической нервной системы играет компенсаторную роль. Однако в то же время повышается потребление кислорода ишемизированным миокардом, увеличивается частота сердечных сокращений и постнагрузка, что может вызвать расширение зоны инфаркта.
Если масса пораженного миокарда превышает 40—45%, то компенсаторные механизмы становятся недостаточными для обеспечения как коронарной, так и периферической циркуляции. Вследствие этого наступает быстро прогрессирующая третья фаза острой циркуляторной недостаточности. Между условно выделенными второй и третьей фазами находится граница необратимости шоковых изменений нарушения процессов гомеостаза.
Принято различать пять основных вариантов «порочного круга» при кардиогенном шоке: 1) резкое снижение контрак-тильной способности миокарда способствует падению артериального давления и резкому ухудшению коронарной перфузии, что в свою очередь способствует дальнейшему повреждению миокарда; 2) снижение контрактильной спо-
585
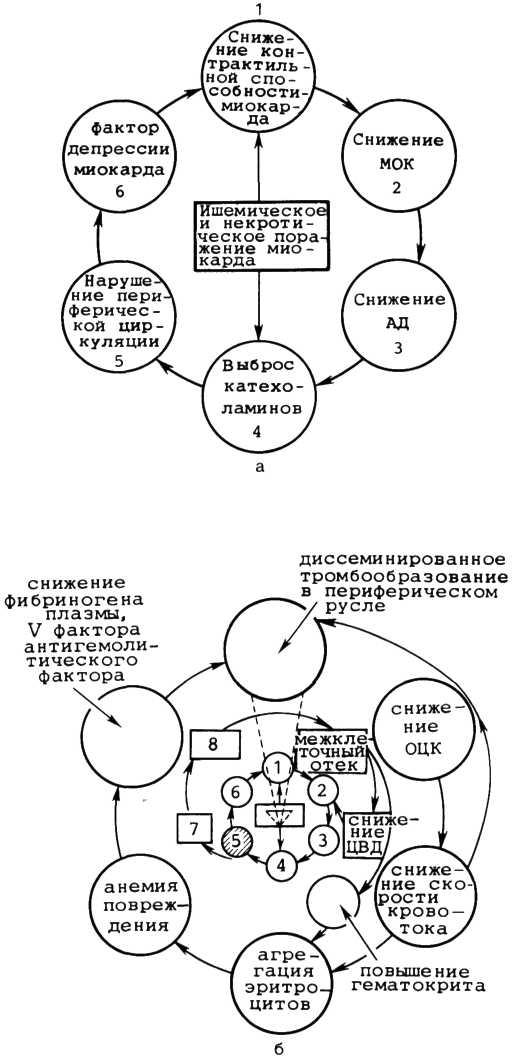
собности миокарда левого желудочка сопровождается повышением конечно-диастолического давления в нем, в левом предсердии и легочных венах, что приводит к вентиляцион-но-перфузионным нарушениям, снижению оксигенации крови и в конечном итоге вызывает еще более выраженную гипоксию миокарда; 3) снижение артериального давления вызывает компенсаторное возбуждение симпатической нервной системы и спазм периферических сосудов; ухудшение перфузии периферических тканей способствует развитию метаболического ацидоза, который оказывает кардиодепрес-
сивное действие; 4) спазм периферических сосудов вызывает трассудацию жидкости из сосудистого русла в ткани, повышение гематокрита и вязкости крови, что сопровождается микротромбозами в сосудах сердца и нарушением микроциркуляции; 5) ухудшение перфузии органов и тканей в результате сосудистого спазма способствует выбросу лизосо-мальных ферментов, главным образом в кишечнике и поджелудочной железе; развивающаяся токсинемия также оказывает кардиодепрессивное действие.
Общая схема патогенеза кардиогенного шока представлена на рис. 5.39.
Развиваясь «по спирали», указанные патогенетические механизмы приводят в конце концов к фатальному снижению функции миокарда и развитию третьей — необратимой — фазы кардиогенного шока.
Клиника. При бурном развитии кардиогенного шока клиническая картина настолько типична, что его невозможно спутать с другими проявлениями левожелудочковой недостаточности при остром инфаркте миокарда. Вместе с тем для более точной идентификации кардиогенного шока необходим строгий контроль и учет всех гемодинамических параметров.
Клиника кардиогенного шока складывается из следующих синдромов: 1) инфаркт миокарда; 2) наличие собственно шока (падение артериального давления, тахикардия и т. д.); 3) симптомы нарушения периферической и органной циркуляции.
Шок может развиваться одновременно с инфарктом, но может возникать и в последующие дни (2—5-й) в связи с расширением зоны инфаркта или возникновением аритмии. У 2/3 больных с кардиогенным шоком инфаркт миокарда имеет переднюю локализацию. Имеются обычно боли в груди и признаки острого инфаркта миокарда на ЭКГ.
Биодинамические критерии шока. К критериям, позволяющим охарактеризовать нарушение сердечного выброса и гемодинамики при кардиогенном шоке, относятся: 1) систолическое артериальное давление ниже 80 мм рт. ст.,
диастолическое артериальное давление ниже 50 мм рт. ст.;
среднее артериальное давление ниже 60 мм рт. ст.;
центральное венозное давление выше 9 мм рт. ст. (120 мм вод. ст.); 5) давление заклинивания или диастолическое дав ление в легочной артерии выше 18 мм рт. ст.; 6) частота сердечных сокращений более 95 в минуту; 7) сердечный ин декс менее 1,8 л/(минм2); 8) общее периферическое сопро тивление более 2000 дин/(с-см~5).
Мониторирование всех этих показателей необходимо для идентификации шока и контроля за его течением, а также для оценки эффективности проводимой терапии.
Симптомы нарушения периферической циркуляции проявляются в виде похолодания кожных покровов и конечностей, развития пятен дисциркуляции на коже, снижения или исчезновения периферического пульса.
Нарушение кровоснабжения головного мозга приводит к спутанности сознания, возбуждению, а в терминальной фазе шока—к сопорозному или коматозному состоянию.
Снижение перфузии кишечника может давать абдоминальный болевой синдром. Нарушение циркуляции в легких сопровождается артериальной гипоксемией, что требует постоянного контроля за концентрацией газов крови. Наряду с понижением оксигенации артериальной крови исследование артериовенознои разницы по кислороду может служить показателем, отражающим тяжесть сердечной недостаточности. Для тяжелой картины шока характерны снижение
586
напряжения кислорода в венозной крови и низкая артерио-венозная разница в насыщении крови кислородом.
Снижение перфузии почек приводит к развитию олигурии и анурии. Критерием кардиогенного шока является олигу-рия менее 30 мл/ч. При наблюдении за больным с кардио-генным шоком необходимо тщательное почасовое измерение диуреза.
Физикальные симптомы: глухие тоны сердца, нередко определяется систолический шум над верхушкой сердца и кардиомегалия. В легких могут выслушиваться влажные хрипы. При исследовании отмечаются метаболический ацидоз, гиперферментемия, гипокалиемия, гиперазотемия, нередко лейкоцитоз, гипоксемия и гиперкапния.
Принято различать отдельные клинические формы кардиогенного шока. Так, М. Mattlof и соавт. (1973) выделяют три группы больных с кардиогенным шоком: а) больные без предшествовавшего анамнеза ИБС, у которых шок развивается остро при первом массивном инфаркте миокарда; шок протекает бурно и быстро приводит к фатальному исходу; б) больные, у которых шок наблюдается в процессе острого инфаркта миокарда (на 2—5-е сутки) и связан с развитием механических осложнений (разрыв сердца, разрыв межжелудочковой перегородки, недостаточность митрального клапана, острая аневризма); в) больные, имеющие длительный анамнез ИБС, перенесшие ранее инфаркт миокарда, у которых свежий инфаркт миокарда, иногда даже небольшой, приводит к резкому ухудшению контрактильной способности миокарда левого желудочка с развитием кардиогенного шока.
Различают также торпидную и бурно протекающую форму кардиогенного шока [Сметнев А. С, 1971 ].
Состояния, осложняющие течение шока. Необходимо выделить группу больных с наличием факторов, осложняющих течение кардиогенного шока. Это прежде всего больные с отеком легких на фоне кардиогенного шока. У таких больных наблюдаются большее угнетение гемодинамики и худшие показатели сердечного выброса, давление «заклинивания» в легочной артерии и индекса ударной работы левого желудочка, чем при кардиогенном шоке без отека легких [Аронов А. Е., 1981].
Другим фактором, осложняющим течение шока, является аритмия. Хотя различные формы аритмии нередко наблюдаются при кардиогенном шоке, тяжелые формы аритмии (тахисистолическое мерцание предсердий, частая желудочковая экстрасистолия, пароксизмы желудочковой тахикардии) значительно осложняют его течение и являются неблагоприятными прогностическими факторами.
Дифференциальный диагноз. Дифференцировать кардио-генный шок следует с острой левожелудочковой недостаточностью без развития шока, которая обычно не соответствует гемодинамическим критериям шока: среднее артериальное давление, показателя сердечного выброса (сердечный и ударный индексы) выше, чем при шоке. Общее периферическое сопротивление ниже 1800 дин/(с-см"5). Индекс ударной работы левого желудочка при кардиогенном шоке составляет 14—16 гм/м2, тогда как при острой левожелудочковой недостаточности без шока—25—27 гм/м2.
Дифференциальный диагноз шока при инфаркте миокарда и шока, развивающегося в результате других механических нарушений в системе циркуляции, сложен.
Другие наиболее частые состояния, с которыми приходит-
ся дифференцировать истинный кардиогенный шок: 1) острая недостаточность правого желудочка в результате инфаркта миокарда; 2) тромбоэмболия легочной артерии; 3) разрыв межжелудочковой перегородки или острая митральная недостаточность в процессе развития острого инфаркта миокарда; 4) наружный разрыв сердца при инфаркте миокарда; 5) тампонада сердца при остром перикардите; 6) внезапная обструкция митрального отверстия миксомой левого предсердия, острая циркуляторная недостаточность в результате прогрессирующего стеноза аортального клапана или перфорация его при септическом эндокардите; 7) острая циркуляторная недостаточность как конечный результат длительно существовавшей кардиопатии; 8) расслаивающаяся аневризма грудных отделов аорты.
Общий принцип дифференциальной диагностики этих состояний заключается в том, что при инфаркте миокарда имеются клинические и электрокардиографические признаки инфаркта и отсутствуют симптомы указанных заболеваний. При шоке, обусловленном одним из указанных состояний, отмечаются признаки, характерные для этих состояний, и нет симптомов массивного инфаркта миокарда.
Дифференциально-диагностические трудности иногда могут возникать при шоке и коме несердечного генеза (токсический шок, септический шок, шок при перитоните, анафилактический шок). Иногда трудно дифференцировать кардиогенный шок с коматозными состояниями, развивающимися в результате гипер- или гипогликемии, мозгового инсульта, особенно при наличии у больного электрокардиографических признаков ИБС или острого нарушения коронарного кровообращения.
Лечение. Одним из наиболее оптимальных и результативных методов лечения, который можно применить даже во время транспортировки больного в кардиологическое отделение, является метод контрпульсации. Метод транспортной контрпульсации был впервые в мире применен в ИССХ им. А. Н. Бакулева. При этом использовали портативный транспортный контрпульсатор. Применение этого метода позволило снизить смертность от кардиогенного шока на догоспитальном этапе на 50%. Существует также транспортная наружная контрпульсация [Шумаков В. И., 1979]. Однако такие условия имеются далеко не всегда.
В настоящее время разработаны достаточно четкие принципы ведения больных с кардиогенным шоком.
Начальная терапия кардиогенного шока заключается в ин-фузии плазмозамещающих растворов (альбумин, протеин, полиглюкин) в тех случаях, когда давление наполнения левого желудочка относительно низкое (5—17 мм рт. ст.). Такая инфузионная терапия позволяет максимально использовать механизм Старлинга, но, как показали исследования многих авторов, улучшения состояния при этом можно добиться лишь в 7—22% больных, однако все больные остаются в состоянии кардиогенного шока.
В ряде случаев терапия, проводимая без достаточного контроля, может вызвать отек легких. При отеке легких начальная инфузионная терапия плазмозаменяющими растворами противопоказана.
Адекватные дозы адреномиметиков—адреналина, дофамина (допамина) назначают в соответствии с исходными параметрами гемодинамики и сердечного ритма. Терапевтическая доза адреналина—до 0,1—0,2 мкг/(кг ■ мин), а допамина—2—10 мкг/(кг ■ мин).
587
5.40. Схема работы внутриаортального баллона. I—систола; II—диастола.
Хотя применение адреномиметиков почти у половины больных с кардиогенным шоком позволяет улучшить показатели артериального давления и сердечного выброса, однако адреномиметики в то же время оказывают отрицательные влияния: повышение общего периферического сопротивления с усугублением периферического сосудистого спазма, тахикардия и аритмии. В отличие от адреналина допамин не угнетает, а даже несколько улучшает почечный кровоток, что при кардиогенном шоке имеет большое значение.
У 15% больных гемодинамические параметры при лечении адреномиметиками не меняются, отмечается лишь увеличение общего периферического сопротивления, а еще у 35% больных вообще отсутствует реакция или наступает ухудшение гемодинамики на фоне их введения [Аронов А. Е., 1981].
Так как отрицательное действие адреномиметиков связано в значительной степени с увеличением потребления кислорода миокардом, в последнее время предприняты попытки комбинированного использования адреномиметиков и препаратов, снижающих потребление миокардом кислорода, прежде всего периферических вазодилататоров и небольших доз Р-б л о кат о ров.
Наиболее разработана в настоящее время комбинированная терапия адреномиметиками и периферическими вазодилататорами—натрия нитропруссидом, нитроглицерином.
Дозы нитроглицерина и натрия нитропруссида определяются методом титрования, т. е. нужная доза подбирается постепенно. Сначала назначают минимальную дозу 1 мкг/(кг-мин) натрия нитропруссида и 0,8 мкг/(кг-мин) нитроглицерина. Затем, если эффекта не наблюдается, дозу медленно увеличивают до максимальной—6—7 мкг/ (кг • мин) натрия нитропруссида и 5—6 мкгДкг ■ мин) нитроглицерина и добиваются сбалансированной реакции, с одной стороны, на адреналин, а с другой—на вазодилататоры.
Основными критериями эффекта при такой терапии является снижение общего периферического сопротивления, повышение артериального давления, сердечного выброса и индекса ударной работы левого желудочка и снижение повышенного давления «заклинивания» в легочной артерии.
Необходимыми препаратами при лечении кардиогенного шока являются антиаритмические средства.
Диуретические препараты в комбинации с препаратами калия назначают при отеке легких. Терапия диуретиками способствует снижению токсинемии.
Кроме перечисленных лекарственных средств, для лечения кардиогенного шока применяют такие инотропные стимуляторы, как хлорид кальция и глюкагон. В ряде работ сообщалось о применении в лечении кардиогенного шока преднизолона, простагландинов, однако полной оценки эффективности их применения в настоящее время еще нет.
Вопрос об использовании сердечных гликозидов при кардиогенном шоке решается отрицательно, поскольку глико-зиды нецелесообразно применять при нарушениях внутри-желудочковой проводимости, экстрасистолии, гипокалие-мии, кроме того, они повышают потребление кислорода миокардом.
В то же время гликозиды необходимо назначать в период реконвалесценции после кардиогенного шока в связи с сердечной недостаточностью.
Все больные с кардиогенным шоком должны получать кислород через маску или носовой катетер. Искусственная вентиляция легких показана при одышке и снижении Р02 артериальной крови ниже 60 мм рт. ст. при дыхании кислородом.
Токсинемия является важным фактором в патогенезе шока. В связи с этим детоксикацию следует широко проводить при этом состоянии [Бердичевский М. С, 1985].
Значение хирургических методов лечения кардиогенного шока. Несмотря на разработку ряда новых методов терапии кардиогенного шока, летальность при этом состоянии, даже при использовании контрпульсации, составляет 80%. Поэтому были разработаны методы хирургического лечения кардиогенного шока. В клинической практике при кардиогенном шоке была применена ранняя инфарктэктомия, однако результаты ее были неутешительными [Mulder D.. Kattus A., 1973]. Тем не менее ранняя инфарктэктомия в сочетании с аортокоронарным шунтированием артерий, снабжающих кровью неинфарцированный миокард, позволила добиться снижения летальности при кардиогенном шоке [MundthE., 1975; Johnson S., 1977].
Первое хирургическое вмешательство при кардиогенном шоке—аортокоронарное шунтирование—выполнил канадский хирург W. Кеоп в 1971 г.
Теоретическое обоснование операции аортокоронарного шунтирования при кардиогенном шоке заключается в возможности обратного развития инфарктных изменений, если операция выполняется в первые 6 ч от начала инфаркта миокарда, и в улучшении перфузии периинфарктной зоны в более поздние сроки. При развитии механических осложнений острого инфаркта миокарда (ДМЖП недостаточности митрального клапана) операция направлена на устранение этих осложнений и нормализацию внутрисердечной гемодинамики.
По сводной статистике к 1984 г. в мире оперированы 230 больных с кардиогенным шоком, 178 из них одновременно проводилась контрпульсация. Средняя послеоперационная летальность составила 48,7%, что значительно ниже среднестатистической летальности при лекарственном лечении этого синдрома.
Реваскуляризация миокарда при кардиогенном шоке не приводит к немедленному восстановлению сократительной функции. Она восстанавливается в течение 2—3 сут, иногда
588
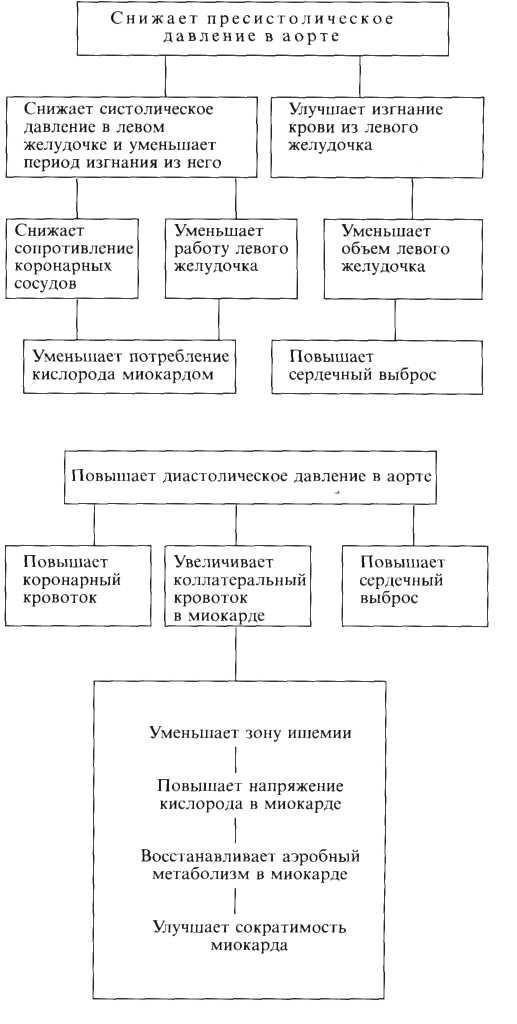
Таким образом, результаты хирургического лечения кар-диогенного шока в настоящее время следует считать обнадеживающими. При тщательном отборе больных хирургическое лечение, проводимое в ранние сроки, особенно с использованием вспомогательного кровообращения, может давать лучшие результаты, чем лекарственное.
Основными методами лечения кардиогенного шока являются контрпульсация внутриаортальным баллоном и другие методы вспомогательного кровообращения.
5.5. ВСПОМОГАТЕЛЬНОЕ КРОВООБРАЩЕНИЕ ПРИ СЕРДЕЧНОЙ И КОРОНАРНОЙ НЕДОСТАТОЧНОСТИ
Одним из наиболее распространенных методов вспомогательного кровообращения является контрпульсация внутри-аортальным баллоном.
Метод артериальной контрпульсации был разработан D. Harken в 1958 г. и R. Clauss в 1961 г. Принцип метода заключается в удалении определенного объема крови из артериального русла и возвращении этого объема в артериальное русло в фазу диастолы.
В 1962 г. S. Moulopoulos предложил использовать специальный внутриаортальный баллон, который в фазу диастолы быстро раздувался и спадался в фазу систолы сердца (рис. 5.40).
В 1968 г. A. Kantrowitz сообщил о применении контрпульсации внутриаортальным баллоном у больных с кардиоген-ным шоком с достоверным улучшением показателей выживаемости благодаря улучшению гемодинамики.
D. Bregman и соавт. в 1971 г. разработали двухкамерный внутриаортальный баллон. Были предложены также трехка-мерные внутриаортальные баллоны, которые увеличивали эффективность контрпульсации.
В нашей стране метод контрпульсации внутриаортальным баллоном разработали и применили В. И. Бураковский, В. Г. Барвынь, В. И. Шумаков и В. Е. Толпекин, М. Я. Руда в 1968—1971 гг.
Биодинамический эффект контрпульсации. Контрпульсация у больных с сердечной недостаточностью вследствие ишемического поражения миокарда, обусловленного коронарной недостаточностью, приводит к следующим изменениям показателей гемодинамики: систолическое артериальное давление снижается, диастолическое повышается; сердечный индекс увеличивается с 15 до 40%; давление «заклинивания» в легочных капиллярах уменьшается в среднем на 18%; увеличивается индекс ударной работы левого желудочка; снижается потребность миокарда в кислороде.
Основная роль контрпульсации заключается в разгрузке левого желудочка, улучшении коронарной перфузии и ок-сигенации миокарда (схема 5.2).
Показания. Внутриаортальная контрпульсация применяется для лечения сердечной недостаточности, вызванной острым нарушением коронарного кровообращения, или для механической поддержки сердца, если его сократительная функция нарушена в результате операции или других причин. Выделяют абсолютные, относительные и возможные показания для использования этого метода [Носов Ю. В., 1979, 1981, 1983; Bregman D., 1979] (табл. 5.8).
Таким образом, контрпульсация может быть использова-
СХЕМ А 5.2. ФИЗИОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ,
ХАРАКТЕРНЫЕ ДЛЯ КОНТРПУЛЬСАЦИИ
[ШУМАКОВ В. И., ТОЛПЕКИН В. Е., 1980]
на для профилактики расстройств коронарного кровообращения и лечения острой сердечной недостаточности.
У больных с кардиогенным шоком или с рецидивирующим ангинозным статусом, а также при моделировании острой коронарной недостаточности (или левожелудочковой недостаточности), т. е. на фоне выраженных метаболических нарушений в миокарде, контрпульсация заметно увеличивает коронарный кровоток [Руда М. Я., 1971; Шумаков В. И. и др., 1971; Jacobey J., 1971; Vogel J., 1971 ].
589
Таблица 5.8.
Показания к
контрпульсации (КП) в
клинике
Ниже представлены гемодинамические и другие показатели при острой сердечной недостаточности, при которых показана контрпульсация.
Артериальное давление Менее 90 мм рт. ст. Давление «заклинивания» в ле гочных капиллярах Более 20 мм рт. ст. Диастолическое давление в ле гочной артерии Более 20 мм рт. ст. Сердечный индекс Менее 2 л/(мин • м2) Ударный индекс Менее 40 мл/м2 Индекс ударной работы левого
желудочка Менее 10 гм/м2
Адреналин Более 0,5 мкг/(кг ■ мин)
Дофамин Более 5 мкг/(кг ■ мин)
Мочевыделение Менее 50 мл/ч
Кожные покровы Выраженный перифери ческий спазм
Дополнительными факторами служат нарастание ишемии миокарда, нарушение ритма сердца, необходимость увеличения дозы адреномиметиков при восстановленных показателях объема циркулирующей крови.
Предоперационная контрпульсация. При реваскуляризации миокарда у больных с высокой степенью операционного риска и у больных с исходно резко нарушенной контрак-тильной функцией миокарда применение контрпульсации перед операцией направлено на снижение частоты развития ишемии миокарда, тяжелых нарушений ритма и гемодинамики в период индукции в наркоз и до подключения АИК.
Клинические и гемодинамические параметры, определяющие показания к контрпульсации в предперфузионном пе-
риоде: а) стеноз ствола левой коронарной артерии более 75% в сочетании с окклюзией правой коронарной артерии; б) нестабильная стенокардия; в) снижение показателей сердечного выброса (менее 2,5 л/(минм2), фракции изгнания левого желудочка (менее 40%) и конечно-диастолического давления левого желудочка более 18 мм рт. ст. Эффективность предоперационной контрпульсации определяют по индексу жизнеспособности эндокарда. При эффективной контрпульсации он возрастает почти в 2 раза.
Послеоперационная контрпульсация. Сердечная недостаточность после операций на сердце—наиболее частое показание для использования метода контрпульсации.
Время начала контрпульсации имеет большое значение, так как от ее своевременного проведения зависят конечные результаты.
Если при отключении АИК выявляется сердечная недостаточность и необходимо использовать адреналин в дозе более 0,5 мкг/(кг • мин), следует попытаться восстановить кон-трактильную функцию миокарда. Для этого при пережатых полых венах дренируют левый желудочек и проводят перфузию в течение 30 мин. При отсутствии эффекта необходимо продолжить ИК, ввести внутриаортальный баллон, начать контрпульсацию и, постепенно снижая производительность аппарата, закончить перфузию. В лечении таких больных используют инотропные стимуляторы в сочетании с вазодилататорами, что на фоне контрпульсации улучшает показатели гемодинамики. По нашим данным, сердечный индекс возрастает на 20%, ударный индекс—на 18%, а ОПС снижается на 15%.
Контрпульсация при синдроме нестабильной стенокардии используется у больных непосредственно перед операцией аортокоронарного шунтирования или у больных с постинфарктной нестабильной стенокардией для стабилизации коронарного кровообращения.
Контрпульсация при остром инфаркте миокарда, осложненном кардиогенным шоком. На протяжении ряда лет большинство исследователей пришли к выводу, что после того, как поставлен диагноз кардиогенного шока, необходимо начинать как лекарственное лечение, так и контрпульсацию [Аронов А. Е., 1981].
В ряде работ была показана зависимость показателей выживаемости больных от срока применения контрпульсации при кардиогенном шоке. Они оказались гораздо выше в группе больных, которым контрпульсация была начата немедленно.
Физиологические и гемодинамические эффекты контр-пульсации имеют совершенно противоположную направленность по сравнению с эффектом от применения адреномиметиков.
При лечении кардиогенного шока контрпульсация оказывает гемодинамический эффект, который проявляется во времени. Это позволило выделить понятие «первичный гемодинамический эффект», который характеризуется увеличением сердечного индекса, снижением общего периферического сопротивления и давления «заклинивания» в легочной артерии, повышением артериального давления и в целом уменьшением работы левого желудочка приблизительно на 10%.
Положительный первичный гемодинамический эффект— это улучшение или нормализация кровообращения у 45% больных через 12—23 ч после начала вспомогательного
590
кровообращения; если это улучшение наступает, то его можно расценивать как положительный вторичный гемодинами-ческий эффект. Однако у 55% больных вторичный гемодина-мический эффект отрицательный. Его выявляют методом пробного отключения контрпульсации на 20—30 мин.
Если показатели гемодинамики остаются стабильными или уменьшаются незначительно, можно судить о положительном вторичном гемодинамическом эффекте; если же после отключения контрпульсации они вновь резко снижаются, то это свидетельствует об отрицательном вторичном гемодинамическом эффекте. Отсутствие положительного вторичного гемодинамического эффекта в течение 3 сут указывает то, что возможности контрпульсации как средства борьбы с кардиогенным шоком практически исчерпаны.
При положительном вторичном гемодинамическом эффекте отключение контрпульсации у больного с кардиогенным шоком следует производить постепенно. Вначале контрпульсация переводится на режим 1:2, затем 1:4, после этого вспомогательное кровообращение прекращают. Если гемодинамические показатели остаются стабильными, то внутриаортальный баллон удаляют через 6—8 ч после отключения вспомогательного кровообращения.
При отрицательном вторичном гемодинамическом эффекте больной становится полностью зависимым от контрпульсации. Возникновение «баллонозависимости» объясняется отсутствием резервов контрактильной функции миокарда, и в этих случаях может встать вопрос о других более эффективных методах вспомогательного кровообращения (обход левого желудочка сердца) или о замене сердца как насоса.
У больных, выведенных из шока, в последующем наблюдается ряд осложнений: левожелудочковая недостаточность, пневмония, почечная и печеночная недостаточность, осложнения контрпульсации.
Хотя с помощью внутриаортальной баллонной контрпульсации из шока можно вывести около 50% больных, 30% из них погибают от осложнений имеющегося инфаркта миокарда, последствий кардиогенного шока, нарушения функций жизненно важных органов вследствие изменений органной перфузии.
По данным различных авторов, летальность от кардиогенного шока после применения контрпульсации составляет 70—85%. Таким образом, контрпульсация позволяет снизить летальность на 15—20%.
Другие методы вспомогательного кровообращения. В тех случаях, когда насосную функцию желудочков сердца нельзя восстановить с помощью контрпульсации, используют механические системы, которые практически полностью заменяют их функцию.
Эти системы можно условно разделить по принципам их работы: 1) внутрижелудочковый баллон; 2) механический прямой кардиомассаж; 3) подсадка второго сердца в качестве вспомогательного насоса; 4) механические устройства обхода желудочков сердца.
Все эти системы пока находятся в стадии экспериментально-клинической апробации.
5.6. ПОСТИНФАРКТНАЯ АНЕВРИЗМА СЕРДЦА
Аневризма сердца впервые описана в конце XVIII в. [Hunter J., 1757; Galeati D., 1757].
5.41. Различные виды постинфарктной аневризмы левого же-
.П'дочка.
а— истинная аневризма; б — функциональная аневризма; в —
ложная аневризма.
В период систолы (I) и диастолы (II) истинная аневризма
совершает парадоксальные движения.
В 1914 г. М. Sternberg отметил связь между развитием аневризмы сердца, поражением коронарных артерий и инфарктом миокарда.
Анатомически аневризму сердца определяют как участок истонченной рубцовой ткани с выпячиванием стенки желудочка в этой области. Функциональная аневризма представляет собой зону миокарда, потерявшую сократительную способность и выбухающую при систолических сокращениях. Функциональная аневризма представлена фиброзно-мы-шечной или истонченной мышечной тканью. Ложная аневризма желудочка образуется при разрыве инфарцирован-ного миокарда и формировании полости, ограниченной сращениями в перикарде (рис. 5.41).
Частота. По патологоанатомическим данным, частота выявления постинфарктной аневризмы составляет 8,5—34% [Колобутина О. М., 1961; Петровский Б. В., Козлов И. 3., 1965; Davis A. et al., 1971]. В клинике после обширного трансмурального инфаркта аневризма формируется в среднем у каждого пятого больного [Успенский Ю. Н. и др., 1974].
У мужчин аневризма сердца встречается в 5—7 раз чаще, чем у женщин. Среди лиц. перенесших инфаркт миокарда
597
в возрасте до 40 лет, аневризма встречается у 13%, а старше 60 лет—у 5,5% [Аронов Д. М., 1974]. Это объясняется тем, что в молодом возрасте развиваются более обширные трансмуральные инфаркты.
Этнология и патогенез. Различают врожденные и приобретенные аневризмы сердца. При врожденных аневризмах, по-видимому, формируются дивертикулы правого и левого желудочков, о чем свидетельствуют описания единичных наблюдений.
Приобретенные аневризмы сердца делят на посттравматические и постинфарктные. Посттравматические аневризмы встречаются редко — после ранения сердца холодным или огнестрельным оружием в области поврежденной стенки левого желудочка, а также при тупой травме сердца.
Формирование постинфарктной аневризмы возможно как в остром периоде инфаркта миокарда, так и в отдаленном — через несколько месяцев.
Предрасполагающими факторами в формировании аневризмы являются: артериальная гипертензия в остром периоде инфаркта, несоблюдение постельного режима, применение кортикостероидов [Schlichter J. et al., 1954; Bulkley B. et al., 1974].
Патологическая анатомия. Выделяют три формы аневризмы сердца: диффузную, мешковидную и расслаивающую.
Диффузная аневризма представлена участком рубцовой ткани, постепенно переходящим в зону нормального миокарда. Мешковидная аневризма характеризуется наличием «шейки», которая, расширяясь, образует мешковидную полость. Расслаивающая аневризма образуется вследствие разрыва эндокарда и формируется мешок в толще миокарда под эпикардом. Нередко наблюдаются множественные аневризмы или дочерние аневризмы из стенки аневризматиче-ского мешка.
Локализация аневризмы. В 85% случаев аневризма располагается по передней, переднебоковой стенке левого желудочка или в области его верхушки. Такая доминирующая локализация аневризмы соответствует частоте ате-росклеротического поражения и тромбоза передней межжелудочковой ветви ЛВА. Тромбоз полости аневризма-тического мешка наблюдается у 40% больных [Davis R. et al., 1971], но мелкие пристеночные тромбы встречаются гораздо чаще. Степень организации тромба неодинакова. Его поверхностные пласты часто представлены свежими красными тромбами.
Структура аневризматического мешка. Различают мышечные, фиброзно-мышечные и фиброзные аневризмы сердца. В стенке мешка, как правило, выявляются воспалительные изменения—тромбоэндокардит. При длительно существующих аневризмах нередко встречаются очаги кальциноза. Фиброзные аневризмы плотно сращены с перикардом, нередко полость перикарда заращена. Структура сохранившегося миокарда левого желудочка отражает функциональные перегрузки—он гипертрофирован, утолщен. При длительном течении аневризмы развиваются дистрофические изменения в мышечных волокнах [Горнак К. А., Копьева Т. Н., 1971].
Гемодинамика. При аневризме вследствие замещения миокарда рубцовой тканью нарушается нормальный механизм сокращения левого желудочка. Для характеристики нарушения сокращения стенок желудочка был предложен термин «асинергия» [Gorlin R. et al., 1967; Klein M. et al., 1967]. Для аневризмы сердца характерны две формы асинергии—акинезия и дискинезия. Основными факторами, нарушающими
гемодинамику при наличии постинфарктной аневризмы, служат: а) снижение систолической функции; б) нарушение диастолической функции; в) митральная регургитация.
Снижение систолической функции левого желудочка наступает вследствие выключения из процесса сокращения большого участка миокарда, превышающего 20—22% площади левого желудочка в период диастолы. При этом кривая Франка—Старлинга смещается вниз и вправо. В результате снижаются напряжение и сила сокращения левого желудочка во время систолы [Gauzet R. et al., 1978].
Нарушение диастолической функции обусловлено нарушением взаимоотношения «давление—объем», что ведет к непропорциональному увеличению конечно-диастолического давления.
Митральная регургитация обусловлена чаще всего дила-тацией митрального кольца, повреждением сосочковых мышц, что является причиной дальнейшего увеличения объема левого желудочка, снижения выброса крови [Cheng Т., 1971].
Дополнительными факторами, нарушающими внутрисер-дечную гемодинамику, являются флотация крови из полости левого желудочка в аневризму и обратно, рубцовое поражение и нарушение функции межжелудочковой перегородки, ухудшение контрактильной способности сокращающейся части левого желудочка.
Компенсаторные механизмы, связанные с гипертрофией сохранившегося миокарда и дилатацией полости левого желудочка, по мере увеличения размеров аневризмы также нарушаются. Причины нарушения компенсаторных механизмов заключаются в нарушении доставки кислорода к гипертрофированному миокарду при множественном поражении коронарных артерий, а также в нарушении субэндо-кардиальной перфузии из-за увеличения напряжения стенки левого желудочка и высокого конечно-диастолического давления [Рабкин И. X. и др., 1985; Шабалкин Б. В. и др., 1985].
Клиника. У всех больных с аневризмой сердца, как правило, в анамнезе отмечается инфаркт миокарда. Характер течения перенесенного инфаркта миокарда указывает на возможность развития постинфарктной аневризмы по следующим признакам: наличие сердечной недостаточности, синдрома Дресслера, несоблюдение постельного режима в первые дни инфаркта, высокое артериальное давление, эпизоды артериальной тромбоэмболии.
Жалобы больных разнообразны. При развитии сердечной недостаточности появляется одышка. Позднее к ней присоединяются отеки, увеличение печени, приступы удушья. Больных постоянно беспокоят тупые боли в области сердца. Типичная стенокардия покоя и напряжения отмечается у 60% больных, различного рода аритмии—у 30% больных.
При осмотре отмечаются усиленная пульсация верхушки сердца и слабый пульс на лучевой артерии. Парадоксальная пульсация в прекордиальной области является патогномо-ничным симптомом аневризмы сердца, но только при ее локализации в области верхушки сердца или передней стенки левого желудочка. Аневризмы задней стенки не вызывают феномена парадоксальной пульсации. Следует определять парадоксальную пульсацию в положении больного на спине и на левом боку. При повороте больного на левый бок сердце несколько приближается к грудной стенке и пульса-
592
ция становится более ощутимой. При небольших размерах аневризмы эти симптомы могут отсутствовать.
Систолический шум у больных с аневризмой сердца, хотя и обнаруживается довольно часто, является результатом относительной недостаточности митрального клапана или дисфункции клапанов в связи с поражением со-сочковых мышц и дилатацией фиброзного кольца митрального клапана.
Стенокардия может развиваться в результате атероск-леротического поражения коронарных артерий, увеличения диастолической «жесткости» левого желудочка и нарушения перфузии субэндокардиальных слоев миокарда. По мере нарастания сердечной недостаточности и дилатации левого желудочка интенсивность ангинозных приступов уменьшается [Бусленко Н. С, 1974; Cabin M. et a!., 1980]. Причины этого явления неясны.
Сердечная недостаточность наблюдается у 58—76% больных [Cosgrove D. et al.. 1978; Harlan В. et al., 1981 ]. У одних больных она выражена отчетливо, у других ее форма скрытая, выявляется при пробах с физической нагрузкой.
Основными причинами сердечной недостаточности являются снижение фракции выброса сокращающейся части миокарда левого желудочка, повышение конечно-диастоличе-ского объема и давления, дилатация полости левого желудочка.
У ряда больных наблюдаются приступы кардиальной астмы с картиной отека легких, что обусловлено увеличением постнагрузки и ишемической дисфункцией функционирующей части миокарда левого желудочка.
Нарушения ритма встречаются в виде желудочковой экстрасистолии, приступов пароксизмальной желудочковой тахикардии и фибрилляции желудочков. В основе пароксизмальной желудочковой тахикардии, которая затем может перейти в фибрилляцию желудочков, лежит механизм риен-три. Зона риентри, по данным катетеризации и интраопера-ционного картирования, находится в субэндокардиальной части на границе рубца и жизнеспособного миокарда [Harlan В. et al., 1981; Josephson M. et al.. 1983].
Фибрилляция желудочков связана как с нарушением коронарного кровообращения, так и с наличием желудочковых экстрасистол.
Тромбоэмболия встречается у 2—5% больных. Основным источником эмболии является тромб в полости аневризмы. Наиболее часто тромбоэмболия происходит в бедренно-подколенный или подвздошный сегмент, реже—в плечего-ловной ствол.
Причиной относительно редкой тромбоэмболии при частом тромбозе являются характер тромба и его фиксация. При аневризме тромб имеет широкую площадку прикрепления и не выступает в полость левого желудочка.
Диагностика. Патогномоничных признаков аневризмы сердца при электрокардиографии не выявляется. Все изменения на ЭКГ отражают картину перенесенного инфаркта миокарда. Для аневризмы сердца наиболее характерна стабильная картина: отсутствует зубец R, глубокие зубцы Q в трех грудных отведениях или более; это выражено особенно отчетливо, когда дугообразные сегменты ST переходят в глубокий зубец Т (рис. 5.42). Подобное можно обнаружить у больных с диффузной гипокинезией без развития аневризмы.
Ве.юэргометри.ч повышает возможность диагностики
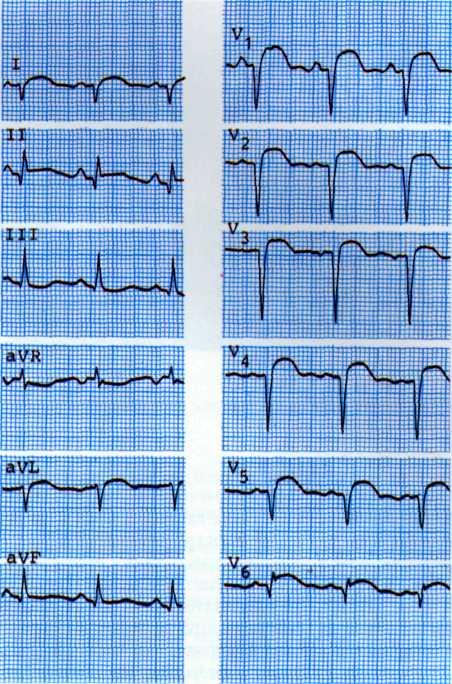
5.42. Электрокардиограмма больного с хронической постинфарктной аневризмой переднеперегородочно-верхушечной области левого желудочка с переходом на боковую стенку.
аневризмы. Особую ценность метод приобретает для выявления скрытых гемодинамических нарушений и определения порога толерантности к нагрузке как критерия коронарного резерва.
Одномерная эхокардиография имеет ограниченное значение в диагностике аневризмы сердца, но позволяет оценить конфигурацию и объем левого желудочка. Двухмерная эхо-кардиография позволяет визуализировать весь левый желудочек, оценить его объем, фракцию изгнания, диагностировать внутриполостной тромбоз, изучить показатели контра-ктильной функции. Результаты двухмерной эхокардиографии имеют высокую степень корреляции с рентгеноконтрастной вентрикулографией.
Увеличение размеров сердца и изменение контуров левого желудочка при рентгеноскопии грудной клетки в прямой проекции дают представление о размерах левого желудочка. Кардиомегалия не является признаком аневризмы, но может служить косвенным доказательством ее существования. При рентгеноскопии сердца в нескольких проекциях можно выявить парадоксальную пульсацию. Для мешковидной аневризмы сердца характерна деформация левого контура, появление «горба» или удлинение дуги левого желудочка.
Рентгенокимография выявляет «немые» зоны по контуру левого желудочка и смещение фаз кимографических зубцов.
593

При электрокимографии видна парадоксальная пульсация. Функциональное состояние миокарда оценивают по анализу фазы изометрического напряжения, времени изгнания крови из левого желудочка и времени заполнения аорты [Коган Б. М., 1969]. При недостаточности кровообращения рентгенологически обнаруживаются признаки застоя в легких и увеличение левого предсердия.
Радионуклидные методы исследования. Изотопная вентри-кулография позволяет судить о локализации, протяженности аневризмы в покое и при нагрузке и определить основные параметры контрактильной функции левого желудочка.
Для определения локализации размеров аневризмы левого желудочка, Тромбоза ее полости и оценки сократительной функции миокарда вентрикулография имеет решающее значение (рис. 5.43). Основные признаки аневризмы обусловлены нарушением подвижности стенки левого желудочка в виде парадоксальной систолической экспансии или акинезии. Размеры аневризмы имеют прямую корреляцию со степенью нарушения сократительной функции миокарда левого желудочка: конечно-диастолический объем и диастолическое давление увеличиваются, а фракция изгнания снижается.
При анализе данных вентрикулографии решающее значение имеет площадь аневризмы и сокращающейся части левого желудочка, поскольку общая фракция изгнания не отражает степени нарушения функции. Площадь аневризмы наиболее удобно рассчитать по методу центрального угла, используя формулу, предложенную М. Klein и соавт. (1967), или метод графической интеграции D. Crawford (1971). Значение рассчитанной площади аневризмы относят к величине внутренней поверхности сердца в конце диастолы и выражают в процентах (рис. 5.44).
Снижение фракции изгнания сокращающейся части левого желудочка менее 40% является плохим прогностическим признаком.
При коронарографии локализация аневризмы четко коррелирует с атеросклеротическим поражением коронарных
артерий. Аневризмы передней и верхушечной областей левого желудочка формируются при окклюзии передней межжелудочковой артерии и ее диагональной ветви. Аневризма боковой и передней боковой стенок левого желудочка обусловлена поражением передней межжелудочковой ветви и огибающей ветви ЛВА.
Аневризма задней стенки левого желудочка образуется при поражении правой венечной артерии или огибающей ветви ЛВА.
Степень атеросклеротического поражения коронарной артерии, в бассейне которой образовалась аневризма, может быть различной. Чаще всего наблюдаются окклюзия и диффузное поражение всей артерии. В 2% случаев наблюдается удовлетворительная проходимость артерии, в зоне которой образовалась аневризма, что позволяет думать о реканали-зации тромба в коронарной артерии [Roberts W, 1976]. Частота поражения одного сосуда составляет 6—12,5%, поражение двух сосудов—13—43%, трех артерий—44— 80% [Шахов Б. Е., 1979; Gerbode F. et al., 1974; Rittenhause E. et al., 1982]. Коллатеральное кровообращение в зоне аневризмы обычно отсутствует.
Течение постннфарктной аневризмы. При лекарственном лечении за 5-летний период наблюдения показатель выживаемости составил примерно 20% [Schlichter J. et al., 1954; Dubnov M. et al, 1965; Roberts W. et al., 1980]. Основными факторами, определяющими показатель выживаемости, являются выраженность сердечной недостаточности, размеры аневризмы, фракция выброса, конечно-диастолическое давление и желудочковые аритмии.
Хирургическое лечение. Первая операция при аневризме левого желудочка была выполнена в 1944 г. Веек. Однако больной умер. С. Bailey в 1955 г. сделал первую операцию по закрытому методу.
В 1958 г. D. Cooley впервые выполнил резекцию аневризмы в условиях ИК. В настоящее время ИК стало основным методом, применяемым при таких операциях, что позволяет осуществить операцию радикальнее, обеспечить реваскуля-ризацию миокарда и резко снизить частоту тромбоэмболи-ческих осложнений.
Показания к хирургическому лечению постинфарктной аневризмы обоснованы теоретически: 1) иссечение рубцового поля увеличивает направленный внутрь желудочка вектор сокращения за счет иссечения несокращающей-
594
5.44. Определение площади аневризмы левого желудочка и расчет фракции изгнания.
а—по методу центрального угла [Klein M. et al., 1967]; S—площадь аневризмы; г—радиус круга, дуга которого соответствует кривизне несокращающегося сегмента; a — угол между радиусами, проведенными к границам зоны акинезии; п 3,14; /—коррекционный коэффициент увеличения; б— по методу графической интеграции [CrawfordD. et al., 1971J; W—длина и г — высота усеченных конусов, на которые разделена вся площадь аневризмы; в—расчет фракции изгнания левого желудочка и его сокращающейся части; V—объем; А — площадь в сантиметрах; L — максимальный перпендикуляр к разделительной линии; остальные обозначения те же, что на рис. 5.41а.
ся части левого желудочка; 2) нормализация объема левого желудочка снижает напряжение его стенок, необходимое для развития нужного внутрижелудочкового давления, которое по закону Лапласа тем выше, чем больше объем; 3) снижение напряжения стенок при уменьшении объема способствует увеличению степени и скорости сокращения мышечных волокон.
Операция показана при больших аневризмах, превышающих 22% площади левого желудочка, и при недостаточности кровообращения I—ПА стадии по Стражеско—Василенко. При недостаточности кровообращения III стадии операция не ликвидирует гемодинамических расстройств и не улучшает контрактильной функции миокарда.
Основная задача хирургического лечения заключается не только в иссечении аневризмы, но и в реваскуляризации миокарда, поэтому показания к операции аортокоронарного шунтирования при постинфарктной аневризме совпадают с таковыми при хронической ИБС.
При сердечной недостаточности и стенокардии необходима комбинированная операция—иссечение аневризмы и аортокоронарное шунтирование.
Техника операции. Доступ к сердцу осуществляется путем срединной стернотомии. У ряда больных имеются массивные сращения между перикардом и сердцем, особенно в области аневризмы. Поэтому для подключения АИК освобождают только восходящую часть аорты и участок
правого предсердия. Выделение аневризмы и полную мобилизацию сердца не производят, пока не будет начато ИК, таким образом фактически исключается опасность тромбоэмболии из аневризмы.
В условиях гипотермической перфузии (28° С) пережимают аорту и вводят кардиоплегический раствор. Затем выделяют из сращений сердце и область аневризмы. Сердце выводят в рану. Аневризму вскрывают линейным разрезом по передней стенке. После тщательного удаления тромбов осуществляют ревизию сердца со стороны полости левого желудочка (рис. 5.45). Чтобы избежать попадания тромбов в полость левого предсердия или аорту, в левый желудочек ниже тромба вводят влажную салфетку. При осмотре полости левого желудочка выявляют границу между миокардом и рубцовой тканью. Аневризму иссекают с оставлением рубцовой ткани до 1,5 см с каждой стороны. Более полное иссечение аневризмы в пределах здорового миокарда опасно из-за повреждения сосочковых мышц и уменьшения полости левого желудочка. При уменьшении полости левого желудочка резко ухудшается его функция и может развиться сердечная недостаточность.
Ушивание разреза левого желудочка осуществляют двухрядным швом. Первый ряд состоит из П-образных швов на тефлоновых прокладках, второй ряд непрерывный об-вивной.
Тщательно удаляют воздух из полости левого желудочка, снимают зажим с аорты и восстанавливают коронарную перфузию. После стабилизации гемодинамики прекращают ИК и заканчивают операцию.
Септошастика. При наличии аневризмы межжелудочковой перегородки иссечение стенки аневризмы не приводит к ликвидации гемодинамических нарушений, так как аневри-зматически измененная перегородка продолжает нарушать контрактильную функцию левого желудочка. В связи с этим разработан ряд методов коррекции парадоксальной подвижности межжелудочковой перегородки. D. Cooley и соавт. (1980) предложили использовать пластику перегородки с помощью тефлоновой ткани, которую подшивают непрерывными швами к перегородке и передней стенке левого желудочка (рис. 5.46). Создание такой искусственной перегородки позволяет уменьшить или прекратить парадоксальную пульсацию истонченной межжелудочковой перегородки.
Второй метод септопластики заключается в укорочении перегородки за счет наложения П-образных швов на теф-
595
Резекция аневризмы и аортокоронарное шунтирование. Во время стернотомии выделяют большую подкожную вену и подготавливают ее в качестве трансплантата. Вначале выполняют резекцию аневризмы по описанному методу. Полость левого желудочка ушивают, оставляя левожелудоч-ковый дренаж. Затем накладывают дистальные анастомозы между венозным трансплантатом и коронарными артериями, которые необходимо шунтировать. Все эти этапы операции осуществляют при пережатой аорте в условиях фар-макохолодовой кардиоплегии.
Сделав все дистальные анастомозы, удаляют дренаж из левого желудочка, предупреждая возможность развития воздушной эмболии, снимают поперечный зажим с аорты и восстанавливают сердечную деятельность. Затем накладывают на пристеночно отжатую аорту проксимальные анастомозы с шунтами. После пуска крови по шунтам и нормализации гемодинамики прекращают ИК.
Реконструкция левого желудочка после резекции аневризмы. Изучение непосредственных и отдаленных результатов резекции постинфарктной аневризмы с закрытием полости левого желудочка линейным швом показало, что у большинства больных наблюдается значительное клиническое улучшение, в том числе при наличии симптомов застойной сердечной недостаточности [Louagie Y. et al.. 1989]. Однако в ряде работ было продемонстрировано, что, несмотря на значительное клиническое улучшение, после резекции аневризмы не отмечалось изменений функциональной способности левого желудочка [Sesto M. et al., 1979; Froelich R. Т. et al., 1980]. По данным этих авторов, аневризмэктомия с линейным швом приводит лишь к уменьшению конечно-диастолического и конечно-систолического объемов левого желудочка, тогда как фракция изгнания не изменяется. В работе D. Dymond и соавт. (1982) показано, что аневризмэктомия способствует улучшению функции левого желудочка в покое, тогда как при нагрузке сохраняются нарушения контрактильности. В противоположность этому N. С. Taylor и соавт. (1985) считают, что, хотя функциональная способность левого желудочка после аневризмэктомии в состоянии покоя не улучшается, при нагрузках она улучшается. Авторы предположили, что этот эффект может быть обусловлен как резекцией аневризмы, так и сопутствующим шунтированием пораженных коронарных артерий.
Стремление улучшить результаты аневризмэктомии привело к разработке новых методов закрытия раны левого желудочка после резекции аневризмы, при использовании которых, по мнению их создателей, не нарушается в отличие от традиционной методики геометрия левого желудочка и наблюдаются лучшие функциональные результаты. Эти методы разработал бразильский хирург A. Jatene, который в 1985 г. вместо традиционной методики резекции аневриз-
5.45. Резекция постинфарктной аневризмы сердца.
а — общий вид аневризмы: б— вскрыта по.юань аневризмы,
удаление тромбов; в—ушивание разреза левого желудочка.
596
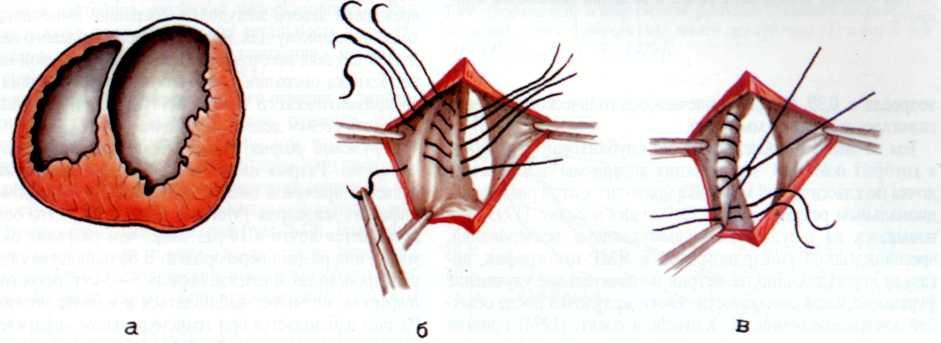
5.47. Септоп.шстика с применением отдельных швов для укорочения межжелудочковой перегородки [Cooley D., 1985]. а — поперечный срез сердца, рубцовые изменения перегородки и передней стенки левого желудочка (заштриховано ); б — накладывают отдельные швы с захватом перегородки; в — при завязывании швов происходит пликация перегородки, что устраняет ее парадоксальную пульсацию.
мы предложил методику реконструкции левого желудочка после аневризмэктомии. Основным элементом методики Жатене является сужение шейки аневризматического мешка после его удаления посредством наложения П-образных или двух полукисетных швов с последующим ушиванием оставшегося небольшого отверстия П-образными швами на прокладках.
В 1977 г. W. M. Dagget и соавт. сообщили о пластическом закрытии левого желудочка тефлоновой заплатой после резекции задней аневризмы. В 1979 г. L. Levinsky и соавт. описали случай резекции обширной левожелудочковой аневризмы и инфарктэктомии, после которой полость левого желудочка значительно уменьшилась: пришлось использовать синтетическую заплату для ее реконструкции, что дало хорошие результаты. Эти операции положили начало применению методов пластического закрытия стенки левого желудочка после резекции аневризмы. A. Jatene (1985) предложил комбинацию собственной методики восстановления геометрии левого желудочка с пластикой синтетической заплатой.
Активным пропагандистом этого метода стал хирург из Монако V. Dor. К 1990 г. на основании изучения морфологии левого желудочка и его функции в отдаленные сроки после резекции аневризмы более чем у 200 больных автор пришел к выводу, что пластика левого желудочка после аневризмэктомии с использованием заплаты имеет значительные преимущества перед традиционным методом наложения линейного шва. При использовании традиционной методики фракция выброса увеличилась в среднем на 0.08, тогда как при применении заплаты—на 0.17. V. Dor придает большое значение удалению рубцово измененной межжелудочковой перегородки из полости левого желудочка при вшивании заплаты, а также шунтированию передней межжелудочковой ветви с целью реваскуляризации проксимальных отделов межжелудочковой перегородки и проводящей системы. В последнее время им разработана новая методика, при которой в качестве заплаты используют отслоенную фиброзно измененную часть межжелудочковой перегородки. При этом устье аневризматического мешка редуцируют путем наложения двух полукисетных швов по методике Жатене. По мнению некоторых авторов, такая методика позволяют добиться оптимальной геометрии полости левого желудочка после аневризмэктомии, что обеспечивает отличные функциональные результаты [Бокерия Л. А. и др., 1995]. По данным М. Salati и соавт. (1993). пластика с использованием заплаты в сочетании с шунтированием ПМЖВ ЛВА значительно улучшает кон-трактильную функцию левого желудочка: фракция выброса
597
возросла с 0,39 до 0,57, конечно-диастолическое давление снизилось с 20 до 15 мм рт. ст.
Тем не менее в последнее время опубликован ряд работ, в которых показано, что резекция аневризмы левого желудочка по классической методике приводит к отличным функциональным результатам. J. Elefteriades и соавт. (1993), основываясь на результатах радионуклидных исследований, чреспищеводной эхокардиографии и ЯМР-томографии, доказали нормализацию геометрии и значительное улучшение функциональной способности левого желудочка после обычной аневризмэктомии. К. Kawachi и соавт. (1994) пришли к выводу, что аневризмэктомия по классической методике приводит к улучшению кривой Франка—Старлинга и восстановлению функциональной способности левого желудочка. Специальная экспериментальная работа была посвящена сравнительной оценке гемодинамических эффектов применения традиционной методики наложения линейного шва и методики с пластическим закрытием левого желудочка [Nicolosi A. et al., 1990]. Несмотря на то что экспериментальная модель не совсем соответствовала реальной ситуации при наличии левожелудочковой аневризмы, нужно отметить, что авторы не выявили значительных преимуществ методики с использованием заплаты перед традиционной методикой.
Следует, таким образом, подчеркнуть, что новые методики пластического закрытия левого желудочка после аневризмэктомии нуждаются в дальнейшем совершенствовании.
Операции при некоторых разновидностях аневризмы левого желудочка. При формировании .южных аневризм левого желудочка стенки ее образуются за счет организованного тромба, прочно сращенного с перикардом. Выделить такую аневризму, отделить ее от перикарда невозможно. В связи с этим операция имеет ряд технических особенностей. После подключения АИК осуществляют кар-диоплегию. На остановленном сердце выделяют переднюю поверхность перикарда и непосредственно через перикард вскрывают полость левого желудочка. Со стороны полости левого желудочка из вскрытой аневризмы удаляют тромбы. Мобилизацию задней стенки левого желудочка выполняют, контролируя края разреза желудочка с внутренней и наружной сторон. Резекция аневризмы в этих случаях не произ-
водится, а опорожняется полость ложной аневризмы и ушивается отверстие в стенке желудочка с помощью П-образных швов на тефлоновых прокладках.
Травматическая аневризма левого желудочка. Если травматическая аневризма образуется в результате острого повреждения левого желудочка, операцию выполняют по методу, описанному для ложной аневризмы левого желудочка. В этих случаях иссечение аневризмы как таковой невозможно. Техника операции заключается в освобождении полости аневризматического мешка от тромбов и ушивании краев дефектов стенки левого желудочка.
Наружный разрыв левого желудочка в остром периоде инфаркта. Разрыв париетальной стенки левого желудочка является причиной смерти 24% больных в остром периоде инфаркта миокарда [Moran J. et al., 1980]. Это осложнение встречается почти в 10 раз чаще, чем разрывы сосочковых мышц или разрыв перегородки. В большинстве случаев разрыв происходит в течение первых 3—5 сут. острого периода инфаркта, но может наблюдаться и в более поздние сроки. Разрыв наблюдается при трансмуральном инфаркте миокарда из-за некроза, интрамуральной гематомы или вследствие интрамурального формирования острой аневризмы с резким истончением стенки (рис. 5.48). Чаще всего он происходит на границе некротической и сокращающейся части миокарда. В большинстве случаев происходит разрыв париетальной стенки левого желудочка, крайне редко—правого желудочка или предсердия.
Диагностика разрывов крайне затруднительна. Однако существует ряд признаков, свидетельствующих о разрыве в остром периоде инфаркта миокарда.
Клиническая картина наружного разрыва. Факторы, увеличивающие риск разрыва: 1) рецидив боли без изменений на ЭКГ. характеризующих повторный инфаркт миокарда или расширение инфаркта; 2) артериальная гипер-тензия после инфаркта миокарда; 3) первичный инфаркт миокарда; 4) трансмуральный инфаркт миокарда в первые 3—5 дней.
Симптомы, позволяющие заподозрить разрыв инфаркта миокарда: 1) жидкость в полости перикарда, выявляемая при эхокардиографии: 2) повторяющиеся тяжелые боли без развития повторного инфаркта; 3) М-комплекс на ЭКГ.
Терминальные симптомы: 1) тампонада и кровь в полости перикарда; 2) электромеханическая диссоциация; 3) отсутствие эффекта от наружного массажа сердца.
По данным большинства авторов, разрыв миокарда чаще наблюдается у женщин, чем у мужчин. В большинстве случаев разрыв приводит к тампонаде сердца и внезапной смерти больных. Однако в ряде случаев из-за падения артериального давления и формирования тромба кровотечение может
598
на некоторое время остановиться, что позволяет после установления диагноза взять больного в операционную и ушить наружный разрыв. Точный диагноз можно установить только путем пункции перикарда. В этом случае проводятся реанимационные мероприятия, постоянно удаляется кровь из полости перикарда; больного срочно доставляют в операционную, где после стернотомии продолжают открытый массаж сердца, подключают АИК и ушивают разрыв. Операцию можно выполнить без подключения АИК. В 1972 г. G. Fitzgibbon и соавт. сообщили о первом случае хирургического лечения постинфарктного разрыва.
Госпитальная летальность составляет 3—16% [Работников В. С. и др., 1984, Moran J. et al., 1980]. Основными факторами, влияющими на госпитальную летальность, являются низкая фракция выброса сокращающейся части миокарда, тяжелое атеросклеротическое поражение коронарных сосудов и застойная сердечная недостаточность. Ряд авторов указывают, что госпитальная летальность снижается благодаря улучшению реваскуляризации миокарда [Loop F. et al., 1981; Rittenhouse E., 1982].
Отдаленные результаты хирургического лечения. Клиническая оценка состояния больных после резекции постинфарктной аневризмы свидетельствует о том, что основная роль операции заключается в нормализации внутрисердеч-ной гемодинамики, предотвращении развития сердечной недостаточности и в улучшении контрактильной функции миокарда и реваскуляризации миокарда (рис. 5.49). Гемодинамика улучшается в том случае, когда после иссечения аневризмы конечно-диастолический и ударный объем приближается к норме и соответственно снижается КДД левого желудочка.
По данным D. Cosgrove (1978), 92% больных получают симптоматическое улучшение благодаря устранению стенокардии. Операция уменьшает степень сердечной недостаточности. При оценке отдаленных показателей выживаемости большую роль играет определение прогностических факторов, к которым относятся: 1) состояние контрактильной функции миокарда и тяжесть сердечной недостаточности; 2) степень поражения коронарного русла; 3) влияние аорто-коронарного шунтирования и другие технические особенности операции.
Общие отдаленные показатели выживаемости при резекции постинфарктной аневризмы в сочетании с аортокоро-нарным шунтированием составляют 76%. При наличии сердечной недостаточности отдаленные показатели выживаемости ниже—около 60% [Burton N. et al., 1979], при поражении одного сосуда—85%, тогда как при множественном поражении коронарных артерий и достаточной реваскуляризации—66% (рис. 5.50).
Применение септопластики по D. Cooley (1980) повышает процент выживаемости больных с 63 до 78. В целом хирургическое лечение позволило улучшить показатели выживаемости за 10-летний период наблюдений на 60% по сравнению с таковыми при лекарственном лечении.
5.7. ПОСТИНФАРКТНЫЙ ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
Постинфарктный ДМЖП—это одно из наиболее тяжелых осложнений инфаркта миокарда с разрывом перегородки
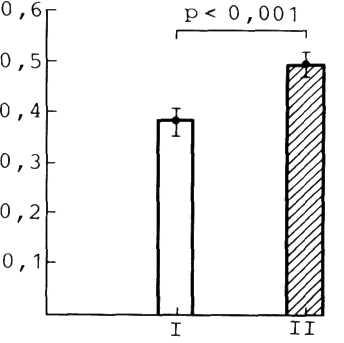
5.49. Графическое изображение фракции изгнания до резекции постинфарктной аневризмы левого желудочка (I) и после нее (II) [Василидзе Т. В., 1979].
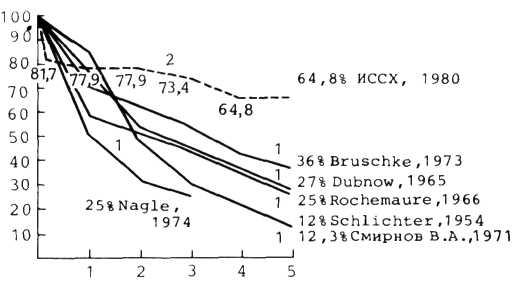
5.50. Актуарные кривые выживаемости при лекарственном (1) и хирургическом (2) лечении больных с постинфарктной аневризмой сердца, по данным ряда авторов и исследовательских групп.
По оси абсцисс — годы после инфаркта миокарда; по оси ординат — выживаемость в процентах.
и формированием внутрисердечного шунта со сбросом крови слева направо.
Впервые анатомическое описание постинфарктного ДМЖП дал P. Latham в 1845 г. Долгое время этот диагноз ставили только после патологоанатомического исследования. Впервые прижизненный диагноз установил F. Brunn (1923).
Частота. Разрыв межжелудочковой перегородки, по данным вскрытий, встречается у 1—2% больных, умерших от острого инфаркта миокарда [Radford M. et al., 1984]. Однако истинная частота разрыва перегородки при инфаркте может быть несколько больше, так как часть больных переживают инфаркт, а в дальнейшем многим из них проводится хирургическое лечение [Alpert J. et al., 1984].
Среди всех разрывов стенок сердца при инфаркте В. Edwards и соавт. (1984) обнаружили ДМЖП в 20% случаев, т. е. на каждые 5 наружных разрывов приходится один разрыв перегородки.
Патоморфология. У 70% больных наблюдается переднее расположение дефекта перегородки, соответствующее перед-
599
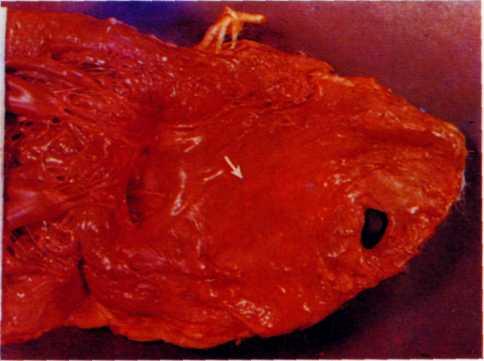
5.51. Макропрепарат сердца с постинфарктным дефектом межжелудочковой перегородки, расположенным в ее апикальной части (вид со стороны левого желудочка).
нему или передневерхушечному инфаркту миокарда. У остальной части больных развиваются задние ДМЖП.
Диаметр дефекта составляет 1—3 см. Края его фиброзно изменены или же представлены некротизированным миокардом, что зависит от сроков развития инфаркта (рис. 5.51).
Дефекты перегородки могут быть единичными и множественными. Последние наблюдаются в 30—40% случаев [Sabiston D., 1981 ]. A. Oyamadi и соавт. (1961) на основании больших статистических исследований выявили, что частота локализации дефектов в апикальной части перегородки составляет 86%, в средней—11%, в базальной—3%.
Выделяют два типа дефекта: простой и сложный. Простой тип дефекта характеризуется наличием прямого сообщения между правым и левым желудочком. При этом края отверстия между двумя камерами сердца находятся на одном уровне. В самой перегородке отсутствуют кровоизлияния и ее расслоение. При сложном типе дефекта обнаруживается извилистый ход в перегородке и отверстия находятся на разных уровнях. Вокруг дефекта в перегородке наблюдаются расслоения, очаги кровоизлияния и некроза [Edwards В. et al., 1984].
Частота. Частота выявления простой и сложной форм дефекта почти одинаковая. Простой тип дефекта наблюдается при передней и верхушечной локализации инфаркта миокарда, а сложный тип чаше при задней локализации инфаркта.
Очень часто в зоне инфаркта миокарда наблюдается формирование острой аневризмы сердца. Одновременно с разрывом перегородки встречаются дополнительные повреждения: у 17% больных—разрыв свободной стенки сердца, у 4% больных—разрыв сосочковых мышц [Murphy Т., DeBoerA., 1980].
Для большинства больных с постинфарктным ДМЖП характерно множественное поражение коронарных артерий [Vlodavez Z. et al., 1977].
Кроме того, В. Edwards отметил наличие тромбоза в артерии, снабжающей кровью зону инфаркта, у 40% больных, а у остальных 60% были стенозы и окклюзии без тромбоза артерий.
Основной причиной разрыва межжелудочковой перегородки служат нарушение ее кровоснабжения по перегородочным ветвям и задержка формирования коллатерального кровоснабжения.
Гемодинамика. Развитие постинфарктного дефекта ведет к сложным гемодинамическим нарушениям, которые обусловлены следующими факторами: 1) величиной сброса крови слева направо; 2) размерами пораженного участка миокарда левого желудочка; 3) острой постинфарктной аневризмой левого желудочка; 4) состоянием перфузии миокарда в его интактной зоне; 5) развитием кардиогенного шока; 6) наличием дополнительных повреждений, таких как некроз сосочковых мышц, отрыв хорд.
Величина сброса крови слева направо зависит от размеров дефекта и контрактильной функции миокарда левого желудочка. Сброс крови может составлять 60—70% от ударного объема левого желудочка. Следствием сброса крови является значительное повышение давления в легочной артерии, достигающее 50—70 мм рт. ст. Отношение величины давления в легочной артерии к системному артериальному давлению колеблется от 0,30 до 0.65 [Murphy Т. et al.. 1980].
Развитие недостаточности кровообращения при ДМЖП имеет в своей основе следующие механизмы: 1) сброс крови, перегрузка правых отделов; 2) обширная зона инфаркта и наличие острой или подострой аневризмы левого желудочка.
Чем больше масса пораженного миокарда, тем вы-раженнее проявления недостаточности кровообращения. Если масса пораженного миокарда составляет 35—40% от массы левого желудочка, то у больного развивается кардиогенный шок.
Клиника и диагностика. Перфорация перегородки во время острого инфаркта происходит в сроки от 12 ч до 14 дней. Дефект чаще наблюдается у женщин в возрасте около 70 лет.
Основными клиническими признаками, позволяющими заподозрить ДМЖП, служат: 1) внезапное ухудшение состояния больного (возобновление болей, одышка); 2) тяжелая левожелудочковая недостаточность вплоть до отека легких или быстрое развитие застойной сердечной недостаточности; 3) резкое ухудшение центральной гемодинамики вплоть до кардиогенного шока; 4) появление ранее отсутствовавшего шума в области сердца. Обычно это грубый систолический шум, который лучше всего выслушивается между верхушкой сердца и нижним концом грудины. Шум может проводиться в подмышечную впадину; 5) дрожание грудной стенки; 6) ЭКГ указывает на изменение перегородки желудочка; 7) нарушение ритма и проводимости. Разрыв межжелудочковой перегородки у 6% больных сопровождается развитием атриовентрикулярной блокады [Donahoo J. et al., 1975].
Блокады чаще наблюдаются при задней локализации инфаркта и соответственно при заднебазальной локализации дефекта перегородки.
Инструментальные методы исследования. Эхокардиогра-фия в сочетании с доплерографией позволяет наиболее точно локализовать дефект и провести дифференциальный диагноз с постинфарктной недостаточностью митрального клапана (рис. 5.52). Контрастная эхокардиография дает возможность очень точно выявить локализацию дефекта и судить о его размерах. Кроме того, этот метод дает возмож-
600
ность оценить контрактильную функцию миокарда желудочков и величину сброса крови. Увеличение насыщения крови кислородом в правом желудочке и легочной артерии, определяемое при катетеризации сердца, указывает на наличие дефекта и позволяет исключить постинфарктную недостаточность митрального клапана.
Вентрикулография выявляет дефект с быстрым контрастированием правого желудочка и легочной артерии. Решающая роль вентрикулографии заключается в выявлении аневризмы левого желудочка передней или задней локализации, а также в оценке контрактильной функции миокарда.
Большинство авторов рекомендуют выполнять коронаро-графию у больных со стабильной гемодинамикой, а у остальных добиваться ее стабилизации с помощью внут-риаортальной контрпульсации и после этого проводить ко-ронарографию.
Клиника. Развитие ДМЖП резко ухудшает прогноз состояния здоровья больного. A. Oyamadi и соавт. (1961), изучив истории болезни 157 больных, установили, что 24% погибают в течение первых суток, 65%—в течение 2 нед, а 81,5%—в течение 2 мес.
Через год после образования дефекта при лекарственном лечении в живых остается только 7% больных.
В остром периоде инфаркта миокарда при развитии ДМЖП можно выделить три группы больных в зависимости от течения болезни: 1) с умеренно выраженной сердечной недостаточностью, поддающейся лекарственному лечению; 2) с быстрым прогрессированием сердечной недостаточности и отеком легких; 3) с кардиогенным шоком, который развивается в ближайшие часы после разрыва перегородки, отеком легких и олигурией.
Основные принципы ведения больных с постинфарктным ДМЖП. В соответствии с клиническим течением в остром периоде болезни и тяжестью гемодинамических расстройств необходима дифференцированная тактика ведения больных.
В 1-й группе больных с умеренно выраженной сердечной недостаточностью проводится лекарственное лечение, включающее периферические вазодилататоры, нитраты пролонгированного действия или внутривенную инфузию нитроглицерина, диуретики, препараты калия. Осуществляется лечение нарушений ритма.
Во 2-й группе больных с быстрым прогрессированием сердечной недостаточности в комплекс лекарственного лечения должна быть включена внутриаортальная контрпульсация, которая чаще всего сочетается с применением допа-мина, адреналина и нитропруссида натрия.
Для лечения 3-й группы больных, когда развивается кар-диогенный шок, также необходима внутриаортальная контрпульсация, но при этом как можно скорее должен быть решен вопрос о возможности хирургического лечения.
Хирургическое лечение. Основная цель хирургического вмешательства заключается в ликвидации сброса крови, ре-васкуляризации миокарда методом аортокоронарного шунтирования и устранении других механических нарушений, если они имеются (иссечение постинфарктной аневризмы сердца, протезирование митрального клапана при выраженной регургитации).
Впервые пластику постинфарктного ДМЖП заплатой из айвалона выполнил D. Cooley в 1956 г. В нашей стране первую успешную операцию при постинфарктном ДМЖП сделал В. И. Бураковский в 1969 г.
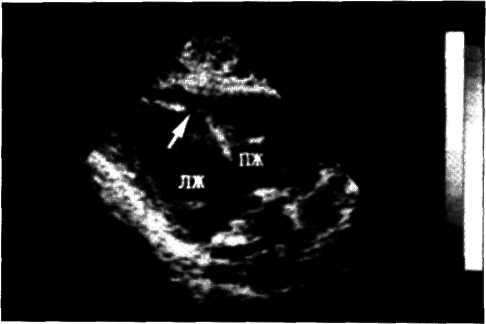
5.52. Эхокардиограмма больного с постинфарктным дефектом межжелудочковой перегородки (ДМЖП). ПЖ—правый желудочек; Л Ж—левый желудочек. Стрелкой указан постинфарктный ДМЖП.
Выбор сроков хирургической коррекции постинфарктного ДМЖП в первую очередь зависит от тяжести гемодинамических нарушений. В 1-й группе больных целесообразно выполнять операцию в стадии рубцевания инфаркта миокарда в плановом порядке.
Во 2-й группе с быстро нарастающей сердечной недостаточностью используются два варианта лечения. Первый заключается в проведении хирургического вмешательства вскоре после того, как установлен диагноз [Murphy Т., DeBoer A., 1980]. Второй—в максимальном использовании лекарственной терапии в сочетании с внутриаортальным баллонированием. В ряде случаев удается проводить контрпульсацию на протяжении 2—3 нед. Такая выжидательная тактика направлена на ограничение зоны повреждения и формирование рубца. В настоящее время считают, что такая выжидательная тактика недостаточно оправдана [Daggett W., Buckley M., 1980]. Операция у больных 3-й группы выполняется срочно по витальным показаниям. Однако риск операции резко возрастает. Необходим крайне осторожный и правильный подход при оценке резервных возможностей сократительной функции работающего миокарда и определении критериев операционного риска у больных, находящихся в критическом состоянии.
Принципы предоперационной подготовки. У больных с быстрым прогрессированием сердечной недостаточности, отеком легких и олигурией, низкими показателями сердечного выброса крови проводят мониторирование МОС с использованием катетера Свана—Ганза. Вводят внутриаор-тальный баллон и начинают контрпульсацию. Как показал опыт, контрпульсация способствует уменьшению сброса крови через дефект, увеличению перфузии миокарда, уменьшению легочно-капиллярного давления. Если на фоне контрпульсации и лекарственного лечения удается добиться стабилизации клинических и гемодинамических показателей, то такую комплексную терапию можно продолжить в течение 5—7 дней, а иногда и более. При продолжающейся контрпульсации можно сделать коронарографию и вентри-кулографию, при этом необходимо иметь подготовленную операционную и сразу же после исследования направить больного на операцию.
601
Больным с кардиогенным шоком также проводят внутри-аортальную контрпульсацию, под защитой которой выполняют ангиографическое исследование. Необходимо отметить, что у таких больных ряд авторов ограничиваются проведением только вентрикулографии, не выполняя коро-нарографию [Kaplan M. et al.. 1976]. Подобный подход мотивируется тем, что послеоперационная летальность не зависит от того, выполнена или нет реваскуляризация миокарда [Murphy Т., DeBoer A., 1980].
Некоторые авторы рекомендуют оперировать больных через 24 ч после ангиографического исследования [Buckley M. et al., 1973]. Эти же авторы считают, что многодневное проведение контрпульсации является «спекулятивным» приемом, не достигающим конечной цели, а только оттягивающим ее.
Хирургическая техника. При первой операции, которую выполнил D. Cooley, был использован доступ к дефекту перегородки через правый желудочек, аналогично тому, как это делается при коррекции врожденного дефекта перегородки. В 1971 г. S. Katamura и соавт. и в 1972 г. Н. Javid и соавт. предложили лучший доступ к дефекту через левый желудочек, отметив возможность более тщательного его закрытия. В 1978 г. W. Daggett предложил использовать доступ к дефекту через зону инфаркта, т. е. при задней локализации дефекта через заднюю стенку, при передней — через переднюю стенку левого желудочка.
Операция при заднем дефекте перегородки. Больным, находящимся в критическом состоянии, вначале подключают АИК через бедренную артерию и вену для стабилизации гемодинамики. После стернотомии переходят на полное И К с гипотермией до 25 С и выполняют кардио-плегию.
Экспозицию задней поверхности сердца осуществляют путем «вывихивания» верхушки сердца в краниальном направлении. Рассекают или иссекают при наличии аневризмы зону повреждения миокарда, расширяя доступ в полость желудочка для лучшего обзора дефекта.
Техника подшивания тефлоновой заплаты, которую выкраивают на 2—3 см больше размера дефекта, зависит от состояния перегородки и стенки желудочка. Заплату укладывают на перегородку со стороны полости левого желудочка и подшивают П-образными швами на прокладках из тефлона. При наложении швов необходимо использовать участки здоровой ткани, часть швов проводят через края вскрытого левого желудочка. После того как заплата подшита, ушивают разрез стенки левого желудочка, используя технику, описанную при резекции постинфарктной аневризмы сердца.
Пластика переднего дефекта. Доступ к дефекту осуществляют через разрез передней стенки левого желудочка. При наличии аневризмы последнюю иссекают. Подши-
вают заплату к краям дефекта со стороны левого желудочка отдельными П-образными швами на тефлоновых прокладках.
Другие варианты техники ушивания дефекта обусловлены особенностями его локализации и размерами. Так, предложено использовать две заплаты с каждой стороны перегородки [Radford M. et al.. 1978].
При локализации обширного инфаркта миокарда в области верхушки с ДМЖП предложена техника ампутации верхушки с замещением перегородки двумя тефлоновыми прокладками [Daggett W. et al.. 1978] (рис. 5.53). В тех случаях, когда зона инфаркта велика и ушивание полости левого желудочка может значительно уменьшить его объем, используют заплату на свободную стенку левого желудочка. Замещение стенки желудочка особенно важно при резекции задней аневризмы и ушивании заднего дефекта, так как заднюю стенку желудочка особенно опасно стягивать с большим натяжением.
Аортокоронарное шунтирование показано больным с сегментарными окклюзиями коронарных артерий и является важным элементом соблюдения принципа полной коррекции патологии. Техника выполнения этой операции описана ранее.
Результаты. Результаты хирургического лечения постинфарктного ДМЖП зависят от локализации дефекта и тяжести поражения миокарда. Госпитальная летальность составляет 15—50%. Она выше при заднем расположении дефекта. Основными причинами летального исхода являются сердечная недостаточность и кардиогенный шок.
В отдаленном периоде выживают к 10-му году 80% от числа выписанных больных [Краковский А. А.. 1984]. Операция полностью нормализует практически все показатели внутрисердечной гемодинамики. Однако контрактильная функция миокарда у большинства больных полностью не восстанавливается и фракция изгнания легкого желудочка остается сниженной до 40—45% [Lukacs L. et al., 1985].
5.8. ПОСТИНФАРКТНАЯ НЕДОСТАТОЧНОСТЬ МИТРАЛЬНОГО КЛАПАНА
Среди различных форм поражения митрального клапана и подклапанных структур особое место занимает его постинфарктная недостаточность. Клинически эта патология представляет собой синдром, обусловленный нарушением функции клапанного аппарата и подклапанных структур ишемического генеза или перенесенным инфарктом миокарда и некрозом сосочковой мышцы.
602
Частота. Различной степени выраженности недостаточность митрального клапана проявляется как в острой фазе инфаркта миокарда, так и в постинфарктном периоде у 20% больных [Тере N., Edmunds L, 1985].
Прижизненный диагноз разрыва сосочковой мышцы после инфаркта миокарда впервые установил S. Davison в 1948 г.
Выделяют три формы митральной регургитации: 1) развившаяся в результате дисфункции сосочковой мышцы (без ее разрыва) [BurchG., 1968]; 2) вызванная разрывом сосочковой мышцы; 3) возникшая в результате дилатации фиброзного кольца.
Патоморфология. Инфаркт миокарда, локализующийся по задней стенке левого желудочка, часто приводит к некрозу задневнутренней сосочковой мышцы. Поскольку правый тип коронарного кровоснабжения доминирует примерно у 70— 80% людей, то заднебазальный инфаркт с повреждением задней сосочковой мышцы возникает чаще при поражении правой венечной артерии (рис. 5.54).
Выделяют две формы поражения сосочковой мышцы: 1) некроз или фиброз без разрыва мышцы; 2) некроз или фиброз с ее разрывом.
Кроме того, в зависимости от локализации W. Roberts (1980) выделяет два типа поражения сосочковой мышцы: 1) только с вовлечением дистальной (апикальной) части мышцы; 2) с диффузно-очаговым поражением всей мышцы.
Эти типы поражения сосочковых мышц, протекая без разрывов, часто приводят к различной по тяжести течения острой сердечной недостаточности. В табл. 5.9 представлены анатомические формы поражения сосочковых мышц при ИБС.
Патогенез недостаточности митрального клапана или дисфункции сосочковой мышцы. Появление митральной регургитации связано не только с поражением сосочковой мышцы, но и с нарушением подвижности свободной стенки левого желудочка.
Дисфункция сосочковой мышцы проявляется при разрыве тела, отрыве головок или хорд. Чаще всего митральная регургитация особенно выражена при сочетании повреждения сосочковой мышцы с дилатацией фиброзного кольца.
Таблица 5.9. Анатомические формы поражения сосочковых мышц при постинфарктной недостаточности митрального клапана
Клиника и диагностика. Разрыв сосочковой мышцы чаще всего происходит в течение первых дней острого инфаркта миокарда, в среднем на 4-е сутки [Sanders R. et al., 1957]. В большинстве случаев митральная регургитация связана с локализацией инфаркта в области задней стенки и с поражением задней мышцы, реже—с инфарктом передней стенки и соответственно с поражением передней мышцы.
Клинические проявления постинфарктной недостаточности митрального клапана можно разделить на три формы: 1) стабильная—через 10—14 дней от начала инфаркта выслушивается слабый систолический шум митральной недостаточности, не сопровождающийся гемодина-мическими расстройствами; 2) медленно прогрессирующая, развивающаяся в различные сроки инфаркта миокарда и проявляющаяся признаками сердечной недостаточности; 3) злокачественная, характеризующаяся внезапным острым началом, тяжелой сердечной недостаточностью, отеком легких, нередко заканчивающаяся кардиогенным шоком и смертью больного.
Основные клинические проявления недостаточности митрального клапана: систолический шум над верхушкой серд-
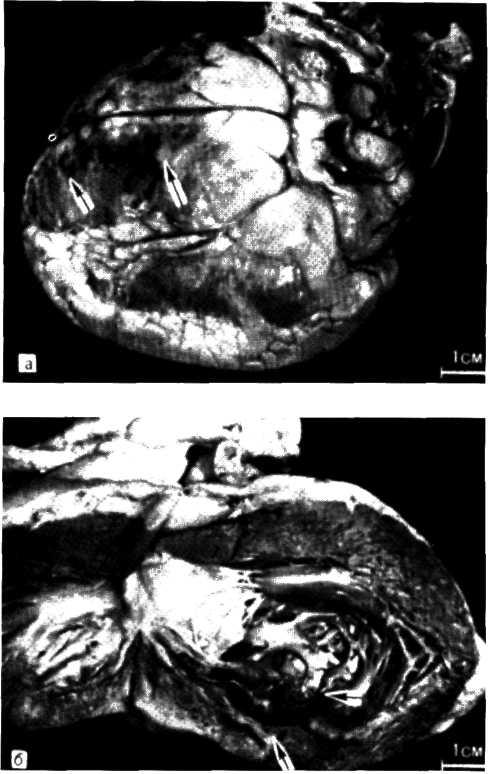
5.54. Макропрепарат сердца при обширном заднебазальном инфаркте миокарда (а) с переходом на основание сосочковой мышцы и ее отрывом (б) (указан стрелками).
603
ца, влажные хрипы в легких, отек легких и симптомы развивающегося кардиогенного шока.
Регистрирующийся над сердцем пансистолический шум типа crescendo—decrescendo может проводиться к основанию шеи, что свидетельствует о дисфункции передней створки, или в подмышечную область вплоть до лопатки, что указывает на поражение задней створки [Tommaso С, Lesch М, 1980].
На ЭКГ выявляются характерные для острого инфаркта миокарда изменения, причем инфаркт может быть как трансмуральным, так и очаговым. Часто на ЭКГ видны признаки перегрузки левого предсердия.
Эхокардиография является основным методом диагностики митральной регургитации и дифференциальной диагностики причин сердечной недостаточности при остром инфаркте миокарда. Она позволяет выявить изменение объема левых камер сердца, рассчитать показатели сократимости миокарда.
В период систолы створка митрального клапана пролаби-рует в левое предсердие; в период диастолы ее движения направлены в сторону, противоположную движениям здоровой створки. Полость левого предсердия обычно не увеличена. Секторное ультразвуковое сканирование позволяет выявить нарушенную структуру сосочковой мышцы. Во время диастолы пораженная створка западает в полость левого желудочка, во время систолы—в полость левого предсердия. Благодаря этому методу исследования можно констатировать нарушения регионарной и общей сократимости, а использование метода допплерографии дает возможность количественно оценить поток регургитации. Рентгенологическое исследование выявляет увеличение размеров сердца в основном за счет левого желудочка и различной степени выраженности застойные явления в малом круге кровообращения вплоть до картины, характерной для отека легких.
Левая вентрикулография позволяет количественно определить объем регуцгитации крови в левое предсердие и дать точную оценку регионарной и общей контрактильной функции левого желудочка.
Коронарография выявляет атеросклеротическое поражение венечных артерий и состояние дистальных отделов сосудов, что позволяет судить о необходимости и возможности реваскуляризирующих вмешательств. У 70% больных с острой постинфарктной недостаточностью митрального клапана отмечены окклюзия или резкий стеноз правой коронарной артерии на фоне атеросклеротического поражения других коронарных артерий.
Течение болезни зависит от двух основных факторов, которые ведут к развитию тяжелой недостаточности кровообращения: 1) выраженности митральной регургитации; 2) массы пораженного инфарктом миокарда и компенсаторных возможностей жизнеспособной части левого желудочка.
Масса пораженного миокарда у этих больных может составлять 1—50% от массы левого желудочка [Wfei J. et al., 1979]. Прогноз жизни больного со значительным поражением миокарда, превышающим 40% от массы левого желудочка, уже сам по себе не зависит от наличия недостаточности митрального клапана, а определяется кардиогенным шоком, приводящим больного к быстрой смерти. У остальной части больных целесообразно выделить два варианта течения: острое и хроническое. При остром течении болезни возникает необходимость в быстрой хирургической коррекции порока.
При хроническом течении возможно поддержание гемодинамики и предупреждение развития сердечной недостаточности с помощью лекарственной терапии, не исключающей замещение клапана в плановом порядке.
Хирургическое лечение. Первая успешная операция была выполнена W. Austen и соавт. в 1965 г.
Основными показаниями к операции являются тяжелая недостаточность митрального клапана и стенозирующий атеросклероз коронарных артерий, а также сопутствующие механические поражения левого желудочка—постинфарктный ДМЖП и постинфарктная аневризма сердца.
Операция противопоказана в том случае, если нет условий для реваскуляризации пораженных коронарных артерий и имеется значительное рубцовое замещение массы миокарда левого желудочка.
Техника операции. Замещение митрального клапана протезом проводится по принципам протезирования митрального клапана у больных с ревматическим пороком сердца. Отличие заключается в отсутствии выраженного фиброза митрального кольца и малых размерах левого предсердия, что обусловливает трудности в подшивании протеза. У ряда больных с наличием аневризмы сердца доступ к митральному клапану осуществляется через полость левого желудочка после иссечения аневризмы.
Предпочтение отдается механическим протезам, а биологические клапаны используются редко. Ряд хирургов предпочитают выполнять пластические операции, которые дают меньший процент тромбоэмболии [Kay J. et al., 1980].
Послеоперационная летальность зависит от исходного состояния больных и сроков, прошедших от начала острого инфаркта миокарда. При хронической постинфарктной недостаточности митрального клапана летальность после операции достигает 8,5%, а при острой недостаточности, сопровождающейся декомпенсацией кровообращения,— 25% [Najafi H. et al., 1980]. Летальность среди больных, оперированных на фоне кардиогенного шока, составляет 60% [Тере N., Edmunds L, 1985].
Процент выживаемости больных в отдаленные сроки в значительной степени зависит от выполнения реваскуляризации миокарда, которая улучшает прогноз. При пластических хирургических вмешательствах на клапане в сочетании с аортокоронарным шунтированием показатель выживаемости к 7-му году составляет 81% [Kay J. et al., 1980]. При замещении клапана протезом отдаленные показатели выживаемости оказались в 2 раза хуже.
Необходимо отметить, что при естественном течении постинфарктной недостаточности митрального клапана летальность к 5-му году составляет 90%. Это позволяет считать хирургическое лечение постинфарктной недостаточности митрального клапана в сочетании с аортокоронарным шунтированием лучшим методом.
5.9. СОЧЕТАННЫЕ ПОРАЖЕНИЯ ВЕНЕЧНЫХ И МАГИСТРАЛЬНЫХ АРТЕРИЙ (ВЫБОР ТАКТИКИ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ)
Атеросклероз, являясь универсальным заболеванием сосудистой системы, часто поражает наряду с венечными артериями и другие сосуды.
G. Backmann (1979) при использовании метода тотальной ангиографии у больных ИБС выявил также поражения дру-
604
гих сосудистых бассейнов: брахиоцефальных сосудов—у 16,2%, брюшной аорты—у 39%, сосудов таза—у 36%, бедренных артерий—у 58,4% больных.
У больных с сочетанными поражениями коронарных и других артерий выбор тактики лечения и подход к выполнению реконструктивных операций на сосудах нескольких бассейнов сложны.
Целесообразно выделить несколько групп больных, имеющих сочетанное поражение ряда сосудистых бассейнов.
Сочетанное поражение коронарных и брахиоцефальных сосудов. Тактика лечения данной группы больных особенно важна, так как сочетанное поражение коронарных и брахиоцефальных артерий может привести к инвалидизации и смерти в результате развития ишемического инсульта и инфаркта миокарда. Хирургическая коррекция только одного из пораженных сосудистых бассейнов связана с повышенным риском развития осложнений в неоперированном бассейне. В 1978 г. J. Morris и Е. Crawford показали, что летальность при каротидной эндартерэктомии у больных с ИБС достигает 18%. Неблагоприятный исход обусловлен развитием острой коронарной недостаточности и инфаркта миокарда в послеоперационном периоде. В настоящее время частота неврологических осложнений после операций аорто-коронарного шунтирования составляет около 2%, и примерно в половине случаев послеоперационный инсульт связан с наличием недиагностированного поражения брахиоцефальных артерий [Faggioli G. et al., 1990].
Поражение ветвей дуги аорты выявляют, по данным разных авторов, у 1,3—16% больных с ИБС. В этой группе в свою очередь можно выделить две подгруппы: 1) больные с клинически выраженными симптомами ишемии мозга (ТИА, перенесенный инсульт); 2) больные с асимптомным поражением экстракраниальных отделов сонных артерий.
Согласно современным представлениям, все больные— кандидаты на операцию реваскуляризации миокарда— должны пройти неинвазивный скрининг для выявления поражений брахиоцефальных артерий. В качестве методов диагностики были использованы офтальмодинамометрия и окулярная пневмоплетизмография [Balderman S. С, 1983]. Однако основным методом выявления поражений брахиоцефальных артерий является ультразвуковая допплерография, включая транскраниальную допплерографию, и дуплексное сканирование. В качестве метода скрининга может быть использована также дигитальная ангиография ветвей дуги аорты. Гёмодинамически значимым поражением брахиоцефальных артерий считают стеноз более 75%.
«Коронарный синдром» у больных с сочетанным поражением коронарных и брахиоцефальных артерий характеризуется тяжестью клинико-ангиографической картины. В этой группе значительно чаще, чем у больных с изолированной ИБС, отмечаются нестабильная стенокардия, поражение ствола левой коронарной артерии, нарушения сократительной функции миокарда [Hertzer N. R. et al., 1983; Newman D.Cetal., 1987].
Предложены различные варианты хирургической тактики при лечении больных с сочетанным поражением коронарных и брахиоцефальных артерий.
1. В первую очередь выполняли каротидную эндартерэк-томию, а затем (второй этап хирургического лечения) производили реваскуляризацию миокарда [Moran J., 1981; Hertzer N., 1983].
Первым этапом выполняли реваскуляризацию миокар да, мотивируя это высоким риском развития коронарных осложнений, а затем (второй этап)—операцию на сосудах, снабжающих кровью головной мозг [Barnes R. W. et al., 1981].
В 1972 г. W. D. Johnson впервые выполнил одномо ментную операцию каротидной эндартерэктомии и аор- токоронарного шунтирования [Bernhard V. М. et al., 1972]. В настоящее время одномоментные операции все шире используют в хирургическом лечении больных с сочетанным поражением коронарных и брахиоцефальных артерий. Ус тановленными показаниями к выполнению этих операций являются: а) сочетание ИБС с интраторакальным пораже нием брахиоцефальных артерий (брахиоцефальный ствол и/или левая общая сонная артерия). Необходимость од номоментной операции в данном случае обусловлена ана томическим характером поражения; б) гёмодинамически значимый стеноз внутренней сонной артерии с симптомами мозговой сосудистой недостаточности в сочетании с тя желыми формами ИБС (нестабильная стенокардия, стеноз основного ствола ЛКА и трехсосудистое поражение ко ронарных артерий). Асимптомный гёмодинамически зна чимый стеноз внутренней сонной артерии в сочетании с тя желыми формами ИБС многие авторы также рассматри вают как показание к одномоментной реконструкции из-за высокого риска развития ишемического инсульта у таких больных при выполнении изолированного аортокоронар- ного шунтирования.
В настоящее время разработаны две методики выполнения одномоментных операций. Операцию может выполнять одна бригада хирургов и две бригады [Newman D. С. et al., 1987]. Первая методика включает выполнение каротидной эндартерэктомии до подключения АИК. При этом с целью защиты головного мозга от ишемии используют тиопентал-натрий или внутренний шунт. Некоторые хирурги открывают грудную клетку одновременно с проведением разреза на шее, чтобы обеспечить возможность быстро начать искусственное кровообращение в случае развития коронарных осложнений на первом этапе операции. По окончании каротидной эндартерэктомии подключают АИК и выполняют реваскуляризацию миокарда.
Вторая методика включает выполнение каротидной эндартерэктомии на фоне гипотермической перфузии, которую используют на первом этапе вмешательства для защиты головного мозга от ишемии. При применении этой методики одновременно производят разрез на шее и стернотомию, выполняют канюляцию и начинают ИК. После охлаждения больного пережимают общую сонную артерию и выполняют эндартерэктомию. По окончании эндартерэктомии восстанавливают кровоток в сонной артерии, пережимают восходящую аорту, вводят кардиоплегический раствор и выполняют аортокоронарное шунтирование.
Необходимыми условиями для выполнения одномоментной операции по любой методике являются: 1) поддержание стабильной гемодинамики на всех этапах операции со средним АД не ниже 80 мм рт. ст. (во избежание гипоперфузии головного мозга); 2) «тиопенталовая защита» мозга на этапе пережатия сонной артерии; 3) режим умеренной гипер-капнии с целью увеличения мозгового кровотока; 4) мони-торный контроль ЭЭГ, давления заклинивания в легочной артерии и сердечного выброса.
605
Преимуществами одномоментной операции, выполняемой в условиях гипотермической перфузии, являются: 1) уменьшение продолжительности предперфузионного периода и снижение частоты коронарных осложнений на этом этапе; 2) обеспечение оптимальной защиты головного мозга с помощью гипотермии, что позволяет избежать использования внутреннего шунта и повысить прецизионность выполнения каротидной эндартерэктомии.
У больных с интраторакальным поражением брахиоце-фальных артерий в сочетании с ИБС (окклюзия брахиоцефального ствола) реконструкцию ветвей дуги аорты целесообразно выполнить до подключения АИК. Для протезирования брахиоцефального ствола используют предварительно тщательно замоченный линейный или бифуркационный протез, при этом дистальные анастомозы накладывают конец в конец, а проксимальный анастомоз— в бок восходящей аорты при ее пристеночном отжатии. После окончания протезирования брахиоцефального ствола подключают АИК и выполняют аортокоронарное шунтирование. При стенозе с проксимальных отделов брахиоцефаль-ных артерий, когда пережатие их может привести к развитию ишемии и повреждению головного мозга, на этапе реконструкции брахиоцефальных артерий целесообразно использовать методику гипотермической перфузии, т. е. необходимо подключить АИК, охладить больного, а затем выполнить протезирование брахиоцефального ствола (или левой общей сонной артерии) с последующим аортокоронарным шунтированием. В случае применения данной методики целесообразно использовать сосудистый протез, сделанный из материала, непроницаемого для крови (тефлон, «Гор—Текс»), или ксеноперикардиальный трансплантат. В отдельных случаях протезирование ветвей дуги аорты может быть выполнено по окончании наложения аортокоронарных шунтов после нейтрализации гепарина.
Выбор уровня гипотермии при выполнении одномоментных операций по второй методике зависит от ряда факторов: распространенности поражения брахиоцефальных артерий, результата дооперационной пробы Матаса и величины мозгового сосудистого резерва, ретроградного давления во внутренней сонной артерии во время эндартерэктомии и показателей ЭЭГ при пережатии общей сонной артерии.
Двухэтапные вмешательства у больных с поражением коронарных и брахиоцефальных артерий следует выполнять при сочетании гемодинамически значимого стеноза внутренней сонной артерии с клинически умеренно выраженной ИБС при поражении одного-двух коронарных сосудов, не являющемся прогностически неблагоприятным. В этой ситуации первым этапом следует выполнить каротидную эн-дартерэктомию, а затем (через 2—3 нед)—аортокоронарное шунтирование.
При гемодинамически незначимом стенозе сонной артерии (менее 75%) у больных с тяжелой ИБС сначала нужно произвести реваскуляризацию миокарда даже при наличии неврологических симптомов, которые при незначимых стенозах обусловлены микроэмболиями с поверхности бляшки.
Результаты одномоментных операций незначительно уступают результатам изолированного аортокоронарного шунтирования. Можно предположить, что в дальнейшем по мере улучшения результатов показания к одномоментным операциям будут расширены [Mackey W. С. et al., 1990].
Мультифокальнме атеросклеротические поражения. Под
мультифокальными понимают сочетанные поражения трех артериальных бассейнов и более. Наиболее частые сочетания: ИБС, поражение брахиоцефальных артерий, брюшной аорты и артерий нижних конечностей; ишемическая болезнь мозга, ИБС, вазоренальная гипертензия (ВРГ); ИБС, ВРГ, поражение артерий нижних конечностей. Малоизученным остается сочетание атеросклеротического процесса разных локализаций с поражением висцеральных ветвей брюшной аорты (синдром хронической абдоминальной ишемии). Хирургическая тактика для больных с мультифокальным поражением окончательно не разработана. В данной группе больных в каждом конкретном случае необходима точная оценка тяжести поражения каждого сосудистого бассейна для решения вопроса об оптимальной хирургической тактике.
Одномоментные вмешательства на нескольких сосудистых бассейнах показаны больным, у которых выявлена критическая ишемия в каждом из этих бассейнов. У нас имеется опыт выполнения 12 одномоментных операций на трех сосудистых бассейнах. У большинства оперированных больных диагностировано гемодинамически значимое поражение внутренней сонной артерии в сочетании с тяжелой ИБС (главным образом с поражением ствола ЛВА) и ишемией нижних конечностей III—IV стадии. Одномоментная операция показана также больным с поражением сонных и коронарных артерий при угрозе разрыва аневризмы брюшной аорты. Аневризму брюшной аорты без признаков угрожающего разрыва можно резецировать через 2—3 нед после одномоментной реконструкции сонной и коронарных артерий.
При наличии у больного с поражением коронарных и брахиоцефальных артерий стеноза почечной артерии и синдрома артериальной гипертензии целесообразно выполнить транслюминальную ангиопластику почечной артерии после проведения гипотензивной каптоприловой пробы) с немедленной или отсроченной на 1—2 дня одномоментной рева-скуляризацией головного мозга и миокарда.
Строго говоря, любого больного, у которого отмечаются клинические проявления атеросклероза в одном из сосудистых бассейнов, нужно рассматривать как больного с мультифокальным поражением до тех пор, пока не будут исключены гемодинамически значимые обструкции в других сосудистых бассейнах. Это обусловлено тем, что у многих больных атеросклеротическое поражение сосудов протекает бессимптомно, и это асимптомное поражение может манифестировать клинически при выполнении сосудистой реконструкции в одном из бассейнов.
Таким образом, необходимо еще раз подчеркнуть, что больной, у которого наблюдаются изолированные клинические проявления мозговой сосудистой недостаточности, ишемии миокарда, нижних конечностей или вазоренальная гипертония, должен пройти тщательное скрининговое обследование с целью выявления асимптомных поражений других сосудистых бассейнов. Большое значение имеют такие простые физикальные методы исследования, как аускультация артерий, измерение АД на всех четырех конечностях, тщательный сбор анамнеза. Неинвазивные методики в большинстве случаев позволяют выявить или заподозрить поражение других сосудистых бассейнов; в сомнительных случаях показано выполнение ангиографического исследования, которое остается «золотым стандартом» для диагностики атеро-склеротических поражений разных локализаций.
6
Трансплантация сердца
В.
И. Бураковский
Л.А.Бокерия
Эта проблема рассматривается в отдельной главе в связи с большим интересом к ней. В 1987 г. в мире было выполнено 2200 трансплантаций сердца, а суммарный опыт (с 1967 г. по март 1988 г.) превысил 6800 операций пересадки сердца, более 130 трансплантаций сердца и легких, более 50 операций имплантации второго сердца, 124 имплантации искусственного сердца.
Определились показания к операции пересадки сердца, уточнены критерии отбора реципиентов и доноров, на качественно новый уровень поднялись диагностика, профилактика и лечение реакции отторжения.
Клиническое значение в связи с пересадкой сердца имеют операции аутотрансплантации, гетеротопической ортотопи-ческой трансплантации, трансплантации сердца и легких (сердечно-легочного комплекса), пересадки второго сердца в грудную клетку. Наименьшее распространение имеют операции аутотрансплантации сердца и пересадки второго сердца, наибольшее—ортотопическая трансплантация сердца.
В 1905 г. A. Carrel и С. Gutrie провели первую гетеротопи-ческую трансплантацию сердца в эксперименте на собаке. Они взяли донорское сердце собаки и переместили на шею более крупному животному. Через час после подключения донорского сердца к кровотоку реципиента оно спонтанно заработало и продолжало функционировать в течение 2 ч. Остановка пересаженного сердца наступила в результате развития внутриполостного тромбоза донорского сердца. Затем, вплоть до 1933 г., никаких специальных исследований по этому вопросу не проводилось. F. Mann и соавт. в 1933 г. начали систематическое изучение вопросов технического обеспечения гетеротопической трансплантации сердца к шейным сосудам реципиента. Эти сердца работали от 1 до 8 дней. При вскрытии было обнаружено, что донорское сердце отечно и имеется выраженная инфильтрация лимфоцитами, моноцитами и полиморфно-ядерными клетками. На этом основании сделано важное заключение, что наблюдаемая реакция не является результатом технических ошибок, а имеет биологический характер. В дальнейшем внимание ученых было направлено на разработку техники операции, которая позволила бы привести к длительной выживаемости трансплантированного сердца, на изучение вопросов метаболизма, физиологии, патологии и иммунологии. Были созданы технически простые модели, не требующие ИК.
Заключения, сделанные на основании исследований с гетеротопической моделью, однако, не могут быть однозначно перенесены на модель ортотопической трансплантации, так как в первой из них часть кровотока принимает на себя второе сердце, находящееся в грудной клетке. Наиболее весомый вклад в разработку гетеротопической пересадки сердца внес советский исследователь В. П. Демихов. Он разработал несколько моделей, в одной из которых без прекращения кровотока создавался анастомоз конец в бок между полыми венами донора и реципиента, между легочными артериями и аортами. Анастомозировались также ушки левых предсердий. Затем, когда донорское сердце становилось достаточно активным, сердце реципиента исключали из кровотока. Это достигалось перевязкой крупных сосудов реципиента проксимальней анастомоза и наложением сужающего шва вокруг митрального клапана. Эксперименты В. П. Демихова, выполненные в 1951 —1952 гг., показали, что донорское сердце способно «взять на себя» все кровообращение реципиента. Так была доказана состоятельность насосной функции полностью денервирован-ного сердца.
Новая эра в проблеме трансплантации сердца начинается в конце 50-х годов, когда в клинической практике получило широкое распространение ИК. В 1960 г. R. Lower и N. Shumway описали первую успешную ортопедическую пересадку сердца в эксперименте. Восемь животных прожили от 6 до 21 дня после операции. На вскрытии в миокарде этих животных отмечались явления воспаления, характери-
зующиеся инфильтрацией круглыми клетками, кровоизлиянием и отеком. Новым в этой работе по сравнению с работами предшествующих авторов, выполнявших свои эксперименты в конце 50-х годов также с применением ИК, было следующее.
Во-первых, авторы для защиты миокарда использовали холод (в периоде, предшествующем трансплантации). Во-вторых, чтобы сократить время операции, вместо анастомозов полых вен для анастомозирования сердца донора и реципиента использовали части левого и правого предсердий с межпредсердной перегородкой.
Ортотопическая трансплантация в эксперименте на собаках не потеряла своего значения и в настоящее время. Она широко применяется для изучения физиологических и иммунологических аспектов трансплантации. В частности, с помощью таких экспериментов было выявлено, что трансплантированное сердце адекватно функционирует в покое, а также может обеспечить умеренные нагрузки. Кроме того, было выявлено, что применение иммунодепрессивной терапии в минимальных дозах позволяет удлинить сроки функционирования донорского сердца с 7 до 17 дней. Если же своевременно диагностировать криз отторжения, то применение иммунодепрессивной терапии позволяет удлинить жизнь животного до 75 дней. Позже R. Lower и соавт. использовали у животных весь арсенал диагностических пособий и лекарств, применяемых в клинической практике, и добились выживаемости собак до 1 года.
Первая клиническая операция пересадки сердца была выполнена в 1964 г. J. Hardy человеку, находящемуся в терминальной стадии кардиогенного шока. В связи с отсутствием донорского сердца человека хирург предпринял попытку пересадить больному сердце обезьяны шимпанзе. Как только был отключен АИК, оказалось, что венозный возврат превышает возможности этого небольшого сердца, появилась компенсаторная тахикардия, снизилось артериальное давление и, несмотря на всю проводимую терапию, через 1 ч после ИК сердце остановилось, и больной погиб.
Первая успешная операция ортотопической трансплантации сердца была выполнена в декабре 1967 г. С. Barnard. Кристиан Барнард — крупнейший кардиохирург и прогрессивный ученый—незадолго до выполнения своей исторической операции в течение нескольких месяцев стажировался в Москве, изучая опыт В. П. Демихова и других советских специалистов по трансплантации сердца. В нашей стране опубликованы его труды по трансплантологии, а также ряд мемуарных и художественных произведений. Первая операция была выполнена больному 54 лет с крайне выраженным атеросклеротическим поражением венечных артерий. Операция и послеоперационный период протекали гладко. Однако в ближайшие дни у больного развилась пневмония, приведшая к смерти на 17-й день. Второй больной, оперированный через 1 мес, прожил 2 года. Последующие несколько лет характеризуются исключительно высоким уровнем хирургической активности в разных странах мира. Этот период можно скорее назвать периодом освоения хирургической техники. Стало совершенно ясным, что основные достижения в области трансплантации сердца следует искать на пути преодоления иммунологического конфликта между донорским сердцем и организмом реципиента. Одна из самых «эмоциональных» страниц кардиохирургии, трансплантация сердца, конечно, пока еще недописана. Вместе с тем необходимо отметить, что в конце 80-х годов XX в., наступил благоприятный период, обещающий быстрый прогресс трансплантации сердца. В большинстве стран мира разрешен этический вопрос о заборе сокращающегося сердца у пациента после смерти мозга. Исключительно важное значение для развития проблемы имело внедрение в клиническую практику циклоспорина А — препарата, позволившего снизить актуальность проблемы иммунологического конфликта. В связи с последними успехами трансплантации сердца следует упомянуть имя профессора N. Shumway из Стенфордского университета (США), где к 1985 г. выполнено более 1000 операций трансплантации сердца. Благодаря усилиям этого хирурга и возглавляемого им коллектива трансплантация сердца в техническом, иммунологическом
609
и социологических аспектах продвинулась вперед. К началу 1988 г. в мире было выполнено 6800 пересадок сердца. Только за 1987 г. сделано 2200 таких операций.
Дальнейшее развитие метода трансплантации сердца было сделано также группой врачей под руководством N. Shumway. Ими начато выполнение операций трансплантации комплекса сердце—легкое больным, страдающим одновременно поражением сердца и легких [Reitz В. et al., 1983].
Однако необходимо отметить, что первые исследования по этой проблеме проведены в нашей стране. Еще в 1940 г. В. П. Демихов выполнил первую успешную пересадку сердечно-легочного комплекса в эксперименте на собаках. Затем он обосновал и выполнил многочисленные модификации своей операции. Вскоре выяснилось, что тотальная дене-рвация приводит к неадекватной вентиляции в послеоперационном периоде. И только в 1972 г.
A. Castaneda и соавт., используя оригинальный метод транс плантации сердца и легких в едином комплексе, сумели доказать возможность «переживания» денервированного легкого. V. Reitz и соавт., используя в эксперименте на обезьянах современные методы иммунодепрессивной тера пии с применением циклоспорина А, добились длительного выживания животных с пересаженным сердечно-легочным комплексом. Первая успешная клиническая операция была выполнена, как указывалось выше, группой врачей, руково димой N. Shumway [Reitz V. et al., 1982]. В нашей стране первая успешная операция пересадки сердца выполнена
B. И. Шумаковым в 1987 г.
Показания и противопоказания к операции. Заключение о том, нуждается ли больной в пересадке сердца, может быть сделано только в том случае, если имеются факторы, указывающие на то, что он по состоянию миокарда находится в терминальной стадии декомпенсации кровообращения. Обследование такого больного включает тщательный сбор анамнеза. При этом надо обязательно выявить факторы, приведшие к ускорению и утяжелению заболевания. Физикальное обследование, типичные лабораторные методы исследования, ЭКГ и рентгенологическое исследование позволят наметить план дальнейшего специального обследования. Важнейшим из них является внутрисердечное исследование. Необходимо, чтобы больному было проведено исследование обеих половин сердца: зондирование и ангиокардиография правого и левого желудочков, а также селективная коронарография. У предполагаемого реципиента следует очень детально оценить проводившееся ему ранее консервативное лечение. Необходимо также доказать, что ни один метод хирургического лечения не способен излечить этого больного. По сводной статистике [Fragomeni S., Кауе Р., 1988], сердце пересаживают в 51,7% случаев при кардиомиопатиях, в 30,2%—при ИБС, а в 18%—при ВПС, клапанной патологии или отторжении трансплантата.
Если окажется, что единственной альтернативой для больного является операция пересадки сердца, то следует очень скрупулезно разобраться в том, какие имеются противопоказания к этой операции. Абсолютным противопоказанием к трансплантации сердца являются выраженная легочная гипертензия, инфекционное заболевание или другие болезни, представляющие угрозу для жизни (например, новообразования). У больных с высокой легочной гипертензией, когда давление в легочной артерии превышает 60 мм рт. ст., а общее легочное сопротивление превышает 6 ед., ранний послеоперационный период характеризуется развитием острой правожелудочковой недостаточности, возникающей вслед за трансплантацией сердца. Это происходит потому, что нормально развитый правый желудочек не в состоянии
выполнять свою нагнетательную функцию в условиях повышенного общелегочного сопротивления; его функция прекращается обычно в первые 72 ч после операции. Сходная ситуация наблюдается у больных, которым трансплантацию сердца производят на фоне активно протекающего инфекционного процесса: при этом наблюдается активизация процесса и неизбежна гибель больного в течение нескольких дней и недель после трансплантации.
Противопоказанием к трансплантации сердца является возраст больного. Большинство авторов считают допустимым возраст реципиента 50 лет. В последнее время в клиниках, накопивших большой опыт трансплантации сердца, этот возраст увеличен до 60 лет. Сейчас уже совершенно ясно, что пожилые больные, особенно страдавшие заболеванием сердца в течение нескольких лет, очень плохо переносят не саму операцию, а иммунодепрессивную терапию, несмотря на то что в этой группе больных реакция отторжения развивается не чаще, чем в более молодой группе. Однако у пожилых больных на фоне сниженных иммунных защитных сил легче развиваются инфекционные осложнения. Смерть у них наступает в первые 3 мес после операции.
Противопоказанием к операции трансплантации сердца являются повторные инфаркты легкого. Как показывает опыт многих центров, у больных с инфарктом легкого, предшествующим трансплантации сердца, очень часто развиваются инфекционные осложнения, не совместимые с жизнью больного. При этом инфекция «гнездится» в инфар-цированном участке легкого. Неблагоприятными кандидатами на трансплантацию сердца являются также больные с инсулинзависимым диабетом. С одной стороны, это обусловлено трудностями подбора терапии диабета в период, когда больные вынуждены получать кортикостероиды. С другой стороны, у таких больных обычно выражена хроническая ишемия нижних конечностей.
Доноры. Потенциальными донорами на пересадку сердца являются сравнительно молодые пациенты, страдающие необратимым повреждением головного мозга, но у которых сердце продолжает сокращаться. По мнению большинства клиницистов, имеющих значительный опыт трансплантации, возраст доноров-женщин не должен превышать 35 лет, доноров-мужчин—40 лет. Потенциальные доноры на трансплантацию сердца могут быть в одной из четырех диагностических категорий: тупая травма головы, огнестрельное повреждение головы, внутричерепное кровотечение и опухоль головного мозга.
Заключение о смерти делает группа врачей, не зависимых от центра трансплантации. Неврологическое исследование основывается на истории болезни, физикальном обследовании, ангиографии головного мозга, оперативных находках и электроэнцефалографии. Основное, что следует соблюдать при установлении изменений головного мозга, это то, что все врачи, принимающие участие в консилиуме, должны быть единодушны в том, что смерть мозга необратима. Естественно, что это заключение делается в соответствии с существующей инструкцией, утвержденной правительством.
Решающим для констатации смерти мозга являются следующие признаки: 1) отсутствие сознания и реактивности на внешние раздражители; 2) полное отсутствие рефлексов и дыхания, мышечная атония; 3) прямая линия на электроэнцефалограмме (отсутствие биоэлектрической активности
670
в течение 2 ч); 4) при ангиографии сосудистой системы мозга контрастное вещество не проникает далее основания мозга, т. е. контрастируется лишь экстракраниальный участок артерий, снабжающих мозг.
Следующий вопрос, который необходимо решить,—необходимость исключить какой-либо патологический процесс в донорском сердце. С этой целью необходимо очень внимательно собрать анамнез и расспросить врача, который наблюдал больного. Затем проводят физикальное обследование сердца, включая электрокардиографию, фонокардиогра-фию, рентгенологическое исследование. Если имеется подозрение на патологические изменения в сердце потенциального донора, то следует выполнить катетеризацию сердца и ангиографию. Кроме того, в настоящее время признано целесообразным всем потенциальным донорам мужского пола старше 30 лет и женского пола старше 35 лет сделать селективную коронарографию. Это позволяет исключить атеросклеротические изменения венечных артерий и предотвратить плохой прогноз операции. Следует также отметить, что функция трансплантированного сердца в послеоперационном периоде не зависит от продолжительности госпитализации, длительности искусственной вентиляции легких и лекарственной «поддержки» сердца, максимального систолического давления и изменений сегмента ST на ЭКГ.
Одним из важных обстоятельств сохранения донорского сердца является улавливание момента, при котором полностью выключается функция регуляции кровообращения со стороны всех отделов мозга. Если это происходит незамеченным, то внезапно наступает глубокая вазоди-латация и падает венозный приток, что приводит к остановке сердца. Но даже эту ситуацию нельзя считать безнадежной. В таких случаях можно быстро ввести большие объемы жидкости (от 2 до 10 л коллоидного раствора) с небольшими дозами а-адренергических веществ, чтобы восстановить сосудистый тонус и кровообращение. Гипотермию использовать не следует.
У потенциального донора может наблюдаться диабетический статус, который достаточно легко поддается лечению внутримышечным введением антидиуретического гормона.
Техника операции. Техника операции близка к той, которая подробно разработана в эксперименте. Реципиента готовят к операции по принятой методике операций с использованием ИК. Доступ к сердцу осуществляется из срединной стернотомии. Полые вены канюлируют через правое предсердие несколько выше межкавального промежутка, а аорту—максимально отступя от ее корня. После начала ИК последовательно пережимают полые вены, аорту и иссекают пораженное сердце. Этот этап операции имеет некоторые особенности. Целесообразно оба предсердия отрезать максимально близко к предсердно-желудочковой борозде и оставить часть межпредсердной перегородки. Аорту и легочную артерию пересекают как можно ближе к полулунным клапанам. Достаточный участок ткани предсердий необходим для облегчения наложения анастомоза и сохранения афферентной иннервации предсердий, что играет существенную роль в поддержании гомеостаза в послеоперационном периоде. Кровоснабжение резецированных стенок предсердия обеспечивается бронхиальными артериями. Это, однако, не значит, что при выкраивании остаточных отделов стенок предсердий и межпредсердной перегородки следует оставлять излишки. Обязательным условием операции является удаление ушек обоих предсердий. Замечено, что оставление излишков предсердий и особенно их ушек может привести к ишемии, стазу и тромбозу. В процессе операции большое значение имеет мобильность магистраль-
ных сосудов. Поэтому после иссечения сердца следует разделить на достаточном расстоянии (не менее 1,5 см) восходящую часть аорты и легочную артерию реципиента, прокоагулировать жировой слой и очень ровно сформировать края сосудов для последующего формирования анастомозов.
Забор донорского сердца осуществляет вторая хирургическая бригада. Доступ к сердцу выполняют из срединной стернотомии. Вскрывают перикард и берут его на держалки. Внимательно осматривают сердце, чтобы исключить наличие травматического повреждения, врожденного или приобретенного порока сердца. Аорту выделяют на широком протяжении, вплоть до плечеголовного ствола. Также на всем протяжении выделяют верхнюю полую вену. Под нижнюю полую вену подводят турникет или толстую лигатуру. На восходящей части аорты накладывают кисетный шов для проведения кардиоплегии. Вводят гепарин из расчета 200 ЕД/кг массы тела донора. Пунктируют аорты для выполнения кардиоплегии. Перевязывают верхнюю полую вену и пережимают ее зажимом. Пережимают аорту у основания плечеголовного ствола. Вскрывают частично нижнюю полую и верхнюю (правую) легочную вены и сразу же начинают кардиоплегию (при температуре 4° С вводят раствор, содержащий 10 мэкв/л К + ). Вводят около 1000 мл кардиоплегического раствора, одновременно орошая наружную поверхность сердца и промывая полость перикарда холодным изотоническим раствором хлорида натрия. Все это занимает примерно 2 мин. Отрезают верхнюю и нижнюю полые вены. Проксимальнее зажима отсекают аорту. Сердце поднимают за верхушку и отсекают легочные вены. Последним пересекают легочный ствол на уровне правой и левой легочной артерии. Сердце освобождают от остатков перикарда и вынимают из грудной клетки. Иссеченное сердце немедленно помещают в изотонический раствор хлорида натрия при температуре +4° С, чтобы обеспечить холодо-вую защиту на периоды транспортировки и трансплантации. К трансплантации донорское сердце готовят в условиях его нахождения в специальной холодовой ванне. После подготовки аорты и легочного ствола готовят левое и правое предсердия (рис. 6.1). Подготовка левого предсердия проста: она состоит в том, что ровно соединяют отверстия всех легочных вен и края. При подготовке правого предсердия к наложению анастомоза необходимо быть очень аккуратным при выполнении разрезов на нем. Уже при выполнении первых операций было замечено, что если разрез провести от нижней полой вены к верхней полой вене по задней границе предсердия, то в послеоперационном периоде синусовый ритм не восстанавливается, а наблюдается узловой ритм или ритм коронарного синуса. Поэтому правильным является разрез, проводимый по переднебоковой поверхности. Таким образом исключается повреждение межузловых путей. Кроме того, при таком разрезе синусно-предсер-дный узел оказывается очень далеко (несколько сантиметров) от линии шва, что уменьшает его натяжение. При соблюдении этих условий синусовый ритм восстанавливается сразу же после восстановления деятельности сердца.
Защита миокарда трансплантируемого сердца за истекшие 20 лет значительно улучшилась. На начальных этапах развития трансплантации сердца одинаково часто использовалась антеградная аортальная или ретроградная коронарная перфузия кардиоплегического раствора. В настоящее время, однако, большинство специалистов предпочитают использовать перфузию в условиях глубокой гипотермии с одновременным орошением сердца холодным изотоническим раствором хлорида натрия при температуре +4° С. Так как время трансплантации составляет 35—75 мин, то для защиты миокарда на этот период обычно достаточно наружного орошения сердца холодным раствором или однократного введения кардиоплегического раствора после пришивания предсердий.
Операция пришивания донорского сердца выполняется в следующей последовательности: пришивают левое предсердие, межпредсердную перегородку, правое предсердие, легочную артерию и аорту (рис. 6.2). После имплантации донорского сердца перед пуском кровотока следует внимательно осмотреть все швы и провести очень тщательную
611

а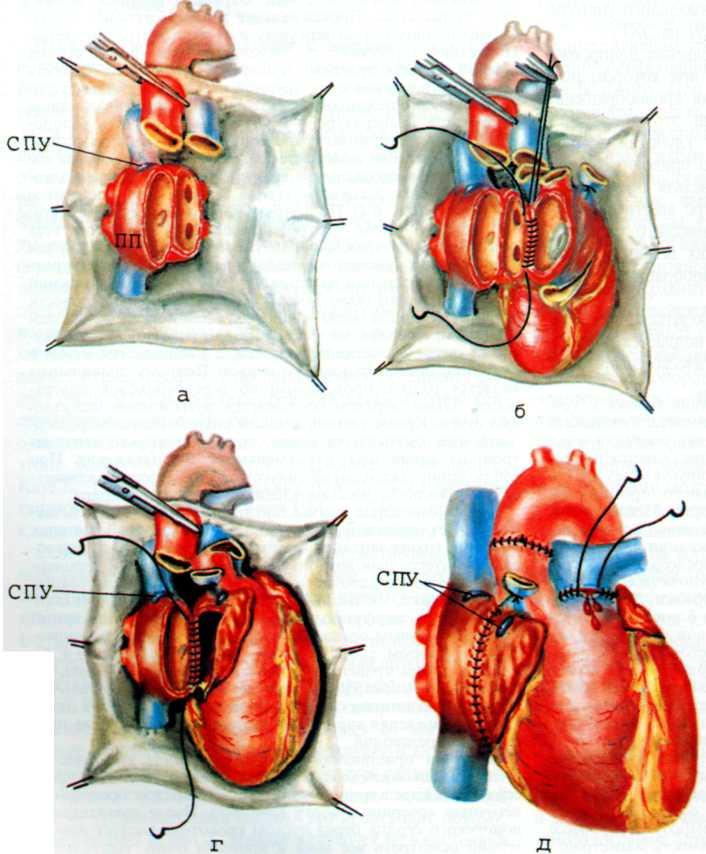 —
в
правом предсердии разрез от нижней
полой вены на ушко правого предсердия
проводят
параллельно предсердно-желудочко-воп
борозде, избегая повреждения заднего
межузлового пути и синусно-предсердного
узла;
б —
в
левом предсердии острым путем
соединяют отверстия легочных вен и
формируют одно отверстие. Ао —
аорта;
ЛС—легочный
ствол; ВПВ и НПВ —
верхняя
и нижняя полые вены; СПУ—си-нусно-предеердный
узел; ПП и ЛП—правое
и
левое предсердия.
—
в
правом предсердии разрез от нижней
полой вены на ушко правого предсердия
проводят
параллельно предсердно-желудочко-воп
борозде, избегая повреждения заднего
межузлового пути и синусно-предсердного
узла;
б —
в
левом предсердии острым путем
соединяют отверстия легочных вен и
формируют одно отверстие. Ао —
аорта;
ЛС—легочный
ствол; ВПВ и НПВ —
верхняя
и нижняя полые вены; СПУ—си-нусно-предеердный
узел; ПП и ЛП—правое
и
левое предсердия.
6.2. Последовательность этапов (а — д) трансплантации сердца, а — топография средостения после кардиожтомии; б. в — первым этапом выполняется левопредсердный анастомоз, он начинается от свободной стенки левого предсердия; г — сшивание перегородок предсердий; д — анастомоз правых предсердий и межаортальный и межлегоч-иый анастомозы; ЛП и ПП—левое и правое предсердия; СПУ—синус-но-предсердный узел.
672
профилактику воздушной эмболии. После снятия зажима с аорты и согревания больного ритм сердца, как правило, восстанавливается спонтанно, однако в ряде случаев приходится дефибриллировать сердце. Операцию заканчивают по принятой методике с оставлением дренажей в полости перикарда и переднего средостения.
Хирург, трансплантирующий сердце, должен быть знаком с некоторыми особенностями, обусловленными патофизиологическим состоянием малого круга кровообращения реципиента, а также особенностями консервации и техники самой операции.
Во-первых, следует иметь в виду, что у большинства больных, которым произведена трансплантация сердца, повышено общелегочное сосудистое сопротивление. Высокое общелегочное сопротивление у этих больных имеет вторичное происхождение и обусловлено длительно существующей левожелудочковой недостаточностью.
Во-вторых, следует очень внимательно ревизовать меж-предсердную перегородку донорского сердца и исключить наличие овального окна или другого межпредсердного сообщения, поскольку это может привести к развитию выраженной гипоксемии в раннем послеоперационном периоде.
В-третьих, вследствие повышенного общелегочного сопротивления из-за длительного периода консервации сердца в ближайшее время после трансплантации может появиться необходимость проведения вспомогательного кровообращения. В этих случаях исключительно эффективной оказывается контрпульсация.
В-четвертых, кроме основного назначения, которое направлено на профилактику воздушной эмболии сосудов головного мозга, профилактика и удаление оставшегося воздуха преследуют цель исключить его попадание в правую коронарную артерию. Такие случаи в литературе описаны. Попадание воздуха после снятия зажима с аорты в правую коронарную артерию, питающую правый желудочек, который в раннем послеоперационном периоде испытывает дополнительные нагрузки, крайне не желательно. Наконец, следует уделить особое внимание периоду «вхождения» реципиента в ИК. Этот этап исключительно важен—он определяет исход операции; анестезиолог должен сделать все, чтобы гемодинамика в этот период была стабильной, не допускать ее падения до уровня, требующего проведения массажа сердца. Известно достаточно много случаев, когда во время торакотомии у реципиента наступала остановка сердца и ведение больного до начала ИК осуществлялось с помощью прямого массажа сердца. Это в последующем приводило к неоднократным случаям операции тромбэкто-мии периферических сосудов. Причиной тромбозов периферических артериальных сосудов являются тромбы в левых камерах сердца примерно у 60% реципиентов. Если операция выполняется с учетом перечисленных рекомендаций, то сердечная деятельность восстанавливается быстро и при небольшой инотропной поддержке хорошо стабилизируется.
6.1. ГЕМОДИНАМИКА И ПАТОФИЗИОЛОГИЯ ТРАНСПЛАНТИРОВАННОГО СЕРДЦА
Гемодинамика у больного, которому произведена трансплантация сердца, в раннем послеоперационном периоде имеет некоторые особенности. В 1-е сутки после операции
сердечный индекс обычно снижен и не превышает 1,6— 2 л/(мин -м2). Затем в течение недели этот показатель повышается и обычно к 7-му дню после операции он достигает Зл/(мин-м2), что соответствует практически нормальным значениям. Характерно, что некоторые общепринятые способы увеличения сердечного выброса не дают эффекта на донорском сердце. Например, замечено, что увеличение частоты сердечных сокращений электрической стимуляцией желудочков не приводит к увеличению сердечного выброса, если число сердечных сокращений в покое менее 60 в минуту. Стимуляция предсердий увеличивает сердечный выброс в том случае, если исходное «ритмовождение» началось при частоте более 80 в минуту. При предсердной стимуляции с частотой 120—130 в минуту сердечный индекс возрастает примерно на 20%. Наиболее эффективной оказалась лекарственная терапия. Так, небольшие дозы адреналина увеличивают сердечный выброс в 3 раза. Оказалось также, что реципиент очень хорошо приспосабливается к этому препарату и для улучшения состояния больного в раннем послеоперационном периоде его следует вводить в течение нескольких дней в небольших дозах. Это позволяет снять возможные осложнения, которые характерны для синдрома низкого сердечного выброса. В отдаленные сроки внут-рисердечная гемодинамика нормализуется. Сердечный выброс, как правило, бывает не ниже 2,5 л/мин, достигая у большинства больных 5 л/мин при небольшой физической нагрузке.
Особый интерес представляет изучение реакции денерви-рованного сердца на физическую нагрузку и введение препаратов. Детально этот вопрос был изучен на материале W. Mason и D. Harrison (1979). Исследования проведены на 145 больных, которым произведена 151 трансплантация сердца. В правое предсердие вводили электрод, что позволяло проводить подробные электрофизиологические исследования трансплантированного сердца. Для определения автономной функции трансплантированного сердца осуществляли массаж каротидного синуса, пробу Вальсальвы, ингаляцию амилнитритов и внутривенное введение атропина. Оказалось, что у всех больных, оперированных в сроки от 1 года до 5 лет, отмечаются отчетливая реакция остаточных отделов предсердий реципиента и полное отсутствие реакции на эти тесты в донорской части сердца. Эти данные позволяют говорить о том, что, несмотря на довольно длительный срок, прошедший после пересадки сердца, иннервация его не восстанавливается.
Каким же образом денервированное сердце отвечает на повышенные запросы организма при физической нагрузке? Таких механизмов два. В первые 3 мин нагрузки частота сердечных сокращений изменяется очень умеренно. Однако сердечный выброс увеличивается значительнее, чем достигается благодаря увеличению ударного объема сердца в ответ на повышение конечно-диастолического давления в левом желудочке. В последующие несколько минут соотношение названных показателей изменяется: отмечается дальнейшее увеличение частоты сердечных сокращений, однако не меняется ударный выброс. Затем, по мере того как возрастает сократительная способность желудочков, конечно-диастоли-ческое давление левого желудочка возрастает, стабилизируется на максимальном уровне и медленно снижается. Таким образом, в денервированном сердце увеличение ударного выброса связано с механизмом Стерлинга; увеличение час-
613
готы сердечных сокращений и усиление сократительной функции миокарда обусловлены эффектом действия катехо-ламинов. В нормальном сердце этот процесс происходит одновременно. Предполагают, что выявленная разница— следствие задержки адренергического эффекта денервиро-ванного сердца в связи с тем, что поступление катехолами-нов в кровоток происходит несколько позже, чем в норме.
После стабилизации кровообращения наиболее грозным осложнением у больного с трансплантированным сердцем является отторжение донорского сердца. В вопросе установления иммунологического баланса между сердцем донора и организмом реципиента нельзя полностью орентироваться на данные, полученные при трансплантации других органов, в частности почек. Трансплантированное сердце иммуноло-гически подавлено меньше, чем трансплантированная почка, поскольку последняя попадает в организм больного, длительно страдающего уремией, и, следовательно, принимавшего более высокие дозы иммунодепрессивных средств. Вплоть до внедрения в клиническую практику циклоспорина А, практически у каждого больного появлялась реакция отторжения. Применение этого препарата существенно изменило возможности трансплантации сердца, уменьшив остроту реакции отторжения. Однако основные проявления внутриорганного конфликта сердце донора и организма реципиента до настоящего времени сохраняют свои черты, а поэтому требуют применения всего комплекса мер диагностики, профилактики и лечения.
Выделяют несколько типов реакции отторжения.
Молниеносное отторжение проявляется в пер вые часы после операции, обусловлено гуморальными фак торами, вызывающими гибель трансплантата, и характери зуется массивным повреждением эндотелиальных клеток.
Острое отторжение наблюдается в сроки от 7 дней до 3 мес, клинически характеризуется «кризами». Криз острого отторжения связан с ответом иммуноком- петентных клеток.
Хроническое отторжение возникает через 12 мес после трансплантации или в более поздние сроки и обуслов лено воздействием антител. Опыт последних лет позволяет установить временные закономерности развития кризов от торжения. Оказалось, что один эпизод острого отторжения наблюдается примерно на 33-й день после трансплантации сердца. В последующем в течение первого года после пере садки сердца следующий эпизод возникает примерно на 90-й день после операции. Наконец, в группе больных, наблюдав шихся в течение 5 лет, такой наиболее грозный период на блюдается примерно на 465-й день после трансплантации сердца. Имеется достаточное количество косвенных призна ков, указывающих на начинающуюся реакцию отторжения. С внедрением метода эндомиокардиальной биопсии стало возможным очень точно ставить диагноз реакции отторже ния и благодаря этому принимать своевременные меры, направленные на его профилактику. Одним из наиболее удобных и достаточно достоверных косвенных признаков начинающейся реакции отторжения может служить система тическая запись ЭКГ. Больному с трансплантированным сердцем 2 раза в день записывают ЭКГ в 12 стандартных отведениях. Один раз в день записывают ФКГ. Проводят анализ ЭКГ. При этом суммируют вольтаж в первых трех стандартных отведениях и в I и VI грудных отведениях. Если суммарный показатель вольтажа ЭКГ в названных отведе-
ниях уменьшается на 10—20% и одновременно появляются аритмии или ритм галопа, то это может служить ранним признаком реакции отторжения. В этом случае следует немедленно выполнить эндомиокардиальную биопсию. Если клинические признаки реакции отторжения очевидны, то следует начать лечение, а затем уже сделать биопсию. Если признаки отторжения не очевидны, то следует сначала выполнить эндомиокардиальную биопсию и на основании полученных результатов сделать заключение о необходимости усиления терапии, направленной на предотвращение реакции отторжения. В этот период, т. е. в период развивающейся реакции отторжения, эндомиокардиальную биопсию выполняют каждые 5—7 дней.
Гистологическая картина реакции отторжения в остром периоде типична и характеризуется периваскулярной, интер-стициальной и подэндокардиальной круговой клеточной инфильтрацией и отеком. Анализ состояния мелких сосудов выявляет повреждение эндотелиальных клеток, а в некоторых случаях миоцитоз и миоцитонекроз.
Лечение острой реакции отторжения: внутривенное введение 500—1000 мг метилпрсднизолона и 200—500 мг актино-мицина D, который вводят 1—2 раза в день. Эти препараты назначают до тех пор, пока не наступит отчетливого регресса реакции. При лечении наиболее острых форм отторжения следует вновь начать введение антилимфоцитарного глобулина или увеличить его дозу. Одновременно вводят гепарин, так как в остром периоде реакции отторжения отчетливо наблюдается повышение функции свертывающей системы крови и накопление субстратов, приводящих к тромбозу мелких сосудов. В остром периоде реакции отторжения или при несвоевременном распознавании этой реакции может наблюдаться значительное подавление функции миокарда. Поэтому следует проводить активную инотропную поддержку деятельности сердца для улучшения функции миокарда. Целесообразно вводить в этот период адреналин и дигоксин. Больному рекомендуется постельный режим, строго следят за температурой тела и при ее появлении начинают симптоматическое лечение. Современные средства позволяют эффективно бороться с реакцией отторжения. Однако необходимо подчеркнуть, что, если реакция отторжения не распознана или распознана чрезвычайно поздно, когда у больного появились признаки острой сердечной недостаточности, обусловленные длительным низким сердечным выбросом, лечение может стать неэффективным, и больные умирают от сердечной недостаточности. Поэтому своевременная диагностика и лечение реакции отторжения имеют исключительно важное значение при пересадке сердца.
Внедрение современных методов лечения позволило продлить жизнь больных с трансплантированным сердцем. Это поставило на очередь необходимость выявления реакций хронического отторжения. Она характеризуется сужением просвета коронарных сосудов в трансплантированном сердце. Таким образом, хроническое отторжение представляет собой не что иное, как артериосклероз трансплантата. Гистологически отличают пролиферацию клеток внутренней оболочки. У некоторых больных этот процесс осложняется увеличением количества жира и формированием атероматоз-ных бляшек. Результатом хронической реакции отторжения является ишемия миокарда, которая заканчивается смертью. Смерть больного наступает на фоне инфаркта миокарда или аритмии. Еще на начальном этапе разработки
614
проблемы трансплантации сердца было отмечено, что при хроническом отторжении наблюдаются внутрисосудистые микротромбозы, а гиперлипидемия обусловливает формирование атероматозных бляшек. В этой связи была разработана специфическая терапия, направленная на профилактику тромбоза (антикоагулянты). Определение содержания липидов и назначение специальной диеты под контролем массы тела позволили снизить частоту образования микротромбов. Назначение антикоагулянтов и специальной диеты снижает частоту реакции отторжения до 4,5%. В контрольной группе артериосклероз в трансплантате развивался в 100% случаев.
6.2. ПРОФИЛАКТИКА И ЛЕЧЕНИЕ РЕАКЦИИ ОТТОРЖЕНИЯ
Несмотря на то что вопросы профилактики и лечения реакции отторжения обычно детально рассматриваются в руководствах по иммунологии, мы тем не менее считаем необходимым привести краткую характеристику некоторых основных препаратов, применяемых при трансплантации сердца.
Приводим краткую характеристику препаратов, применяемых при трансплантации сердца.
Аналоги пурина. Азатиоприн (имуран)—пуриновый аналог, наиболее широко используется в качестве имму-нодепрессивного препарата при клинической трансплантации органов. Он обеспечивает «защиту» лабильных сульф-гидрильных групп. Используется в комбинации с другими препаратами.
Антибиотики. К антибиотикам-иммунодепрессантам относятся такие, которые обладают способностью подавлять внутриядерный синтез кислот либо взаимодействовать с синтезом клеточных белков. К сожалению, ни один из таких антибиотиков, включая актиномицин D и митомицин С, не имеет клинического значения, как иммунодепрессив-ный препарат при трансплантации.
Циклоспорины. Циклоспорины—циклические пептиды, которые представляют принципиально новый класс важных иммунодепрессивных препаратов. На клеточном уровне их действие оказывается исключительно специфичным и направлено на субпопуляцию Т-лимфоцитов. В клинической практике циклоспорин А сыграл важную роль при трансплантации сердца, а также сердца и легких. В сочетании с умеренными дозами преднизолона его клиническое значение эквивалентно сочетанному действию антилимфоцитарного глобулина, иммурана и преднизолона или превышает его.
Кортикостероиды. Независимо от механизма действия стероиды необходимы для успешной трансплантации органов у человека. Известно множество механизмов действия стероидов. Один из важнейших—лизис клеток (цитолиз), в частности С-лимфоцитов. Антилимфоцитарное действие кортикостероидов состоит в их способности разрушать лимфоциты, благодаря этому нарушается их активация антигенами. Стероиды самостоятельно не предотвращают отторжения трансплантата, однако в сочетании с другими медикаментами они не только предотвращают развитие реакции отторжения, но и приостанавливают ее.
Антилимфоцитарный глобулин. Использование антилимфоцитарных антител для подавления иммунного ответа все еще остается противоречивым, несмотря на очевидные доказательства эффективности как для предотвращения, так и для лечения реакции отторжения.
Действие антилимфоцитарного глобулина направлено преимущественно против Т-лимфоцитов. Антилимфоцитарный глобулин усиливает действие имурана и кортикостероидов против быстро развивающейся реакции отторжения; при этом суммарная токсичность препаратов не увеличивается. Лейкоциты, соединившиеся с антилимфоцитарным глобулином, лизируются или удаляются из организма фагоцитирующими макрофагами печени и селезенки. Более длительный прием этого препарата освобождает паракорти-кальные области лимфатических узлов, где находятся Т-лимфоциты, а при назначении больших доз уменьшается количество и В-лимфоцитов в мозговом слое и в фолликулах лимфатических узлов. Эти свойства антилимфоцитарного глобулина послужили основанием для широкого применения его в клинической практике для профилактики и лечения реакции отторжения.
Несмотря на то что опыт трансплантации сердца нельзя назвать недостаточным, единой схемы иммунодепрессивной терапии пока не разработано. Приводим наиболее типичную схему этой терапии. В операционной перед прекращением перфузии больному вводят 125 мг преднизолона. Повторно препарат в той же дозе вводят через 4 ч, а затем в той же дозе еще 2 раза каждые 8 ч.
Важнейшим препаратом является циклоспорин А. Больному до операции вводят насыщающую дозу препарата, которая определяется по его концентрации в крови (до 1000 мкг/мл). После операции для поддержания необходимой концентрации 6—14 мг/кг его вводят ежедневно. Необходимо исключить токсическое влияние препарата на печень и почки, поэтому определяют содержание билирубина, кре-атинина и контролируют диурез. К 5—7-му дню концентрацию препарата в крови снижают до 500—300 мкг/мл. В дальнейшем препарат принимают внутрь постоянно.
Преднизолон назначают с первого послеоперационного дня в дозе 0,5 мг/кг 2 раза в день. Каждую неделю дозу уменьшают на 0,1 мг/кг, пока она не составит 0,2 мг/кг (примерно к 2-му месяцу после операции). Препарат принимают постоянно. Имуран назначаю: в комбинации с пред-низолоном и антилимфоцитарным кроличьим глобулином. Дозу имурана регулируют по показателям лейкограммы.
Иммунодепрессивная терапия требует большой осторожности. Поэтому подготовка больного начинается в доопера-ционном периоде с санации очагов инфекции и профилактического введения антибиотиков. После операции обычно назначают цефазолин (цефамезин, кефзол), который вводят внутримышечно по 1 г каждые 6 ч. После удаления эндо-трахеальной трубки и мочевого катетера следует сделать с них посев, определить чувствительность к флоре и провести дополнительную антибиотикотерапию.
При развитии реакции отторжения в течение 3 дней внутривенно вводят по 1000 мг метилпреднизолона. Если реакция отторжения не останавливается, начинают лечение антилимфоцитарным глобулином из расчета 2,5 мг/(кг-сут). Препарат вводят внутривенно 2 раза в сутки. Одновременно проводят активную симптоматическую терапию. При неэффективности комплекса перечисленных мер единственным
675
выходом из кризиса становится повторная операция трансплантации сердца.
Инфекция (37,8%), реакция отторжения (33,1%) и сердечная недостаточность (24,8%) являются наиболее частыми причинами смерти больных после операции трансплантации сердца.
6.3. ТРАНСПЛАНТАЦИЯ СЕРДЦА И ЛЕГКИХ (СЕРДЕЧНО-ЛЕГОЧНОГО КОМПЛЕКСА)
Показанием к одномоментной трансплантации сердца и легких является терминальная стадия болезни и возможность восстановления у реципиента функций кровообращения и дыхания после операции. Конкретная группа больных, которой предполагается выполнить операцию трансплантации сердца, стоит перед угрозой несостоятельности донорского сердца из-за наличия у них высокой легочной гипертензии. Правый желудочек донорского сердца очень быстро теряет нагнетательную функцию в связи с препятствием току крови по малому кругу кровообращения. В другой группе больных, находящихся в терминальной стадии болезни, поражение легких может сочетаться с легочным сердцем. Лечение таких больных оказывается более успешным, если одновременно с легким пересадить и сердце. Остаются неповрежденными коронарно-бронхиальные анастомозы, которые сразу же по окончании операции обеспечивают кровоснабжение трахеобронхиального дерева. Достоинством метода операции является и то, что облегчается диагностика реакции отторжения, поскольку возможна биопсия миокарда.
Отбор донора и реципиента для трансплантации сердечно-легочного комплекса. Подбор донора для этой операции очень труден, так как искусственная вентиляция даже в течение нескольких часов при необратимых изменениях мозга приводит к развитию инфекционных осложнений в легких и другим нарушениям соотношения вентиляция—перфузия. Поэтому прежде всего необходимо осуществлять вентиляцию легких. Интубационная трубка должна быть предельно широкой, а содержание кислорода во вдыхаемой смеси не должно превышать 40%. При ИВЛ используют положительное давление в конце выдоха для профилактики коллапса легкого. Для профилактики нейрогенного отека легких центральное венозное давление должно быть очень низким (менее 100 мм вод. ст.), а среднее артериальное давление—в пределах 70—80 мм рт. ст.
При трансплантации сердечно-легочного комплекса резко сокращается допустимое время консервации легкого—оно не должно превышать 2 ч.
Методы операции. Предложены два принципиально различных метода. Группа хирургов, руководимая N. Shumway, на операции полностью удаляют трахеобронхиальное дерево реципиента. При этом особое внимание уделяют сохранению целостности диафрагмального и блуждающего нервов. Анастомозирование сердечно-легочного комплекса проводится в следующей последовательности: трахея, правое предсердие, аорта.
В послеоперационном периоде у этих больных, если не превышены сроки ишемии (до 2 ч), не наблюдается острой сердечной недостаточности. Реакция отторжения может иметь преимущественное проявление как со стороны сердца, так и со стороны легких. Эндомиокардиальная биопсия позволяет уточнить преимущественное поражение миокарда. Наиболее типичными послеоперационными осложнениями при этой операции являются: нарушение газообмена, уменьшение комплайенса легкого и выявляемое рентгенологически «затемнение» в легком. Последнее расценивается как реакция отторжения легкого. Лечение состоит в строжайшем ограничении введения жидкости и приеме диуретиков. При реакции отторжения сердца лечение проводится по описанной выше методике.
Результаты трансплантации сердца большинство авторов анализируют до и после периода внедрения циклоспорина А. Так, до 1977 г. выживаемость больных в течение 1 года составляла 60%, а к 1987 г.—80,6% [Кауе М., 1987]. Среди больных, оперированных после внедрения в клиническую практику циклоспорина А, более 5 лет жили 78,3%, до применения этого препарата—только 27%. Опыт трансплантации сердечно-легочного комплекса сравнительно невелик. Наибольшим опытом располагает группа хирургов из Стенфордского университета. В течение 1986—1988 гг. в мире выполнена 281 операция пересадки сердечно-легочного комплекса. Выживаемость в течение 2 лет повысилась с 52% в 1985 г. до 62% в 1987 г.
Отдаленные результаты после операции пересадки сердца, а тем более сердечно-легочного комплекса, требуют серьезного изучения. Операция, несомненно, улучшает «качество» жизни больных, совершенно «прикованных» к постели до операции. Многие из них возвращаются к прежней работе. Из 75 больных, оперированных группой Шамвея, 89% отметили улучшения «качества» жизни, а 82% выразили «высочайшее удовлетворение» нынешним статусом (по прошествии 1—14 лет после операции) [bought M. Е., 1985]. Однако нам бы не хотелось, чтобы у читателя складывалось впечатление, что проблема пересадки сердца решена полностью. Скорее всего, именно нынешний уровень трансплантации сердца ставит ряд серьезных вопросов, решение которых будет зависеть и от накопления клинического опыта.
 7
7
Болезни сосудов
А.А.Спиридонов
Л .И.Клионер
.И.Клионер
7.1. СИНДРОМ АТИПИЧНОЙ КОАРКТАЦИИ НИСХОДЯЩЕЙ ЧАСТИ АОРТЫ
Под этим термином следует понимать в основном два совершенно различных по своей этиологии процесса: неспецифический аортоартериит и врожденную сегментарную гипоплазию нисходящей части аорты, известные в литературе как «атипичные коарктации аорты», «коарктации абдоминальной аорты», «синдром средней аорты».
В 1733 г. Т. Morgagni впервые выявил гипоплазированную брюшную часть аорты у 33-летнего монаха [цит. по J. Palmar et al., 1983]. В 1949 г. Н. Bahnson и соавт. описали ангиографическую картину данного заболевания. В том же 1949 г. С. Olim выполнил резекцию супраренального сегмента аорты с ее протезированием. В нашей стране первую резекцию нисходящей части грудной аорты сделали Е. Н. Мешалкин и соавт. (1957), а Г. М. Соловьев и соавт. (1965) первыми произвели торакоабдоминальное шунтирование. Наибольшим опытом хирургического лечения данного синдрома располагает ИССХ им. А. Н. Бакулева АМН СССР [Спиридонов А. А. и др., 1986].
Частота. По данным вскрытий, частота стенозирующих поражений нисходящей части аорты составляет 1:62500 [Onat Т. et al., 1969]. На долю «атипично расположенных коарктации» приходится 0,5—3,8% всех коарктации аорты [Saveuse N. et al., 1983].
Патологическая анатомия врожденной сегментарной гипоплазии нисходящей части аорты. Характерно уменьшение наружного и внутреннего диаметра с сохранением нормального строения аортальной стенки и возможной вторичной пролиферацией внутренней оболочки. Просвет в аорте обычно расположен центрально (рис. 7.1). Утолщенная внутренняя оболочка имеет слоистое строение: у ее основания находится более зрелая соединительная ткань, нередко с сосудами, а ближе к просвету—более рыхлая и молодая. Эти слои иногда разделяются эластическими волокнами. Подобное строение внутренней оболочки свидетельствует о постепенном прогрессировании пролиферативных процессов вследствие турбулентного кровотока. Иногда наблюдается ее ги-перэластоз преимущественно у основания аорты. Средняя оболочка состоит как бы из двух слоев, в одном из которых имеется нормальный ход гладкомышечных волокон, а в другом он нарушен, видны признаки склероза, что, по-видимому, является следствием нарушения слияния дорсальных аорт. Наружная оболочка всегда носит совершенно нормальный вид (см. рис. 7.1).
Этиология и патогенез неспецифического аортоартериита.
По классификации В. В. Серова и соавт. (1982), неспецифический аортоартериит относится к первичным васкулитам с преимущественным поражением аорты и ее крупных ветвей и гигантоклеточной гранулематозной реакцией. Этиология большинства первичных васкулитов практически неизвестна. В ряде случаев можно связать их с переохлаждениями, перенесенными инфекциями, приемом лекарственных средств, профессиональными вредностями. Эту группу болезней можно считать полиэтиологичными. Патогенез связан с иммунными реакциями замедленного типа. При гиперчувствительности данного типа сенсибилизированные лимфоциты при «встрече» с тканевым антигеном высвобождают фактор, ингибирующий миграцию макрофагов, что приводит к скоплению в просвете и в стенке артерий моноцитар-ных клеток с последующей их трансформацией в макрофаги. Последние, выделяя лизосомальные ферменты, вызывают повреждение артериальной стенки. Сами макрофаги превращаются в эпителиоидные и гигантские клетки, что лежит в основе образования гранулем.
Макроскопическая аорта и ее ветви носят следы перенесенного воспаления—спаяние с периаортальной клетчаткой, наличие плотной фиброзной капсулы, увеличение парааор-тальных лимфатических узлов. Диаметр аорты может быть даже увеличен за счет утолщения наружных слоев стенки аорты (рис. 7.2). Просвет аорты на разрезе, напротив, сужен. Внутренняя оболочка бугристая, толстая, имеются наплывы оболочки белесоватой окраски. Характерна четкая граница измененной и неизмененной зон. Гистологически наружная оболочка представлена соединительнотканной муфтой в виде гиалинизированных пучков коллагена. Имеются очаги клеточного скопления, располагающиеся вокруг мелких сосудов и состоящие из лимфоидных, плазматических круглых клеток и полинуклеаров. Клеточные инфильтраты выявляются на границе наружной и средней оболочек. В vasa vasorum утолщен мышечный слой, отмечаются пролиферация и гиперэластоз средней оболочки. В ней также отмечается воспалительный процесс с клеточными инфильтратами из таких же клеток, реже встречаются гигантские клетки типа Лангханса и клетки инородных тел. Клеточные элементы богаты рибонуклеопротеидами. Гладкие мышцы и эластические мембраны фрагментированы, между ними выявляется грануляционная ткань. В местах отсутствия эластической мембраны видны участки фиброза с накоплением кислых и нейтральных мукополисахаридов (см. рис. 7.2).
Патологическая физиология. Любой коарктационный синдром характеризуется наличием шлюза в супра- или интер-ренальном сегменте аорты, проявляющегося развитием режима артериальной гипертензии проксимальнее участка сужения и артериальной гипотензии дистальнее него с развитием комплекса присущих данному синдрому определенных патофизиологических изменений.
Стенозированный сегмент может иметь различную локализацию. Различают стенозы среднегрудной, диафрагмаль-ной, интервисцеральной, интерренальной и инфраренальной локализации. Компенсация кровотока осуществляется через висцеральные и париетальные пути. При этом окольное кровообращение получает такое мощное развитие, какое никогда не наблюдается при атеросклерозе. Это обусловлено хорошими адаптационными пластическими возможностями молодого организма и длительным течением процесса. При всех локализациях стенозирующего процесса в аорте, кроме инфраренального, развивается артериальная гипертензия. Гёнез гипертензии обусловлен изменением характера магистрального почечного кровотока. Наряду с этим коарктационный синдром нисходящей части аорты дополняется новыми клиническими симптомами, обусловленными хронической ишемией органов пищеварения, почек, тазовых органов, нижних конечностей. Злокачественней становится артериальная гипертензия. В отличие от типичной коарктации аорты отмечается значительное повышение диастолического давления. При аортите, как правило, присоединяется общее воспаление.
Аортит нисходящей части аорты в изолированном виде следует относить по общепризнанной классификации, разработанной Е. Lupi-Herrera и соавт. (1977), к II типу. В данной классификации выделяют: I тип—поражение дуги аорты и ее ветвей; II тип—поражение торакоабдоминальной аорты и ее ветвей; III тип—генерализованное поражение; IV тип—поражение легочного ствола и легочных артерий. Достаточно часто аортит нисходящей части аорты сочетает-
679
а — наружная оболочка аорты без признаков воспаления, стенка аорты тонкая, наружный диаметр на разрезе уменьшен, внутренняя оболочки умерен-но гиперплазирована; б — наружная оболочка без признаков воспаления, тонкая; средняя оболочка не изменена, виден обычный эластический каркас аорты. Окраска орсеином. х 18.
ся с поражением других артериальных бассейнов и тогда его следует относить к III типу данной локализации.
Клиника. В анамнезе больных аортитом отмечается период острого воспаления, сопровождающийся общими, кар-диальными и легочными симптомами. К общим симптомам относятся: гипертермия, слабость, потливость, анорексия. дисменорея, артралгии, системные кожные реакции, сопровождающиеся воспалительной реакцией со стороны крови. Кардиальные симптомы являются следствием переносимого миокардита и перикардита [Saito V. et al., 1972] и включают в себя тахикардию, нарушения ритма, кардиомегалию. В 2/3 случаев отмечаются легочные симптомы, обусловленные поражением сосудов малого круга кровообращения, пневмониями и плевритами: кашель, кровохарканье, боли в грудной клетке [Nakao К. et al., 1967; Morocka S. et al., 1972]. В ан-гиологические стационары больные поступают обычно в хронической стадии заболевания, когда на первый план выступают сосудистые жалобы, немотивированная температура, общее недомогание, похудание, кардиалгии могут встречаться и в этой стадии; у 25% больных выявляют стадию обострения хронического воспалительного процесса, о чем свидетельствуют лабораторные данные.
У больных с врожденными сегментарными гипоплазиями нисходящей части аорты все эти явления отсутствуют. Опорными пунктами диагноза являются жалобы, характерные для артериальной гипертензии, наряду с умеренной картиной ишемии нижних конечностей, хронической ишемией органов пищеварения и тазовых органов.
При осмотре нет выраженной гипертрофии плечевого пояса и гипотрофии мышц нижних конечностей. Пульсация
сонных артерий усилена, как у гипертоников. Видимой на глаз пульсации межреберных артерий нет.
Пульс на руках—отчетливый, напряжен, на бедренных артериях—резко ослаблен, реже не определяется. При соче-танных вариантах аортита с поражением ветвей дуги аорты выявляется асимметрия пульса на сонных артериях и на руках. Патологический градиент артериального давления на руках и ногах при гипоплазии обычно составляет в среднем около 70 мм рт. ст. При аортите артериальное давление на ногах часто не определяется.
Перкуторно определяется увеличение границ относительной тупости сердца влево с расширением границ сосудистого пучка во втором межреберье с обеих сторон.
При аускультации определяется акцент II тона над аортой. Над областью сердца выслушивается систолический шум малой интенсивности. Эпицентр шума фиксируется со спины на уровне тел восьмого—одиннадцатого грудных позвонков паравертебрально слева, а спереди—в области эпигастрия. Аускультативные данные подтверждаются на ФКГ: фиксируется веретенообразный или ромбовидный систолический шум в эпигастрии и паравертебральной области. На ЭКГ отмечается отклонение электрической оси сердца влево, обусловленное перегрузкой и гипертрофией миокарда левого желудочка сердца. При аортите наблюдается выраженная гипертрофия миокарда практически у всех больных наряду с явлениями относительной коронарной недостаточности. Истинная коронарная недостаточность, обусловленная коронаритом. выявляется у 25% больных.
Методы функциональной диагностики (объемная сфигмография, осциллография, реография и допплерография ко-
I
" '■ •• "" "'
620
нечностей) отражают особенности гемодинамики, т. е. два режима кровообращения: на руках—магистральный характер кровотока с большой амплитудой колебаний, на ногах—пологие, запаздывающие волны, свидетельствующие о снижении магистрального или коллатерального кровотока.
При рентгенологическом исследовании определяется гипертрофия левого желудочка сердца. Сердце аортальной конфигурации, восходящая часть, дуга и начальный отдел нисходящей части аорты расширены, пульсация их усилена. «Клюв аорты» по левому контуру сохранен, «симптома тройки» нет. Во второй косой проекции контрастированный пищевод имеет прямолинейный ход. При аортите в V3 случаев фиксируется кальциноз стенок аорты. Узурация ребер встречается при аортите крайне редко, напротив, при врожденной гипоплазии часто видна узурация восьмого—десятого ребер с обеих сторон.
Ангиографическое исследование в отличие от типичной ко-арктации аорты при аортите обязательно. Детальный неин-вазивный этап обследования определяет «заинтересованность» различных артериальных бассейнов при аортите. Тщательное изучение ангиографии позволяет выбрать оптимальный вариант хирургического лечения. При сохраненном сниженном магистральном кровотоке на бедренных артериях показана трансфеморальная ангиография по Сель-дингеру с обязательной записью артериального давления и его градиента с целью выявления функционально значимого стеноза. Ангиография брюшной части аорты производится обязательно в двух проекциях для выявления стенозиро-вания висцеральных ветвей. При окклюзии терминальной части аорты показана ангиография. Доступ к ней осуществляется через подмышечные артерии.
Ангиографическая картина врожденной гипоплазии позволяет выделять следующие два варианта патологии аорты: фокальный, или сегментарный (менее 3 см по протяженности—рис. 7.3); тубулярный, или пролонгированный (рис. 7.4). Чаще встречается тубулярная форма, причем длина сужения может достигать 20 см и более. Ангиографическая картина изолированного торакоабдоминального поражения аорты при неспецифическом аортоартериите в значительной степени отличается от картины врожденной гипоплазии. При гипоплазии переход от нормального диаметра аорты к стенозированному происходит более плавно, стенки аорты ровные (рис. 7.5). При аортите отмечается диффузная неровность контуров аорты с дефектами наполнения (рис. 7.6). Нередко поражается торакоабдоминальный сегмент нисходящей части аорты с ее ветвями; изолированного поражения аорты практически не бывает. При гипоплазии в 40% случаев выявляется изолированный стеноз аорты в грудном и диафрагмальном сегментах без вовлечения в процесс ее ветвей. При аортите в '/з случаев отмечается полная окклюзия инфраренального сегмента аорты, почечные артерии стенозируются при аортите в 85% случаев, имеется обычно поражение ветвей дуги аорты, коронарных артерий и артерий малого круга кровообращения, чего не бывает при врожденной гипоплазии.
Прогноз и естественное течение болезни. Острый период аортита развивается обычно в возрасте 6—20 лет, а сосудистые проявления—в третьей декаде жизни—к 25—30 годам. К 15-му году заболевания, несмотря на лекарственное лечение, от мозговых и почечных осложнений умирают 82%
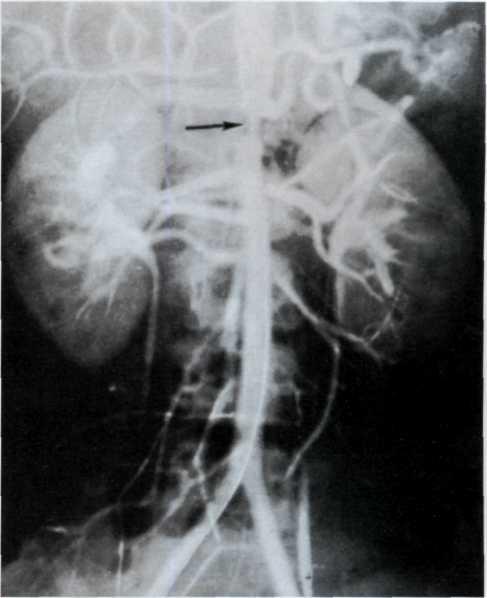
7.3. Ангиограмма больной с сегментарным стенозом суп-раряшльного сегмента брюшной части аорты (указано стрелкой).
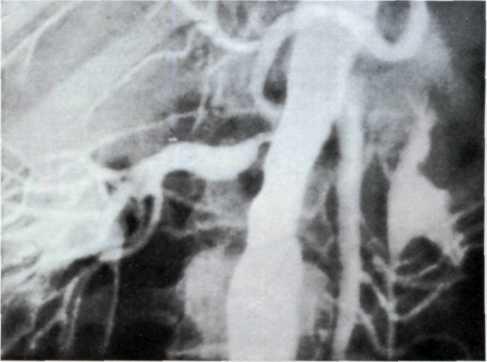
7.4. Ангиограмма больного с врожденной гипоплазией инфраренального сегмента брюшной части аорты.
больных [Morocka S. et al., 1972]. Врожденная гипоплазия в связи с отсутствием сочетанных поражений коронарных артерий и ветвей дуги аорты—заболевание менее злокачественное. И аортит, и гипоплазия нисходящей части аорты— процессы прогрессирующие и их основной клинический симптом—артериальная гипертензия—неизбежно приводит к типичным осложнениям со стороны мозга и миокарда. Поэтому наличие коарктационного синдрома является пока-
621
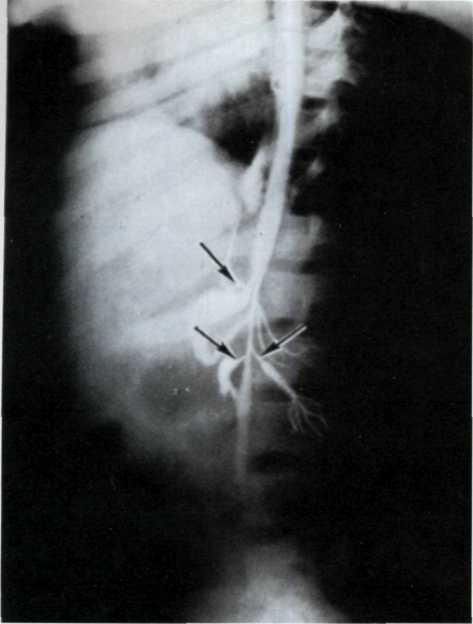
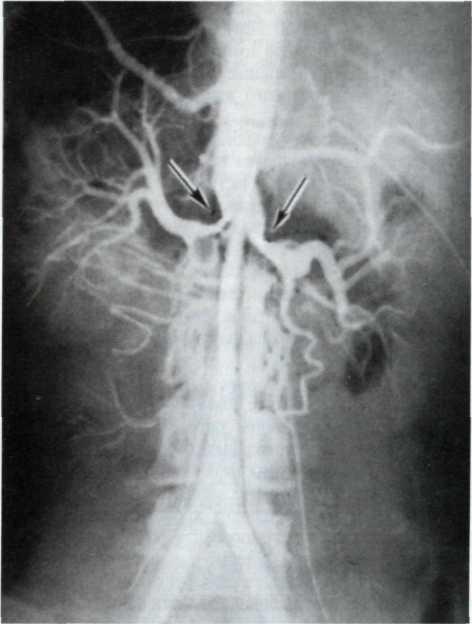
Сужения аорты в области перешейка не выявлено. Резкая гипоплазия среднего сегмента аорты со стенозом и пост-степотической аневризмой чревного ствола, стенозом верхней брыжеечной и обеих почечных артерий (стрелки).
7.7. Схематическое изображение единого оперативного доступа к грудной и брюшной частям аорты, разработанного в ИССХ им. А. Н. Бакулева АМН СССР. Положение больного па правом боку с валиком под девятым-десятым ребром. Производится левосторонняя торакофре-нолюмботомия в пятом — седьмом межреберье (в зависимости от уровня проксимального поражения) с пересечением реберной дуги и переходом разреза в параректальный.
7.6. Ангиограмма больной со стенозирующим неспецифическим аортоартериитом брюшной части аорты и ее ветвей. Четко видны дефекты наполнения самой аорты, резкий стеноз правой и окклюзия левой почечных артерий (указано стрелками).
занием к операции. При поражении ветвей брюшной части аорты необходима одновременная реваскуляризация ише-мизированных органов. Не следует оперировать больных аортитом в стадии острого воспаления или при подостром течении процесса.
Хирургическое лечение. Оперативные доступы зависят от локализации стеноза, его протяженности и сопутствующих процессов. При изолированном поражении среднегрудного отдела аорты показана левосторонняя боковая торакотомия в пятом—шестом межреберье. При диафрагмальной локализации процесса показана заднебоковая торакотомия в восьмом межреберье. При сужении верхнего сегмента брюшной части аорты показана левосторонняя торакофре-нолюмботомия в девятом межреберье. Этот же доступ целесообразно использовать при интерренальном поражении аорты. При инфраренальной локализации поражения можно сделать операцию, используя метод полной срединной лапа-ротомии или косой забрюшинный доступ. При диффузном поражении всей нисходящей части аорты в ИССХ им. А. Н. Бакулева АМН СССР разработан и применяется единый доступ—левосторонняя торакотомия в пятом— седьмом межреберье с пересечением реберной дуги и переходом разреза в параректальный вплоть до лобковой области (рис. 7.7). Приводим краткое описание клинического наблюдения.
622

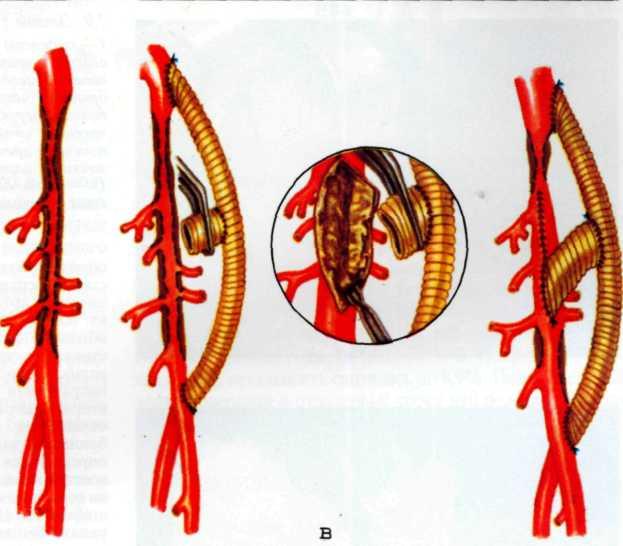
Больная Т., 17 лет, поступила в институт с жалобами на общую слабость, субфебрильную температуру, дисме-норею. головные боли, одышку. Больна в течение 2 лет со времени выявления повышенного АД до 180/100 мм рт. ст. При поступлении пульсация на брахиоцефальных сосудах отчетливая, шумов над ними нет. С уровня брюшной части аорты и дистальнее пульсация не определяется. Выслушивается систолический шум в межлопаточной области, проводящийся паравертебрально до поясничной области, а также в эпигастрии. На нижних конечностях АД не определяется. Допплерографически выявлен градиент давления на верхних и нижних конечностях 60 мм рт. ст. На ан-гиограмме (рис. 7.8) грудная и брюшная части аорты резко сужены. Правая почка снабжается кровью двумя почечными артериями, левая — одной. Во всех почечных артериях имеются участки резкого сужения в области устьев. Иммунологическое исследование позволило выявить наличие процесса аутоиммунной природы. Клинический диагноз: неспецифический аортоартериит; пролонгированный стеноз нисходящей части аорты; синдром атипичной коарктации
нисходящей части аорты; вазорснальная гипертензия. Операция произведена в условиях общей гипотермии (28 С). Левосторонняя торакофренолюмботомия по седьмому меж-реберью. Пульсация аорты сохранена до седьмого грудного позвонка, далее резко ослаблена. Выделен участок аорты на уровне тела пятого грудного позвонка. При ревизии брюшной части аорты выявлены участки резкого стеноза чревного ствола, верхней брыжеечной артерии, двух правых и левой почечной артерий. Нижняя брыжеечная артерия и дистальнее нес аорта имеют мягкие стенки, признаков воспаления нет. После пережатия грудной части аорты проксимальнее стеноза в ее стенке по левой полуокружности выкроено овальное окно диаметром по длиннику 30 мм, в которое вшит протез диаметром 16 мм. Протез пережат, восстановлен кровоток в аорте. В передней стенке протеза на уровне висцеральных ветвей в созданное «окно» вшит дополнительный коллектор из протеза диаметром 22 мм, длиной 35 мм (см. рис. 7.8; рис. 7.9). Брюшная часть аорты пережата выше бифуркации, в боковой стенке ее проксимальнее нижней брыжеечной артерии выкроено окно, в ко-
623

7.9. Этапы (I—IV) операции шунтирования. I—выделены брюшпа.ч часть аорты и ее ветви; II—произведены торакоабдомшш.гыюе шунтирование аорты (в шунт вшит приводящий коллектор для реваскуляризации ветвей брюшной части аорты), заднебоковая аортотомия и тромбоэндартерэктомия из среднего сегмента аорты и устьев чревного ствола, верхней брыжеечной, двух правых и левой почечной артерий; III—препарат удаленной внутренней оболочки из аорты и устьев висцеральных и почечных артерий; IV—заключительная картина произведенной операции, представленной на рис. 7.8, в.
оболочка как из просвета аорты, так и из устьев чревного ствола, верхней брыжеечной, двух правых почечных и левой почечной артерий. Получен хороший ретроградный кровоток из всех ветвей. В дистальном участке аорты внутренняя оболочка фиксирована. Ушит разрез в аорте от чревного ствола до уровня верхней брыжеечной артерии, а в оставшийся участок аортотомического разреза вшит в косом направлении общий коллектор. Длина анастомоза коллектора с аортой 40 мм. После пуска кровотока получена отчетливая пульсация всех реконструированных ветвей брюшной части аорты. Симптом дрожания над ними не определяется. Послеоперационный период протекал гладко, восстановился пульс на артериях стоп, градиента давления на верхних и нижних конечностях нет. Артериальное давление стабильное (ПО—120/60 мм рт. ст.) без гипотензивной терапии. Выписана домой через 3 нед после операции с рекомендациями проводить противовоспалительную терапию.
Для ликвидации стеноза аорты и устранения коарктацион-ного синдрома возможны следующие виды пластических операций: 1) резекция стенозированного участка аорты с замещением его синтетическим протезом; 2) шунтирование аорты в обход стенозированного сегмента; 3) боковая пластика аорты с помощью «заплаты» из синтетической ткани. При аортите следует предпочесть радикальное иссечение измененного участка аорты в пределах здоровых тканей с его протезированием. При одновременном поражении ветвей брюшной части аорты (склеротическая стадия аортита) показаны тромбоэндартерэктомия из аорты и ее ветвей или реплантация ветвей в протез, или их резекция с протезированием. Учитывая опасность выключения функционирующих нижнегрудных и верхних поясничных артерий из кровотока, для профилактики ишемии спинного мозга следует стремиться к их сохранению путем наложения проксимального и дистального анастомозов по типу длинных, косых «заплат» либо использовать метод, аналогичный методу рева-
IV
624
I—схема патологического ок-клюзионного поражения аорты; II—модификации аорто-томического разреза по типу «люка»; III—после тромбэндар-терэктомии аортотомическое отверстие ушивается и производится протезирование брюшной части аорты бифуркационным протезом с имплантацией по методу Карреля устья нижней брыжеечной артерии в основную браншу протеза. НБА—нижняя брыжеечная артерия.
скуляризации спинальных артерии при операциях по поводу торакоабдоминальных аневризм. Перевязка нижнегрудных межреберных артерий может производиться только в случае отсутствия по ним ретроградного кровотока, выявляемого при аортотомии. При врожденной гипоплазии аорты операция интимэктомии не производится. Если имеется стеноз верхнебрюшного отдела аорты без вовлечения в просвет устьев ветвей аорты, возможна боковая пластика аорты «заплатой». Если ветви аорты вовлечены в процесс, необходима их имплантация в протез. При этом удобнее сначала имплантировать из левостороннего доступа правую почечную артерию, затем чревный ствол и верхнюю брыжеечную артерию и лишь затем левую почечную артерию.
Техника операции при етенозирующем аортите интервисцерального и интерренального сегментов аорты с вовлечением в процесс устьев ветвей при окклюзии инфра-ренального сегмента аорты, вплоть до бифуркации, заключается в следующем. Производится левосторонняя торако-френолюмботомия по девятому межреберью, переходящая в параректальный разрез, вплоть до лобковой области. Рассекают диафрагму до аортального кольца. Брюшину и левую почку отводят медиально. Аорту выделяют выше чревного ствола вместе со всеми ветвями (рис. 7.10). При окклюзии аорты дистальнее почечных артерий аорту пересекают и дистальный ее отрезок ушивают. Ретроаор-тально выделяют правую почечную артерию. Выше чревного ствола аорту пережимают. От инфраренального сегмента аорту рассекают по заднебоковой поверхности в краниальном направлении. Зондами останавливают ретроградный кровоток из межреберных и поясничных артерий. Утолщенная склерозированная внутренняя оболочка отслаивается лопаточкой и единым блоком производится тромбоэндар-терэктомия из аорты и ее ветвей. Проксимальный край внутренней оболочки отсекают. Аортотомический разрез ушивают проленовой нитью 3/0—4/0. Если сужения наружного диаметра аорты нет, то разрез ушивают полностью. Если сужение наружного диаметра имеется, то анастомоз аорты с протезом лучше создавать по типу косой «заплаты». Дистальный отрезок протеза анастомозируют по показаниям. Пластику устья нижней брыжеечной артерии производят в случае необходимости по методу Карреля.
Результаты операций. Летальность при реконструкции нисходящей части аорты при врожденной гипоплазии в настоящее время равна нулю [Graham L. et al., 1979]. По данным А. А. Спиридонова и соавт. (1985). все 26 оперированных больных перенесли операцию. В отдаленные сроки у 88,9% больных сохранялся хороший гипотензивный эффект операции. Операции по поводу неспецифического аортоартериита длительное время сопровождались высокой летальностью. Лишь в последние годы, по данным А. В. Покровского и соавт. (1984), летальность снизилась до 8.9%. Положительный эффект операции в отдаленные сроки наблюдения зафиксирован у 72,9% больных.
7.2. АНЕВРИЗМЫ ГРУДНОЙ ЧАСТИ АОРТЫ
Под аневризмами грудной части аорты понимают локальное или диффузное расширение ее просвета, превышающего нормальный диаметр аорты в 2 раза и более. Хирургическое лечение аневризм артериального русла составляет 10% всей оперативной деятельности наиболее активных хирургов [Rutherford R., 1984].
Первые сообщения относительно аневризм грудной части аорты появились в XVI веке. В 1557 г. Везалий сообщил о мешковидной, по-видимому, травматической аневризме грудной части аорты [цит. по L. Parmley et al.. 1958]. Описание сифилитической диффузной аневризмы грудной части аорты встречено у Фернеля в 1581 г. [цит. по R. Reemtsma, 1978]. Реконструктивная хирургия аневризмы грудной части аорты получила свое начало, однако, лишь в 40-х годах нашего столетия, когда в 1944 г. J. Alexander. F. Byron первыми произвели резекцию мешковидной аневризмы грудной части аорты. Их начинание продолжили в 1948 г. Н. Shumacker и соавт., которые первыми резецировали аневризму при коарктации аорты с анастомозом аорты конец в конец. О первой успешной резекции аневризмы грудной части аорты с замещением трансплантатом сообщили в 1953 г. М. DcBakey, D. Cooley. 1955 год ознаменовался двумя новыми победами в хирургическом лечении аневризм
625
7.11. Схема классификации аневризм грудной части аорты по сегментам.
грудной части аорты — D. Cooley и соавт. сообщили о полном замещении аневризмы дуги аорты, a F. Ellis и соавт. и независимо от них S. Etteredge осуществили успешные операции по поводу торакоабдоминальных аневризм. Первую успешную операцию раздельного протезирования аортального клапана и восходящей части аорты осуществил в 1964 г. R. Wheat. В дальнейшем М. Bcntall (1968), J. Edwards (1974) и С. Cabrol (1981), учитывая вовлечение в патологический процесс фиброзного кольца, синусов Валь-сальвы и устьев венечных артерий, предложили различные модификации одновременного протезирования аортального клапана и восходящей части аорты клапансодержащим «кондуитом» с реимплантацией венечных артерий.
В СССР первую успешную операцию резекции посттравматической аневризмы грудной части аорты в условиях И К выполнил 17 апреля 1962 г. М. Н. Аничков. 28 декабря того же года успешную резекцию мешковидной аневризмы восходящей части аорты с наложением краевого шва аорты в условиях ИК выполнил А. В. Покровский. Первые успешные операции супракоронарной резекции аневризмы восходящей части аорты с раздельным протезированием аорты и аортального клапана, а также вмешательства по методике Бентала и Каброля при синдроме Марфана выполнил Г. И. Цукерман соответственно в 1973, 1978 и 1983 гг.
Частота. По данным P. Parsche и соавт. (1980), на материале более чем 67 000 аутопсий аневризмы аорты были выявлены в 516 случаях (0,7%), причем только в 70 случаях аневризмы были диагностированы прижизненно. Соотношение аневризм аорты разной локализации было следующим: аневризмы восходящей части аорты—22,9%, дуги аорты— 18,9%, нисходящей части аорты—19,5%, брюшной части аорты—37,2%. Таким образом, аневризмы грудной части аорты составляют почти /3 всех случаев аневризм аорты. По данным ИССХ им. А. Н. Бакулева АМН СССР, аневриз-
мы восходящей части аорты с аортальной недостаточностью встречаются у 1,7% больных с аортальными пороками сердца и в 44% всех аневризм грудной части аорты.
Классификация. Классификация аневризм грудной части аорты достаточно сложна, поскольку требуют своей оценки не только локализация аневризмы по сегментам аорты, но и ее этиология, форма, структура стенки аневризмы, клиническое течение самого заболевания (бессимптомное, неос-ложненное и осложненное).
Сегментарная классификация аневризм грудной части аорты представляется наиболее целесообразной, так как во многом позволяет дифференцировать клинические симптомы и тактику оперативного лечения. Выделяют аневризмы: 1) синуса Вальсальвы (см. гл. 2.34); 2) восходящей части аорты; 3) дуги аорты; 4) нисходящей части аорты; 5) грудной и брюшной частей аорты; 6) комбинированные аневризмы (по локализации) (рис. 7.11).
Этиология. Классификация аневризм грудной аорты по этиологии может быть представлена в настоящее время следующим образом: 1) врожденные заболевания стенки аорты (болезнь Марфана, синдром Элерса — Данлоса, фиброзная дисплазия); 2) приобретенные заболевания: а) воспалительные— специфические и неспецифические аортиты, ми-котические аневризмы, послеоперационные (обусловленные инфекцией); б) невоспалительные, дегенеративные (атеросклероз, аневризмы трансплантатов, послеоперационные, обусловленные дегенеративными изменениями стенки аорты, дефектами протезов и шовного материала); в) механические (гемодинамические-постстенотические, в том числе после наложенных анастомозов, и травматические); г) идио-патические (медионекроз Эрдгейма. медионекроз во время беременности). В зависимости от локализации аневризм соотношение их по этиологии носит различный характер. В более ранних сообщениях доказано, что сифилитический аортит, поражающий аорту на всем протяжении, клинически чаще проявляется в виде аневризм восходящей части аорты и ее дуги. Однако R. Campmeier (1938) показал, что среди 596 случаев сифилитических аневризм их локализация была практически одинаковой как в восходящей части аорты, так и в дуге и в нисходящей части (соответственно в 36, 34 и в 30% случаев). По данным М. DeBakey (1958), среди 50 аневризм дуги аорты 70% были сифилитической этиологии и лишь 20% — атеросклеротической. Аневризмы нисходящей части аорты (73 наблюдения) распределялись по этиологии несколько иначе: 47% составили атеросклеротические аневризмы, 32% — сифилитические, 12% — поеттравмати-ческис. В последние годы, однако, среди аневризм нисходя-шей части аорты первое место по своей частоте занимают травматические аневризмы (42%). затем атеросклеротические (25%), реже встречаются сифилитические (12%), коарк-тационные (8%). С увеличением частоты операций на грудной части аорты увеличилось количество и послеоперационных аневризм [Shilberg Т. et al., 1971 ].
Патогенез. Развитие аневризм грудной части аорты, помимо самого фактора заболевания стенки аорты, определяется и двумя другими факторами — гемодинамическим и механическим. Гемодинамичсские факторы (скорость кровотока, крутизна пульсовой волны и форма ее) особенно выражены в восходящей части аорты и тотчас дистальнее левой подключичной артерии, где дуга аорты делает значительный изгиб. Кроме того, грудная часть аорты имеет 3 наиболее функционально напряженных и подвергающихся хронической, а нередко и острой травматизации сегмента — корень, перешеек и диафрагма (рис. 7.12). При внезапной остановке человека слабо фиксированные участки аорты продолжают инерционное движение вперед, в то время как более фиксированные участки аорты препятствуют этому смешению аорты. При большой скорости движения, в острой ситуации (авто, мото-, авиакатастрофы, падение с высоты, спортивные игры) этот механизм травмы стенки аорты приводит
626
к ее разрыву (рис. 7.13) или чаще надрыву внутренней оболочки с образованием субинтимальной гематомы, а в последующем— посттравматической аневризмы. При хронической травматизации аорты могут возникать в ее стенке своеобразные морфологические изменения, которые аналогичны изменениям выявляемым при медионекрозе Эрдгей-ма. Травма vasa vasorum приводит к травматическому медио-некрозу с дегенерацией стенки, что, с нашей точки зрения, может обусловливать развитие истинных приобретенных дегенеративных аневризм в грудной части аорты, не характерной для локализации атеросклероза. Этот же генез развития аневризм, по-видимому, имеет определенное значение и в образовании аневризм грудной и брюшной части аорты, где причиной хронической травмы стенки аорты является диафрагма, так как аорта фиксирована аортальным каналом.
Патологическая анатомия. При синдроме Марфана основные изменения отмечаются в соединительной ткани, что связано с врожденными нарушениями метаболизма хондро-итинсерной кислоты и основной субстанции соединительной ткани. Для этого заболевания характерны дегенерация эластических волокон и дезорганизация средней оболочки сосудов эластического типа. При гистологическом исследовании всегда имеются очаги разрушения эластических, гладкомы-шечных и коллагеновых структур стенки аорты с образованием заполненных мукоидным содержимым кист Эрдгейма (рис. 7.14). Аналогичные изменения имеются и при идиопа-тическом медионекрозе. Для сифилитического мезаортита характерно разрушение мышечного и эластического каркаса стенки аорты. При неспецифическом аортите отмечаются выраженный периаортит, утолщение наружной оболочки, продуктивное воспаление в наружных слоях медии с дезорганизацией наружной эластической мембраны, разрушением гладкомышечных структур. Внутренняя оболочка обычно утолщена, но без признаков воспаления. В хронической стадии vasa vasorum обычно облитерированы. Толщина стенки аорты в ряде случаев составляет 0,8— 1 см.
Патологическая физиология заболевания обусловлена в первую очередь потерей аортой своей роли компрессионной камеры. Снижение пропульсивной способности грудной части аорты извращает нормальный пульсовой характер волны в более дистальных ее отделах. Изменяется и характер возвратной диастолической волны. Кровоток приобретает турбулентный характер. Сопутствующее поражение аортального кольца приводит к его дилатации и развитию
7.12. Схематическое изображение трех наиболее уязвимых сегментов аорты, в которых происходит повреждение стенки аорты при тупых травмах, а— корень; 6—перешеек; в—уровень диафрагмы.
7.13. Схематическое изображение надрыва внутренней оболочки аорты в области перешейка (а) с ограниченным расслоением стенки и образованием субинтимальной гематомы (б). Этот процесс в дальнейшем приводит к образованию травматической аневризмы грудной части аорты в типичном месте (в).
627
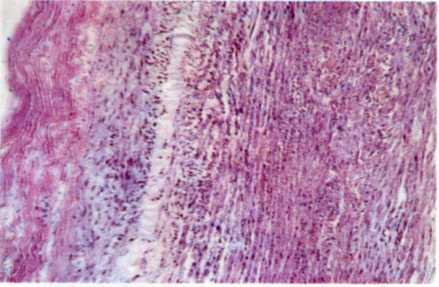
7.14. Синдром Марфина. В наружных отделах средней оболочки восходящей части аорты видна линейной формы киста, заполненная базофильной субстанцией (кистозный медионек-роз). Окраска гематоксилином и эозином, х 18.
аортальной недостаточности с регургитацией крови в левый желудочек, снижением диастолического давления и гемоди-намически обусловленным изменением характера и величины венечного кровотока. При аортите утолщение инти-мального слоя аорты также нередко приводит к стенозиро-ванию устьев венечных артерий или их поражению на протяжении с развитием истинной коронарной недостаточности, к перегрузке левого желудочка с развитием его гипертрофии и последующей дилатации. Сердечная недостаточность, помимо развития аортальной недостаточности, может быть обусловлена при аневризмах больших размеров компрессией выходных отделов левого, а иногда и правого желудочка, легочного ствола и венечных артерий. При осложненном течении аневризм восходящей части аорты разрыв аневризмы в полости сердца, легочный ствол, верхнюю полую вену приводит к специфическим патофизиологическим изменениям, характерным для значительного и остро развившегося сброса крови слева направо или справа налево.
Клиника аневризм грудной части аорты чрезвычайно вариабельна и обусловлена в основном размерами аневризма-тического мешка, его локализацией и протяженностью, а также этиологией заболевания. В ряде случаев аневризмы могут протекать практически бессимптомно и стать случайной находкой при профилактическом осмотре. В других случаях клиника носит весьма скудный характер. Ведущим симптомом аневризм грудной части аорты является боль, обусловленная либо самим заболеванием стенки аорты (сифилитический мезаортит, неспецифический аортит), либо растяжением стенки аорты, либо компрессией близко расположенных органов. При аневризме восходящей части аорты боли обычно локализуются в области сердца и за грудиной.
Типичные стенокардитические боли обычно обусловлены либо компрессией венечных артерий, либо их стенозирова-нием, сопутствующим основному процессу (атеросклероти-ческому или воспалительному). Симптомы сердечной недостаточности (одышка, сердцебиение, головокружение и пр.) обычно характерны для больных с недостаточностью аортального клапана. При больших аневризмах восходящей части аорты, вызывающих компрессию верхней полой вены,
больных беспокоят обычно головные боли и отечность лица, шеи и рук. При аневризмах дуги аорты больные жалуются на боль за грудиной и в межлопаточной области, что обусловлено растяжением и сдавлением аортальных нервных сплетений. Компрессия пищевода приводит к явлениям дис-фагии, а в дальнейшем к нарушению питания стенки пищевода, небольшим пищеводным кровотечениям—предвестникам прорыва аневризмы грудной части аорты в пищевод. У трети больных одним из ведущих симптомов являются одышка и стридор, которые обусловлены компрессией трахеи, левого бронха, легочных сосудов. Компрессия корня левого легкого приводит к застойным явлениям, частым пневмониям. Вследствие сдавления возвратного нерва возможно развитие характерной симптоматики с осиплостью голоса, сухим кашлем. Сдавление блуждающего нерва вызывает брадикардию, слюнотечение. Эти же симптомы могут развиться и при аневризме начального сегмента нисходящей части аорты. Раздражение периаортального симпатического сплетения приводит к развитию аортально-плечевого синдрома, проявляющегося болями в левой лопатке, плече и в предплечье. Вовлечение в процесс межреберных артерий на значительном протяжении с их окклюзией может привести к ишемии спинного мозга, вплоть до развития нижних парапарезов и параплегии. Реже возможно сдавление лимфатического протока с развитием отека верхней половины левого плечевого пояса. Компрессия тел позвонков может вызвать их узурацию, дегенерацию, смещение с образованием кифоза. Компрессия нервов и сосудов приводит к радикулярным и межреберным невралгиям.
Клиника аневризм грудной и брюшной части аорты обусловлена несколькими факторами: компрессией соседних тесно расположенных органов—кардиального отдела желудка, двенадцатиперстной кишки, вовлечением в процесс висцеральных артерий. Основными жалобами являются боли в животе, отрыжка, ощущение переполнения желудка, тяжесть в эпигастрии. Боли могут быть связаны с приемом пищи. Одновременно отмечаются тошнота, рвота, явления дисфункции кишечника, похудание. Больные отмечают усиленную пульсацию в животе. Если аневризма не распространяется на инфраренальный сегмент аорты, пальпировать пульсирующее образование в животе не удается. В тех случаях, когда удается пальпировать пульсирующее образование в эпигастрии, оно практически неотделимо от реберной дуги, плотное, напряженное, неподвижное и болезненное.
Осложнения аневризм грудной части аорты с их разрывом или прорывом в соседние органы обычно возникают остро, приводят к шоку и сердечно-сосудистому коллапсу или же к острой сердечной недостаточности. Таковы случаи прорыва аневризмы в верхнюю полую вену, пищевод, трахеоброн-хиальное дерево, а также в полость перикарда, в плевральную полость, забрющинное пространство. При прорыве аневризмы в систему верхней полой вены остро развиваются картины синдрома верхней полой вены, усиленная пульсация сосудов шеи и сердечная недостаточность. При прорыве аневризмы трахеобронхиальное дерево развивается картина массивного легочного кровотечения, при прорыве в пищевод— рвота кровью, а в двенадцатиперстную кишку—мелена. Симптомы эмболизации периферических артерий не столь характерны, однако, могут иметь место вследствие отрыва тромботических масс из аневризматического мешка или вследствие изъязвления атеросклеротических бляшек.
628
Редко картина эмболии периферических артерий может быть первым симптомом аневризмы.
Диагностика. Тщательно собранный анализ позволяет выявить в ряде случаев у родственников больного синдром Марфана, синдром Элерса—Данлоса. Важным является установление факта заболевания сифилисом, тупой или острой травмы грудной клетки, а также периода острого системного воспалительного заболевания, характерного для неспецифического аортоартериита.
Внешний осмотр дает мало информации для предположительного диагноза аневризмы грудной части аорты. Тем не менее характерный внешний вид больных с синдромом Марфана, усиленная пульсация дуги аорты в области рукоятки грудины, а также редкие случаи видимого на глаз выпячивания аневризматического мешка в области грудины или сзади паравертебрально (характерные для поздних стадий аневризм и обусловленные узурацией грудины и ребер) могут позволить врачу заподозрить данную патологию. В типичных случаях больные с синдромом Марфана обычно отличаются высоким ростом, худощавостью, необычно длинными руками, арахнодактилией, воронкообразной грудной клеткой, кифосколиозом, нарушениями зрения (вследствие эктопии хрусталика), повышенной слабостью связочного аппарата суставов (рис. 7.15). При аневризмах дуги аорты отмечаются обычно усиленная пульсация аорты в яремной вырезке, а также положительный симптом Коломнина— Оливера—Кардарелли—при подтягивании перстневидного хряща кверху четко ощущаются его синхронные с пульсом движения вниз, что обусловлено интимным прилеганием дуги аорты к левому главному бронху. При аневризмах грудной и брюшной части аорты иногда определяется пульсация расширенной аорты в эпигастрии, причем образование плотно спаяно с реберной дугой. Ряд больных с атеро-склеротическими аневризмами грудной части аорты вследствие системности патологии могут иметь признаки поражения периферических артерий, доступных для обычного ангиологического обследования (асимметричность пульса, артериальная гипертензия, систолический шум в проекции сонных, подключичных и бедренных артерий). При сдавлении аневризмами восходящей части аорты и ее дуги верхней полой вены для больного характерны одутловатость шеи и лица, их синюшность, компенсаторно расширенная сеть подкожных вен плечевого пояса, гиперемия склер.
Систолический шум, который выслушивается над аневри-зматически расширенными участками аорты, обычно достаточно мягок и, по утверждению F. Robicsek (1984), не патог-номоничен для данного заболевания. А. В. Покровский (1979), однако, придает данному симптому большое значение и считает его одним из наиболее ценных симптомов, встречающихся в 75% случаев. Если во втором межреберье справа (в проекции восходящей части аорты) выслушивается выраженный систолический шум, следует думать в первую очередь о стенозе аортального клапана. В подобных случаях, однако, встречается наиболее типичная ошибка, когда больному ставится диагноз аортального стеноза и не диагностируется аневризма восходящей части аорты. Диастоли-ческий шум, выслушиваемый во втором межреберье справа и в точке Боткина, наряду со снижением диастолического давления свидетельствует об аортальной недостаточности вследствие дилатации аортального кольца при диффузном
7.15. Внешний вид больного с синдромом Марфана и аневризмой грудной части аорты.
расширении восходящей части аорты. Продолжительный систоло-диастолический шум в проекции аортального клапана обычно характерен для прорыва аневризм синуса Валь-сальвы в одну из полостей сердца. Перкуторно можно выявить расширение сосудистого пучка вправо при аневризмах восходящей части аорты и влево при аневризмах нисходящей части аорты.
Одним из самых доступных и информативных инструментальных методов исследования является рентгенологический. Достаточно сказать, что около 50% аневризм грудной части аорты были выявлены при рентгенологическом исследовании, произведенном по совершенно другим поводам или профилактически [Robicsek F., 1984]. В переднезадней проекции на первый план выступают изменения контуров средостения: четко выраженные контуры однородной полуокруглой тени, примыкающей к обычной тени средостения справа и слева, иногда с обеих сторон. Выявление патологической тени справа чаще всего свидетельствует об аневризме восходящей части аорты (рис. 7.16). Расширение восходящей части аорты выявляется и во второй косой проекции, причем при этом можно определить уровень распространения аневризмы на дугу (рис. 7.17). При наличии выраженной аортальной недостаточности видна усиленная пульсация расширенной восходящей части аорты. Увеличение тени средостения слева свидетельствует об аневризме нисходящей части аорты. Если эта тень расположена выше третьего
629
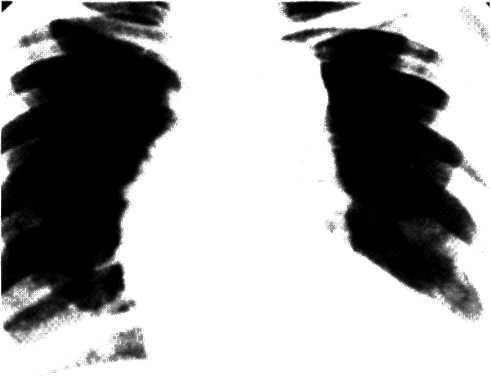
7.76. Рентгенограмма грудной клетки у больного с аневризмой восходящей части аорты (переднезадняя проекция). Расширение тени средостения вправо за счет выбухания восходящей части аорты.
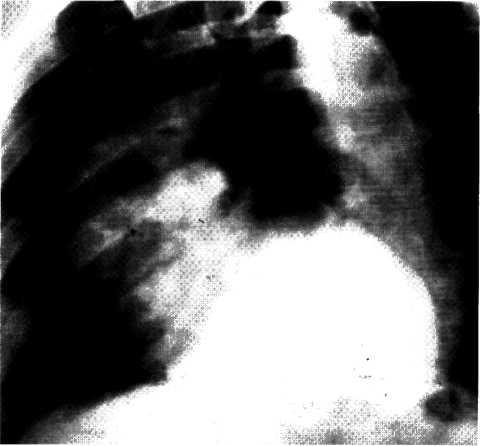
7.17. Рентгенограмма грудной клетки у больного с аневризмой восходящей части аорты (вторая косая проекция). Восходящая часть аорты резко расширена до уровня отхож-дения плечеголовного ствола.
ребра, то это свидетельствует о заинтересованности ди-стального отдела дуги. Двустороннее расширение тени средостения свидетельствует о диффузном поражении всех трех сегментов грудной части аорты. Во второй косой проекции тень расширенной нисходящей части аорты обычно хорошо видна и заходит на тень позвоночника. В этой же проекции выявляются и размеры дуги аорты. Следует сказать, что веретенообразные аневризмы небольших или средних размеров обычно описываются рентгенологами как расширение
тени аорты. Веретенообразные аневризмы больших размеров, а также мешковидные аневризмы обычно описываются как дополнительная тень, примыкающая к контуру аорты или наслаивающаяся на него. Рентгенодиагностика аневризм аорты строится на неотделимости дополнительного образования от аорты при многоосевом исследовании больного и зависит от локализации, размеров и формы аневризмы. Легче распознаются веретенообразные аневризмы, чем мешковидные, а также аневризмы восходящей и нисходящей части аорты, чем аневризмы дуги. Ценным диагностическим признаком может служить выявление участков кальциноза стенки аорты в виде линейных теней по контуру патологического образования. Это позволяет отдифференцировать данную патологию аорты от злокачественных новообразований средостения и легких. Следует, однако, помнить, что тератомы также могут подвергаться обызвествлению. Дополнительными признаками аневризмы аорты могут быть смещение трахеи и бронхов, их сужение с ателектазом легкого или его гиповентиляцией. Важные сведения рентгенологи могут получить при одновременном контрастировании пищевода: изменения положения пищевода всегда наблюдаются при аневризмах дуги и нисходящей части аорты. В тени смещенного пищевода отмечается вдавление с сужением просвета (рис. 7.18). Локализация этого «дефекта наполнения» пищевода позволяет установить локализацию и протяженность аневризмы.
Опухоль, расположенная вблизи от аорты, может создавать видимость экстенсивной пульсации при рентгеноскопии и этот симптом может стать фальш-позитивным. При затруднительном дифференциальном диагнозе между аневризмой аорты и опухолью грудной полости заключение рентгенолога может быть двояким: а) выявленное образование не есть опухоль или б) выявленное образование несомненно является аневризмой аорты. В тех случаях, когда диагноз затруднен, ни в коем случае не следует идти по пути назначения таким больным пункционной биопсии, медиастиноско-пии или бронхоскопии, так как эти процедуры могут стать фатальными при аневризме дуги аорты. Единственно правильным будет проведение в подобных случаях ангиографии. Достаточно редким рентгенологическим признаком может быть узурация грудины при аневризмах восходящей части аорты и ее дуги, а также узурация тел грудных позвонков при аневризмах нисходящей части аорты. Этот признак обычно фиксируется во второй косой проекции. В тех случаях, когда аневризмы грудной части аорты являются следствием коарктации или врожденной деформации дуги аорты, рентгенологическая картина характерна для указанных врожденных пороков развития аорты с учетом особенностей, характерных для аневризм данной локализации. При рентгенокимографическом исследовании можно отличить активную сосудистую пульсацию стенки аорты от пассивной (передаточной) пульсации опухолей средостения. Зубцы ки-мограммы в подобных случаях в области экстенсивной пульсации аорты имеют вид «копья». Однако следует помнить, что при тромбозе мешка на рентгенокимограмме может отмечаться значительное снижение амплитуды зубцов по контуру аневризмы.
В план рентгенологического обследования больных с аневризмами грудной и брюшной части аорты необходимо обязательно включить рентгеноскопию и рентгенографию желудка, пищевода и двенадцатиперстной кишки. Эти мето-
630
ды позволяют выявить смещение пищевода и кардии желудка вправо и кпереди. Нередко видны сдавление двенадцатиперстной кишки в силу ее фиксированное™, а также картина дуоденостаза, что может быть ошибочно расценено как опухоль головки поджелудочной железы.
В настоящее время большое значение в распознавании аневризм восходящей части аорты имеет эхокардиография. Метод позволяет определить диаметр аорты, наличие расслоения, диаметр аортального кольца, а при аортальной недостаточности выявить несмыкание створок в диастоле, дрожание передней створки митрального клапана.
Компьютерная томография с внутривенным введением контрастного вещества позволяет достаточно наглядно выявить расширение просвета аорты, наличие в ней тромботи-ческих масс, расслоения, парааортальную гематому, очаги кальциноза.
Диагностика аневризм грудной части аорты достаточно сложна. Об этом свидетельствует хотя бы тот факт, что 2/3 больных, поступивших в ИССХ им. Бакулева АМН СССР, уже перенесли ошибочную торакотомию по поводу опухолей средостения и легкого. Это происходит не только из-за трудностей диагностики, но и отсутствия целенаправленной схемы обследования больных с заболеваниями аорты.
Аортография. Методом выбора является трансфемораль-ная аортография по Сельдингеру. При поражении терминальной части аорты, когда катетер провести невозможно или опасно, целесообразно использовать трансаксиллярный доступ. В первой серии исследования изучают состояние корня аорты, восходящей ее части и дуги с брахиоцефаль-ными ветвями. Лучше производить аортографию в двух проекциях с тугим заполнением аорты контрастным веществом. Обычно аневризма восходящей части аорты, сочетающаяся с аортальной недостаточностью, начинается непо-стредственно от фиброзного кольца аортального клапана (рис. 7.19).
В боковой проекции, как правило, проксимальнее плечего-ловного ствола виден переход аневризмы в аорту нормального диаметра (рис. 7.20). Заполнение контрастным веществом полости левого желудочка свидетельствует о наличии аортальной недостаточности.
Аневризмы дуги аорты лучше видны во второй косой проекции. При этом важным является изучение состояния устьев ветвей дуги аорты.
Для аневризмы нисходящей части грудной аорты наиболее характерной локализацией является сегмент аорты дистальнее левой подключичной артерии, расположенной на расстоянии 2—3 см от ее устья (рис. 7.21). Чаще в этом сегменте выявляются мешковидные аневризмы, однако, встречаются и веретенообразные, занимающие весь грудной отдел нисходящей части аорты. Нередко аневризмы данной локализации захватывают и дистальный отдел дуги аорты—между устьем левой сонной и подключичной артерий. Этот факт чрезвычайно важен, так как определяет хирургическую тактику. Если проксимальная граница аневризмы начинается со среднего сегмента грудной части аорты, следует думать о наличии аневризмы грудной и брюшной части аорты. Поэтому в подобных случаях показано проведение брюшной аортографии в двух проекциях.
Естественное течение н прогноз. По сводной статистике Т. Shilberg и соавт. (1971), через 3 года после установления диагноза аневризмы грудной аорты умирают 37,5% боль-
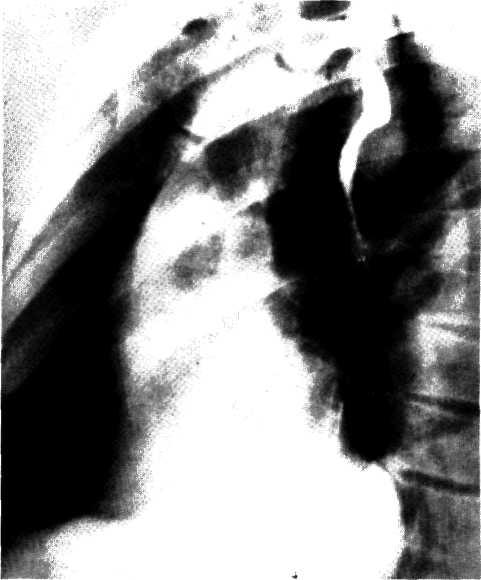
7.18. Рентгенограмма грудной клетки больного с аневризмой грудной части аорты (вторая косая проекция). Расширение тени нисходящей части аорты и отклонение контрастированного пищевода вперед.

7.19. Аортограмма больного с аневризмой восходящей части аорты и аортальной недостаточностью (переднезадняя проекция). Аневризма берет начало непосредственно от фиброзного кольца аортального клапана. Определяется одновременное контрастирование левого желудочка.
631

7.20. Аортограмма больного с аневризмой восходящей части аорты и аортальной недостаточностью (боковая проекция). Аневризма переходит в нормальную аорту проксимальнее плече головного ствола. Определяется аортальная регхргита-ци.ч с контрастированием полости левого желудочка.
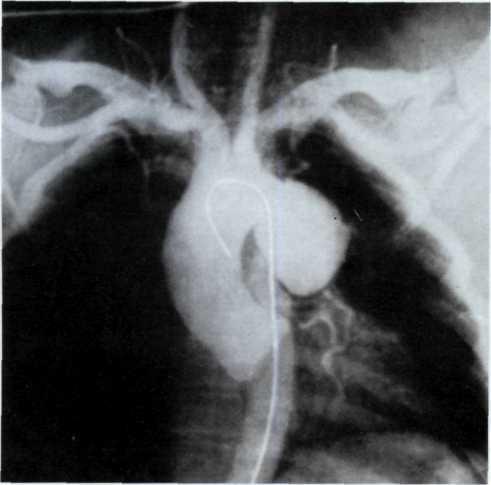
7.21. Аортограмма больного с травматической аневризмой грудной части аорты в области перешейка.
ных. К 5-му году остаются живыми 46% больных. Причины смерти различны, но 35—40% больных умирают от разрыва аневризмы, около 1/3 больных—от сердечной недостаточности. 14—20%—от легочных осложнений и пневмонии. Это относится в основном к аневризмам нисходящей части аорты. Аневризмы же восходящей части аорты, особенно у больных с синдромом Марфана. приводят к разрыву, расслоению или сердечной недостаточности в течение 1—3 лет при современном лекарственном лечении. В прежние годы средняя продолжительность жизни при аневризмах грудной части аорты составляла лишь 6,3—8,9 мес и 98% больных умирали от осложнений аневризмы в течение двух лет [Kampmeier R.. 1938]
Хирургическое лечение. Показания к операции. После установления диагноза аневризмы грудной части аорты ввиду неблагоприятного прогноза жизни больного необходима плановая операция. Динамическому наблюдению подлежат лишь больные с изолированными истинными небольшими по размерам веретенообразными аневризмами, развившимися на почве атеросклероза и аортита, не сопровождающиеся симптомами мозговой недостаточности, хронической ишемии органов пищеварения и почек, а также кальцинированные по всему периметру аневризмы. Такие аневризмы обычно протекают асимптомно и выявляются случайно при профилактических осмотрах. Все мешковидные аневризмы, даже небольших размеров, подлежат хирургическому лечению. Операции подлежат также все больные с аневризмами, протекающими с болевым синдромом, или с симптомами компрессии соседних органов и нарушениями системной и регионарной гемодинамики. Особенному вниманию и обязательному оперативному лечению подлежат больные с аневризмами врожденной и инфекционной этиологии, а также с послеоперационными аневризмами. Срочному оперативному вмешательству подлежат больные с аневризмами, осложнившимися эмболизацией периферических артерий, кровохарканьем, меленой, а также при увеличении тени аневризмы, по данным рентгенографии, и при усилении болевого синдрома. При кровотечении показана экстренная операция по жизненным показаниям.
Методы зашиты внутренних органов во время операции. Условия, в которых проводятся операции, обычно зависят от локализации аневризмы и вида операции. Паллиативные операции наружного окутывания аневризмы, а также резекция небольших мешковидных аневризм аорты с четко выраженной шейкой аневризмы проводятся без каких-либо мер защиты жизненно важных органов. Не требуют проведения И К различные варианты шунтирующих операций с последующим «выключением» аневризмы из кровотока.
Особое внимание необходимо уделять условиям операций у больных с аневризмами нисходящей части аорты. Основной задачей хирурга при этом является предупреждение: 1) кровотечения при выделении аневризматического мешка; 2) перегрузки левого желудочка при пережатии аорты; 3) ишемии спинного мозга и почек; 4) развития «синдрома снятия зажима с аорты». Е. Crawford и соавт. (1973) считают, что основной причиной спинномозговых нарушений после операций по поводу аневризм нисходящей части аорты являются нестабильная гемодинамика и ишемия спинного мозга во время пережатия аорты. Т. Schilberg и соавт. (1971), напротив, считают, что часто развитие параплегии зависит от величины резецированного сегмента аорты, количества пе-
ревязанных межреберных артерий и особенностей кровоснабжения спинного мозга и плохого развития коллатералей. Для зашиты спинного мозга и почек при протезировании нисходящей части аорты применяются различные методы. М. DeBakey и соавт. (1965) оперируют в условиях ИК. используя шунт «левое предсердие—бедренная артерия». W. Кеоп и соавт. (1968) применяют внутренний шунт из силиконовой трубки, на которую «надевается протез». По окончании наложения анастомозов внутренний аортальный шунт извлекают из аорты через поперечный разрез в протезе. В последние годы находят применение гепаринсодер-жащие наружные шунты, тромборезистентные и не требующие применения насосов. Проксимальную канюлю при этом можно ввести либо в левый желудочек, либо в восходящую часть аорты, либо в левую подключичную артерию. Дистальную канюлю шунта обычно вводят в нисходящую часть аорты или подвздошную артерию. Гепарин в таких случаях не вводят, чтобы избежать дополнительной крово-потери. I. May и соавт. (1977) вводят поливинилграфитовую трубку через правую бедренную вену в правое предсердие, откуда с помощью насоса, а также через аналогичную трубку кровь нагнетают в бедренную артерию. Одновременно осуществляют вентиляцию 100% кислородом. В ИССХ им. А. Н. Бакулева АМН СССР чаще использовали метод общей умеренной гипотермии и лишь при предполагаемом коротком сроке пережатия аорты операции осуществляли при нормотермии. Е. Crawford и соавт. (1980). имеющие самый большой опыт операций на нисходящей части аорты и высокую хирургическую технику, проводят операции без каких-либо методов защиты спинного мозга при нормотермии. Полное ИК обычно применяется в тех случаях, когда необходимо пережатие аорты проксимальнее левой подключичной артерии. Этот метод позволяет проводить адекватный контроль за кровообращением в органах и легко манипулировать на дуге аорты. Недостатком данного метода является необходимость системной гепаринизации, что увеличивает опасность большой кровопотери. Во время операции полые вены канюлируют через правое предсердие. Артериальную канюлю вводят в бедренную артерию. Обязательна защита миокарда методом фармакохолодовой кардиоплегии, а также декомпрессия левого желудочка. Уровень гипотермии тела при ИК различен. При операциях полного замещения дуги аорты показана гипотермия 13— 15 С в пищеводе, в результате чего возможна полная остановка кровообращения на 45 мин. При операциях на восходящей части аорты, аортальном клапане и венечных артериях в ИССХ им. Бакулева АМН СССР применяют гипотер-мическое ИК, снижая температуру тела больного до 20— 22: С. Защита миокарда осуществляется путем наружного охлаждения сердца «ледяным» изотоническим раствором хлорида натрия и периодического введения в обе венечные артерии кардиоплегического раствора.
При изолированных аневризмах восходящей части аорты в настоящее время применяют два типа операций. Первый тип операции заключается в резекции аневризмы восходящей части с протезированием. При выполнении второго типа операции применяют специальные протезы на ригидных кольцах и не сшивают протез с аортой. Протез в этих случаях фиксируют с помощью наружных тесемок. Период пережатия аорты в этих случаях значительно короче (рис. 7.22). Обычный метод протезирования восходящей час-
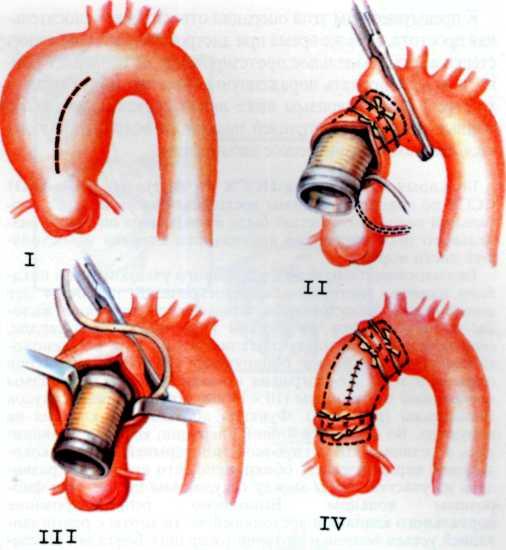
7.22. Схематическое изображение этапов (I—IV) резекции аневризмы восходящей части аорты с эндопротезированием эксплантатом на ригидных кольцах.
I—продольная аортотомия; II—введение в расширенную аорту эндопротеза на кольцах: III—фиксация дисталыюго кольца тесьмой; IV—фиксация проксимального кольца тесьмой и ушивание стенки аорты вокруг протеза.
ти аорты проводится в настоящее время с применением внутримешкового наложения анастомоза без пересечения задней стенки аорты. Протез обязательно изолируется с помощью стенок аневризматического мешка (рис. 7.23).
Операции, применяемые для коррекции аневризм восходящей части аорты с сопутствующей аортальной недостаточностью, подразделяются на две группы в зависимости от способа хирургической «обработки» устьев венечных артерий и синусов Вальсальвы. К первой группе относится метод раздельного протезирования аортального клапана и восходящей части аорты (рис. 7.24). Устья венечных артерий при этой операции остаются интактными. Такую операцию можно выполнять при атеросклеротических аневризмах восходящей части аорты, особенно при нормальном взаиморасположении венечных артерий и фиброзного кольца аортального клапана и при незначительном расширении синусов Вальсальвы. В оставшемся участке аорты при атеросклерозе не образуются послеоперационные ложные аневризмы и па-равальвулярные фистулы.
Техника операции. После пережатия аорты и остановки сердца аневризму вскрывают продольно. Створки аортального клапана иссекают и с помощью П-образных швов на прокладках имплантируют аортальный протез. Аорту циркулярно рассекают на 5—10 мм выше устьев венечных артерий и накладывают проксимальный анастомоз между сосудистым протезом и аортой. Затем выполняют дистальный анастомоз. Следует обращать внимание на то, чтобы в шов захватывались все слои стенки аорты.
633
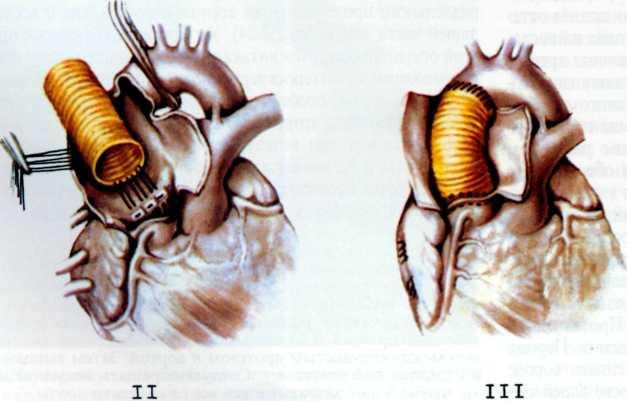
Больному Н., 29 лет, в ИССХ им А. Н. Бакулева АМН СССР по поводу аневризмы восходящей части аорты с аортальной недостаточностью была произведена операция раздельного протезирования аортального клапана и восходящей части аорты.
Гистологическое изучение удаленного участка аорты показало наличие кистозного медионекроза. В течение 4 лет самочувствие было хорошим, однако затем появились жалобы на одышку при физической нагрузке, боли в сердце, сердцебиение. Больной госпитализирован. При рентгенологическом исследовании обнаружено увеличение размеров сердечной тени. Аортография выявила рецидив аневризмы восходящей части аорты (10 х 14 см) с вовлечением синусов Вальсальвы (рис. 7.25). Функция аортального клапана не нарушена. Во время повторной операции, которая проводилась в условиях ИК с глубокой гипотермией и фармакохо-лодовой кардиоплегией, обнаружено, что аневризма развилась из участка аорты между сосудистым протезом и фиброзным кольцом. Выполнено репротезирование аортального клапана и восходящей части аорты с реимплан-тацией устьев венечных артерий (операция Бентала). Послеоперационный период протекал с явлениями умеренной сердечной недостаточности. Больной выздоровел.
Операции второй группы основаны на применении кла-пансодержащего «кондуита» (рис. 7.26). «Кондуит» можно изготовить непосредственно перед операцией путем подшивания аортального механического или биологического клапана к сосудистому протезу либо использовать «кондуит»
7.23. Схематическое изображение этапов (I—IV) резекции изолированной супракоронарной аневризмы восходящей части аорты с протезированием.
I—внешний вид сердца: II—начальный этап наложения проксимального анастомоза с помощью трех П-образных швов на заднюю стенку; III—закончено наложение обоих анастомозов без пересечения задней стенки; IV—ушивание аневризматического мешка над протезом.
фабричного изготовления. Непосредственно перед имплантацией для уменьшения порозности сосудистого протеза его следует замачивать в аутоплазме или крови, затем осуществляют автоклавирование.
Если после вскрытия аневризматического мешка обнаруживается, что устья венечных артерий располагаются на расстоянии 2 см и более от уровня фиброзного кольца аортального клапана, целесообразно выполнить операцию Бентала (рис. 7.27). После иссечения створок аортального клапана П-образными швами на прокладках имплантируют «кондуит». Затем в сосудистом протезе с помощью электроножа создают два отверстия в проекции устьев венечных артерий. Не выделяя устья из стенки аорты, поочередно, начиная с левой венечной артерии, создают анастомозы с отверстиями в сосудистом протезе. Накладывают ди-стальный анастомоз. Избытки стенки аневризматического мешка иссекают и «кондуит» окутывают оставшимися тканями. При выполнении этой операции следует очень тщательно и правильно реимплантировать венечные артерии в «кондуит» во избежание кровотечения и образования псевдоаневризм.
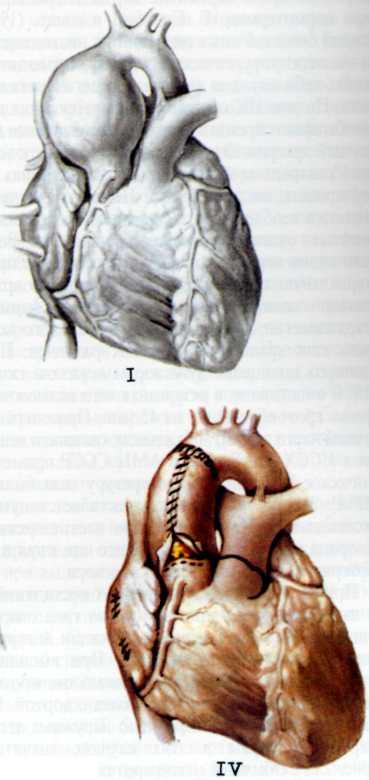
При низком отхождении венечных артерий, когда прямые анастомозы технически трудно выполнимы, можно сделать
634
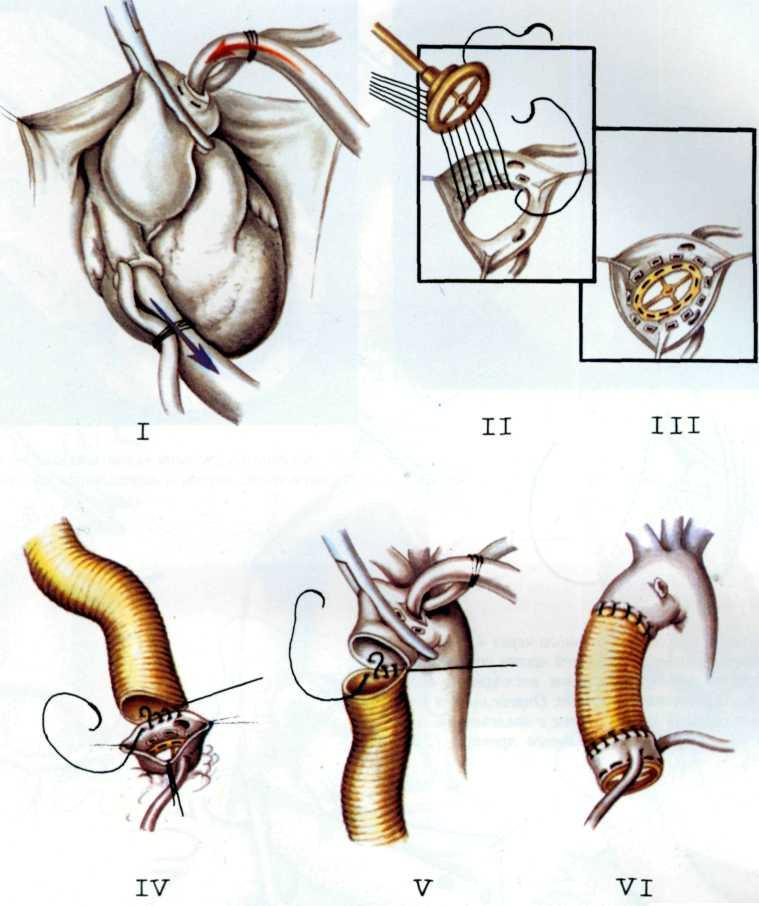
операцию Каброля, которая состоит из нескольких этапов (рис. 7.28): 1) наложение анастомоза между устьем левойвенечной артерии с малым сосудистым протезом длиной 10 см и диаметром 8 мм; 2) подшивание «кондуита» к фиброзному кольцу; 3) наложения дистального анастомоза «кондуита» с аортой; 4) наложение анастомоза между устьем правой венечной артерии с сосудистым протезом; 5) наложение анастомоза бок в бок между сосудистым протезов и «кондуитом»; 6) создание анастомоза между ушкомправого предсердия и полостью аневризмы и окутывание «кондуита» остатками аневризматического мешка.
Помимо описанных технических приемов реимплантации венечных артерий, можно выкраивать их устья на площадке
из аорты и имплантировать в протез или выполнять аутове-нозное аортокоронарное шунтирование в тех случаях, когда имеется проксимальное поражение венечных артерий. При аортокоронарном шунтировании анастомозы аутовены можно накладывать как «с кондуитом», так и со стенкой аорты в дистальных ее отделах (рис. 7.29).
С целью предупреждения кровотечения создается анастомоз между ушком правого предсердия и полостью, образовавшейся после окутывания «кондуита» остатками стенки аневризматического мешка. По такому анастомозу происходит сброс крови в правые отделы сердца. Как правило, анастомоз закрывается на 2—3-й день после операции. Описанный технический прием широко применяется в ИССХ им. А. Н. Бакулева АМН СССР, он снижает опасность развития кровотечений и медиастинита.
При аневризмах дуги аорты используют несколько типов операций. Наиболее простым методом, не требующим применения ИК, является метод, предложенный М. DeBakey (1957).
635
 7.25.
Аортограмма и ее схема у больного через
4 года после раздельного протезирования
восходящей части аорты и аортального
клапана по поводу аневризмы восходящей
части аорты
с аортальной недостаточностью.
Определяется рецидив
аневризмы восходящей части аорты с
вовлечением синусов
Вальсальвы (1). Функция аортального
протеза (2) не нарушена.
7.25.
Аортограмма и ее схема у больного через
4 года после раздельного протезирования
восходящей части аорты и аортального
клапана по поводу аневризмы восходящей
части аорты
с аортальной недостаточностью.
Определяется рецидив
аневризмы восходящей части аорты с
вовлечением синусов
Вальсальвы (1). Функция аортального
протеза (2) не нарушена.
7.27. Схематическое изобра жение этапов (I—IV) опера ции по методу Бентала при аневризмах восходящей части аорты с аортальной недоста точностью. Объяснение в тексте.
636
7.28. Схематическое
изображение этапов (I—VI/
операции по
методу Каороля при аневризмах восходящей
части аорты с
аортальной недостаточностью. Объяснение
в тексте.
7.29.
Схематическое изображение протезирования
восходящей
части аорты с шунтированием венечных
артерий с помощью
аутовенозных трансплантатов (представлены
три варианта
наложения проксимальных анастомозов).
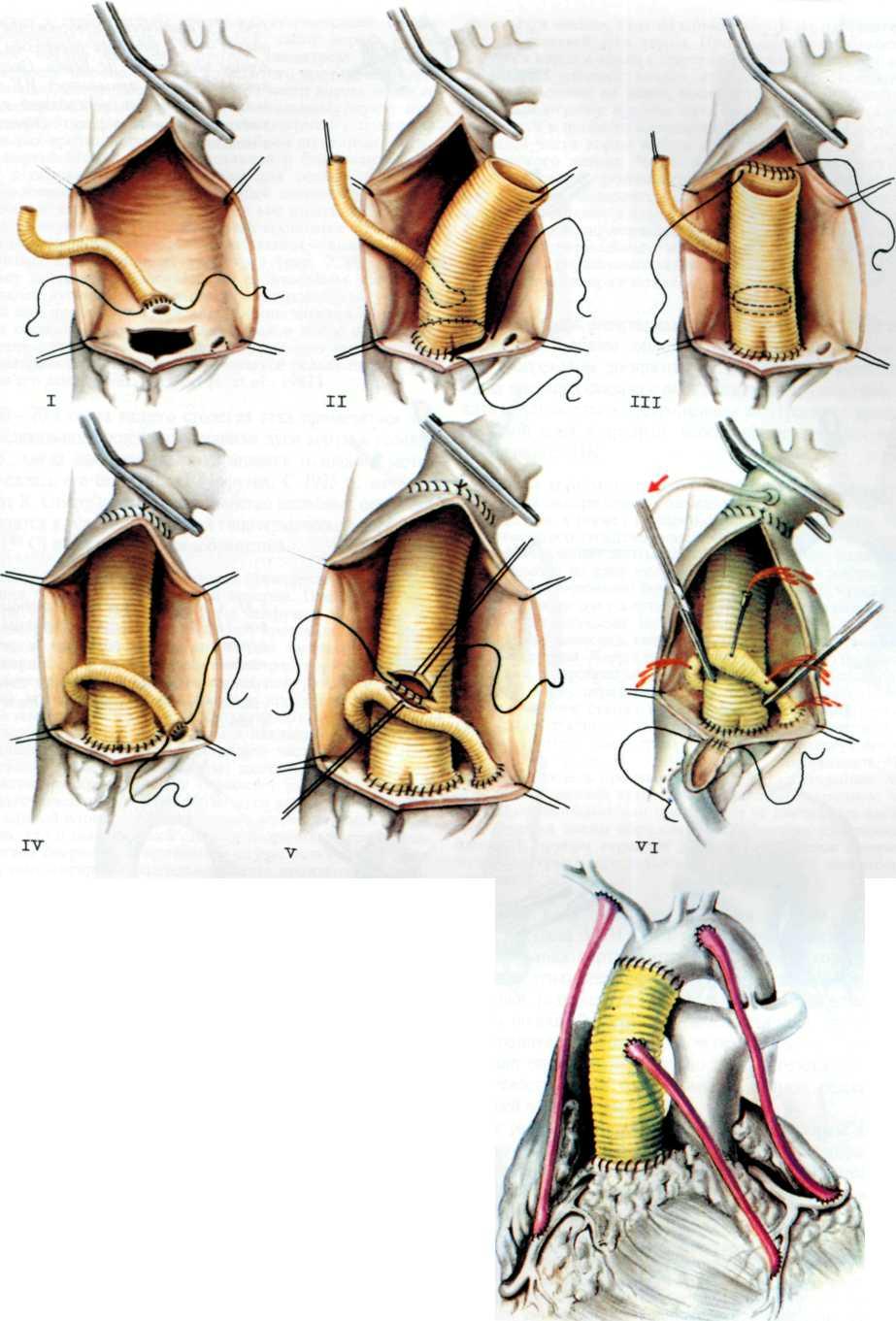

7.31. Схематическое изображение этапов (I—III) резекции аневризмы дуги аорты с протезированием и реплантацией всех ветвей дуги аорты на единой площадке в условиях глубокой гипотермической перфузии. Объяснение в тексте.
638
Доступ к сердцу путем срединной стернотомии. Путем пристеночного отжатия восходящей части аорты в созданное «окно» вшивается протез диаметром не менее 16 мм, после чего дистальный конец этого протеза вшивается в «окно», созданное в нисходящей части аорты после ее пристеночного отжатия. По аортоаортальному шунту пускается кровоток. От данного протеза поэтапно с помощью отдельных протезов диаметром 10—8 мм шунтируют ветви дуги аорты. Может быть использован и бифуркационный шунт с основной браншей 14 мм для реваскуляризации плечеголовного ствола и левой общей сонной артерии, от которого отдельным протезом 7—8 мм шунтируют левую подключичную артерию. После пуска кровотока по шунтам операция заканчивается последним этапом — выключением аневризмы дуги аорты из кровотока (рис. 7.30). Второй вариант операции заключается в радикальном иссечении аневризмы дуги аорты с прямым протезированием дуги и ее ветвей под прикрытием описанных выше шунтов, которые, таким образом, являются временными и после окончания операции удаляются. В настоящее время этот метод резекции аневризмы дуги аорты применяется редко, но ряд хирургов его использует [Urschel H. et al., 1982].
В 60—70-х годах нашего столетия стал применяться метод радикального иссечения аневризм дуги аорты в условиях ИК, когда для профилактики ишемии головного мозга проводилась его селективная перфузия. С 1975 г., начиная с работ R. Griepp и соавт., большинство подобных операций проводится в условиях глубокой гипотермической перфузии (13—15° С) и остановки кровообращения.
После стернотомии используется стандартный метод ка-нюляции полых вен и бедренной артерии. После снижения температуры тела больного путем перфузии до 13—15° С восходящую часть аорты пережимают проксимальнее плечеголовного ствола, в корень аорты для защиты миокарда вводят холодный кардиоплегический раствор (рис. 7.31). Восходящую часть аорты пересекают циркулярно и накладывают проксимальный анастомоз с протезом, предварительно замоченным в крови. Останавливают ИК, продольно вскрывают аневризму дуги аорты и накладывают дистальный анастомоз протеза с нисходящей частью аорты (без пересечения задней стенки аорты) дистальнее устья левой подключичной артерии. Если позволяет взаиморасположение анатомических структур, ветви дуги аорты имплантируют на единой площадке в созданное «окно» в верхней стенке протеза, что в значительной степени укорачивает сроки данного этапа операции. В противном случае устья ветвей дуги аорты имплантируют раздельно. Далее производятся тщательное удаление воздуха из протеза, восстановление кровотока, согревание больного и восстановление сердечной деятельности. Для облегчения наложения дистального анастомоза некоторые хирурги применяют два раздельных протеза, которые затем сшивают. После окончания протезирования дуги аорты и ее ветвей протез укутывают стенками аневризматического мешка.
Если аневризма восходящей части аорты и ее дуги сочетается с аневризмой грудной части аорты, возможен вариант операции, предложенный Н. Borst (1983),—так называемый метод протезирования аорты подобно «хоботу слона».
Первым этапом в условиях гипотермической перфузии и кардиоплегии одним протезом замещают восходящую часть аорты (рис. 7.32). Затем пережимают начальный отдел нисходящей части аорты, останавливают ИК и аневризму дуги аорты рассекают вдоль. Для замещения дуги аорты применяется сосудистый протез, дистальный отрезок которого инвагинирован в проксимальный. Дистальный конец инвагинированного протеза анастомозируется с нисходящей частью аорты без пересечения задней стенки. После окончания анастомоза инвагинированный конец протеза выворачивается и проводится, как «хобот слона», свободно в грудную часть аорты. В верхней полуокружности протеза дуги вы-
краивается «окно», куда на единой площадке имплантируют все устья ветвей дуги аорты. Протез дуги аорты анастомозируется конец в конец с протезом восходящей части аорты. Тщательно удаляют воздух из протеза, восстанавливают кровообращение по аорте после согревания больного. Дистальный отрезок протеза дуги аорты при этом свободно находится в просвете нисходящей части аорты. Протез восходящей части аорты и дуги укутывают стенками аневризматического мешка. Через несколько недель после этого этапа операции производится левосторонняя заднебоковая торакотомия, выделяется и пережимается нисходящая часть аорты дистальнее аневризмы. Просвет аорты рассекается вдоль и свободно лежащий в ее просвете протез анастомозируется с нормальным просветом аорты по типу конец в конец без пересечения задней стенки аорты. Протез также укутывается аневризматическим мешком.
Наконец, при аневризмах дистального отдела дуги аорты между левой общей сонной и левой подключичной артериями с переходом аневризмы на нисходящую часть аорты, когда операция связана с определенными трудностями пережатия дуги аорты и прекращением антеградного кровотока по левой сонной артерии, можно применить двухэтапную операцию без ИК.
Первым этапом путем срединной стернотомии и верхней срединной лапаротомии обнажаются восходящая часть аорты и ее дуга, а также инфраренальный сегмент аорты. Путем пристеночного отжатия восходящей части аорты производят шунтирование аорты протезом диаметром более 16 мм. Затем протез по типу конец в бок вшивают в инфраренальный сегмент брюшной аорты (рис. 7.33). После пуска кровотока по шунту дугу аорты пережимают зажимами или прошивают отдельными матрацными швами на тефлоновых прокладках непосредственно дистальнее устья левой общей сонной артерии. Левую подключичную артерию перевязывают. Если в процесс вовлечено устье левой общей сонной артерии, аорту пережимают или прошивают между устьем плечеголовного ствола и левой общей сонной артерии, но перед этим левую общую сонную артерию шунтируют с помощью протеза диаметром 8 мм, анастомозируя его с основным протезом. На этом операцию заканчивают. Через несколько недель производят второй этап операции. Методом левосторонней торакотомии обнажают грудную часть аорты, пережимают или прошивают ее дистальнее аневризмы, которая таким образом «выключается» из кровообращения. В другом варианте дистальный отрезок аневризмы можно вскрыть продольно и прошить все межреберные артерии.
С 1986 г. в отделении хирургии сосудов ИССХ им. Л. Н. Бакулева АМН СССР применяют аналогичный метод шунтирования аорты от восходящей к нисходящей части при повторных операциях на аорте в случае синдрома реко-арктации, развившегося после протезирования аорты. Однако для подобной операции применяется иной доступ—правосторонняя торакотомия в четвертом межреберье. Этот принцип операции значительно легче и безопаснее повторной левосторонней торакотомии и прямой резекции нисходящей части аорты.
Для резекции аневризмы грудной части аорты доступом выбора является левосторонняя заднебоковая торакотомия в четвертом—пятом межреберье (рис. 7.34). Целесообразна при этом раздельная интубация бронхов. Левое легкое на момент выделения колабируют и не травмируют.
Выделения аневризматического мешка не производят. Выделяют левую подключичную артерию, затем дугу аорты между левой общей сонной и левой подключичной артериями. Выделяют дистальные участки нисходящей части аорты. Для уменьшения кровопотери при вскрытии мешка пе-
639
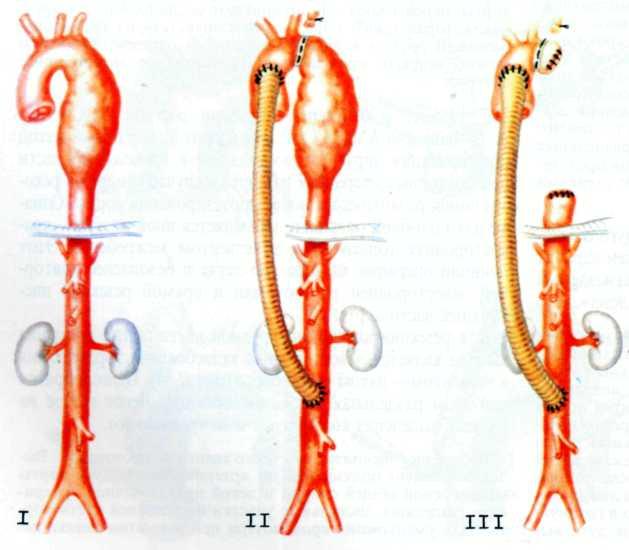
7.33. Схематическое изображение этапов (I—III) выключения аневризмы дистального отдела дуги и грудной части аорты с помощью шунта от восходящей части аорты к брюшной части с прошиванием дуги аорты дистальнее левой общей сонной артерии и последующей резекцией грудной части аорты. Объяснение в тексте.
640
ревязывают заранее четыре верхние левые межреберные артерии. Медленно, согласованно с анестезиологической бригадой пережимают дугу аорты проксимальнее левой подключичной артерии или, если позволяют анатомические условия и границы аневризмы, нисходящую часть аорты дистальнее левой подключичной артерии. Пережимают аорту дистальнее аневризмы. Аневризму вскрывают продольно электроножом, быстро удаляют тромботические массы, в случае необходимости ушивают функционирующие правые межреберные артерии. Стенку аневризмы в проксимальном и дистальном отделах рассекают в поперечном направлении. Накладывают проксимальный анастомоз проленовой нитью 3/0, после чего проверяют его герметичность. Если пережималась левая подключичная артерия, зажим перекладывают на протез и восстанавливают антеградныи кровоток по ней. Аналогичным способом без пересечения задней стенки аорты накладывают дистальный анастомоз. Его герметичность проверяют путем снятия дистального зажима на аорте. Протез заполняют кровью, вытесняют воздух, после чего медленно поэтапно снимают проксимальный зажим. При условии хорошей экспозиции и отсутствии осложнений подобная операция длится 30—45 мин и может быть проведена без каких-либо мер по защите спинного мозга и почек от ишемии. Однако такую тактику могут себе позволить лишь опытные хирурги в специализированных сосудистых центрах.
В последние годы применяется метод эндопротезирования аорты специальными протезами на ригидных кольцах-каркасах, как при операции на аневризмах восходящей части аорты. Длительность пережатия аорты при этом составляет 15—20 мин.
При резекции аневризм грудной и брюшной части аорты в отличие от ранее применявшегося метода раздельного протезирования ветвей брюшной части аорты в настоящее время используют метод имплантации висцеральных ветвей на единой площадке (рис. 7.35). Большинство хирургов при выполнении операции на брюшной части аорты используют методы шунтирования или гипотермию. Для контроля за гемодинамикой во время операции необходимы монитор-ный контроль артериального и центрального венозного давления, а также определение давления в легочной артерии, давления «заклинивания» и МОС с помощью катетера Свана— Ганза. Во время пережатия аорты нормальную сердечную гемодинамику поддерживают путем введения натрия нитропруссида. Проксимальный зажим на аорту накладывают постепенно, чтобы избежать резких колебаний артериального давления и давления «заклинивания» в малом круге
7.34.
Схематическое изображение этапов
(I—IV)
резекции травматической
аневризмы грудной части аорты с
протезированием.
Объяснение в тексте.
кровообращения. По мере введения натрия нитропруссида вводят дополнительные объемы крови и жидкости. Когда протезирование аорты закончено, перед снятием зажима с аорты прекращают введение вазодилататоров. По мере постепенного снятия зажима с аорты увеличивается скорость введения крови и электролитов.
Операцию проводят в положении больного на боку под углом в 60 к поверхности стола (рис. 7.36). Разрез торакоаб-доминальный, но его направление и уровень зависят от локализации и протяженности аневризмы. Если аневризма занимает всю нисходящую часть аорты вплоть до подвздошных артерий, разрез начинают, как широкую срединную лапаротомию с последующим пересечением реберной дуги и с переходом разреза в шестое — седьмое межреберье. Если поражены дистальный отдел грудной и проксимальный сегмент брюшной части аорты, возможен разрез в восьмом межреберье с переходом его выше пупка на правую переднюю поверхность передней брюшной стенки (см. рис. 7.36). Если аневризма захватывает в основном брюшную часть аорты, делают разрез в девятом межреберье, а косой абдоминальный разрез — на 3 см ниже пупка. Диафрагму рассекают непосредственно по направлению к аортальному кольцу. Левое легкое колабируют с помощью
7.35. Схематическое изображение этапов (I—III) операции при аневризме грудобрюшного отдела аорты по методу Де Бейки.
I—путем пристеночного отжшпи.ч аорты производится грудобрюшное шунтирование аорты синтетическим протезом по типу конец протеза в бок аорты; II—///—поэтапная реваскуляризация всех ветвей брюшной части аорты путем их резекции и протезирования. Спинномозговые ветви не рева-скуляризуются.
раздельной интубации бронхов. Брюшную часть аорты мобилизуют после предварительной мобилизации толстой кишки, селезенки, желудка, поджелудочной железы и левой почки, которые отводят вправо. Для выделения правой общей подвздошной артерии в ряде случаев применяют отдельный трансперитонсальный доступ. После медленного пережатия аорты выше и ниже аневризмы ее стенку вскрывают продольно на всем протяжении электроножом, что предотвращает кровотечение из стенок. Тремя — четырьмя швами держалками стенки аневризмы отводят в стороны (рис. 7.37). Ретроградный кровоток из ветвей брюшной части аорты останавливают с помощью баллонных катетеров Фогерти № 4. Функционирующие межреберные и верхние поясничные артерии окклюзируют баллонными катетерами Фогерти № 3. Протез вшивают в аорту методом внутримеш-кового протезирования (без пересечения задней стенки аорты) проленовой нитью 2/0—3/0. После проверки герметичности анастомоза частичным снятием зажима аорту вновь пережимают, протез натягивают и против основных межреберных артерий по задней поверхности в нем создают «окно», куда единым блоком вшивают всю площадку задней стенки аорты с устьями межреберных артерий. Протез вновь натягивают и против висцеральных ветвей и почечных артерий в нем создают «окно» в передней стенке, куда вшивают все указанные ветви, если их устья расположены концентрированно. Если устья расположены далеко друг от друга, их также на площадках отдельно имплантируют в протез. Из ветвей брюшной части аорты удаляют катетеры Фогерти. Опускают головной конец операционного стола, протез пережимают дистальнес почечных артерий и восстанавливают кровоток во все ветви брюшной части аорты. Еще раз подчеркиваем, что снятие зажима с аорты следует производить медленно, в соответствии с показателями центральной гемодинамики. В дальнейшем, если это необходимо, в протез имплантируют верхнюю пару поясничных артерий на площадке и нижнюю брыжеечную артерию. Затем накладывают дистальный анастомоз с аортой или с общими
642

I—левосторонняя торакофренолапаротомия в шестом межреберье при локализации аневризмы преимущественно в грудной и брюшной частях аорты; II—косой торакоаб-домипальный доступ при супраренальных аневризмах брюшной части аорты; III—положение больного на операционном столе — на боку под углом 60 ; IV—общий вид операционной раны при аневризме грудной и брюшной частей аорты; легкое ко.шбировано, диафрагма рассечена вплоть до аортального кольца, все внутренние органы отведены медиально. 1 — доступ в шестом межреберье; 2 — доступ в восьмом межреберье; 3—внутренние органы; 4 — аневризма; 5—диафрагма; 6 — легкое.
подвздошными артериями. Этот вопрос должен быть решен заранее для выбора моно- или бифуркационного протеза. После пуска кровотока столу придают горизонтальное положение. Стенки аневризмы ушивают над протезом, предотвращая кровотечение и изолируя протез от близлежащих органов.
В ряде случаев при умеренном диффузном расширении дистального отдела восходящей части аорты, дуги и нисходящей части аорты без симптомов компрессии соседних анатомических образований и ишемии головного мозга для
предотвращения дальнейшего увеличения аневризм аорты и ее разрывов не исключается вариант паллиативной операции «окутывания грудной аорты протезом» [Robicsek F., 1984]. Показанием для подобных паллиативных операций служит также отсутствие тромбов в аневризме и изъязвлений стенки аорты по данным ангиографии. Эти операции не требуют применения ИК и гипотермии. Однако, с нашей точки зрения, кажущаяся простота подобных операций в действительности требует высокого хирургического мастерства при выделении аневризмы по всему ее периметру.
Результаты операций. По данным И. Н. Гришина и соавт. (1981), летальность после операций по поводу аневризм грудной части аорты составляет 7—30% и зависит от локализации аневризмы.
Согласно данным А. А. Спиридонова и соавт. (1989). госпитальная летальность после операций, произведенных по поводу аневризм дистального отдела дуги аорты и нисходящей грудной аорты, за 25 лет (1963—1988) составила 14,3%. С 1983 г. летальность не превышает 5,4%. После операций по поводу хронических посттравматических аневризм нисходящей грудной аорты летальность составила 4%. Для профилактики повреждений спинного мозга авторы применяли общую поверхностную умеренную гипотермию (29—31 С). Параплегия наблюдалась у 125 оперированных
643
(1,6%). С 1989 г. в дополнение к гипотермии для профилактики ишемии спинного мозга и почек А. А. Спиридонов (1992) применил внутриаортальную инфузию препарата ПГЕ, у 20 больных с расслаивающими аневризмами нисходящей грудобрюшной аорты. Случаев развития послеоперационной параплегии не отмечено. По данным автора, через 5 лет после операции по поводу расслаивающих аневризм нисходящей грудобрюшной аорты были живы 92% больных, а через 10 лет—73%. В группе больных с хроническими посттравматическими аневризмами грудной аорты через 10 лет после операции были живы 95,5%.
7.3. АНЕВРИЗМЫ БРЮШНОЙ ЧАСТИ АОРТЫ
Под аневризмой брюшной части аорты понимают локальное или диффузное расширение ее диаметра более 3 см.
Первые случаи патологоанатомических наблюдений и клинических описаний аневризм брюшной части аорты относятся к XVI в. В 1817 г. A. Cooper первым произвел перевязку брюшной части аорты по поводу аневризмы. Первую успешную резекцию аневризмы брюшной части аорты
с протезированием гомотрансплантатом сделали С. Dubost и соавт. в 1952 г. Общепринятую в настоящее время резекцию аневризмы с внутримешковым протезированием выполнили Н. Javid и соавт. в 1962 г. В нашей стране первую операцию сделал Б. В. Петровский (1959).
Частота. На основании анализа 12 различных серий вскрытий (145000 случаев) Gore и соавт. (1973) выявили аневризмы брюшной части аорты в 1,2% случаев. Соотношение числа мужчин и женщин составило при этом 5:1. С увеличением возраста частота заболевания резко возрастала—для мужчин, умерших в возрасте до 50 лет, частота аневризм брюшной части аорты составила 6%, свыше 60 лет—10%, свыше 70 лет—12%. Среди аневризм аорты аневризмы брюшной части аорты составляют большинство—80%.
Этиология. Болезнь в основном носит приобретенный характер и обусловлена атеросклерозом, неспецифическим аортоартериитом, специфическими артериитом (туберкулез, сифилис, ревматизм, сальмонеллез). В последние годы увеличилось число травматических аневризм, в том числе ят-рогенных — после реконструктивных операций на брюшной части аорты, ангиографии и баллонной дилатации. Среди врожденных причин образования аневризм брюшной части аорты выделяют фиброзно-мышечную дисплазию.
Приводим одно из таких наблюдений.
Девочка 1 года 4 мес в 3-месячном возрасте перенесла краснуху, с 5 мес стала беспокойной, перестала лежать
644
на животе. При осмотре выявлено опухолевидное образование в области живота. Обследована в онкологическом отделении, поставлен диагноз — неорганная забрюшинная опухоль.
Больная поступила в ИССХ им. А. Н. Бакулева АМН СССР. При осмотре живот обычной формы, на 2 см ниже реберной дуги пальпируется образование тугоэластической консистенции, пульсирующее, умеренно болезненное, с неровными контурами, размером 6x8 см. Над образованием выслушивается систолический шум.
На эхограмме на 3 см дистальнее левой почечной артерии видно расширение аорты, доходящее до бифуркации. При компьютерной томографии (рис. 7.38) отчетливо фиксируется большая аневризма брюшной части аорты с кальцинозом стенок и ротацией левой почки. На ангиограмме видна аневризма инфраренального отдела брюшной части аорты размером 6,5 х 5,5 см. Слева дистальнее левой почечной артерии и над
бифуркацией брюшной части аорты видны две ложные дочерние аневризмы. Стеноз правой почечной артерии.
Диагноз: фибромускулярная дисплазия брюшной части аорты, аневризма брюшной части аорты инфраренальной локализации, стеноз правой почечной артерии.
На операции после срединной лапаротомии выявлено, что диаметр аорты выше образования равен 8 мм. Пережаты аорта и обе общие подвздошные артерии, аневризма вскрыта продольно. В верхнем отделе аневризмы виден разрыв ее стенки диаметром 2,5 см с образованием ложной аневризмы. В нижнем отделе имеется аналогичный разрыв диаметром 1,5 см. Произведена резекция аневризмы с протезированием брюшной части аорты протезом фирмы «Гор — Текс» диаметром 8 мм. Анастомозы накладывались без пересечения задней стенки аорты. Послеоперационный период протекал гладко. Швы сняты на 12-й день, заживление первич-
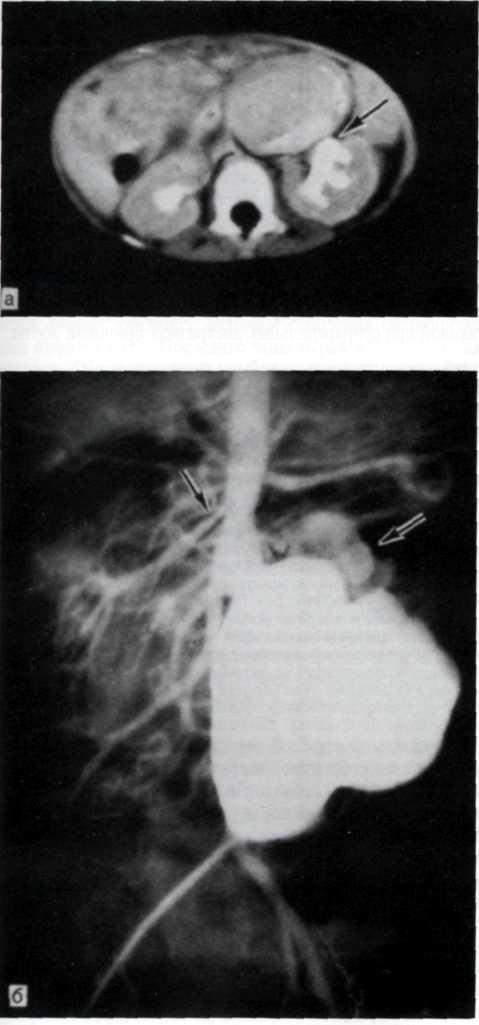
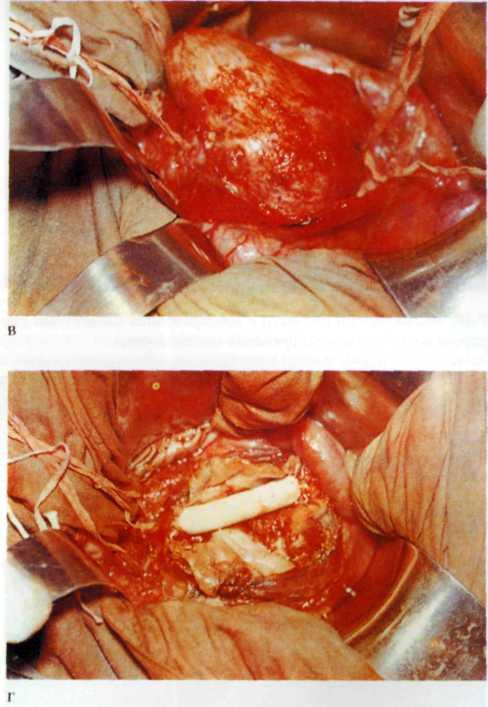
7.38. Результаты диагностических исследований и этапы операции у больной с аневризмой брюшной части аорты, а — на компьютерной томограмме брюшной части аорты представлен поперечный срез через аиевризматический мешок. Видны кальцииоз стенок апевризматического мешка, ротация и пиелоэктазия левой почки (указано стрелками); б—аортограмма брюшной части аорты с истинной аневризмой инфраренального сегмента брюшной части аорты, надрывом ее стенки и образованием ложной дочерней аневризмы (указано стрелкой); стеноз правой почечной артерии (указан стрелкой); в — интраоперациоиный снимок — выделены аневризма брюшной части аорты, супрарепальный сегмент брюшной части аорты и общие подвздошные артерии; г — интра-операционный снимок — произведена резекция аневризмы брюшной части аорты с прямым протезированием протезом.
645
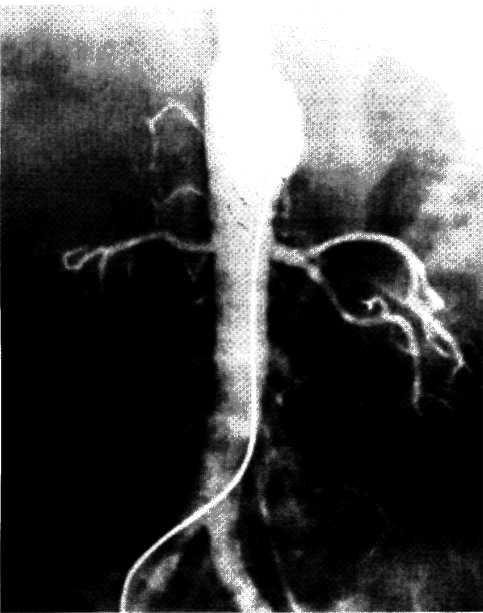
7.J9. Ангиограмма больного с изолированной аневризмой суп-раренального сегмента брюшной части аорты.
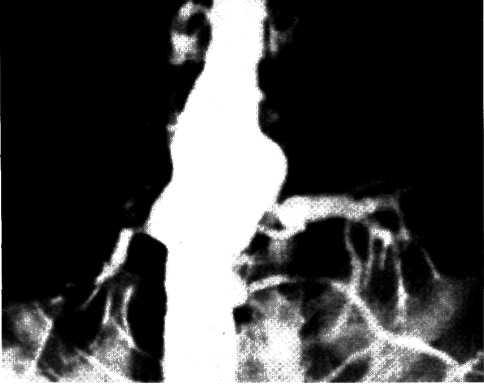
7.40. Ангиограмма больного с супраренальной аневризмой брюшной части аорты со стенозированием обеих почечных артерий без вовлечения в процесс подвздошных артерий.
ным натяжением. Выписана в удовлетворительном состоянии. Девочка осмотрена через год: жалоб нет, развивается нормально.
Хирургическая классификация аневризм брюшной части аорты представлена с учетом основных критериев, определяющих оперативную тактику проксимального уровня аневризмы и ее распространения на бифуркацию брюшной части аорты. В связи с этим различают: 1) супрареналь-ные аневризмы изолированные (рис. 7.39), диффузные без вовлечения в процесс бифуркации брюшной части аорты (рис. 7.40) и диффузные с вовлечением в процесс бифуркации брюшной аорты, а также 2) инфраренальные аневризмы без вовлечения в процесс бифуркации и с вовлечением бифуркации брюшной части аорты (рис. 7.41).
Супраренальные аневризмы достаточно редки, они могут возникать в результате аортита, атеросклероза, ангиографии, баллонной дилатации и операции. Инфраренальные аневризмы, как правило, носят атеросклеротический характер и встречаются в 95—96% случаев всех аневризм брюшной части аорты.
Среди инфраренальных аневризм брюшной аорты следует выделить так называемые субренальные, или юкстареналь-ные, аневризмы, проксимальный уровень которых начинается ниже устьев почечных артерий, в связи с чем во время операции необходимо изменить доступ (вместо лапарото-мии выполняют либо левостороннюю торакофренолюмбо-томию, либо торакофренолапаротомию) и уровень пережатия аорты выше почечных артерий. Таким образом, хирургическая тактика при субренальных аневризмах аналогична таковой при супраренальных аневризмах брюшной аорты.
Патогенез. Развитие аневризм брюшной части аорты, по мнению большинства исследователей, обусловлено в первую очередь дегенеративными или воспалительными изменениями стенки аорты. Наиболее частое поражение инф-раренального сегмента аорты зависит от следующих факторов: 1) резкого уменьшения кровотока по брюшной части аорты дистальнее почечных артерий, поскольку около 23% от минутного объема крови поступает к внутренним органам, а 22% — к почкам; 2) нарушение кровотока по vasa vasorum, вызывающего дегенеративные и некротические изменения в стенке аорты с замещением ее рубцовой тканью; 3) постоянной травматизации области бифуркации брюшной части аорты о близлежащие костные образования (про-монториум); 4) бифуркация брюшной части аорты — практически первое непосредственное препятствие на пути кровотока, где впервые возникает «отраженная волна», что повышает гемодинамическую нагрузку на стенку аорты, и наряду с повышенным периферическим сопротивлением в артериях нижних конечностей приводит к увеличенному боковому давлению в инфраренальной части аорты.
Клинически хорошо известны факты дистального смещения бифуркации брюшной части аорты, возникающей в связи с этим девиации подвздошных артерий и развития аневризмы брюшной части аорты в форме лягушки (рис. 7.42). Все эти факторы тфиводят к дегенерации и фрагментации эластического каркаса стенки аорты и атрофии ее средней оболочки. Основную роль каркаса аорты начинает выполнять наружная оболочка, которая не может адекватно предотвратить постепенное расширение просвета аорты. Отмечено также, что стенка аневризмы содержит меньше коллагена и эластина, нежели нормальная стенка аорты. Выявляется значительная фрагментация эластина. D. Summer (1970) выявил, что передняя стенка аневризмы в норме содержит
646
больше коллагеновых и эластических волокон, чем и обусловлена ее большая прочность. Задняя и боковые стенки аорты содержат меньше эластических структур и поэтому менее прочны. Разрывы аневризм брюшной части аорты в связи с этим происходят в основном в забрюшинное пространство. Напряжение стенки сосуда зависит, по закону Лапласа, от радиуса сосуда, поэтому возможность разрыва аневризмы большого диаметра увеличивается.
Патологическая анатомия. Форма аневризмы (мешотчатая или веретенообразная) зависит от степени и распространенности изменений стенки аорты. Мешотчатые аневризмы возникают при локализованном изменении одной из стенок аорты. При этом образуется добавочная полость—мешок, стенки которого составляют измененные стенки аорты. Веретенообразная аневризма—это диффузное расширение брюшной части аорты по всему периметру в связи с более обширным циркулярным поражением всех слоев стенки аорты. Макроскопически внутренняя поверхность аневризмы представлена атероматозными бляшками, нередко изъязвленными и кальцинированными. Внутри полости аневризмы пристеночно располагаются уплотненные массы фибрина, тромботические и атероматозные массы. Они составляют «тромботическую чашку». Последняя обычно легко отделяется от внутренней поверхности аорты, так как происходит некротическое расплавление как тромботических масс, так и самой стенки аневризмы.
Микроскопически внутренняя оболочка выглядит в виде утолщенного слоя за счет атероматозных масс и атероск-леротических бляшек. Средний слой истончен, в нем отмечаются фиброз, гиалиноз, очаговые скопления гистиоцитар-ных инфильтратов. Последние чаще выражены по ходу vasa vasorum. Обе эластические мембраны резко изменены, фраг-ментированы. Изменения среднего слоя могут быть настолько выражены, что местами полностью исчезает средняя оболочка. Наружная оболочка также изменена и истончена. Аневризматический мешок может быть тесно спаян с соседними органами, развивается асептическое воспаление.
Патологическая физиология кровообращения. При аневризме брюшной части аорты отмечаются резкое замедление линейной скорости кровотока в мешке, его турбулентность. Это хорошо видно на рентгенокинематограмме, а также подтверждается данными электромагнитной флоуметрии, кривая которой приближается к кривой, характерной для полной окклюзии аорты. Площадь положительной волны становится равной площади отрицательной волны. В ди-стальное русло артерий нижних конечностей поступает лишь 45% объема крови, находящейся в аневризме. Такой застой крови подтверждается и данными среднего времени циркуляции, что обнаруживается при радионуклидной ангиографии. Механизм замедления кровотока в аневризматическом мешке обусловлен тем, что основной поток крови, проходя по аневризматической полости, устремляется вдоль стенок. Центральный поток при этом замедляется вследствие возврата крови, что обусловлено турбулентностью кровотока, наличием тромботических масс в аневризме и близким расположением бифуркации аорты.
Клиника неосложнеиных форм аневризм брюшной части аорты. В 24% случаев [Berstein E. et al., 1978] аневризмы брюшной части аорты протекают бессимптомно и выявляются случайно при пальпации живота на профилактических осмотрах, при рентгенографии органов брюшной полости
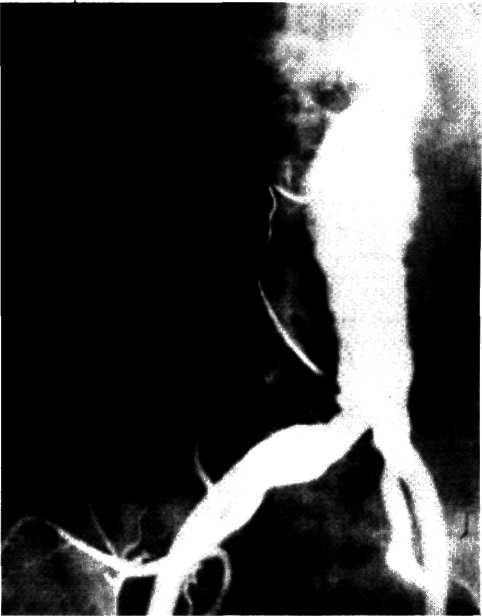
7.41, Ангиограмма больного с частично тромбированной аневризмой инфраренального сегмента брюшной части аорты и аневризматическим расширением правой общей подвздошной артерии.
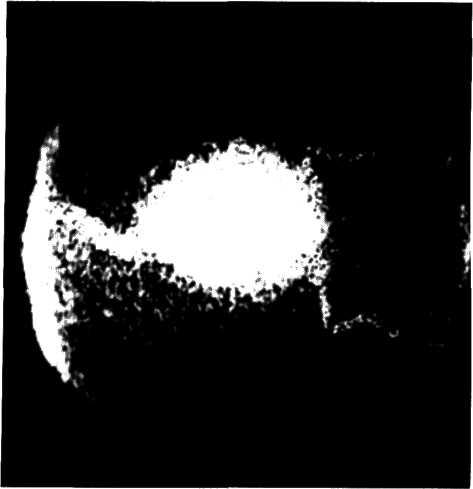
7.42. Радионуклидная ангиограмма больного с аневризмой брюшной части аорты «типа лягушки» инфраренальной локализации.
647
(при условии кальцификации стенок аневризмы) либо при лапаротомии, производимой по другому поводу. Нередко аневризмы выявляются посмертно как случайная находка, не являясь причиной смерти. В последние годы аневризмы брюшной части аорты часто выявляются при ангиографии брюшной части аорты и ее ветвей. В связи с внедрением в клиническую практику (3-сканирования, компьютерной томографии бессимптомные формы аневризм стали выявляться чаще.
Выделяют характерные (типичные) и косвенные клинические признаки болезни. Типичные симптомы, выявляющиеся в среднем у 76% больных,—пульсирующее образование и боли в области живота. Боли носят тупой, ноющий характер, локализуются обычно в мезогастрии или слева от пупка. Они могут иррадиировать в спину, поясницу, крестец. Характер болей разнообразен—от интенсивных мучительных, острых, требующих применения наркотиков и анал-гетиков, до постоянных и слабо выраженных. Очень часто эти жалобы в первую очередь побуждают врача ошибочно диагностировать более распространенные и известные ему болезни органов брюшной полости.
Косвенные клинические признаки аневризмы брюшной части аорты складываются из ряда синдромов.
Абдоминальный синдром (анорексия, отрыжка, рвота, запоры) развивается в результате вовлечения в стенотиче- ский процесс висцеральных ветвей брюшной части аорты, а также механической компрессии двенадцатиперстной кишки и желудка с ложной картиной опухоли головки под желудочной железы.
Урологический синдром обычно обусловлен смещением почки, сдавлением лоханки, мочеточника, нарушенным пас сажем мочи и проявляется тупыми болями в поясничной области, ощущением тяжести в ней, дизурическими рас стройствами, гематурией, приступами, напоминающими по чечную колику. Компрессия тестикулярных артерий и вен нередко вызывает болевой симптомокомплекс в яичках, а также развитие варикоцеле. Это нередко приводит к оши бочному диагнозу орхоэпидидимита.
Ишиорадикулярный синдром связан с компрессией по звоночника, нервных корешков поясничного отдела спинно го мозга и проявляется болями в пояснице с характерной иррадиацией, чувствительными и двигательными расстрой ствами в нижних конечностях.
Синдром хронической ишемии нижних конечностей обус ловлен стагнацией крови в аневризматическом мешке или вовлечением в окклюзионный процесс артерий нижних ко нечностей. Проявляется типичной картиной перемежающей ся хромоты и нарушениями трофики нижних конечностей.
Диагностика. Пульсирующее образование в животе пальпируется обычно в мезо- или эпигастрии по срединной линии или слева от нее. Если не удается определить верхнюю границу мешка, можно думать о супраренальной локализации аневризмы. Если между реберной дугой и аневризмати-ческим мешком удается расположить ребро ладони, следует предполагать инфраренальную локализацию аневризмы. Пульсация обычно носит экстенсивный характер. Образование имеет эластическую консистенцию, овальную форму, чаще бывает неподвижным, в редких случаях легко смещается вправо и влево от срединной линии; у женщин его можно принять за кисту брыжейки или гениталий. Пальпация образования достаточно неприятна для больного и даже бо-
лезненна. Редко у худых больных и у детей можно выявить дочерние аневризматические выпячивания. После обнаружения пульсирующего образования в животе следует произвести его поэтапную аускультацию (эпигастрии, мезогастрии, гипогастрий, подвздошные и бедренные артерии), а затем стандартный ангиологический осмотр всех магистральных артерий.
Систолический шум над аневризмой брюшной части аорты выслушивается в 50—60% случаев [Шалимов А. А. и др., 1979]. Он может быть обусловлен турбулентным потоком крови, стенозированием ветвей брюшной части аорты, отклонением аорты резко кпереди, сразу же дистальнее почечных артерий. У худых больных не следует прижимать фонендоскоп плотно к передней брюшной стенке, так как компрессия самого мешка или ветвей брюшной части аорты может вызвать артефактный шум. Необходимо обязательно обратить внимание на наличие «язвенного анамнеза» у больного, так как, по данным P. Kester и соавт. (1981), почти в 20% случаев аневризмы брюшной части аорты сочетаются с язвенной болезнью двенадцатиперстной кишки, что является отягощающим моментом в ближайшем послеоперационном периоде с возможной активизацией процесса и кишечным кровотечением.
Кроме осмотра, необходимо провести рентгенологическое обследование больного.
Рентгенография органов брюшной полости и забрю- шинного пространства в прямой и боковой проекциях осу ществляется для выявления калышноза или тени самого мешка обычно слева от позвоночника. Важным симптомом является «раздвинутость» кишечника в стороны от центра брюшной полости. Редким признаком аневризмы брюшной части аорты может быть узурация передней поверхности тел поясничных позвонков (II—V) в боковой проекции.
Томография органов забрюшинного пространства на фоне пневморетроперитонеума позволяет отдифференциро вать аневризму брюшной части аорты от опухолей забрю шинного пространства, информирует о размерах, положе нии и форме почек.
Внутривенная урография выявляет пиелоэктазию, ком прессию мочеточников, а также необычный ход мочеточ ников, что косвенно свидетельствует об аневризмах под вздошных артерий. Благодаря этому методу можно диаг ностировать подковообразную почку, опухоль или кисту почек.
В предварительный диагностический комплекс исследований включают радиоизотопные методы исследования.
Сцинтиграфия почек позволяет отдифференцировать подковообразную почку от аневризмы, выявляет функцио нальное состояние почек.
Радионуклидная ангиография с 99 гаТс помогает вы явить расположение аневризмы, ее размеры, наличие тром- ботических масс.
При компьютерной томографии видны структура аневризмы, ее наружный и внутренний контуры, тромботические массы, участки расслоения. Определяются продольные и поперечные размеры аневризмы, вовлечение в процесс ветвей брюшной части аорты. С целью изучения кровотока по аорте компьютерная томография сочетается с внутривенным введением контрастного вещества.
Непрерывное ультразвуковое ^-сканирование позволяет отдифференцировать девиацию аорты от ее расширения, от-
648
личить опухоль, тесно прилежащую к стенке аорты, выявить расслоение стенки аорты, ее разрыв, состояние подзвздош-ных артерий, точно установить размеры аневризматическо-го мешка, зафиксировать пристеночный тромбоз, а также толщину аортальной стенки, состояние парааортальной клетчатки, что важно для диагностики аневризм, возникших в результате аортоартериита. Точность определения размеров аневризмы составляет 3 мм.
Современный комплекс диагностических неинвазивных методов исследования позволяет не проводить ангиографию. Следует, однако, помнить, что только ангиографическое исследование дает полную и достоверную информацию, а значит, обеспечивает выбор оптимального хирургического доступа, объема операции, ее радикализм и минимальную травматичность. Методом выбора следует считать трансфе-моральную ангиографию по Селдингеру в двух проекциях. Однако необходимо помнить о неудачах и опасности данного метода при извитости и поражении подвздошных артерий и возможных осложнениях (перфорации стенки, тромбозы и тромбоэмболии и расслоения).
Если известно расположение проксимального уровня аневризмы, возможно проведение высокой транслюмбаль-ной ангиографии. При супраренальной локализации аневризмы показан метод ангиографии через подмышечную артерию.
Трактовка ангиограмм должна быть направлена на установление размеров аневризмы, ее точной локализации, определение состояния проксимального сегмента аорты и путей оттока, а также ветвей брюшной части аорты и степени их вовлечения в процесс.
Малыми следует считать аневризмы диаметром до 3— 5 см, средними—до 5—7 см. Все аневризмы, диаметр которых превышает 7 см, расценивают как аневризмы большого диаметра и крайне опасными в плане разрыва. По данным Е. Bernstein (1978), 76% подобных аневризм подвергаются разрыву. Существуют и «гигантские» размеры аневризм, превышающие нормальный диаметр инфраренального сегмента аорты в 8—10 раз.
Предоперационная оценка состояния каждого конкретного больного с аневризмой брюшной части аорты важна не только в связи с возрастом, но и наличием у большинства из них сопутствующих заболеваний. К. Scobie и соавт. (1977) установили, что 73% больных имеют по два сопутствующих заболевания—коронарная недостаточность, артериальная гипертензия, мозговая сосудистая недостаточность, ишемия органов пищеварения, хроническая ишемия верхних и нижних конечностей, болезни почек, желудочно-кишечного тракта, легких).
Особенно большое внимание должно быть уделено определению тяжести поражения коронарного русла у больных с аневризмами брюшной аорты. По данным Кливлендской клиники (США), из 263 больных с аневризмами брюшной аорты, которым была произведена коронарография, у 44% больных, у которых отмечались клинические признаки ИБС, диагностировано тяжелое, но операбельное поражение коронарных артерий. Кроме того, еще у 18% больных с асимп-томной формой ИБС было выявлено требующее реваскуля-ризации миокарда стенозирование коронарных артерий.
В связи с этим наличие аневризмы брюшной аорты можно считать своеобразным «маркером» мультифокального атеросклероза с соответственно необходимыми мероприятиями
по выявлению сопутствующей ИБС и степени кардиального риска. Для выявления сопутствующей ИБС у больных с аневризмами брюшной аорты в НЦССХ в последние 10 лет разработана следующая стандартная схема обследования, которая включает: опрос больного, стандартное физи-кальное обследование; электрокардиографию; ЭКГ-монито-рирование в течение 24 ч; велоэргометрическую пробу; эхо-кардиографию; ЭКГ с проведением медикаментозных проб (дипиридомоловая, каптоприловая, допаминовая); таллие-вую сцинтиграфию миокарда с дипиридомолом; селективную коронарографию, левую вентрикулографию.
Считаем целесообразным проведение коронарографии больным, у которых положительны две или три нагрузочные пробы и снижена, согласно результатам эхокардиогра-фии, фракция выброса левого желудочка сердца, что подтверждают результаты сцинтиграфии миокарда с дипиридомолом.
Показания к операции. Если установлен диагноз «аневризма брюшной части аорты», то это уже является показанием к операции, которую можно осуществлять в любом возрасте. Противопоказания к операции: острые расстройства коронарного, мозгового кровообращения с выраженным неврологическим дефицитом и недостаточность кровообращения ПБ—III стадии. Перенесенный 3 мес назад инфаркт миокарда при стабильных показателях ЭКГ, а также 6 нед назад инсульт при отсутствии выраженного неврологического дефицита не являются противопоказанием к операции. Необходимо детально оценить состояние дыхательной функции легких и исключить «скрытую почечную недостаточность». Обязательно выясняют состояние дистального русла артерий нижних конечностей, так как невозможность адекватной реваскуляризации хотя бы глубоких артерий бедра является противопоказанием к операции. При наличии выраженной коронарной недостаточности проводят коронарографию и определяют функцию миокарда для решения вопроса о первоочередном выполнении аортокоронар-ного шунтирования. В ряде случаев длительная интенсивная лекарственная терапия позволяет подготовить больных к операции (схема 7.1)
Сроки проведения второго этапа операции—резекции аневризмы брюшной аорты после аортокоронарного шунтирования до сих пор не уточнены. Обычно они составляют 2—3 мес при средних размерах аневризмы и невыраженном болевом синдроме. Однако отмечались случаи, когда при таком достаточно длительном перерыве между двумя операциями происходил разрыв аневризмы брюшной аорты. В связи с этим решающими факторами при определении сроков проведения второго этапа операции являются клиническая картина, размеры и течение аневризмы брюшной аорты. В некоторых случаях при выраженных клинических проявлениях ИБС и аневризмы брюшной аорты возможно проведение одномоментной реваскуляризации миокарда и резекции аневризмы брюшной аорты, техника которых описана ниже.
Аналогично решается и вторая частая проблема: сочетан-ное стенозирование внутренних сонных артерий у больных с аневризмой брюшной аорты. Для подобных случаев нами выработаны следующая тактика ее выявления и оценка степени риска развития инсульта во время операции резекции аневризмы брюшной аорты (схема 7.2).
За 24 ч до операции больным начинают терапию антибио-
649
тиками,
к которым чувствительны стафилококки
и кишечная палочка.
Всем больным необходимо интраоперационное
мо-ниторирование
артериального давления, центрального
венозного давления, газового состава
крови, а также некоторым
из них—введение катетера Свана—Ганза
с поэтапной фиксацией сердечного
выброса крови, определением давления
в легочной артерии и давления
«заклинивания».
Метод резекции аневризмы инфраренально-го отдела брюшной части аорты. Полная срединная лапаротомия. После рассечения заднего листка брюшины пересекают связку Трейтца, затем тонкую и двенадцатиперстную кишку отводят вправо и вверх. Может оказаться
СХЕМА 7.1. ЛЕЧЕБНО-ДИАГНОСТИЧЕСКИЕ
МЕРОПРИЯТИЯ У БОЛЬНЫХ С АНЕВРИЗМАМИ
БРЮШНОЙ АОРТЫ В СОЧЕТАНИИ С ИБС

СХЕМА 7.2. ЛЕЧЕБНО-ДИАГНОСТИЧЕСКИЕ
МЕРОПРИЯТИЯ У БОЛЬНЫХ С АНЕВРИЗМОЙ
БРЮШНОЙ АОРТЫ В СОЧЕТАНИИ С ПОРАЖЕНИЕМ
ВНУТРЕННИХ СОННЫХ АРТЕРИЙ (ВСА)
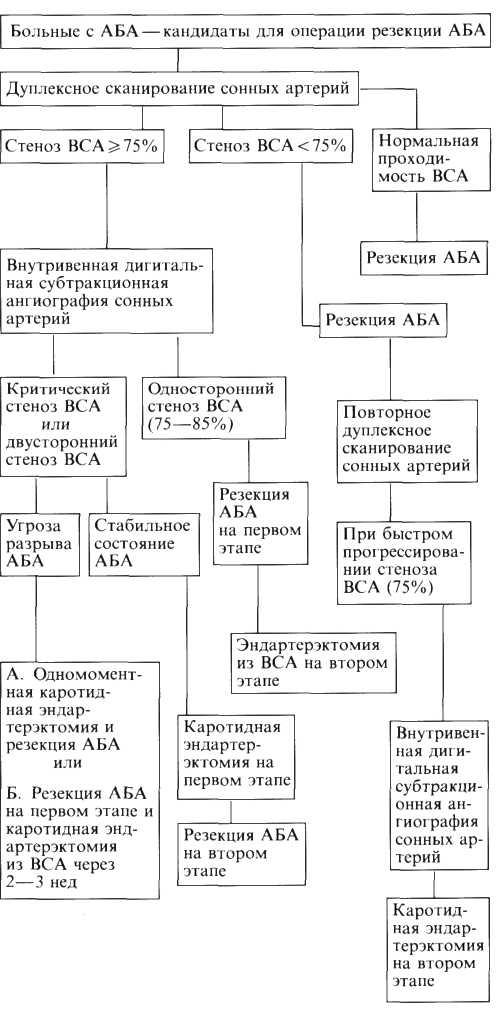
необходимой мобилизация левой почечной вены, распластанной на аневри'зматическом мешке. При тесном спаянии двенадцатиперстной кишки, почечной вены с аневризматиче-ским мешком их не выделяют. Необходимо выделить лишь переднюю и боковые стенки аорты выше аневризмы и общие подвздошные артерии. Ревизией бифуркации аорты определяют возможность прямого протезирования аорты. После внутривенного введения 5000 ЕД гепарина прямым мощным зажимом постепенно, медленно, под контролем артериального давления пережимают аорту выше аневриз-матического мешка и общие подвздошные артерии. Аневризму вскрывают продольно электроножом, из мешка удаля-
650
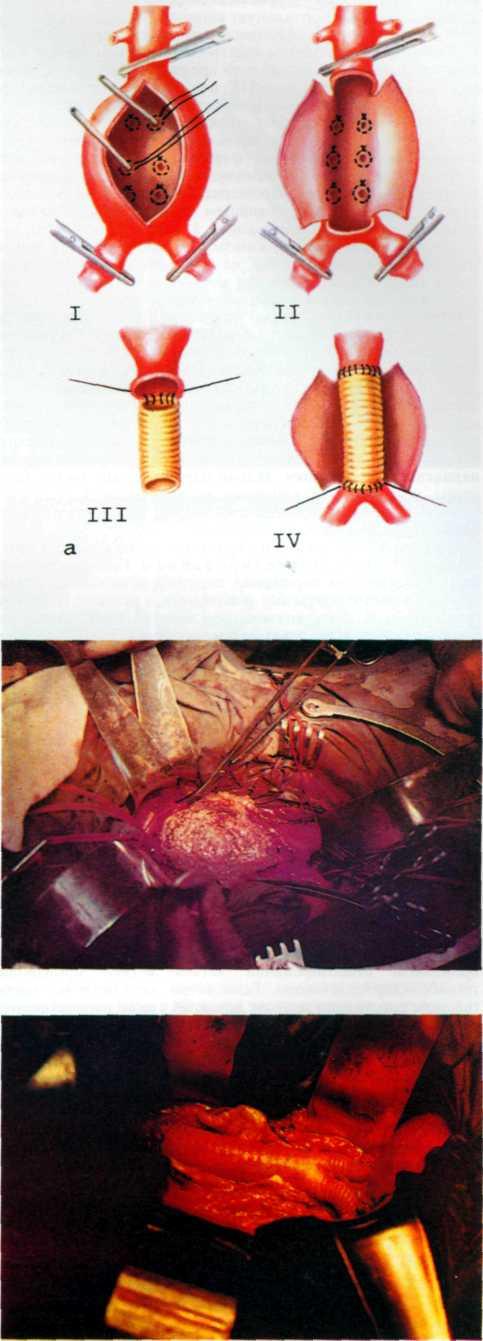
Метод одномоментной операции аортокоро-нарного шунтирования и резекции аневризмы брюшной аорты с протезированием. Преимущество комбинации этих операций заключается в следующем:
превосходный абдоминальный доступ, в связи с чем не нужно отведение стенок передней брюшной стенки;
потери крови во время операции абдоминальной анев- ризмэктомии минимальны, поскольку кровь может быть возвращена больному через АИК;
если гемодинамика нестабильная или во время резек ции АБА возникла сердечная декомпенсация, то возможно быстрое подключение АИК, который постоянно наготове;
в конечном итоге продолжительность комбинирован ной операции незначительно превышает длительность обыч ной операции резекции АБА.
Методика операции. Доступ к сердцу путем срединной стернотомии. Забор аутовен происходит в то время, пока идет подготовка к проведению ИК. Непосредственно перед канюляцией больному вводят гепарин из расчета 3 мг на 1 кг массы тела и в правое предсердие вводят единственную
7.43. Схематическое изображение этапов (1—IV) резекции аневризмы брюшной части аорты инфраренальной локализации.
Пережата аорта, продольно вскрыт аневризматический мешок, ушиты устья функционирующих поясничных артерий с дальнейшим протезированием брюшной части аорты внут-римешковым методом. I, II, б—интраоперационный снимок— вскрыт продольно аневризматический мешок. Видны тромботические массы внутри просвета мешка; III, IV, в — интраоперационный снимок — исходный этап операции резекции инфраренальной аневризмы брюшной части аорты с протезированием бифуркационным протезом, видны протез и стенки аневризматического мешка, которым «укрывают» протез.
657
канюлю для венозного дренажа. Возврат крови в организм происходит через аортальную канюлю, которая также служит для введения кардиоплегического раствора. Оксигенатор заполняют раствором электролитов. Кровь вводят в аппарат только в том случае, если предоперационный гематок-рит менее 35%. Во время ИК поддерживают температуру 28—30° С. Холодовая кардиоплегическая остановка и местная гипотермия защищают миокард, поэтому их используют во всех случаях. Все дистальные анастомозы аутовен с коронарными артериями формируют с помощью нити пролен 6/0 непрерывным обвивным швом с использованием хирургической оптики. Проксимальные анастомозы накладывают непрерывным обвивным швом с использованием нити пролен 5/0 по типу конец в бок стенки аорты при частичном ее отжатии зажимом. До тех пор, пока шунты полностью не подшиты, ИК не прекращают. После отключения АИК и восстановления нормального кровотока нейтрализацию гепарина и деканюляцию не производят.
Стернотомический разрез продолжают вниз вплоть до лона и вскрывают брюшную полость. Для протезирования аневризмы следует применять низкопористые протезы, которые не нужно предварительно замачивать. Техника операции стандартная. Когда протезирование закончено, все зажимы с аорты снимают и только после этого при стабильной гемодинамике нейтрализуют гепарин раствором протамина сульфата. Стенками аневризматического мешка укрывают протез и изолируют линию анастомозов от двенадцатиперстной кишки. Задний париетальный листок брюшины закрывают, и кишечник возвращается в брюшную полость. Только после этого производят деканюляцию, ушивание ран и дренирование полостей.
Метод резекции аневризмы супраренальной локализации с протезированием. При изолированном сегментарном поражении поддиафрагмального отдела брюшной части аорты без вовлечения в процесс ее нижнегрудного отдела и с вовлечением висцеральных ветвей используют доступ по девятому межреберью (левосторонняя торакофренолюмботомия). После рассечения диафрагмы в области аортального канала выделяют нижнегрудной, ин-фраренальный сегменты аорты, чревный ствол, верхнюю брыжеечную и левую почечную артерии. С целью уменьшения кровопотери перевязывают левые поясничные артерии в зоне аневризмы. После пережатия аорты выше чревного ствола и ниже почечных артерий аневризматическии мешок вскрывают продольно и широко. У верхней и нижней границ мешка стенки аневризмы пересекают поперечно, оставляя заднеправую поверхность аорты. В устье правой почечной артерии вводят катетер Фогарти для остановки ретроградного кровотечения. Висцеральные ветви и левую почечную артерию пережимают зажимами. Устья межреберных и поясничных артерий ушивают изнутри. Протезирование аорты производится внутримешковым способом протезом диаметром 20—22 мм. При близком расположении устья висцеральных ветвей их и правую почечную артерию имплантируют в «окно» в протезе на единой площадке. При одновременном стенозировании устьев ветвей производят тромбоэндартерэктомию. Если ветви находятся на значительном расстоянии друг от друга, их также имплантируют в протез, но отдельно на площадках по методу Карреля. После предварительной проверки анастомозов на герметичность постепенно производят пуск кровотока по протезу. Если супраренальная аневризма диффузно захватывает весь терминальный отдел аорты, хирургический доступ расширяют за счет продления кожного разреза по параректальной линии практически до лобковой области.
При интактности бифуркации осуществляют прямое или бифуркационное протезирование аорты.
Результаты операций. Еще 15—20 лет назад летальность после операции по поводу инфраренальных неосложненных аневризм брюшной аорты была равна 10% [De Bakey M. et al., 1964]. К середине 70-х годов она снизилась до 3—5% [Mannick J. et al., 1978]. В настоящее время в серии, описанной К. W. Johnston (1989), летальность составила 0,8% на 666 операций, произведенных больным без признаков ИБС,
а при сочетании с ИБС—6,2%. Эта же тенденция четко прослеживается и в отдаленные сроки после операции. По данным G. Johnsson и соавт. (1990), через 5 лет после резекции аневризм брюшной аорты были живы 68% больных, у которых отсутствовала ИБС, и лишь 48% больных, у которых на момент операции была ИБС. Нельзя полностью согласиться с мнением А. В. Покровского (1979), что оперированные больные практически живут так же долго, как все люди их возраста. Это не совсем так. Приводим средние показатели выживаемости в течение 5 лет трех групп наблюдавшихся в 7 крупнейших центрах США лиц одного возраста: здоровых больных с аневризмами брюшной части аорты, лечившихся консервативно и оперированных [Bernstein E. et al., 1978] (табл. 7.1).
Таблица 7.1. Выживаемость (в процентах) трех групп лиц одного возраста
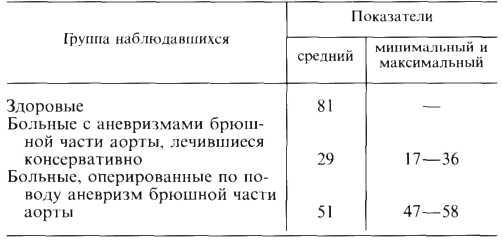
Следует, однако, отметить явные преимущества хирургического метода лечения аневризм брюшной части аорты перед консервативным (рис. 7.44). Госпитальная летальность при хирургическом лечении составляет 5,4%.
Клиника осложненных форм аневризм брюшной части аорты. Аневризмы брюшной части аорты—болезнь постоянно прогрессирующая. Однако существуют различные мнения относительно темпов увеличения размеров аневризм и наступления разрывов. Какой размер аневризм следует считать опасным с точки зрения разрыва? Этот вопрос носит риторический характер, поскольку известны случаи разрывов асимптомных аневризм диаметром не более 4 см. Принято, однако, считать, что частота разрывов аневризм брюшной части аорты следующим образом увеличивается в зависимости от ее диаметра: при диаметре аневризмы менее 5 см средняя частота разрывов равна 5%, менее 6 см—16%; 7 см и более—76% [Berstein E. et al., 1978]. Эти авторы в группе больных (49 человек) с аневризмами брюшной части аорты диаметром
см провели динамическое наблюдение с помощью Р-скани- рования каждые 3 мес на протяжении ряда лет. Больных не оперировали из-за высокой степени риска. Оказалось, что в среднем диаметр аневризм увеличивался ежегодно на
мм. Следовательно, диаметр аневризм через 7,5 года дол жен увеличиться до опасных границ—6—7 см. Однако на блюдались и совершенно непредсказуемые быстрые темпы увеличения аневризм, что требовало срочных операций. Эти данные свидетельствуют о необходимости «агрессивного» подхода в отношении больных с данным диагнозом. J. Bergan и соавт. (1980) считают, что больной с аневризмой диаметром до 6 см имеет 75% шансов выжить без операции
652
в течение 1 года и 50%—в течение 5 лет. Это положение резко меняется у больных, имеющих диаметр аневризмы свыше 6 см. Они имеют 50% шансов выжить в течение года и только 6%—в течение 5 лет.
Разрыв аневризматического мешка с кровотечением в брюшную полость, забрюшинное пространство или близлежащие органы—закономерная заключительная стадия развития каждого аневризматического процесса, если другие причины не приведут ранее больного к смерти. Выше было отмечено, что при операциях, сделанных в плановом порядке, летальность составляет менее 5%. Однако летальность больных после операций по поводу разорвавшихся аневризм высокая и до настоящего времени (30—70%). Поэтому для улучшения результатов операций при аневризмах брюшной части аорты возможны следующие меры: 1) производство операций в бессимптомной или моноси-мптомной стадиях болезни (пульсирующее образование в животе), после соответствующей подготовки и тщательного всестороннего обследования больных; 2) квалифицированный ранний диагноз разрыва аневризм брюшной части аорты и правильные организационные мероприятия, направленные на своевременное поступление больного в специализированный стационар; 3) квалифицированная анестезиологическая, хирургическая и послеоперационная реаниматологическая помощь.
До настоящего времени значительная часть больных погибают дома или в стационарах разного профиля от недиаг-ностированного разрыва аневризм брюшной части аорты. Такие больные могут быть ошибочно госпитализированы в терапевтические и кардиологические отделения, а также в отделения интенсивной терапии с диагнозом «абдоминальная форма инфаркта миокарда», или «кардиогенный шок»; 50% больных оперируют в общих хирургических стационарах по поводу «тромбоза мезентериальных сосудов», «острого панкреатита», «перфорации язв желудка». Часть больных поступают в урологические отделения с диагнозом: «паранефрит», «почечная колика» и даже в ортопедические и неврологические стационары с диагнозом «ущемление межпозвонкового диска» [Stephenson H. et al., 1977]. В то же время существует одно принципиальное положение: моментальная смерть при разрыве аневризм брюшной части аорты—крайне редкое явление. У хирурга всегда есть время для оказания больному ургентной квалифицированной хирургической помощи. Темпы развития сосудистой катастрофы обусловлены анатомическими особенностями органа: локализацией кровоизлияния, величиной разрыва, уровнем артериального давления, показателями свертывающей системы крови, общим состоянием больного и его компенсаторными возможностями. За исключением очень остро протекающего разрыва аневризмы в брюшную полость в течение данного ургентного состояния, следует выделять период временной стабилизации процесса, который в зависимости от ряда перечисленных причин имеет различную продолжительность [Углов Ф. Г. и др., 1970]. Стабилизация состояния обычно обусловлена прекращением кровотечения вследствие тромбоза, артериальной гипотензией, тампонадой места разрыва стенки аорты. По данным Н. Shumacker (1977), шок возникает в каждом случае разрыва аневризмы брюшной части аорты, но выраженность его может быть различной: тяжелый (артериальное давление менее 65 мм рт. ст.) наблюдается у 50% больных, средней тяже-
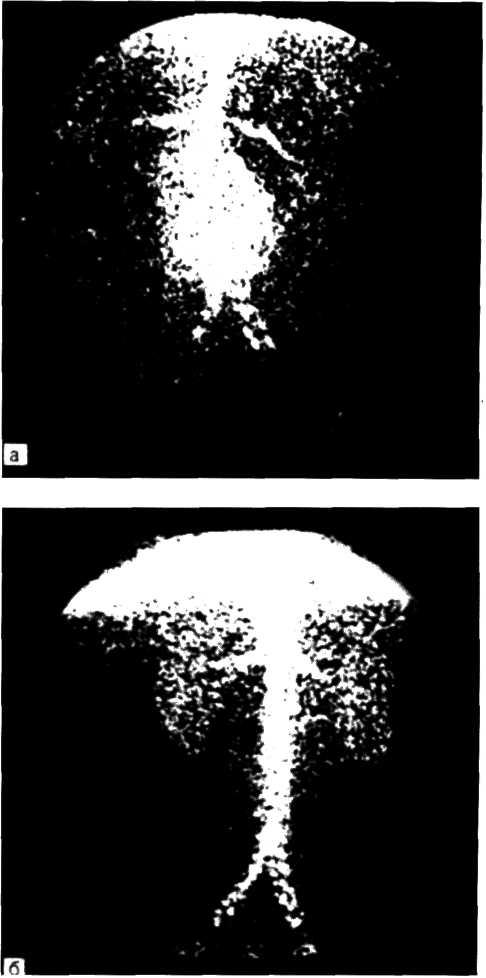
7.44. Радионуклидная ангиограмма больного с аневризмой ж-фраренального отдела брюшной части аорты до операции (а) и после нее (б). На послеоперационной ангиограмме видны проходимые почечные артерии, протез и обе подвздошные артерии.
ста—у 20% больных. У 30% больных протекает сравнительно легко.
Среди осложненных форм аневризм брюшной части аорты следует различать: неполный разрыв—надрыв, вернее расслоение, стенки аневризмы брюшной части аорты с образованием субадвентициальной гематомы, иногда с дистальной фенестрацией в области бифуркации и полный разрыв с кровоизлиянием в забрюшинное пространство, свободную брюшную полость, органы желудочно-кишечного тракта и в систему нижней полой вены.
653
Клиническая картина надрыва стенки аневризмы характеризуется появлением острых резких болей в животе или поясничной области, но без коллапса и анемии. Умеренная гипотензия и тахикардия обычно обусловлены болевым фактором. Одновременно, если больной наблюдался в динамике, отмечаются увеличение размеров аневризмы, усиление ее пульсации, изменение конфигурации пульсирующего образования. В ряде случаев можно отметить, что местами стенка пульсирующего образования более податлива и как бы пролабирует вследствие образования дочерних тонкостенных аневризм. Боли требуют введения аналгетиков и наркотиков. Надрыв может принять хроническое течение при условии достаточно прочных наружных слоев стенки аневри-зматического мешка. На операции в таких случаях по задне-боковым стенкам обычно выявляются места разрывов внутренней оболочки с заполненными тромбами полостями «дочерних аневризм». В острых случаях отмечаетсяинфильтрация стенок аневризмы, иногда полное отсутствие задней стенки аорты, которую заменяют узурированные тела поясничных позвонков.
Особенности клинической картины разрывов аневризм брюшной части аорты различной локализации. Разрыв аневризмы в свободную брюшную полость—самый острый и самый трагический вариант разрыва, так как кровотечение идет быстрыми темпами, эффект тампонады не возникает. Такой разрыв встречается в 10— 14,4% всех случаев разрывов [Darling R., 1970; Stephenson Н. et al., 1977]. В клинической картине преобладают острые боли по всему животу, симптомы острого массивного кровотечения в большую полость (коллапс, шок, бледность, анемия, холодный пот, тахикардия). Несколько позднее появляются симптомы раздражения брюшины, вздутие живота, тошнота. На фоне гипотензии развивается олигурия и даже анурия. При обследовании, если больной наблюдался в динамике, отмечаются уменьшение размеров пульсирующего образования и нечеткость его контуров, перкуторно в отлогих частях живота—тупость, при исследовании через прямую кишку—нависание передней стенки прямой кишки, при влагалищном исследовании—нависание заднего свода у женщин. Перистальтика вялая, определяются симптомы раздражения брюшины по всему животу. В анализах крови—нарастающая анемия. Если ранее уже был установлен диагноз аневризмы брюшной части аорты, то данная клиническая картина служит показанием к срочной операции. Если ранее больной не наблюдался по поводу данного заболевания, то показаны срочное проведение (З-сканирования, компьютерной томографии или дигитальной субтракцион-ной ангиографии и операция.
Разрыв аневризмы брюшной части аорты в забрюшинное пространство—наиболее частый и наиболее удобный для транспортировки и операции вариант, так как кровотечение не бывает столь быстрым и массивным, всегда имеет место эффект тампонады и тромбоза отверстия, что на фоне гипотензии приводит к временной остановке кровотечения. Однако не следует забывать, что эта стабилизация состояния— явление временное, отодвигающее катастрофу на неопределенный, достаточно кратковременный период времени. В клинической картине отмечаются острые интенсивные боли в левой половине живота и левой поясничной области. Боли могут симулировать почечную колику, тем более что параренальная гематома может вызвать гематурию. Кол-
лапс менее выражен, нежели при кровоизлиянии в брюшную полость. Однако болевой синдром на фоне кровотечения приводит к достаточно выраженному шоку с падением артериального давления, тахикардией, анемией, олигурией. При осмотре: в брюшной полости больше слева определяется пульсирующее образование значительных размеров, без четких границ, над ним выслушивается систолический шум, перкуторно—притупление в левой половине живота. Позднее может выявиться картина ишемии нижних конечностей за счет сдавления подвздошных артерий и их тромбоза на фоне гипотензии или, наоборот, картина венозного стаза в нижних конечностях за счет компрессии подвздошных вен. В дальнейшем появляется синюшность нижних боковых отделов передней брюшной стенки, поясницы, бедра, мошонки. Рентгенологически в прямой проекции отмечается исчезновение тени большой поясничной мышцы. В боковой проекции выявляется смещение газов в кишечнике кпереди. При даче взвеси сульфата бария желудок также смещен кпереди. При наличии пульсирующего образования в животе диагноз достаточно ясен и больному показана ургентная операция. При неясной клинической картине показаны неинвазивные методы диагностики аневризм брюшной части аорты, а если позволяет общее состояние больного, то и экстренная рент-геноконтрастная ангиография.
Прорыв аневризмы брюшной части аорты в органы желудочно-кишечного тракта также позволяет хирургу оценить ситуацию и подготовить больного к ургентной операции, поскольку, по данным J. Reckles и соавт. (1979), у 41% больных между первым и вторым обильным кровотечением в желудочно-кишечный тракт проходит менее суток, у 26,9% больных—от 1 до 7 дней и у 32,1%—более 7 дней. Наиболее часто прорыв происходит в двенадцатиперстную кишку (76—81%). У 5—16% больных аневризма может прорваться в желудок, у 3—10%—в тощую кишку и крайне редко—у 3—5%—в толстую кишку. Установить диагноз помогают следующие признаки: 1) наличие в анамнезе пульсирующего образования в животе; 2) «продромальный период» разной продолжительности, заключающийся в усилении болей в мезогастрии, гипертермии, лейкоцитозе, повышении СОЭ; 3) развитие острого болевого синдрома в эпимезогастрии, рвота кровью, икота наряду с явлениями коллапса (бледность, холодный пот, тахикардия, анемия); 4) мелена—более поздний признак кишечного кровотечения. Прорыв в двенадцатиперстную кишку происходит чаще в связи с тесным прилеганием этого отдела кишки к брюшной части аорты. Перистальтика кишки обычно способствует тромбозу и прикрытию отверстия в ее стенке на фоне снижения артериального давления.
Уточнить диагноз позволяют неинвазивные методы исследования, дуоденоскопия, а в крайний случаях—рентгено-контрастная ангиография.
Прорыв аневризмы брюшной части аорты в бассейн нижней полой вены может быть: 1) непосредственно в ствол нижней полой вены; 2) в левую почечную вену; 3) в правую подвздошную вену. Это осложнение встречается лишь в 1% случаев всех операций по поводу аневризм брюшной части аорты. Основные симптомы прорыва: 1) наличие пульсирующего образования в животе; 2) дрожание при пальпации живота в проекции нижней полой вены и систолодиастоли-ческий шум при аускультации пульсирующего образования; 3) остро развивающаяся картина сердечной недостаточ-
654
ности (одышка, сердцебиение, а позднее прогрессирующая недостаточность правой половины сердца—увеличение печени, асцит); 4) развитие синдрома нижней полой вены за счет повышения венозного давления в ее системе. Указанная картина не сопровождается проявлениями внутреннего кровотечения. Дополнительно к описанной клинической картине вследствие увеличения печени у больных может отмечаться чувство тяжести в правом подреберье, а также в ногах и в тазу за счет венозного стаза и аноксии тканей. Нередко отмечается расширение подкожных вен передней брюшной стенки и нижних конечностей. При катетеризации нижней полой вены выявляется повышение венозного давления и насыщения кислородом венозной крови.
Осложненные формы аневризм брюшной части аорты требуют срочной операции, однако для обеспечения положительного результата необходимо детальное соблюдение предоперационной тактики и принципов хирургической помощи данным контингентамбольных [Tarhan S. etal., 1982]: 1) не следует стремиться к повышению систолического артериального давления выше 80 мм рт. ст.; 2) нельзя вводить вазопрессоры; 3) исключить все процедуры, которые могут провоцировать натуживание больных (клизмы, катетеризация мочевого пузыря, введение зонда в желудок, нежелательны даже кашель и чиханье); 4) больной должен быть полностью подготовлен для операции до момента введения в наркоз, а бригада хирургов должна быть готова к экстренным хирургическим мероприятиям, поскольку на фоне вазо-дилатационного эффекта вводного наркоза и интубации кровотечение может прогрессировать. При наркозе тампо-надный эффект ликвидируется.
Как только дан наркоз, бригада хирургов начинает полную срединную лапаротомию. Основная задача—пережатие аорты выше аневризмы с целью прекращения кровотечения. Остановка кровотечения из аорты возможна несколькими путями: 1) рекомендуемый рядом авторов метод прижатия аорты через переднюю брюшную стенку кулаком малоэффективен; 2) трансфеморальное введение в аорту об-турирующего баллона типа баллона Фолея выполнимо редко в связи с изгибами и стенозами подвздошно-бедренного сегмента. Кроме того, этот метод опасен возможностью эмболизации периферического русла из аневризматического мешка; 3) более радикален метод введения обтурирующего баллона через подмышечную артерию; 4) метод компрессии проксимальной аорты после быстрой лапаротомии специальным зеркалом-компрессором, предложенный J. ЕШа и соавт. в 1959 г., нашел широкое применение в клинической практике; 5) идеальный вариант—быстрое выделение шейки аневризмы и пережатие ее вертикально наложенным зажимом—не всегда выполним из-за наличия гематомы и опасен возможностью ранения крупных венозных стволов, что увеличивает кровопотерю и усложняет операцию; 6) надежным и малотравматичным является метод рассечения передней стенки аневризмы и введения баллонного катетера типа Фолея в проксимальное русло аорты, а затем и в обе подвздошные артерии; 7) Н. Schumacker (1974) и Н. Stephenson (1977) предложили использовать метод предварительной торакотомии в шестом межреберье с целью пережатия аорты в грудном отделе над диафрагмой пальцами ассистента, в то время как хирург с помощью других хирургов производит лапаротомию. Преимущества данного метода заключаются в следующем: во-первых, аор-
та может быть перекрыта быстро и надежно, после чего следует начать мероприятия по восстановлению объема циркулирующей крови и т. д.; во-вторых, операционное поле не заполняется кровью, поэтому легче и быстрее можно выделить шейку аневризмы без дополнительной травмы почечных сосудов, поджелудочной железы, венозных стволов. Наконец, чрезвычайно важен визуальный и пальпатор-ный контроль за деятельностью сердца, так как в 30—80% случаев во время операции по поводу разрыва аневризмы брюшной части аорты происходит остановка сердца. Критическими периодами для остановки сердца являются индукция в наркоз, которая провоцирует вазодилатацию, а также переливание большого количества несогретой крови, что снижает температуру миокарда и в сочетании с нарушениями кислотно-основного равновесия приводит к остановке сердца. Если это осложнение произошло в момент введения в наркоз, необходимо срочно начать вентиляцию легких, как можно быстрее—интубацию трахеи больного, внутривенную массивную гемотрансфузию, приподнять ножной конец стола, что позволяет уменьшить количество переливаемой крови на 500—1000 мл, произвести быструю торакотомию, пережать аорту над диафрагмой и сделать прямой массаж сердца, позволяющий улучшить перфузию миокарда и мозга. Открытая грудная клетка дает возможность произвести, если это необходимо, прямую дефибрилляцию сердца. Переливаемая кровь и жидкости должны быть согреты до нужной температуры.
В ИССХ им. А. Н. Бакулева АМН СССР в настоящее время в ряде случаев при супраренальных и осложненных аневризмах брюшной части аорты применяется широкая левосторонняя торакофренолюмботомия с продолжением разреза в параректальный. Этот доступ позволяет при необходимости контролировать и нижнегрудной отдел аорты, легче выделять шейку аневризматического мешка, практически исключает опасность ранения крупных венозных стволов, при этом сохраняются все преимущества торакотомии. Поэтому данный метод можно рекомендовать в случае ур-гентных операций при разрывах брюшной части аорты.
После пережатия аорты выше аневризмы и остановки кровотечения проводятся мероприятия, направленные на стабилизацию гемодинамики, профилактику почечной недостаточности и шока: массивная трансфузия свежеконсерви-рованной и подогретой крови до нормализации центрального венозного давления, введение глюконата кальция, диуретиков (лазикс), бикарбоната натрия для ликвидации метаболического ацидоза, гидрокортизона. По возможности желательна подготовка больного за 2 сут до операции путем введения больших доз антибиотиков.
Техника самой операции мало отличается от техники операции в «холодном» периоде аневризмы брюшной части аорты. Сообщение с нижней полой веной ушивается изнутри аневризматического мешка. При наличии фистулы с двенадцатиперстной кишкой отверстие ушивают из просвета мешка двух- или трехэтажным швом. Можно ушивать фистулу после дуоденотомии или даже произвести резекцию двенадцатиперстной кишки. Обязательным условием является надежное укрытие протеза от места ушивания фистулы с помощью стенки мешка или сальника.
Результаты операций зависят от тяжести состояния больных и выраженности шока. A. Young и соавт. (1977) собрали данные о летальности больных в 9 крупнейших центрах
655
7.46. Схема классификации расслаивающих аневризм аорты по Дюбосту. Объяснение в тексте.
США. Оказалось, что при развившемся шоке летальность составляла 77%, а без него—29%. Некоторые авторы [Darling R., 1970; Shumacker H., 1973] добились снижения летальности до 8—10% при невыраженном шоковом состоянии. Отдаленные результаты операций аналогичны таковым у больных, оперированных по поводу неосложненных аневризм брюшной части аорты.
7.4. РАССЛАИВАЮЩИЕ АНЕВРИЗМЫ АОРТЫ
Под термином «расслаивающая аневризма аорты» подразумевают внезапное образование вследствие различных причин дефекта внутренней оболочки стенки аорты с последующим проникновением потока крови в дегенеративно измененный средний слой, образованием внутристеночной гематомы и продольным расслоением стенки аорты преимущественно в дистальном или реже в проксимальном направлении.
Расслоение аорты впервые было описано в 1761 г. Morga-gni, а затем в 1802 г. Maunoz. В 1819 г. французской школой Laennec в клиническую практику был введен термин «anew-risme dissequant» (расслаивающая аневризма), сохранившийся до настоящего времени, поскольку само по себе расширение аорты в ряде случаев носит умеренный характер и не затрагивает ее внутреннего слоя. Этот термин нельзя считать абсолютно правильным, но он тем не менее является общепринятым.
Первая попытка коррекции расслоения аорты была предпринята D. Gurin и соавт. в 1935 г. путем создания дисталь-ной фенестрации на уровне наружной подвздошной артерии. В 1955 г. R. Shan повторил эту операцию уже на уровне брюшной части аорты. Оба больных умерли от почечной недостаточности. Первая успешная операция создания ди-стальной фенестрации на уровне грудной нисходящей части аорты была произведена также в 1955 г. М. DeBakey. В 1955 г. М. DeBakey произвел успешную операцию резекции расслаивающей аорты с ее протезированием, проксимальная фенестрация которой локализовалась дистальнее левой подключичной артерии. В 1959 г. М. DeBakey выполнил первую операцию по поводу расслаивающей аневризмы
восходящей части аорты. В нашей стране подобную операцию впервые сделал в 1964 г. Б. В. Петровский. В 1965 г. А. В. Покровский выполнил операцию протезирования грудной нисходящей части аорты при ее расслоении. Наибольший опыт в лечении расслаивающих аневризм грудной части аорты накоплен в ИССХ им. Бакулева АМН СССР.
Частота. Не следует считать расслоение аорты казуистически редким заболеванием. Об этом свидетельствуют данные статистики. Среди острых заболеваний аорты ее расслоение может считаться самой частой катастрофой [Sorensen H. et al., 1964], причем оно наблюдается в 2—3 раза чаще, чем, например, разрыв аневризм брюшной части аорты [Wheat M., 1973]. Расслоение аорты встречается у 1 из 10000 госпитализированных больных. Однако значительная часть больных погибают на догоспитальном этапе. Расслаивающие аневризмы аорты в 1,1% случаев бывают причиной внезапной смерти. По данным В. С. Смоленского (1964), суммарный материал литературы свидетельствует о том, что с 1909 по 1956 г. 1 случай разрыва или расслоения аорты приходится в среднем на 400 вскрытий. По данным М. Wheat (1973), частота расслоения аорты составляет 5— 10 случаев на 1 млн населения ежегодно. Среди аневризм аорты расслаивающие аневризмы составляют 6%, а среди аневризм грудной части аорты—20% [DeBakey M., 1961 ].
Классификация. Классификации расслаивающих аневризм аорты обычно основаны на локализации проксимального разрыва внутренней оболочки аорты и протяженности расслоения стенки аорты. Поскольку принципиально разрыв внутренней оболочки аорты может произойти в любом сегменте аорты и бывает множественным, теоретически варианты расслоения аневризмы могут быть разнообразными. Ch. Dubost выделяет, например, три формы расслоения грудной части аорты с местом расположения дефекта внутренней оболочки в восходящей части аорты, в области ее дуги и в начальном сегменте нисходящей части аорты (рис. 7.45). На практике, однако, разрыв внутренней оболочки чаще всего происходит в передней стенке восходящей части аорты на границе проксимальной и средней трети,
656
7.48. Расслаивающие аневризмы III типа (А — D) по классификации Робичека. Объяснение в тексте.
а также в начальном сегменте нисходящей части аорты дистальнее устья левой подключичной артерии. Именно на этом принципе и основана классификация М. DeBakey, которой придерживаются большинство отечественных хирургов (рис. 7.46). Однако, с нашей точки зрения, в клинической практике для определения прогноза болезни и выработки консервативной и оперативной тактики более удобной является модификация этой классификации, которую предложил в 1984 г. F. Robicsek (рис. 7.47, 7.48).
Тип I—разрыв внутренней оболочки локализуется в восходящей части аорты, а расслоение ее стенок распространяется до брюшной части аорты. Патологический процесс имеет два варианта: а) расслоение стенки аорты заканчивается слепым мешком в дистальных отделах аорты; б) имеется второй—дистальный—разрыв аорты (дистальная фене-страция).
Тип II—разрыв внутренней оболочки локализуется в восходящей части аорты, расслоение заканчивается слепым мешком проксимальнее плечеголовного ствола.
Тип III — разрыв внутренней оболочки аорты локализуется в начальном отделе нисходящей части грудной аорты дистальнее устья левой подключичной артерии. Процесс расслоения имеет 4 варианта: а) расслоение заканчивается слепым мешком выше диафрагмы; б) расслоение заканчивается слепым мешком в дистальных отделах брюшной части аорты; в) расслоение направлено не только дистально, но и распространяется ретроградно на дугу и восходящую часть аорты, заканчиваясь слепыми мешками; г) расслоение аорты распространяется на брюшную часть аорты с развитием дистальной фенестрации.
Частота выявления различных типов расслоения аорты лучше всего демонстрируется на большой серии клиниче-
657
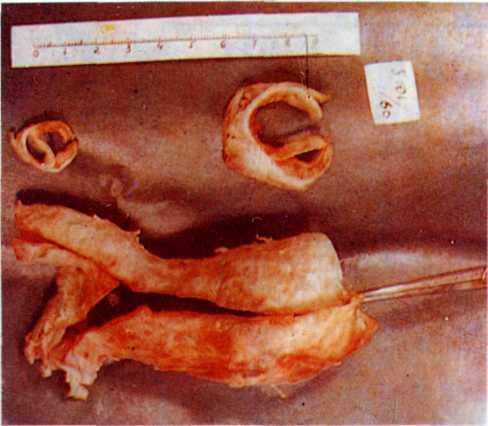
7.49. Макропрепарат расслаивающей аневризмы аорты. Отчетливо видны .южный и истинный просветы аорты.
ских наблюдений, приведенных М. DeBakey в 1982 г.: расслаивающие аневризмы I типа составляют 26,2%, II типа— 10,8%, III типа—63% от числа всех случаев. По данным ИССХ им. А. Н. Бакулева АМН СССР, частота выявлений
I типа расслоения аорты составляет 24%, II типа—21%, III типа—55% от числа всех расслаивающих аневризм груд ной части аорты. Данные вскрытий свидетельствуют о зна чительном преобладании расслаивающих аневризм I—
II типа (80%), т. е. о высокой догоспитальной летальности больных с расслоением аневризм именно этих типов.
Этиология. Принято считать, что основной причиной расслоения стенки аорты является артериальная гипертензия, поскольку 84% больных имеют повышенные цифры артериального давления. Однако артериальная гипертензия и гемо-динамические особенности различных сегментов аорты могут привести к расслоению стенки только при дегенеративных изменениях ее средней оболочки, мышечных и эластических ее структур. Последнее может быть вызвано различными этиологическими факторами: атеросклерозом, фиброзной дисплазией, идиопатическим медионекрозом, генетическим дефектом эластических структур (болезнь Мар-фана), гормональными изменениями в них, характерными для последнего триместра беременности. В последние годы в связи с развитием ангиографии и методов баллонной дилатации выделяют еще одну группу расслаивающих аневризм аорты и ее ветвей — ятрогенные аневризмы.
Патогенез. Аорта имеет три наиболее уязвимых сегмента— корень, перешеек и диафрагму. Гёмодинамическое напряжение указанных зон и их хроническая травматизация приводят к дегенеративным изменениям средней оболочки аорты. Экспериментально подтвержден следующий механизм расслоения аорты: длительное повышение артериального давления всегда ведет к той или иной степени дилатации аорты. Известно также, что внутренняя оболочка по своей структуре менее растяжима, чем средняя и наружная оболочки, обладающие большей эластичностью. Именно поэтому при одном из очередных «критических» повышений артериального давления происходит разрыв внутренней оболочки. Особенности формы потока крови в восходящей части и начальном отделе нисходящей части аорты, скорость кровотока и характер пульсовой волны — эти гемоди-намические параметры и определяют закономерность в развитии разрыва внутренней оболочки аорты в указанных
отделах. Однако гидравлический удар о стенку аорты и разрыв внутренней оболочки сами по себе могут привести лишь к развитию внутристеночной гематомы. Дальнейшее расслоение происходит лишь при наличии патологического процесса в средней оболочке аорты (рис. 7.49).
При разнообразных процессах в аорте этиологические факторы повышения артериального давления и дегенеративных изменений средней оболочки имеют различное значение. Так, например, расслоение аорты при беременности, болезни Кушинга, феохромоцитозе в основном обусловлено «кризовыми» подъемами артериального давления. Расслоение аорты при коарктации. так же как и при атеросклерозе, обусловлено обычно и высоким артериальным давлением, и дегенеративными изменениями стенки аорты. У больных моложе 40 лет расслоение аорты чаще всего обусловлено врожденными и генетическими изменениями в стенке аорты, нежели нарушениями гемодинамики. Ятрогенные причины расслоения аорты (при ангиографии, баллонной дилатации, канюляции аорты при проведении ИК или введении кардио-плегического раствора) зависят только от технических погрешностей и не связаны ни с уровнем давления, ни с дегенеративными изменениями стенки аорты.
Патологическая анатомия. При гистологическом исследовании аорты больных, страдающих артериальной гипертен-зией, Л. Н. Попов (1956) отметил надрывы внутренней и средней оболочек аорты. При хронической травматизации стенки аорты возникают своеобразные морфологические изменения, аналогичные медионекрозам Эрдгейма. При иди-опатическом медионекрозе, описанном Эрдгеймом (1929— 1930 гг.), наблюдающемся обычно в возрасте старше 40 лет, образуются очаги некроза в мышечном слое средней оболочки, фрагментация эластических мембран и характерные кисты-полости, заполненные желеобразной массой. Некоторые считают, что этот процесс развивается в результате инфекции, интоксикации и даже ревматизма. При болезни Марфана отмечается разрежение соединительнотканных, эластических структур с замещением их мукоидным веществом.
Гистологическая картина напоминает патологические изменения при идиопатическом медионекрозе.
Патологическая физиология. Выделяют три основных фактора: 1) расслоение стенки аорты; 2) развитие обширной внутристеночной гематомы; 3) сдавление или отрыв многочисленных ветвей аорты, снабжающих кровью жизненно важные органы (миокард, головной или спинной мозг, почки), с последующей их ишемией. Само по себе внезапное расслоение стенки аорты даже при отсутствии выраженной кровопотери вызывает болевой синдром. Образование гематомы в области восходящей части аорты и нередко ее корня приводит к компрессии коронарных артерий, выходного отдела левого желудочка сердца, что обусловливает развитие острой сердечной недостаточности. Кроме того, истинный просвет аорты нередко стенозируется на 50—60%, что создает своеобразный проксимальный коарктационный синдром с постнагрузкой на левый желудочек, развитием выраженной артериальной гипертензии. Это увеличивает размеры гематомы и способствует дальнейшему процессу расслоения аорты с переходом на дугу, нисходящую часть с компрессией или отрывом ветвей дуги аорты, межреберных артерий, ветвей брюшной части аорты, что также резко меняет условия как центральной, так и регионарной гемодинамики. Обширная внутристеночная гематома вмещает достаточно значительный объем циркулирующей крови, причем это депо крови создает своеобразный «олигемический
658
синдром», утяжеляя шоковое состояние больного. Кроме того, расстройства нормальной адаптационной деятельности организма обусловлены нарушением кровоснабжения центральной и вегетативной нервной системы, эндокринных органов.
Возможны несколько вариантов течения расслоения стенки аорты: 1) ложный просвет аорты полностью заполняется тромбом и при отсутствии симптомов компрессии соседних органов может наступить «самоизлечение»; 2) расслоение стенки аорты прекращается на том или ином уровне аорты с неизмененной стенкой, однако всегда имеется опасность расширения ложного просвета аорты с последующим разрывом наружных стенок аорты; 3) при расслоении стенки аорты может произойти вторичный—дистальный—разрыв внутренней оболочки аорты с образованием дистальной фе-нестрации; некоторые авторы считают этот факт благоприятным и говорят о «самоизлечении» болезни. Мы, однако, не согласны с этим мнением; вторая фенестрация в действительности снижает «напряженность» внутристеночной гематомы и прекращает процесс более дистального расслоения стенки аорты. Однако это важно только в период острой стадии развития процесса. В хронической стадии фактор сохранения кровотока по ложному просвету аорты всегда создает опасность увеличения его размеров и разрыва, даже в случае устранения проксимальной фенестрации оперативным путем; 4) больной может умереть либо вследствие разрыва стенки аорты и внутреннего кровотечения, либо вследствие острой окклюзии магистральных артерий, снабжающих кровью миокард, мозг, почки, органы брюшной полости.
Клиника. Симптомы расслоения аорты разнообразны и могут имитировать практически все сердечно-сосудистые, а также неврологические, урологические заболевания. Клиническая картина обусловлена локализацией первичной фенестрации аорты и протяженностью процесса расслоения. Расслоение аорты—процесс динамический и при более или менее продолжительном наблюдении за больным в финальной стадии болезни клиническая картина может значительно отличаться от первоначальной.
Процесс расслоения может иметь три формы течения: острую (до 2 сут), подострую (до 2—4 нед) и хроническую (месяцы и даже годы).
В анамнезе обычно отмечается артериальная гипертензия. Наиболее частым симптомом расслоения аорты является боль. Боль настолько интенсивна, что нередко вызывает коллаптоидное состояние. Падение артериального давления в свою очередь приостанавливает процесс расслоения аорты, что несколько снижает интенсивность болей и стабилизирует общее состояние больных. Однако это лишь видимость благополучия. Волнообразное течение болезни вновь приводит к повышению артериального давления и продолжению расслоения стенки аорты. При этом характер болевого синдрома по своей первичной локализации и иррадиации в значительной степени меняется.
При II типе расслоения аорты боль обычно локализуется за грудиной и имитирует острый инфаркт миокарда. Эта ситуация особенно часто наблюдается в тех случаях, когда расслоение в действительности распространяется на корень аорты и способствует компрессии коронарных артерий. Болевой синдром действительно имеет коронарный генез. При дальнейшем расслоении аорты I типа боль «перемещается»
в межлопаточную область, а затем постепенно «спускается» по позвоночнику в поясничную область.
При аневризмах III типа первоначально боль локализуется в межлопаточной области. Больные сравнивают ее с кинжальным ударом в спину. Боль иррадиирует в левую руку, левую половину грудной клетки, распространяется на поясницу. При распространении процесса расслоения на брюшную часть аорты при аневризмах I и III типа боль появляется в области эпигастрии, гипогастрия или же локализуется в поясничной области. При ретроградном расслоении аневризм III типа боль может носить загрудинный инфарктопо-добный характер и иррадиировать в шею, что обусловлено расслоением дуги аорты. Значительно реже расслоение аорты протекает с малоинтенсивными болями. У ряда больных (по данным ИССХ им. Бакулева АМН СССР, в 14% случаев) расслоение аорты протекало практически асимптомно и первыми признаками болезни были симптомы ишемии головного или спинного мозга, аортальной недостаточности, ишемии почек, органов пищеварения и нижних конечностей. Нередко первым признаком расслоения бывает развитие пульсирующего образования в животе, трактующееся как аневризма брюшной части аорты. В. С. Ермолаев (1981) утверждает, что болевой синдром в животе является патог-номоничным для расслаивающих аневризм аорты I и III типа. Однако, по данным автора, этот симптом был выявлен лишь у 10% больных с аневризмами I типа и у 17% больных с аневризмами III типа, поэтому данный признак считать патогномоничным нельзя. Мы считаем, что без болевого течения процесса не бывает; необходимо более тщательно и целенаправленно собирать анамнез.
Расслоение ветвей дуги аорты и нисходящей грудной и брюшной частей аорты может сопровождаться: 1) острой, а затем хронической ишемией головного или спинного мозга; 2) острой ишемией органов пищеварения; 3) стабильной вазоренальной гипертензией или инфарктом почки; 4) острой ишемией нижних конечностей. В связи с этим больным могут ставить самые различные диагнозы—инсульт, тромбоз мезентериальных сосудов, почечная колика, тромбоэмболия бифуркации аорты—и госпитализировать их в стационары различного профиля: кардиологические, неврологические, урологические, гастроэнтерологические и общехирургические.
При остром развитии болезни и прорыве аневризмы в полость перикарда, плевральную полость или забрюшинное пространство первыми клиническими признаками могут быть боль и типичная картина внутреннего кровотечения.
Симптомы компрессии соседних органов, характерные для истинных аневризм грудной части аорты, могут развиваться и при расслаивающих аневризмах аорты. При аневризмах II типа нередко отмечаются симптомы венозной гипертензии головы, шеи, верхних конечностей, связанные со сдавлением верхней полой вены. При аневризмах I типа с расслоением дуги аорты могут появляться симптомы, связанные с компрессией трахеи, левого бронха (одышка, стридор, частые пневмонии) и возвратного нерва (осиплость голоса, сухой кашель).
Диагностика. Типичны острое начало болезни, указания в анамнезе на артериальную гипертензию, имеются внешние признаки болезни Марфана. При стандартном ангиологиче-ском осмотре более чем у половины больных отмечается асимметрия пульсации и уровня артериального давления на
659
верхних и нижних конечностях. В ряде случаев пульс не определяется; отмечаются признаки острой или хронической ишемии. Чаще снижение пульса и давления отмечается на левых конечностях. При перкуссии может определяться расширение тени средостения вправо или влево. Аускультатив-но над восходящей частью аорты при I—II типе расслоения аорты выслушивается систолический шум. Почти у половины таких больных отмечаются признаки аортальной недостаточности—диастолический шум и снижение уровня диа-столического артериального давления. В ряде случаев над областью сердца выслушивается шум трения перикарда. При распространении расслоения на нисходящую часть аорты систолический шум может определяться сзади в межлопаточной области и паравертебрально слева в поясничной области. При этом шум выслушивается над брюшной частью аорты и в области эпигастрия. Выявление пульсации сонных артерий и систолического шума над ними позволяет определить вовлечение в процесс ветвей дуги аорты. Важным для постановки диагноза аневризм I и III типа с распространением расслоения на брюшную часть аорты является пальпаторное определение ее пульсации, которая может быть усилена. Аорта при пальпации расширена, мягкая на ощупь, податлива за счет увеличения в основном ложного просвета. Могут определяться и большие ложные аневризмы брюшной части аорты, обычно неотделимые от реберной дуги.
Результаты электрокардиографии служат в основном двум целям: установить или исключить острый инфаркт миокарда (данный диагноз ставится практически у 90% больных с расслоением аорты). Если имеются признаки острого инфаркта миокарда, данные ЭКГ обязательно необходимо сопоставить с данными рентгенографии органов грудной клетки, поскольку расширение тени восходящей части аорты позволяет предположить у больного расслаивающую аневризму I—II типа с вовлечением в процесс устьев коронарных артерий. Кроме того, признаки острой коронарной недостаточности определяют как тактику подготовки больного к операции при наличии расслоения аорты, так и ее характер.
Фонокардиография подтверждает данные аускультации и позволяет зафиксировать у больного развитие аортальной недостаточности. Объемная сфигмография и ультразвуковая допплерография позволяют выявить «заинтересованность» магистральных артерий конечностей, уточнить распространенность процесса, особенности кровоснабжения головного
мозга, а также вовлечение в процесс расслоения сонных и позвоночных артерий.
Большое значение в диагностике расслаивающих аневризм грудной части аорты имеет рентгенологический метод. Практически у всех больных выявляется расширение тени верхнего средостения. Расширение восходящей части аорты лучше фиксируется в левой косой проекции. В той же проекции хорошо видна и тень нисходящей части аорты. Расширение ее тени наблюдается, по нашим данным, у 50% больных с I типом расслоения и у 100% больных с III типом расслоения. При этом отмечаются неровность контуров нисходящей части аорты и деформация ее тени. Рентгенологически может выявляться жидкость в полости перикарда и в плевральной полости, причем даже в хронической стадии процесса. Для уточнения диагноза большую роль имеет динамическое рентгенологическое исследование.
Эхокардиография позволяет достаточно четко фиксировать двойной просвет восходящей аорты, а также состояние аортального клапана и наличие перикардиального выпота при угрожающем разрыве аорты (рис. 7.50).
Высокими информативными возможностями обладает в диагностике расслаивающих аневризм аорты и компьютерная томография с одновременным введением рентгено-контрастного вещества. Она позволяет дифференцировать тромбоз обычной аневризмы грудной части аорты от тромбоза ложного просвета при ее расслоении.
Заключительным методом диагностики является тотальная аортография. Ее особенности заключаются в том, что при трансфеморальном доступе катетер в ряде случаев не попадает в истинный просвет аорты, в связи с чем информативность метода значительно снижается. В подобных случаях лучше использовать трансаксиллярный доступ справа. Цель ангиографического исследования—определить точное место проксимальной фенестрации, протяженность расслоения, «заинтересованность» ветвей аорты и наличие или отсутствие дистальной фенестрации. Не все ангиографические признаки расслоения аорты могут быть получены в 100% случаев. Наиболее достоверный признак—расширение и деформация тени аорты. Этот признак позволяет диагностировать проксимальный уровень расслоения и его протяженность. Частым признаком (примерно у 75% больных) является одновременное контрастирование истинного и ложного просветов аорты. Чаще удается фиксировать ложный просвет в нисходящей части аорты. Истинный просвет аорты нередко значительно сужен. В 10—15% случаев ложный
660

просвет может быть тромбирован, причем вероятность тромбоза возрастает в дистальном направлении. Однако наличие в этом сегменте стенозирования истинного просвета свидетельствует о тромбировании ложного просвета. Истинный просвет обычно носит спиралеобразный ход в нисходящей части аорты, что характерно для расслоения. У */з больных при аортографии фиксируется четкая разделительная полоса—отслоенная внутренняя оболочка—между истинным и ложным просветом. Уровень проксимальной фе-нестрации обычно определяется наличием сброса рентгено-контрастного вещества в резко расширенный ложный просвет. В ряде случаев этот сброс не удается фиксировать,и по контуру истинного просвета аорты выявляется лишь небольшой дефект наполнения.
Одним из признаков расслоения является отрыв ветвей дуги аорты и брюшной части аорты от истинного просвета. Если ветви аорты контрастируются одновременно с контрастированием истинного просвета, то это свидетельствует об их нормальном отхождении. Если контрастирование запаздывает или вообще отсутствует, следует думать об их отрыве. В подобных случаях необходимо дополнить исследование контрастированием ложного просвета аорты. Во-первых, это четче позволит определить размеры ложного просвета, степень его тромбоза и, во-вторых, выявить проходимость отходящих от ложного просвета ветвей аорты. При ангиографии корня аорты удается фиксировать регур-гитацию контрастного вещества из аорты в левый желудочек, что свидетельствует о той или иной степени аортальной недостаточности. Это осложнение мы обнаружили примерно у 50% больных с расслоением восходящей части аорты. ПриIIтипе расслоения аортальная недостаточность встречается в 2 раза чаще, чем при I типе (рис. 7.51).
Естественное течение расслаивающих аневризм грудной части аорты у 1000 больных проанализировали М. Wheat и соавт. (1973): 28% больных погибли в течение 24 ч, только 10% были живы в течение 3 мес. Интересным является тот факт, что 80% больных, переживших острую и подострую стадии болезни, были живы в течение 1—3 лет наблюдения. Что касается отдельной группы больных с развитием проксимальной фенестрации в восходящей части аорты, то в течение 3 нед погибли все больные. Интересныев этом отношении данные были представлены в 1976 г. A. Appelbaum и соавт., которые сравнили две группы оперированных и лечившихся консервативно больных с расслоением грудной части аорты (табл. 7.2).
Авторы сделали вывод об эффективности хирургического лечения больных с расслоением аортыI—IIтипа и егонеэффективности у больных при III типе расслоения аорты.
Различными были у этих групп больных основные причины смерти и при лекарственном лечении. Основной причиной смерти больных с I—II типом расслоения аорты была тампонада сердца, менее частой причиной была окклюзия магистральных ветвей аорты. У больных сIIIтипомрасслоения аорты основной причиной смерти были кровотечение в левую плевральную полость и почечная недостаточность. Последняя развилась не только в результатеокклюзии почечных артерий из-за расслоения брюшной части аорты, но и воздействия проводимой гипотензивной терапии.
М. DeBakey (1965) не выявил существенной разницы в послеоперационной летальности у больных, оперированных в острой и хронической стадиях болезни. Этот фактпозволил автору сделать вывод о необходимости операции без учета стадии заболевания, что в последующем оказалосьверным лишь для I—II типа расслоения.
Хирургическое лечение. В настоящее время при остром расслоении грудной части аорты наиболее рациональнымявляется дифференцированный подход к тактике лечения в зависимости от типа расслоения и развития осложнений. По мнению М. Wheat и соавт. (1980), лекарственная терапия показана больным с различными типами расслоения аорты как начальный этап лечения, до момента проведения аортографии и обеспечения оперативного лечения. Срочная операция необходима при угрожающем разрыве аневризмы, прогрессирующем расслоении, выраженной аортальной недостаточности, при образовании мешковидной аневризмы,
Таблица 7.2. Госпитальная летальность больных с различными типами расслаивающих аневризм грудной части аорты после хирургического и консервативного лечения
|
Тип |
Госпитальная летальность, % | |
|
лечившиеся консервативно |
оперированные | |
|
I—II III |
88 31,8 |
23.5 36,4 |
661
а также при неэффективности проводимой терапии, не снимающей болевого синдрома, и при «неуправляемой» гипер-тензии. Показанием к операции является также наличие крови в перикарде или плевральной полости.
Лекарственная терапия в острой и подострой стадиях болезни рекомендуется больным с III типом расслоения аорты, у пациентов с предполагаемым I типом расслоения, но при стабильном течении процесса у больных с высокими факторами риска (обычно старше 50 лет), а также в тех случаях, когда место фенестрации не удается выявить на аортограмме и при отсутствии контрастирования ложного канала. Следует также придерживаться консервативного метода лечения при ее эффективности у больных, у которых с момента расслоения прошло более 14 дней. Основной целью лекарственной терапии являются предотвращение прогрессирования расслоения аорты и нормализация гемодинамики и гомеостаза. Для этого проводится управляемая гипотензия с помощью арфонада, гигрония, натрия нитроп-руссида, индерала, обзидана, каптоприла. Необходимы постоянный контроль за уровнем артериального давления, диуреза, мониторирование ЭКГ. Каждые 12 ч проводится рентгенологический контроль грудной клетки с целью выявления динамики размеров аневризмы и наличия жидкости в плевральных полостях и перикарде. Как показывает опыт, риск операций, производимых в хронической стадии процесса при стабилизации гемодинамики и гомеостаза, а также вследствие укрепления наружных слоев аорты в сегменте расслоения, значительно уменьшается, чем в острой и подострой стадиях.
Тем не менее хирургическое лечение показано больным с I—II типом расслоения сразу же после стабилизации гомеостаза в связи с непредсказуемым развитием осложнений. Помимо указанных признаков угрожающих осложнений, важным симптомом для решения вопроса о срочной операции являются симптомы острой окклюзии ветвей аорты, снабжающих кровью жизненно важные органы (мозг, почки, висцеральные органы). При угрозе разрыва аорты операция показана по витальным показаниям. Для больных с III типом расслоения операцию чаще следует производить в хронической стадии процесса, преимущественно у больных не старше 50 лет, при аневризме только грудной части аорты либо мешковидных аневризмах брюшной части аорты, сочетающихся с болевым синдромом, при синдроме хронической ишемии органов пищеварения, вазоренальной гипертен-зии и ишемии нижних конечностей.
При тяжелых сопутствующих заболеваниях у больных пожилого возраста следует предпочесть лекарственную терапию, если она эффективна.
Техника операций при расслаивающих аневризмах I—II типа аналогична таковой при обычных аневризмах восходящей части аорты. При наличии расслоения аорты швы накладывают так, чтобы ликвидировать ложный просвет в ее стенке. Операции направлены на устранение проксимальной фенестрации в аорте. При развитии острой аортальной недостаточности восходящую часть аорты протезируют с помощью специального «кондуита», содержащего протез клапана. Для лучшей герметизации швов дис-тального анастомоза можно использовать специальный клей, заливаемый между расслоенными слоями аортальной стенки.
При расслоении аорты I типа, симптомах ишемии мозга вследствие окклюзии ветвей дуги аорты показано одновре-
менное протезирование восходящей части аорты и ее дуги с имплантацией брахиоцефальных сосудов в протез или их протезирование. При симптомах, характерных для расслоения брюшной части аорты и ее ветвей, не исчезающих и даже усугубляющихся после устранения проксимальной фенестрации расслоения, вторым этапом показана операция на брюшной части аорты и ее ветвях. Второй этап операции направлен обычно на резекцию больших ложных аневризм брюшной части аорты, а также на реваскуляризацию почек, органов брюшной полости и нижних конечностей.
При расслаивающих аневризмах III типа устранение только проксимальной фенестрации в аорте с протезированием грудной части аорты следует считать радикальной при ограниченном участке расслоения, не переходящем на брюшную часть аорты. Если расслоение распространяется на брюшную часть аорты, то устранение ложного просвета при протезировании грудной части аорты приводит часто к ишемии почек вследствие редукции кровотока по ложному просвету, от которого чаще отходит левая почечная артерия. Современная тактика при подобных операциях должна заключаться в одномоментной реконструкции всей нисходящей части аорты и ее магистральных ветвей. Метод операции при этом по доступу к аорте и условиям ее проведения практически не отличается от такового при аневризме грудной и брюшной частей аорты, но требует некоторой детализации. В грудной части аорты межреберные артерии обычно не вовлечены в процесс расслоения, так как ложный просвет аорты расположен по переднелатеральной стенке аорты. В брюшной части аорты ложный просвет в 85% случаев располагается слева. Именно поэтому левая почечная артерия значительно чаще отходит от ложного просвета аорты, чем правая. Устья висцеральных артерий могут быть вовлечены в процесс расслоения, но чаще отходят от истинного просвета. Они обычно расположены близко друг к другу и поэтому могут быть имплантированы в протез на одной площадке.
Аорту пережимают и рассекают в продольном направлении. Внутреннюю оболочку между истинным и ложным просветом иссекают на всем протяжении. Площадку с межреберными артериями вшивают в окно протеза по задней его поверхности. По описанному методу на площадке имплантируют ветви брюшной части аорты. Отдельно вшивают на площадке устье левой почечной артерии. В случаях острого расслоения в связи со слабостью стенок аорты производится устранение проксимальной фенестрации аорты (рис. 7.52).
Учитывая, что кровоснабжение спинного мозга в основном осуществляется через артерию Адамкевича, которая чаще всего расположена на уровне X—XI грудного позвонка, можно использовать несколько видоизмененный метод сохранения кровотока по спинномозговым ветвям. Четыре—пять пар верхних межреберных артерий можно перевязать. Из площадки нижнего сегмента грудной части аорты с устьями межреберньгх артерий на уровне VIII—XII грудных позвонков создается слепой канал, открытый в просвет аорты. Именно в этом месте накладывается дистальный анастомоз протеза с аортой (рис. 7.53) [Guilmet D. et al., 1968]. В тех случаях, когда винтообразный ход расслоения грудной аорты выглядит таким образом, что нижние межреберные и верхние поясничные артерии, а также чревный ствол и верхняя брыжеечная артерия отходят от истинного просвета аорты, радикальную коррекцию расслаивающей
662
I—продольная аортотомия: наложен проксимальный анастомоз протеза с грудной частью аорты, в широкое окно по задней стенке протеза на единой площадке имплантируются устья межреберных и поясничных артерий; II—на единой площадке имплантируются в протез близко расположенные висцеральные ветви и почечные артерии; III—дистальный анастомоз в данном случае накладывается с бифуркационным протезом с общими подвздошными артериями, так как расслоение аорты распространилось на бифуркацию брюшной части аорты.
7.53. Схематическое изображение этапов (I—III) резекции аневризмы грудной части аорты с протезированием и реваскуля-ризацией спинномозговых ветвей по методу Гилмета. Объяснение в тексте.
663
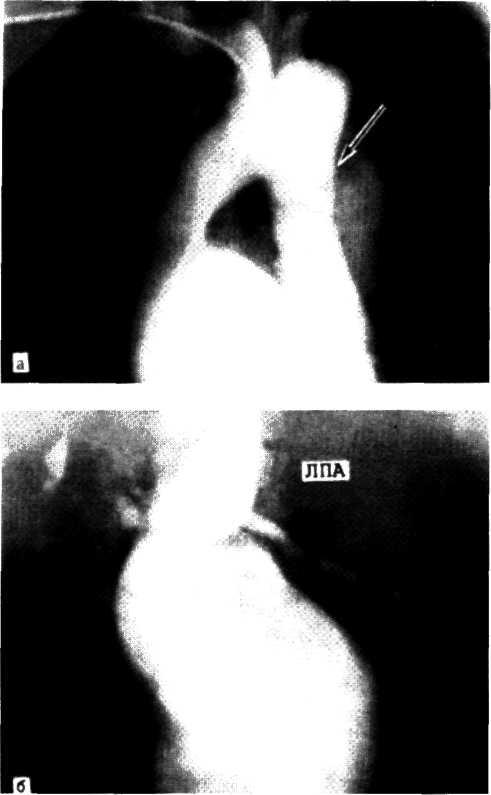
7.54. Аортограмма грудной (а) и брюшной (б) частей аорты больного с расслаивающей аневризмой нисходящей части аорты III типа по Де Бейки.
а—истинная аневризма восходящей части аорты и фенест-рация в области перешейка аорты с контрастированием двух просветов аорты (указано стрелкой); б—два просвета брюшной части аорты; левая почечная артерия (ЛПЛ) отходит от ложного просвета аорты.
аневризмы грудной и брюшной частей аорты производят одномоментно. При этом можно раздельно протезировать грудную часть аорты с целью ликвидации ложного просвета и проксимальной фенестрации, а затем произвести резекцию аневризмы брюшной части с протезированием и реваскуля-ризацией почек.
Больной Л., 33 лет, поступил в институт с жалобами на умеренные боли в межлопаточной области и в животе, наличие громадного пульсирующего образования в животе. После умеренной физической нагрузки появились сильнейшие острые боли в межлопаточной области. Больной госпитализирован с диагнозом инфаркта миокарда. Объективно при поступлении: больной астеничного телосложения, отмечаются арахнодактилия, подвывих хрусталика. АД 110/60 мм рт. ст. В брюшной полости пальпируется опухолевидное образование, болезненное, пульсирующее, размером
20 х 15 см, над которым выслушивается систолический шум. На сцинтиграмме почек — значительное снижение функции левой почки. На аортограмме видна аневризма восходящей части аорты, расслаивающая аневризма IIIB типа по Роби-чеку с отрывом устья левой почечной артерии. Диагноз: болезнь Марфана, аневризма восходящей части аорты с аортальной недостаточностью, расслаивающая аневризма нисходящей части аорты с отрывом устья левой почечной артерии (рис. 7.54).
11 декабря 1985 г. в условиях общей гипотермии (29° С) произведена радикальная ликвидация расслаивающей аневризмы грудобрюшной части аорты. Произведена торако-френолюмботомия по пятому межреберью слева с пересечением реберной дуги и переходом разреза в параректальный. Расслоение аорты начинается непосредственно дистальнее левой подключичной артерии. Диаметр аорты на протяжении 10 см равен 7 см, далее до устья верхней брыжеечной артерии — 3 см. Дистальнее верхней брыжеечной артерии видна аневризма брюшной части аорты диаметром до 17 см с отхождением левой почечной артерии и нижней брыжеечной от ложного просвета аорты. После пережатия грудной части аорты проксимальнее левой подключичной артерии и над диафрагмой вскрыты продольно истинный и ложный просветы аорты. Проксимальная фенестрация выявлена на
см дистальнее устья левой подключичной артерии. Проши ты три пары межреберных артерий. Выше места прокси мальной фенестрации в аорту вшит тефлоновый протез диаметром 25 мм и длиной 10 см. Дистальный анастомоз наложен с грудной частью аорты после ликвидации се лож ного просвета. Время пережатия грудной аорты 48 мин. Через 20 мин после пуска кровотока аорта вновь пережата между чревным стволом и верхней брыжеечной артерией. Пережаты также верхняя брыжеечная, левая почечная и ле вая подвздошная артерии. Правая почечная и правая общая подвздошная артерии после вскрытия аневризмы продоль ным разрезом окклюзированы катетерами Фолея и Фогерти. Прошиты устья трех поясничных артерий. Сначала наложен дистальный анастомоз протеза диаметром 22 мм с брюш ной частью аорты в области ее бифуркации. Непосредствен но ниже устья правой почечной артерии наложен косой проксимальный анастомоз протеза с аортой. Время пережа тия брюшной части аорты 43 мин. Все анастомозы протезов с аортой наложены без пересечения правой стенки аорты. После пуска кровотока по аорте протез пристеночно отжат и в «окно» протеза по левой его поверхности имплантирова на на площадке левая почечная артерия. Аналогично в про тез имплантирована и нижняя брыжеечная артерия. Длина протеза в абдоминальной позиции 15 см. Протезы грудной и брюшной частей аорты «окутаны» стенками аневризмати- ческих мешков. Больной экстубирован на 4-е сутки после операции. Отмечался «гладкий» послеоперационный период. Швы сняты на 12-й день после операции (рис. 7.55). Через
мес после первой операции больному успешно произведе на операция резекции веретенообразной аневризмы вос ходящей части аорты с протезированием восходящей части и аортального клапана по методу Бентала в усло виях ИК.
Результаты операций. В 1965 г. М. DeBakey проанализировал результаты операций у 179 больных. При операциях по поводу расслоения аорты I типа летальность составила 33%, II типа—29%, III типа—20%. Причем автор указывает, что удалось снизить летальность с 41 до 12% за анализируемый период. Несколько иные результаты получили A. Appelbaum и соавт. (1976): при расслоении аорты I—II типа летальность составила 23,5%, Ш типа—36,4%. В то же время, по данным G. Rheul и соавт. (1975), летальность после операций, произведенных по поводу расслаивающих аневризм III типа, составила 6,5%.
По данным G. Rheul и соавт. (1975), выживаемость больных в течение года составляет 88%.
По данным ВНЦХ, в отдаленные сроки после операции живы 80% больных.
664
7.5. ХРОНИЧЕСКАЯ ИШЕМИЯ ГОЛОВНОГО МОЗГА
Под этим термином следует понимать как очаговую, так и диффузную хроническую недостаточность артериального кровообращения головного мозга, обусловленную окклюзией магистральных ветвей дуги аорты—сонных и позвоночных артерий.
В 1908 г. японский офтальмолог М. Takayasu впервые описал характерный клинический синдром — отсутствие пульса на руках, усиленную пульсацию на ногах и сосудистые изменения на глазном дне. Первую успешную реконструктивную операцию при тромбозе внутренней сонной артерии выполнили R. Саггеа и соавт. (1951), а пластику позвоночной артерии — W. Cate и соавт. (1957). В нашей стране первые операции на плечеголовном стволе выполнили Б. В. Петровский и соавт. (1962) и В. С. Савельев и соавт. (1962).
Частота. По данным R. Kester и соавт. (1981). 13% всех летальных исходов обусловлено «мозговыми катастрофами», причем 70—80% из них связаны с последствиями ок-клюзирующих поражений ветвей дуги аорты. С возрастом частота инсульта резко возрастает: в среднем у 2 из 1000 человек ежегодно возникает инсульт, старше 55 лет—у 3,5, старше 65 лет—у 9, старше 75 лет—у 20 человек.
Этиология. Нарушение магистрального кровотока в ветвях дуги аорты может быть обусловлено врожденными и приобретенными факторами. Среди них различают аномалии развития ветвей дуги аорты, их патологическую извитость, разнообразные компрессионные повреждения, приобретенные окклюзии (атеросклероз, неспецифический аортоартериит, другие виды артериитов). В зависимости от уровня окклюзии выделяют интраторакальные, цервикаль-ные, интракраниальные и «многоэтажные» поражения.
Окклюзионное поражение внутригрудного сегмента ветвей дуги аорты носит название «синдрома дуги аорты». Существует закон Фуа, согласно которому чем дистальнее окклюзия, тем сильнее «страдает» мозг, поскольку возможности коллатерального кровообращения ограничиваются. С этой точки зрения проксимальные окклюзии носят наиболее благоприятный характер и ишемия мозга, как правило, развивается лишь при одновременном множественном поражении проксимальных ветвей дуги аорты (рис. 7.56) или при «многоэтажном» поражении одной и той же магистральной артерии. При стенозировании нескольких артерий мозга уменьшается суммарная площадь просвета артерий, снабжающих кровью мозг, снижаются возможности коллатеральной компенсации и саморегуляции церебральной гемодинамики. В результате возникает зависимость мозгового кровотока от центральной гемодинамики. Артериальная недостаточность мозга—это диспропорция между потребностями и возможностями обеспечения головного мозга кровью. Клинические проявления болезни возникают на фоне постоянной недостаточности кровоснабжения мозга при дополнительном факторе депрессии кровотока. Стенозы и окклюзии экстракраниальных артерий мозга встречаются в 2—5 раз чаще, чем интракраниальные.
Патологическая анатомия. Наиболее частым процессом, поражающим ветви дуги аорты, является атеросклероз. Он в 4 раза чаще встречается у мужчин, чем у женщин (обычно в возрасте 50—60 лет). Поражение носит обычно сегментарный характер, более частая локализация—бифуркация общей сонной артерии. Реже поражается устье безымянного
7.55. Схематическое изображение патологического процесса (а) и одномоментной ликвидации проксимальной фенестрации с протезированием всей грудной части аорты и резекцией громадного .южного аневризматического мешка брюшной части аорты с ликвидацией дисталыюй фенестрации и одновременной пластикой на площадке устья левой почечной и нижней брыжеечной артерий (б).
Через 6 мес больному произведена резекция аневризмы восходящей части аорты и протезирование аортального клапана.
ствола, подключичной артерии, общих сонных артерий, позвоночных артерий. В 20% случаев это неспецифический аортоартериит. который обычно поражает ветви дуги аорты на протяжении (общие сонные артерии поражены на всем протяжении, вплоть до бифуркации, однако внутренняя сонная артерия, первый и второй сегменты подключичной артерии проходимы). У 2, з больных аортоартериитом процесс поражает несколько ветвей дуги аорты, а также нисходящую часть аорты и ее ветви. Из редких сосудистых заболеваний следует отметить фибромускулярную дисплазию сонных артерий, которая чаще наблюдается в экстракраниальном сегменте внутренней сонной артерии, а также в позвоночных артериях.
Патологическая физиология. Для нормальной функции головного мозга необходимо, чтобы интенсивность мозгового кровотока была не менее 55 мл/(100 г-мин), т. е. не менее 55 мл крови на 100 г мозгового вещества в минуту. Снижение регионарного кровотока ниже 40 мл(100 г-мин) вызывает недостаточность кровоснабжения головного мозга. Компенсация сниженного кровотока по ветвям дуги аорты осуществляется несколькими путями: а) за счет компенсаторного увеличения кровотока по непораженным ветвям дуги аорты (так, например, при окклюзии подключичной артерии кро-
665
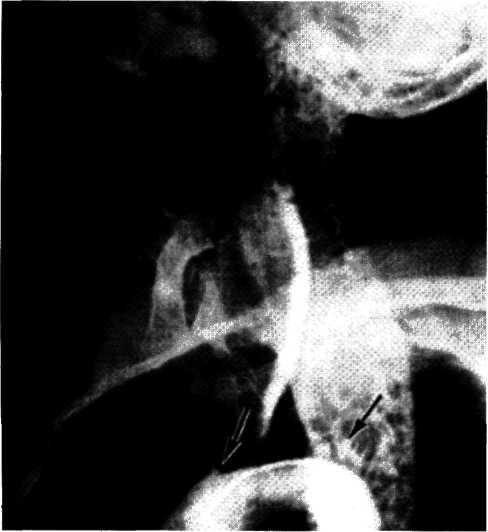
7.56. Ангиограмма больного с множественным атеросклеро-тическим стенозирующим поражением ветвей дуги аорты. Все проксимальные отделы артерий поражены («синдром дуги аорты»): окклюзия плечеголовного ствола, левой подключичной артерии, стеноз левой общей сонной артерии (указано стрелками).
воток по противоположной позвоночной артерии увеличивается на 78%, а в сонной артерии—на 23%); б) благодаря коллатералям всех четырех уровней коллатерального кровообращения мозга—экстракраниальный, артериальный круг большого мозга (виллизиев круг), анастомозы поверхности мозга и внутримозговые коллатерали; в) путем ауторегуля-ции мозгового кровотока—миогенной, метаболической, нейрогенной и нейрогуморальной.
Сужение просвета артерий, снабжающих кровью мозг, приводит к нарушению мозгового кровообращения за счет ряда процессов.
В атеросклеротической бляшке возникают распад, кро воизлияние, тромбообразование, тромбоэмболии. Тромбоз в основном распространяется в дистальном направлении, блокируя коллатеральные пути кровотока.
При стенозе артерии и повышении артериального дав ления ускоряется кровоток и происходит его временная функциональная окклюзия. При стенозировании 70—80% просвета сосуда возникает состояние неустойчивого турбу лентного кровотока, уменьшается объемный кровоток.
В постстенотических участках сосуда наблюдается рез кое замедление кровотока, приводящее к агрегации формен ных элементов крови и микроэмболиям.
Снижение артериального давления в постстенотическом отрезке артерии создает условия для развития ретроград ного кровотока в дистальных участках артерии, застоя и тромбоза.
В патогенезе расстройств мозгового кровообращения, помимо органических стенозов артерий, значительную роль
играют деформации ветвей дуги аорты—перегибы, образованные локальными органическими изменениями наружной оболочки, что почти полностью прекращает антеградный кровоток. Величина просвета в области перегиба в зависимости от поворота или положения головы и уровня артериального давления изменяется мгновенно. При повышении давления угол изгиба уменьшается, при снижении—увеличивается. При этом возможна практически остановка кровотока дистальнее перегиба. Развитие ретроградного кровотока приводит к тромбозу.
Выделяют несколько стадий хронической мозговой недостаточности.
Стадия начальных проявлений артериальной недоста точности головного мозга развивается в виде очаговых нев рологических нарушений, а также диффузной артериальной недостаточности.
Стадия субкомпенсации проявляется клинически очаго выми транзиторными ишемическими «атаками» или цереб- растенией. Преходящие нарушения мозгового кровообраще ния при наличии начальных признаков мозговой сосудистой недостаточности могут быть следствием экстрацеребраль ных факторов, вызывающих дополнительное снижение кро вотока в стенозированной артерии.
В стадии декомпенсации возможны нарушения мозго вого кровообращения в виде «малых инсультов», или про лонгированного обратимого ишемического неврологическо го дефицита, длительность очаговых расстройств при кото ром составляет 24 ч—2 нед. При этом клиника диффузной недостаточности кровоснабжения мозга соответствует тако вой при энцефалопатии средней степени выраженности. Дру гим проявлением декомпенсации могут быть прогрессирую щий «законченный инсульт» и остаточные явления после него. Этой стадии процесса при диффузном поражении соот ветствует клиническая картина выраженной энцефалопатии. Очаговая симптоматика нередко сочетается с диффузными проявлениями мозговой недостаточности.
Клиника. О начальных признаках недостаточности кровоснабжения головного мозга свидетельствуют жалобы на головную боль, головокружение, шум в ушах, ухудшение памяти, снижение работоспособности. Основанием для установления диагноза является наличие двух симптомов и более, часто повторяющихся или наблюдающихся определенный промежуток времени. Обычно симптомы недостаточности кровоснабжения головного мозга усиливаются в условиях гипоксии (например, в душном помещении) или во время работы, требующей умственного напряжения.
В стадии относительной компенсации мозгового кровотока развиваются транзиторные ишемические атаки (ТИА). Под этим термином, по решению ВОЗ, понимают остро развившееся расстройство мозгового кровообращения с быстро проходящей (до 24 ч) очаговой и (или) общемозговой симптоматикой. В вертебробазиллярном бассейне ТИА встречаются в 3 раза чаще, чем в каротидном. Это объясняется тем, что центры мозга, «реагирующие» на минимальную степень ишемии в стволовой части, расположены намного теснее, чем в полушариях, где выявляется достаточное количество «немых» участков. Ишемия каротидного бассейна в 60% случаев проявляется онемением и парестези-ями конечностей, корковыми моногемипарезами, преходящей афазией, корковой дизартрией, преходящей слепотой одного глаза, односторонним синдромом Горнера, пере-
666
крестным окулопирамидным синдромом. Клиническая картина вертебробазиллярной недостаточности более чем у 40% больных выражается в головных болях, приступах потери сознания, диплопии, системных головокружениях, нарушениях статики и походки, звоне в ушах, появлении «пелены» или «сетки» перед глазами. Реже развиваются преходящие глухота и амавроз, тотальная амнезия, двига-тельно-чувствительные альтернирующие симптомы, буль-барные нарушения, метаморфопсии, гомонимная гемианоп-сия, вегетативно-сосудистые пароксизмы. Отмечается сходство клинических проявлений у больных этой группы и перенесших инсульт с обратимым синдромом «неврологического дефицита». По данным компьютерной томографии мозга, при ТИА выявляются мелкие очаги деструкции мозговой ткани, идентичные таковым при «малых инсультах». Поэтому «граница» между ТИА и «малым инсультом» чисто временная (24 ч и 14 дней) по срокам редукции очагового неврологического синдрома.
Диффузные нарушения кровоснабжения головного мозга после стадии начальных признаков недостаточности переходят в стадию относительной компенсации—церебрастению, а затем—в энцефалопатию, для которой характерны ипохондрическое состояние, замкнутость, невозможность выполнения работы, связанной с быстрым переключением внимания. При неврологическом обследовании можно обнаружить рассеянные микросимптомы: миоз, вялость зрачковых реакций, асимметрию напряжения нижнелицевой мускулатуры, оральные рефлексы, повышение и асимметрию сухожильных рефлексов, тремор пальцев, парестезии. В стадии декомпенсации развивается выраженная энцефалопатия с нарастанием описанных симптомов, появляются расстройства интеллекта, снижение критики к своему состоянию, дизартрия в виде смазанности речи и др. Появляются симптомы ами-остатического характера, связанные с патологией экстрапирамидной системы: замедленность движений, бедность мимики, монотонная речь, а позже—мозжечковые симптомы, парезы, нарушения памяти, выраженное слабодушие, уплощение эмоций, признаки глубокой деменции. Возможны два варианта течения: с преобладанием психических нарушений и минимальной неврологической симптоматикой или с «массивной» пирамидной и экстрапирамидной недостаточностью при минимальных изменениях психики. При данной клинической форме болезни в ткани мозга морфологически обнаруживаются участки ишемически измененных нервных клеток с развитием глиоза, мелких очажков некроза и соединительнотканных рубцов. Нервная ткань приобретает вид губчатой ткани.
Стадия декомпенсации с развитием ишемических инсультов также протекает различно как до инсульта, так и после него. Инфаркт мозга может наступить на фоне бессимптомного течения стеноза ветвей дуги аорты, начальных признаков недостаточности кровообращения или же ТИА. Течение инсульта может быть острое, подострое и псевдотумороз-ное. Постинсультный период протекает с быстрым регрессом «неврологического дефицита» без ТИА или же с периодическим возникновением ТИА, а также в виде декомпенси-рованной стадии заболевания с выраженным неврологическим дефицитом на фоне ТИА или без них.
Диагностика. Необходимо детально остановиться на анамнезе больного (диабет, артериальная гипертензия, болезни сердца). Осмотр больного следует начинать с опреде-
ления пульсации обеих сонных, височных, подмышечных и лучевых артерий. При этом необходимо учитывать несколько своеобразных симптомов: а) наличие болей в лице при окклюзии внутренней сонной артерии, что обусловлено дилатацией наружной сонной артерии вблизи крылонебного узла; б) болезненность сонных артерий, что наблюдается при неспецифическом аортоартериите в стадии обострения; в) усиленная пульсация височной артерии как признак окклюзии внутренней сонной артерии. Важными являются провокационные пробы, позволяющие диагностировать различные варианты синдрома обкрадывания. Если при интенсивной работе рукой, на которой снижены пульсация лучевой артерии и артериальное давление, возникают головокружения и головные боли, следует думать о стенозе или окклюзии подключичной артерии с позвоночным стил-син-дромом. Интенсивная работа жевательной мускулатуры и появление головных болей и головокружения свидетельствуют о перетоках крови из системы внутренней сонной артерии в наружную из-за окклюзии общей сонной артерии и проходимости ее бифуркации. Аускультация ветвей дуги аорты должна включать в себя аускультацию общих сонных артерий и их бифуркаций, подключичных артерий в надключичной области и в подмышечной впадине, позвоночных артерий.
Функциональные методы исследования. Прямая сфигмография с общих сонных и височных артерий позволяет фиксировать снижение амплитуды и запаздывание вершины кривой по сравнению с контралатеральными артериями. Реоэнцефалография в типичных отведениях позволяет на основании формы волны, индекса, наличия асимметрии кровенаполнения, скорости кровотока и состояния сосудистого тонуса выявить одностороннее поражение внутренней сонной артерии. При множественных поражениях ветвей дуги аорты на реоэнцефалограмме фиксируется резкое снижение волн во всех отведениях, что характеризует диффузную ишемию мозга. Электроэнцефалография демонстративна при проведении компрессионных проб до операции и во время операции. Отсутствие появления патологических дельта- и тета-волн при пережатии сонной артерии свидетельствует о хорошей компенсации кровотока в исследуемом каротидном бассейне. Обратная картина характерна для декомпенсации коллатерального кровотока. Необходим во время операции внутренний шунт. Выявляется наиболее важная в функциональном отношении сторона поражения, что определяет показания к операции и его этапы при двустороннем стенозировании внутренних сонных артерий. Термография при одностороннем поражении сонных артерий выявляет гипотермию тканей. Ишемизиро-ванные участки практически не дают инфракрасного излучения: на черно-белых термограммах фиксируется темный фон, на цветных—синяя гамма. Ультразвуковая допплеро-графия позволяет регистрировать величину скорости импульса и направления кровотока в общих сонных и над-блоковых артериях. Уменьшение кровотока в общей сонной артерии на 30% и более по сравнению с контралатеральной свидетельствует о стенозе, а отсутствие кровотока—об окклюзии. Основным тестом являются компрессионные пробы при фиксации направления кровотока в надблоковых артериях. В норме кровоток по надблоковой артерии направлен из черепа в бассейн наружной сонной артерии. При стенозе внутренней сонной артерии он уменьшается, а при
667
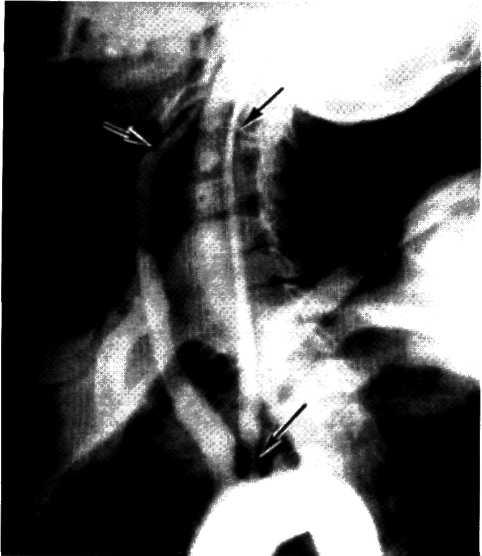
7.57. Панартериографин дуги аорты у больного с хронической мозговой сосудистой недостаточностью, произведенная по методу Сельдингера.
Видны стеноз плечеголовного ствола, окклюзия обеих подключичных артерий и резкий стеноз устья левой общей сонной артерии (указано стрелками). Помимо внутригрудного поражения ветвей дуги аорты имеется поражение обеих бифуркаций сонных артерий: стеноз внутренней артерии справа и окклюзия левой внутренней сонной артерии (указано стрелками).
резком стенозе или окклюзии приобретает ретроградное направление.
При компрессии височных и лицевых артерий эти показатели изменяются: при умеренном стенозе внутренней сонной артерии увеличивается антеградный кровоток, а при окклюзии ретроградный кровоток меняется на антеградный (за счет виллизиева круга и глазничного анастомоза). Если при компрессии ветвей наружной сонной артерии и окклюзии внутренней сонной артерии ретроградный кровоток уменьшается или исчезает, можно думать о несостоятельности передней соединительной артерии виллизиева круга. При компрессии общей сонной артерии появление антеградного кровотока с более низкой линейной скоростью свидетельствует о нормальной функции виллизиева круга. Если кровоток исчезает или становится ретроградным—виллизиев круг разомкнут, а переток крови осуществляется из противоположной наружной сонной артерии. Доплерография позволяет определять линейную скорость кровотока и его направление. Благодаря этому принципу можно выявить лишь гемодинамически значимые стенозы, т. е. более 50% просвета артерий.
Объемная скорость кровотока данным методом не определяется из-за отсутствия информации о поперечном сечении артерии.
С помощью метода ультразвуковой ангиографии можно увидеть бифуркацию сонной артерии в трех проекциях и рассчитать объемные скорости кровотока, а также получить графическое отображение профиля скорости каждые 25 м/с. Спектральный анализ звука доплерсигнала позволяет выявить стенозы бифуркации до 50% просвета сосуда.
Основным методом диагностики является рентгеноконт-растная ангиография. Методом выбора при синдроме дуги аорты является трансфеморальная пункционная ангиография по Сельдингеру (рис. 7.57). При поражении цервикаль-ного уровня ветвей дуги аорты более демонстративна селективная ангиография или пункционная каротидная ангиография. Для ангиографии позвоночных артерий показано селективное введение контрастного вещества в устье подключичных артерий. Прямая пункционная ангиография, как и селективная ангиография позвоночных артерий, не должна применяться. При получении информации о состоянии ди-стального русла артерий, снабжающих кровью головной мозг, особенно важна трактовка состояния интракраниаль-ных отделов как каротидного, так и базилярного бассейнов. При окклюзии плечеголовного ствола и левой подключичной артерии в интраторакальном сегменте необходимо сделать серию ангиограмм для получения информации о характере и выраженности синдрома «обкрадывания» головного мозга по позвоночным артериям. Большой интерес для диагностики стенотических процессов ветвей дуги аорты представляет метод дигитальной субтракционной ангиографии, позволяющий выявить с достаточной разрешающей способностью даже умеренные стенозы и патологическую извитость (рис. 7.58).
Хирургическое лечение. Применявшиеся ранее методы прямых реконструктивных операций при «синдроме дуги аорты», предусматривавшие выполнение стернотомии или то-ракотомии, в настоящее время сохранили свое значение практически только при реконструкции плечеголовного ствола. Включение антеградного кровотока непосредственно из аорты является более оправданным. При поражении других артерий в основном выполняются «операции переключения» с использованием экстраторакального доступа, что позволяет избежать в большинстве случаев протезирования. Эти операции могут проводиться у соматически и неврологически крайне тяжелых больных, а также у больных пожилого возраста. Ранее предполагая, что при «операциях переключения» может развиться «синдром обкрадывания» в бассейне «артерии донора». Однако флоуметрические исследования при имплантации подключичной артерии в сонную показали, что снижения кровотока до донорской артерии не наблюдается. Единственным условием для успешного исхода подобных операций является полная интактность «артерий донора», поскольку, например, стеноз бифуркации сонной артерии при операции имплантации в нее подключичной артерии вызывает выраженный сброс крови в систему артерий верхней конечности, в 2—3 раза превышающий норму. В связи с этим в настоящее время при изолированном поражении левой общей сонной артерии и обеих подключичных артерий в проксимальном сегменте необходимо использовать во время операции интратора-кальный доступ независимо от состояния больных. Целесообразнее рекомендовать операцию прямой имплантации «артерии реципиента» в «артерию донора» по типу конец в бок на стороне поражения.
668
Таким образом, при изолированных окклюзиях подключичных артерий предпочтительнее их имплантировать в ип-силатерально расположенную общую сонную артерию и, наоборот, при изолированных окклюзиях проксимальных сегментов общих сонных артерий—в ипсилатерально расположенные подключичные артерии. Основными условиями для осуществления прямых операций имплантаций являются изолированный и непротяженный окллюзирующий сегмент поражения «артерии реципиента» и полная интак-гность «артерии донора». «Операции переключения» выполняют с учетом ряда положений: 1) при наличии адекватных «артерий доноров», равнозначных снабжаемому кровью бассейну, предпочтение отдается артерии на ипсилатераль-ной стороне; 2) при отсутствии адекватной «артерии донора» на инсилатеральной стороне в связи с ее поражением в дистальном отделе это поражение корригируют в первую очередь, т. е. «артерия донора» должна быть подготовлена к «операции переключения». Эту подготовку можно сделать в начале «операции переключения» или одновременно с ней, но всегда перед ней; 3) при отсутствии «артерии донора» на ипсилатеральной стороне можно сделать операцию перекрестного шунтирования. Однако следует избегать объединения в один бассейн двух сонных артерий. В вынужденных ситуациях этот вариант операции не исключен. Предпочтительнее для реваскуляризации бассейна сонной артерии выбирать бассейн подключичной артерии с контралатераль-ной стороны. Для реваскуляризации бассейна подключичной артерии при необходимости перекрестного шунтирования лучше выполнить операцию подключично-подключичного или подмышечно-подмышечного шунтирования.
Методы пластики плечеголовного ствола и левой общей сонной артерии с использованием интраторакального доступа. Универсальным хирургическим доступом является срединная стернотомия. Если имеется пролонгированное поражение общих сонных артерий, то этот разрез продолжают на шею справа или слева перед грудиноключично-сосцевидной мышцей. Необходимо вскрывать перикард для широкой экспозиции восходящей части аорты. Если бифуркация ствола интактна, то при протезировании используют монопротез диаметром 10—12 мм. Аорту пристеночно отжимают по переднеправой поверхности. В стенке аорты выкраивают «окно» и в него вшивают кососрезанный протез, причем направление протеза должно быть гемодинамически адекватным—по ходу кровотока. Протез «замачивают» в крови, проверяют герметичность анастомоза, пережимают протез, снимают зажим с аорты. Пересекают плечеголовной ствол. В случае необходимости производят тромбэндартерэктомию из дисталь-ного отдела, проверяют ретроградный кровоток из сонной и подключичной артерий раздельно и накладывают дисталь-ный анастомоз протеза с бифуркацией ствола. Протез следует проводить под безымянной веной. Пускают ретроградный кровоток и проверяют герметичность анастомоза, а также удаляют воздух из протеза. Антеградный кровоток в первую очередь направляется в подключичную артерию, а затем в сонную. Аналогично производится бифуркационное протезирование правой общей сонной и подключичной артерий, а также обеих сонных артерий, если подключичная артерия не подлежит реконструкции из-за поражения на протяжении. Диаметр основной бранши бифуркационного протеза должен быть 14 мм (рис. 7.59). При окклюзии устья
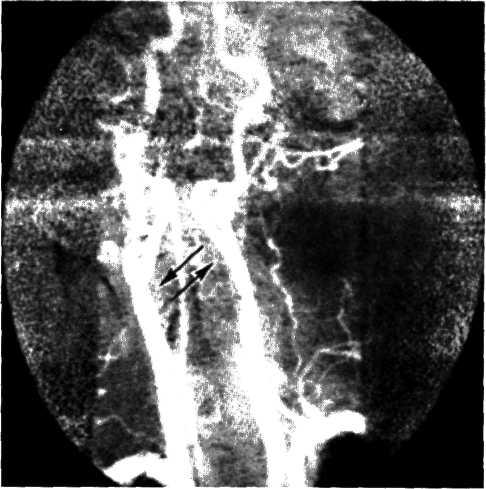
7.58. Дигитальная субтракционная ангиография ветвей дуги аорты, четко выявляющая стенозирование обеих бифуркаций сонных артерий (указано стрелками) и окклюзию левой позвоночной артерии.
общей сонной артерии ее пластику можно осуществить, используя экстраторакальный доступ.
Положение больного на спине, голова повернута в сторону, противоположную операции. На расстоянии 1 см и параллельно ключице проводится разрез, проксимальный конец которого должен заходить за грудиноключично-сосце-видную мышцу, а латеральный — до середины ключицы. Обнажаются подключичная и общая сонная артерии на протяжении. Общая сонная артерия пересекается, проксимальный ее сегмент прошивается. Проверяется адекватность ретроградного кровотока по ней, после чего артерия имплантируется в верхнюю полуокружность подключичной артерии дистальнее устья позвоночной артерии. Если натяжение артерии достаточно велико, не следует прибегать к операции прямой имплантации, а целесообразнее выполнить операцию аутовенозного или синтетического шунтирования. При окклюзии внутренней сонной артерии производится реваскуляризация наружной сонной артерии с помощью аутовены или протеза, проксимальный сегмент которого имплантируется в подключичную артерию. В подобных случаях возможна эверсионная тромбэндартерэктомия из ствола общей сонной артерии с последующей имплантацией эверсированной артерии в подключичную.
Среди всех операций на ветвях дуги аорты чаще используют каротидную тромбэндартерэктомию из бифуркации сонной артерии. В зависимости от этиологии стеноза можно сформулировать следующие показания к операции: 1) неровности контуров внутренней сонной артерии при наличии ТИА в бассейне пораженной артерии; 2) изъязвленная, по данным ангиографии, атеросклеротическая бляшка; 3) стеноз внутренней сонной артерии более 50% ее просвета; 4) стеноз внутренней сонной артерии в результате фибромуску-лярной дисплазии; 5) перегиб (кинкинг) общей или внутренней сонной артерии на стороне, где имеются неврологические симптомы поражения; 6) выраженный стеноз внутренней
669
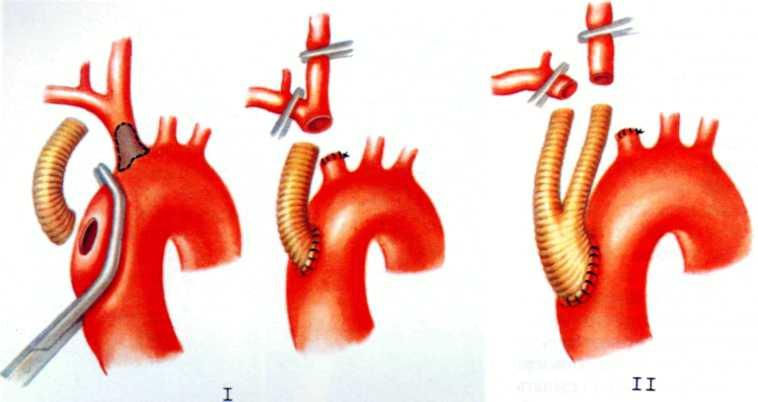
сонной артерии у больных с «законченным» инсультом и полным восстановлением неврологического дефицита.
При асимптомном течении стеноза внутренней сонной артерии операция показана в следующих случаях: 1) стеноз более 70% ее просвета при необходимости проведения общехирургической операции или операции на брюшной части аорты и ее ветвях; 2) окклюзия контралатеральной внутренней сонной артерии. Эти операции проводятся для профилактики инсульта.
Факторы риска при каротидной тромбэндар-терэктомии. Общие: стенокардия, инфаркт миокарда давностью менее 3 мес, артериальная гипертензия более 180/105 мм рт. ст.. выраженная сердечная недостаточность, хронический обструктивный процесс в легких, возраст больных старше 70 лет, ожирение; неврологические: прогрессирующий инсульт, инсульт давностью менее 2 нед, частые ежедневные ТИА, повторные ишемические инсульты; ачгиографические: стеноз внутренней сонной артерии в области сифона, обширное поражение артерии (3 см дистальнее бифуркации и 5 см проксимальнее), высоко расположенная бифуркация на уровне II шейного позвонка при короткой и толстой шее. мягкий свежий тромб на поверхности изъязвленной бляшки, окклюзия контралатеральной внутренней сонной артерии и множественные поражения ветвей дуги аорты.
В зависимости от факторов риска Т. Sundt (1975) распределил всех больных с поражением сонных артерий в области бифуркации на пять групп: 1) «неврологически стабильные» больные, у которых не выявляется каких-либо общесоматических факторов риска (в том числе на ангиограммах), имеющих односторонние или двусторонние стенозы внутренних сонных артерий с изъязвлениями; 2) «неврологически стабильные» больные, общесоматическое состояние которых хорошее, но имеются выраженные факторы риска на ангиограммах; 3) «неврологически стабильные» больные, у которых имеются или отсутствуют общесоматические факторы риска, а также выявляются значительные ангиографические изменения; 4) «неврологические нестабильные» больные при наличии или отсутствии ангиографических признаков факторов риска; 5) «неврологически нестабильные» больные с выраженными поражениями венечных артерий и нестабильной стенокардией.
В последних двух группах с наибольшей степенью риска целесообразно отложить плановую операцию по поводу
каротидной ишемии на 6 мес, избегать операций у больных 4-й групп, за исключением тех случаев, когда эта операция является операцией по жизненным показаниям; тщательно и всесторонне обследовать больных, контролировать и устранять факторы риска; проводить тщательное монито-рирование больных во время операции; в предоперационном периоде обследование обязательно должно включить в себя проведение велоэргометрии, сцинтиграфию миокарда, эхо-кардиографию, изотопную вентрикулографию и коронаро-графию.
Полезно использовать в практической работе следующий алгоритм: 1) отрицательные данные обследования состояния венечных артерий позволяют оперировать больного с поражением внутренних сонных артерий; 2) при получении данных, свидетельствующих о коронарной и сердечной недостаточности, больного следует оперировать, проводя тщательное мониторирование с введением внутриаорталь-ного баллона, контрпульсацию; 3) при умеренном поражении коронарных артерий первый этап операции—каротид-ная эндартерэктомия на фоне контрпульсации; 4) при выраженном поражении коронарных артерий вначале осуществляется аортокоронарное шунтирование.
При двусторонних поражениях бифуркации сонных артерий, когда ТИА наблюдаются на одной стороне, операцию выполняют на той стороне, где выявляется неврологическая симптоматика. Если на другой стороне стеноз сосуда превышает 50% его просвета, он ликвидируется после первой операции, но не ранее чем через 15 дней. Двухэтапные операции следует предпочитать одноэтапным двусторонним в связи с возможными осложнениями: отеком гортани, преходящими парезом подъязычного нерва и отеком мозга, тахикардией, артериальной гипертонией, обусловленными интраоперационной травмой каротидных сплетений.
Метод каротидной тромбэндартерэктомии. Кожаный разрез может быть либо продольным — вдоль гру-диноключично-сосцевидной мышцы, либо косым «косметическим» [О"Мага С. et al., 1980]. При продольном разрезе проекция бифуркации общей сонной артерии должна находиться в средней трети разреза, что можно определить на боковой ангиограмме по отношению к углу нижней челюсти. Задняя поверхность бифуркации не выделяется, что
670
сводит к минимуму опасность эмболии и предохраняет от травматизации верхний гортанный нерв.
При высоком отхождении наружной и внутренней сонных артерий кожный разрез следует заранее продлить вверх по направлению к углу нижней челюсти на 2—3 см. Общую сонную артерию выделяют на 4—5 см проксимальное бифуркации. На протяжении выделяют наружную сонную артерию и ее проксимальные ветви, а также внутреннюю сонную артерию дистальнее атеросклеротической бляшки. Бляшку пальпируют осторожно из-за опасности эмболии. Если операция производится без внутреннего шунта, то манипуляции в области бифуркации артерии начинают с субадвентициального введения в ее область новокаина или лидокаина с целью блокирования патологических рефлексов с каротидного сплетения. По возможности дистальнее сначала пережимают внутреннюю сонную артерию, затем общую и наружную сонные артерии. Артериотомию осуществляют с передней стенки общей сонной артерии по направлению к стенке внутренней сонной артерии как можно дальше от устья наружной сонной артерии, чтобы избежать пересечения сонного гломуса. Дистальный конец артериотомиче-ского разреза должен заканчиваться дистальнее бляшки. Первый этап операции — отслоение бляшки в общей, затем в наружной сонной артерии. После снятия дистального зажима с наружной сонной артерии бляшку удаляют до получения адекватного кровотока по артерии и ее ветвям.
Максимальное внимание следует уделять отслоению бляшки из просвета внутренней сонной артерии, особенно на границе ее перехода во внутреннюю оболочку сосуда. Последняя обычно фиксирована, но при ее отслоении необходима фиксация узловыми швами или непрерывным швом проленовой нитью 7/0. Обязательно удаляют циркулярные обрывки внутренней оболочки в просвете артерий. Тщательно вымывают тромбы и обрывки внутренней оболочки путем поэтапного «пуска» ретроградного кровотока из внутренней, наружной сонных артерий и антеградного кровотока из общей сонной артерии. Просвет артерии заполняют изотоническим раствором хлорида натрия с гепарином. Ар-териотомическое отверстие ушивают с дистального конца разреза проленовой нитью 6/0. Перед завершением шва снимают зажим с внутренней сонной артерии для вымывания тромбов и удаления воздуха. Шов завязывают. Пережимают внутреннюю сонную артерию и снимают зажим с наружной, после этого снимают зажим с общей сонной артерии и антеградный кровоток направляют на 10—15 с в систему наружной сонной артерии для профилактики эмболии бассейна внутренней сонной артерии (рис. 7.60). Операцию можно проводить при введении гепарина в дозе 5000 ЕД внутривенно или непосредственно в просвет сонной артерии. Ряд хирургов осуществляют все операции, обязательно вшивая аутовенозные или синтетические заплаты в артериотомическое отверстие. При использовании внутреннего шунта его удаляют таким образом: сначала центральный конец шунта из общей сонной артерии и ее пережимают, затем дистальный конец шунта из внутренней сонной артерии, которую также пережимают.
Артерию «промывают» изотоническим раствором хлорида натрия с гепарином, швы затягивают и производят «пуск» кровотока в описанном порядке.
Все реконструктивные операции на ветвях дуги аорты сопровождаются пережатием магистральных артерий и прекращением антеградного кровотока (исключение составляют случаи полной окклюзии артерии). В настоящее время основным методом «защиты» головного мозга является применение внутреннего силиконизированного шунта. Показания к применению шунта: а) ретроградное давление менее '/з от величины центрального артериального давления у больных с ТИА и менее 2/3 от центрального АД у больных с асимптомным течением процесса; б) появление й- и 9-волн на интраоперационных электроэнцефалограммах или по данным компрессированного анализа мозговой деятельности на аппарате Берга—Фурье; в) шунт показан боль-
7.60. Схематическое изображение этапов каротидной эндар-терэктомии без применения внутреннего шунта (I) и с применением внутреннего шхнта (II, III).
I—этап тщательного удаления циркулярных обрывков средней оболочки после удаления атеросклеротической бляшки, которые могут вызвать ишемический послеоперационный инсульт; II—продольная артериотомия общей сонной артерии с переходом на переднюю поверхность внутренней сонной артерии, в просвете сонной артерии виден внутренний шунт; III—под защитой головного мозга от ишемии с помощью шунта производится удаление атеросклеротической бляшки.
ным, перенесшим инсульт давностью менее 1 мес до операции, а также всем больным, которым предстоит длительная операция.
При окклюзии внутренней сонной артерии и стенозе наружной реваскуляризацию мозга можно осуществлять путем пластики последней, благодаря этому возможно компенсаторное восстановление адекватного кровотока в области ишемии (помимо артерий виллизиева круга). Расширить просвет устья наружной сонной артерии можно путем
671
а—видны соотношение поверхностной височной артерии и место трепшшционного отверстия в проекции корковой части средней мозговой артерии; б— микрососудистый анастомоз после его наложения по типу конец в бок. 1—корковая часть средней мозговой артерии; 2 — поверхностная височная артерия; 3 — область окклюзии внутренней сонной артерии.
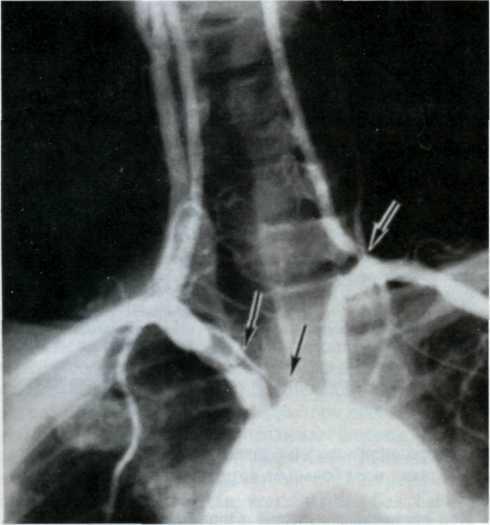
7.62. Ангиограмма больного с хронической мозговой сосудистой недостаточностью в каротидном и вертебробазилляр-ном бассейнах, обусловленной стенозом плечеголовного ствола, окклюзией левой общей сонной артерии и стенозом устья левой позвоночной артерии (указано стрелками).
аутоартериальной боковой пластики стенкой внутренней сонной артерии после тромбэндартерэктомии или аутове-нозной пластики заплатой. Данная операция является самостоятельной при реваскуляризации бассейна внутренней сонной артерии при ее окклюзии, и, кроме того, создает адекватный проксимальный приток крови в систему наружной сонной артерии при проведении экстра-интракраниального анастомоза. Микрососудистый анастомоз между поверхностной височной и средней мозговой артериями предложил невропатолог М. Fisher в 1951 г., а в 1967 г. эту операцию успешно выполнил М. Jasargil (1969). К 1981 г. в мире было сделано более 10000 подобных операций [Kester R. et al., 1981]. Возможны различные типы анастомозов: а) имплантация поверхностной височной артерии в кортикальную ветвь средней мозговой артерии; б) имплантация затылочной артерии в заднюю нижнюю мозжечковую артерию; в) аутоартериальное шунтирование (из сегмента лучевой артерии) между позвоночной и задней нижней мозжечковой артериями; г) поверхностная височная артерия имплантируется в верхнюю мозжечковую артерию.
Показания к операции: 1) окклюзия внутренней сонной артерии при неадекватности коллатерального русла; 2) недостижимый для реконструкции стеноз внутренней сонной артерии при неадекватности коллатерального русла; 3) окклюзия средней мозговой артерии со средним неврологическим дефицитом и плохими коллатералями; 4) стеноз средней мозговой артерии с неадекватными коллатералями вследствие атеросклероза, опухоли, дисплазии; 5) профилактика предполагаемой ишемии мозга после операции по по-
672
воду аневризмы внутренней сонной артерии или при осложнении каротидной тромбэндартерэктомии, закончившейся лигированием внутренней сонной артерии (рис. 7.61).
Показания и метод операции на позвоночной артерии. В изолированном виде «позвоночный синдром» встречается достаточно редко. Чаще он сочетается с «подключичным синдромом» и развивается вследствие феномена перетока крови ретроградно по позвоночной артерии сосудов верхней конечности.
В ряде случаев изолированный «позвоночный синдром» может быть обусловлен перегибом позвоночной артерии (рис. 7.62).
Среди реконструктивных операций непосредственно на позвоночной артерии следует отметить основную и наиболее распространенную операцию—трансподключичную тромбэндартерэктомию из устья позвоночной артерии. Доступ к области операции надключичный, как и при обнажении II сегмента подключичной артерии. Позвоночная артерия выделяется до входа в позвоночный канал.
После введения гепарина больному подключичную артерию пережимают проксимальнее и дистальнее устья позвоночной артерии и артерию вскрывают либо путем продольной артериотомии, либо дугообразной, окаймляющей устье позвоночной артерии (рис. 7.63). При достаточной мобилизации позвоночной артерии возможна ее умеренная эверсия. Осторожно удаляют бляшки и после получения адекватного ретроградного кровотока просвет подключичной артерии ушивают проленовой нитью 6/0. За рубежом выполняют и второй вариант операции, когда разрез переходит на стенку самой позвоночной артерии. При этом, помимо прямой тромбэндартерэктомии, осуществляют вшивание заплаты.
Результаты операций. В группе общесоматически здоровых, «неврологически стабильных» больных с односторонними и двусторонними стенозами каротидных бифуркаций летальность после операции каротидной эндартерэктомии составляет 1% [Kester R. et al., 1981]. В группе больных с множественными осложненными стенозами летальность равна 2%. Среди «неврологически стабильных» больных, но имеющих общесоматические факторы риска (ИБС, артериальная гипертония, легочные заболевания) летальность составляет 7%. В группе «неврологически нестабильных» больных летальность равна 10%. В отдаленные сроки наблюдения (от 6 мес до 13 лет) полное выздоровление или улучшение мозгового кровообращения отмечено у 92,7% больных, оперированных в асимптомной стадии, в стадии ТИА—у 96,7%, в стадии «малого инсульта»—у 88,9%, при диффузной ишемии мозга—у 55,5%.
При операциях экстра-интракраниального шунтирования, по данным R. Rodrigez и соавт. (1979), летальность минимальная, а при послеоперационной ангиографии шунты проходимы у 97% больных.
Сопоставление хирургического и лекарственного методов лечения у одних и тех же групп больных показало, что при одностороннем стенозе внутренней сонной артерии из числа больных ТИА, перенесших каротидную эндартерэктомию. через 42 мес были живы, по данным R. Kester и соавт. (1981), 81%, а после консервативного лечения—лишь 64%. При наличии синдрома «неврологического дефицита», обусловленного инсультом, через 42 мес после каротидной эндартерэктомии были живы лишь 47% больных, а после лекарственного лечения—76%. Среди больных с двусторон-
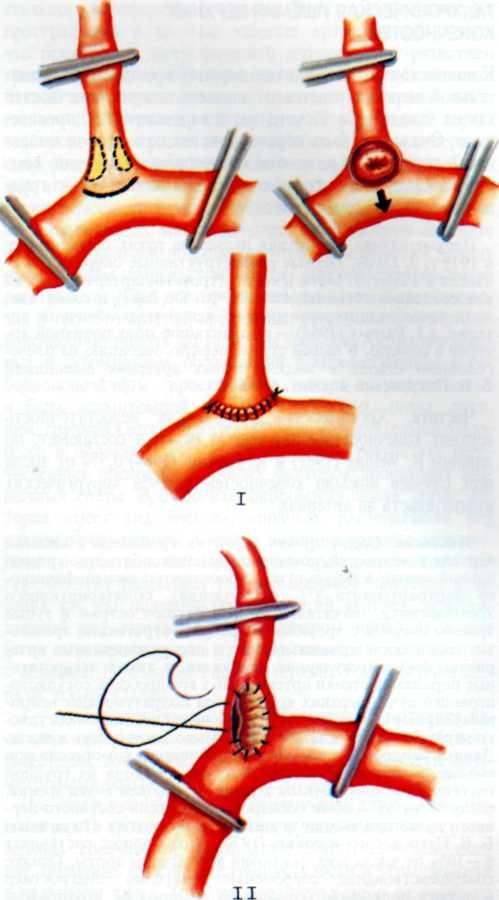
7.63. Схематическое изображение этапов тромбэндартерэктомии из устья позвоночной артерии путем чресподключич-ной эверсионной эндартерэктомии (I) и чреспозвоночной открытой продольной тромбэндартерэктомии с пластикой устья позвоночной артерии заплатой (II).
ним поражением бифуркаций каротидных артерий (наблюдалась окклюзия одной из внутренних сонных артерий) при наличии ТИА через 42 мес после эндартерэктомии были живы 56% больных, а среди лечившихся различными препаратами—49%. Хирургическое лечение больных, оперированных после инсульта, позволило сохранить жизнь через 42 мес наблюдения 24% из них, а получавшим лекарственные средства—89%.
Таким образом, у больных, перенесших инсульт и имевших большой «неврологический дефицит», при любом варианте поражения сонных артерий консервативное лечение было более эффективным, кроме того, отмечались лучшие показатели выживаемости.
673
7.6. ХРОНИЧЕСКАЯ ИШЕМИЯ ВЕРХНИХ КОНЕЧНОСТЕЙ
Клиническая картина ишемии верхних конечностей в значительной мере отличается от ишемии нижних конечностей как по этиологии и частоте, так и по клиническим проявлениям. Она может быть обусловлена окклюзией проксимальных и дистальных сегментов магистральных артерий, компрессией сосудисто-нервного пучка при выходе его из грудной клетки, болезнью Рейно.
Первые случаи отсутствия пульса на руках описаны еще в 1939 г. J. Davis. Первые реконструктивные операции произвели в 1956 г. J. Davis и соавт. (тромбэндартерэктомия из плечеголовного ствола); в 1958 г. М. De Bakey и соавт. сделали тромбэндартерэктомию из левой подключичной артерии, a I. Parroty (1964) — имплантацию подключичной артерии в сонную. В нашей стране первую операцию на плече-головном стволе и подключичных артериях выполнили Б. В. Петровский и соавт. в 1960 г.
Частота. Хроническая артериальная недостаточность верхних конечностей наблюдается редко и составляет, по данным R. Wfelling (1981) и R. Gordon (1984) 0,5% от числа всех случаев ишемии конечностей и 0,9% хирургических вмешательств на артериях.
Этнология. Среди причин развития хронической ишемии верхних конечностей, помимо поражения собственно артериальной стенки в результате атеросклероза, неспецифического аортоартериита ('/3 наблюдений), облитерирующего тромбангиита, значительную роль играют острые и тупые травмы сосудов с тромбозом артерий, ятрогенные тромбозы, хронические травматические и пострадиационные артерииты, фибромускулярная дисплазия, а также лекарственные поражения стенки артерии. Под компрессией сосудисто-нервного пучка верхних конечностей подразумевают нейро-васкулярные синдромы, обусловленные сдавлением сосудисто-нервного пучка в области шейно-подмышечного канала. Данные синдромы носят названия «синдром компрессии при выходе из грудной клетки», «синдром выхода из грудной клетки». Наиболее точным термином, с нашей точки зрения, следует считать такой: «синдром компрессии сосудисто-нервного пучка при выходе его из грудной клетки». По данным Б. В. Петровского и соавт. (1970), этот процесс составляет 8—10% от числа всех окклюзии ветвей дуги аорты. Однако совершенствование современных методов диагностики и лучшее понимание механизмов компрессии, обусловленных различными врожденными и приобретенными факторами, должно способствовать более тщательной диагностике и выявлению больных с данным синдромом.
В развитии синдромов играет роль ряд факторов врожденного, профессионального, возрастного и травматического характера. К врожденным факторам сдавления сосудисто-нервного пучка относятся: 1) особенности строения плечевого сплетения, которое образуется из верхних грудных сегментов спинного мозга, вследствие чего нижний его ствол перегибается через нормально расположенное I ребро; 2) изменения в структуре передней лестничной мышцы в месте прикрепления ее к I ребру, где она представляет собой широкое сухожилие, смещенное латерально и кзади. Если при этом медиальная ножка средней лестничной мышцы смещена кпереди в месте прикрепления к ребру, то между двумя участками прикрепления этих мышц имеется множество сухожильных пучков, создающих узкое межлестничное пространство, через которое проходит как плечевое сплетение, так и артерия; сплетение при этом как бы висит на остром плотном сухожильном образовании; 3) врожденные добавочные шейные ребра. К приобретенным факторам компрессии относятся сужение реберно-ключичного пространства вследствие искривления шейно-грудного отдела позвоночника; переломы ключицы и I ребра с образованием избыточной мозоли опухоли ключицы и мягких тканей ре-
берно-ключичного пространства; физиологическое возрастное опущение плечевого пояса, что способствует высокому расположению I ребра; травма шеи, переохлаждение, приводящее к шейному радикулиту и спазму лестничных мышц, которые как бы приподнимают I ребро; шейный остеохондроз, вызывающий постоянные ирритации со спазмом лестничных мышц и дистрофические, фиброзные изменения в них; травма грудной клетки, приводящая к дистрофическим и дегенеративным изменениям малой грудной мышцы, особенно в дистальной ее части — в области прикрепления сухожильной части к клювовидному отростку лопатки.
К профессиональным факторам компрессии относятся гипертрофия лестничных и малых грудных мышц у спортсменов и лиц физического труда; постоянное ношение тяжести на плечах с отведением плечевого пояса (ношение рюкзака), приводящее к уменьшению ключично-реберного пространства; все виды работ, связанные с необходимостью находиться длительное время с поднятыми руками (малярные, слесарные по ремонту автомобилей, преподавание).
Патологическая анатомия. Наиболее частым органическим заболеванием артерий верхних конечностей является атеросклероз, который встречается в 3 раза чаще, чем артериит. Он в основном локализуется в I внутригрудном сегменте подключичной артерии, при этом устья позвоночной артерии нередко остаются интактными. Эта особенность локализации процесса способствует лучшей компенсации сниженного артериального притока к верхним конечностям за счет ретроградного кровотока по позвоночной артерии. Ате-росклеротические бляшки могут локализоваться также в ге-модинамически ответственных сегментах магистральных артерий верхних конечностей—в области устья глубокой артерии плеча и бифуркации плечевой артерии. Для неспецифического аортоартериита наиболее характерно поражение дистальных (II—III) сегментов подключичных артерий. На основании комплекса гистологических, гистохимических и морфометрических исследований неспецифический аорто-артериит в острой стадии характеризуется деструкцией внутренней эластической мембраны и инфильтрацией наружной и средней оболочек лимфоидными и плазматическими клетками. В более поздних стадиях болезни (подострой) отмечается продуктивное воспаление. В финальной склеротической стадии отмечаются остатки внутренней эластической мембраны в зоне поражения, организация тромботических масс, васкуляризация средней оболочки. Воспалительные изменения наружной оболочки в основном обнаруживаются в местах наиболее выраженных участков стенозов. Склероз, диффузная лимфоидно-макрофагальная инфильтрация с наличием плазмоцитов отмечаются преимущественно вокруг vasa vasorum. Изменения во внутренней оболочке неоднородны. В прогрессировании процесса стенозирования важнейшую роль играет нарастание пристеночного тромбоза. Закономерным финалом поражения vasa vasorum и реактивного утолщения внутренней оболочки является превращение без-липидных бляшек в липидно-фиброзные и атероматозные вследствие гипоксии ее внутренних слоев и вторичного перерождения.
Облитерирующий тромбангшт, напротив, выявляется в основном в дистальных сегментах артерий верхних конечностей; процесс поражает артерии предплечья и кистей. Картина ишемии при этом выражена в большей степени и проявляется значительно раньше. Процесс встречается в основном у молодых мужчин, злоупотреблявших курением, он чаще носит двусторонний характер, сочетается, как правило, с поражением дистальных артерий нижних конечностей.
674
Патологическая физиология. Состояние верхних конечностей при окклюзии магистральных артерий, в частности подключичной, определяется двумя основными факторами: ишемией тканей как таковой и нарушением иннервации руки вследствие ишемии нижнешейных и верхнегрудных сегментов спинного мозга. Кровоснабжение спинного мозга осуществляется сегментарными передними и задними корешково-спинальными артериями, которые впадают в продольно идущие спинальные артерии. Бассейн подключичной артерии является основным источником кровоснабжения шейного утолщения спинного мозга. Адекватной компенсации нарушений кровообращения не происходит.
Хорошо развитые предуготовленные коллатерали магистральных артерий верхних конечностей обычно компенсируют ограничение или полное прекращение магистрального кровотока. При атеросклерозе основные коллатерали обычно не вовлечены в окклюзионный процесс, поэтому выраженная ишемия может быть обусловлена либо наличием второго (дистального) блока, либо артериоартериальной эмболией в артерии кисти или предплечья. При артериите клинические проявления обычно более выражены в связи с тем, что окклюзионный процесс имеет более дистальную локализацию с перекрытием основных коллатералей, в частности глубокой артерии плеча. Кроме того, перекрытие устьев позвоночной артерии и реберно-шейного и щитошей-ного стволов ликвидирует основные предуготовленные коллатерали. Окклюзия указанных стволов увеличивает также ишемизацию шейного утолщения спинного мозга с последующими нарушениями иннервации руки.
Большую роль играет переход воспалительного процесса на расположенные близко нервные стволы. Выраженная ишемия верхних конечностей может быть обусловлена и присоединением спастического компонента в связи с резкими нарушениями регуляции сосудистого тонуса (чаще у женщин). Окклюзия проксимального отдела подключичной артерии и плечеголовного ствола, помимо нарушения магистрального кровотока в верхних конечностях, приводит к своеобразному феномену—«феномену обкрадывания мозгового кровотока»—путем ретроградного тока крови по позвоночной артерии. При этом мозговой кровоток может снижаться на 40% [Reivich M., 1961]. При окклюзии II сегмента подключичной артерии и устья позвоночной артерии (при артериите) «синдром обкрадывания головного мозга» происходит опосредованно за счет ретромастоидального анастомоза, который образован ветвями позвоночной, затылочной артерий (ветвью наружной сонной артерии) и щито-шейным и реберно-шейным стволами. При окклюзии плечеголовного ствола возможны различные варианты «обкрадывания»: сонно-позвоночно-подключичные или позвоночно-подключичное «обкрадывание» с реверсированным кровотоком в общую сонную артерию. Патофизиология «синдрома компрессии сосудисто-нервного пучка при выходе из грудной клетки» требует специального анализа. В клинической картине могут быть три разные категории симптомов: артериальная недостаточность, венозная недостаточность и неврологическая симптоматика со стороны верхних конечностей. Эти симптомы могут комбинироваться между собой, носить острый и хронический характер.
Артериальная недостаточность имеет различный генез: первичное раздражение симпатических нервов плечевого сплетения вызывает стабильное спастическое состояние ди-
стального периферического русла. Этот стойкий спазм распространяется и на vasa vasorum артериальной стенки, что приводит к дистрофической дегенерации с развитием травматического артериита и утолщением стенок подключичной артерии, стенозом ее просвета, развитием пост-стенотического расширения артерии. Турбулентный характер кровотока, пристеночный тромбоз в артерии нередко сопровождаются либо артериально-артериальными эмболи-ями в периферическое русло, либо острым тромбозом артерии в месте прогрессирующего стеноза. Микроэмболии на первых этапах могут вызывать лишь острую ишемию отдельных пальцев, повышенную чувствительность к холоду и изменениям температуры, а также умеренные трофические расстройства. При повторных эмболиях возможны окклюзия и тромбоз артерий предплечья, острая ишемия верхних конечностей, вплоть до гангрены пальцев. Аномалия костных и сухожильных образований в межлестничном и ре-берно-ключичном пространстве может «существовать» и быть асимптомной до момента травмы плеча, руки, шеи, грудной клетки, переохлаждения, воспалительного процесса в области плечевого сплетения. В результате перечисленных предрасполагающих факторов происходит мышечный спазм. Врожденная фибромускулярная ткань, которая имеет вид «петли», «пращи», располагается под плечевым сплетением, образуя нижнюю границу межлестничного пространства. При спазме мышц происходит натяжение этих фиброзных тяжей и плечевое сплетение и артерия как бы подвешиваются на этой «петле», приобретающей вид струны. Болевой синдром приводит к еще более выраженному спазму; так замыкается порочный круг.
Клиника. В развитии ишемии верхних конечностей выделяют четыре стадии:
I—стадия компенсации кровообращения, или стадия начальных проявлений окклюзионного заболевания (зябкость, парестезии, повышенная чувствительность к холоду с вазомоторными реакциями).
II—стадия относительной компенсации, или стадия недостаточности кровообращения при функциональной нагрузке верхних конечностей (преходящие симптомы—похолодание, онемение, чувство быстрой усталости и утомляемости в пальцах и кисти, мышцах предплечья либо развитие на фоне функциональной нагрузки преходящих симптомов вер-тебробазилярной недостаточности).
III—стадия недостаточности кровообращения в верхней конечности в состоянии покоя (постоянное похолодание, боли, онемение пальцев кисти, атрофия мышц плечевого пояса, предплечья, снижение мышечной силы, потеря возможности выполнения тонких движений пальцами рук— чувство неловкости в пальцах).
IV—стадия язвенно-некротических изменений в верхних конечностях (отечность, синюшность пальцев рук, болезненные трещины, участки некрозов в области ногтевых фаланг, гангрена пальцев).
Наиболее ранним симптомом ишемии верхних конечностей являются повышенная чувствительность к низким температурам воздуха и воды, сопровождающаяся выраженными вазомоторными реакциями и болями в дистальных фалангах пальцев, скованностью их движений, неловкостью, гипофункцией при выполнении упражнений и движений. Особенностью ишемии верхних конечностей является то, что боли в покое наблюдаются реже, чем язвенно-некроти-
675
ческие изменения. Это обусловлено достаточным коллатеральным кровотоком верхних конечностей в покое и частыми микро- и макроэмболиями из проксимальных сегментов артерий в дистальные вследствие большей подвижности верхних конечностей.
Клиническая картина различных вариантов синдрома компрессии сосудисто-нервного пучка при выходе его из грудной клетки зависит от места компрессии и превалирования артериального, венозного или неврологического компонента. При самой проксимальной компрессии в межлестничном пространстве («скаленус-синдром» и «синдром добавочного шейного ребра») неврологическая симптоматика характеризуется в основном болевым синдромом. Боли локализуются в области шеи и надплечья, иррадиируют по плечевой поверхности руки, вплоть до кисти. Характер болей разнообразный: ноющие, ломящие, изредка весьма интенсивные, носящие каузалгический характер. Интенсивность болей зависит от движений шеи, головы, рук, туловища. Их иррадиация может быть самой разнообразной: кзади в лопатку, кпереди в область грудной мышцы, к сосцевидному отростку, в затылочную часть головы. Головные боли носят характер мигрени, обычно они не поддаются консервативному лечению. Наряду с болевым синдромом наблюдаются парестезии. Они носят преходящий характер, ощущаются в основном в кисти, чаще всего в области IV—V пальцев. Постепенно появляются онемение, слабость в руке, снижаются некоторые функции пальцев, больные жалуются на быструю утомляемость. Кроме того, они отмечают ряд основных признаков компрессии—нарастание симптоматики при любых движениях, сопровождающихся сокращением или напряжением шейных или плечевых мышц (работа или сон с поднятой рукой, поднятие тяжелых предметов, воздействие холодного ветра на область шеи и плеча). Только при полном физическом и эмоциональном покое (релаксация), воздействии горячих компрессов и массаже наступает облегчение. Рецидив возникает при нормальных движениях. Характерные симптомы—ограничение движений рук, головы, шеи, вегетативные расстройства (гипергидроз кожи рук, их отечность). Для добавочного шейного ребра характерны некоторые внешние конституциональные особенности: конусообразная толстая шея, утолщение ее переднезаднего диаметра, низко опущенные плечи являются как бы продолжением шеи. При компрессии сосудисто-нервного пучка в ре-берно-ключичном пространстве чаще наблюдаются отечность и боли в руке. При «синдроме малой грудной мышцы» возникают боли и парестезии по переднебоковой поверхности грудной клетки и в области лопатки, иррадиируют в плечо, предплечье, кисть, провоцируются при отведении руки.
Неврологическая симптоматика обычно превалирует в клинической картине. В поздних стадиях развивается атрофия мягких тканей предплечья и кисти, наблюдаются си-нюшность и влажность кожи кистей, трофические расстройства кожи пальцев, что также обусловлено раздражением симпатических нервов.
Диагностика. Диагноз основывается на детальном сборе жалоб, анализе характерных факторов, провоцирующих обострение, а также на осмотре больного и проведении ряда клинических проб. Особенно важны неврологические тесты: а) болезненность при перкуссии надключичной ямки, пара-цервикальных мышц и трапециевидной мышцы; б) появле-
ние выраженной болезненности и парестезии при надавливании большим пальцем руки на область плечевого сплетения; в) слабость при сжатии кисти, слабость трехглавых и межкостных мышц предплечья; г) снижение кожной чувствительности в области иннервации плечевого нерва при нормальной чувствительности кожи в области иннервации лучевого и срединного нервов. Характерен провокационный тест с поднятием рук: больной держит плечи под углом 90 е в положении отведения и наружной ротации и одновременно медленно, но регулярно сжимает и разжимает кисть в течение 3 мин. При наличии синдрома компрессии больной рано ощущает тяжесть и усталость в руке, боли в трапециевидной мышце и мышцах плеча, потерю силы в кисти, парестезии пальцев. Постепенно плечевой пояс опускается и рука падает, как плеть (до истечения 3 мин). Кроме того, при таком положении руки больной предъявляет жалобы, характерные для периода обострения болезни.
Изучение состояния сосудов заключается в определении пульсации артерий на верхних конечностях в обычном положении и при проведении специальных проб, осмотре ногтей ногтевого ложа, цвета и формы пальцев, аускультации ветвей дуги аорты. Артериальное давление на больной руке снижено на 20 мм рт. ст. и более, что является признаком стеноза артериальных сосудов. О недостаточности артериального кровотока свидетельствуют снижение или отсутствие пульсации на лучевой артерии. Обычно врачи уделяют меньше внимания окклюзиям локтевой артерии, пульсация которой не определяется на поверхности. Однако существует простой и достаточно демонстративный клинический тест для определения состояния локтевой артерии: после прижатия лучевой артерии пальцем больного просят сжимать и разжимать кисть до тех пор, пока кожа не станет бледной и не появится ощущение усталости в кисти. Двигательные упражнения прекращаются, но компрессию лучевой артерии продолжают. Если локтевая артерия проходима, то у больного быстро восстанавливается нормальная окраска кожных покровов кисти. Если имеется окклюзия в локтевой артерии, то бледность кожи сохраняется до момента декомпрессии лучевой артерии [Juergens J. et al., 1980].
Проба Эдсона позволяет выявить компрессию подключичной артерии передней лестничной мышцы: при глубоком вдохе, запрокидывании головы и наклоне ее в сторону больной руки лестничная мышца напрягается, что проявляется снижением пульсации на лучевой артерии, снижением артериального давления и появлением систолического шума в надключичной области. Диагностическая проба для выявления реберно-ключичного синдрома заключается в следующем: при отведении рук и плечевого пояса назад, смыкании рук сзади в замок или в положении по стойке «смирно» у больных появляются болезненность, парестезии, побледне-ние и ощущение усталости в руке. Аускультативно при этом в подключичной области может фиксироваться систолический шум. При «синдроме малой грудной мышцы» проводят отведение руки вертикально вверх, что вызывает снижение пульсации на лучевой артерии и артериального давления, а также появление систолического шума в подмышечной области (рис. 7.64).
Рентгенологическое обследование больного осуществляется для выявления костных аномалий: апофизомегалии VII шейного позвонка, шейных ребер II—III—IV степени, переломов ключицы, аномалий ребер. Если ранее костные
676
\ а—положительная проба при «синдроме передней лестничной мышцы» слева; 6—отрицательная проба при этом же синдроме справа; в — положительная проба при «реберно-
I ключичном синдроме» справа; г—положительная проба при
[ «синдроме малой грудной мышцы» справа.
аномалии идентифицировались с компрессионным синдромом, то в последние годы стало ясно, что отсутствие кост-шых аномалий не свидетельствует об отсутствии компрессии, так как сдавление плечевого сплетения и магистральных геосудов возможно за счет фибромускулярных тканей. Эти [аномально расположенные образования может видеть только оперирующий хирург, причем только тогда, когда целенаправленно ищет причину компрессии. Высокое стояние кребра определяется на снимках в прямой и боковых проек-Юиях. В боковых проекциях можно определить, что тело В грудного (и даже II грудного) позвонка находится выше игровня ключицы. Важными признаками являются также величина дуги I ребра в боковой проекции и величина угла Ьпочицы по отношению к горизонтальной и фронтальной проекциям.
I Функциональные методы исследования важно проводить ■ах в обычном положении рук, так и при проведении описан-■ых диагностических проб. Информативными обычно явля-■отся объемная сфигмография верхних конечностей, а также Ёльтразвуковая доплерография, с помощью которой можно
определить состояние магистральных сосудов верхних конечностей (рис. 7.65), а также провести картирование пальцевых артерий для выявления эмболизации дистального русла. Для диагностики ишемических состояний верхних конечностей важными методами являются термометрия и термография, а также тепловидение, особенно в сочетании с диагностическими пробами.
Заключительным методом диагностики является рентге-неконтрастная ангиография, которая направлена на изучение состояния как проксимального, так и дистального русла верхних конечностей. Методом выбора является трансфемо-ральная ангиография по Сельдингеру с проведением панаор-тографии дуги аорты, а затем (по показаниям) селективной артериографии подключичных артерий. Ангиография позволяет выявить уровень окклюзии, наличие ретроградного кровотока по позвоночным артериям или признаков опосредованного «стил-синдрома», состояние коллатерального кровотока, протяженности стенотического процесса, а также постстенотические аневризмы подключичных артерий, ди-стальные блоки артерий. Важной особенностью ангиографии верхних конечностей при наличии компрессионных синдромов является проведение артериографии в обычном положении руки и при диагностических пробах (рис. 7.66).
Хирургическое лечение. Показания к хирургическому лечению окклюзии артерий верхних конечностей благодаря внедрению экстраторакальных операций в настоящее время расширены. При асимптомном течении окклюзии или в ста-
677
7.65. Ультразвуковые допплерограммы верхних конечностей при окклюзии подключичной (а) и плечевой (о) артерий.
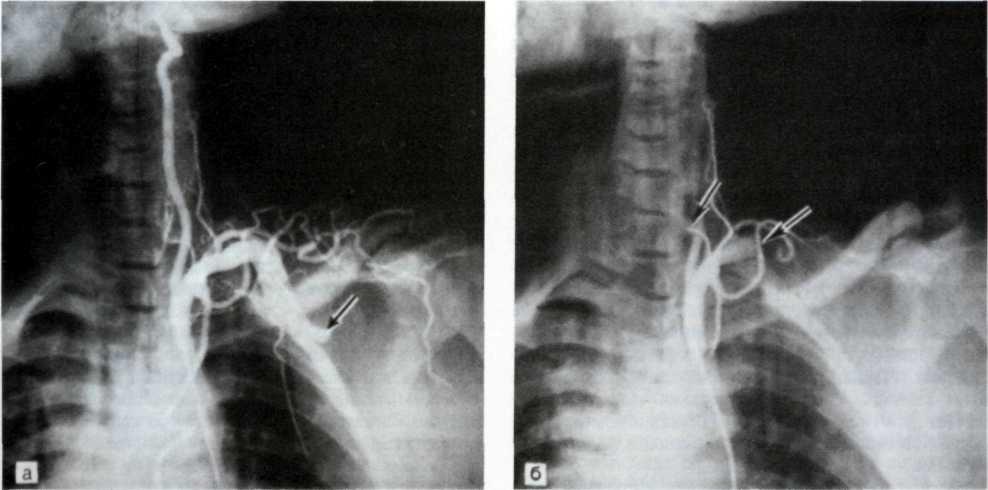
7.66. Селективные ангиограммы (а, б) больного с окклюзией левой подключичной артерии в реберно-к.почичпом пространстве с обильным развитием колштералей (стрелкой указано место тромбоза).
При проведении пробы на наличие «синдрома лестничной мышцы» (б) слева также отмечается более проксимальная окклюзия левой подкли>чич1юй артерии и одновременно окклюзия левой позвоночной артерии (указано стрелками).
678
дии начальных проявлений процесса операция показана только при наличии признаков вертебробазилярной недостаточности, обусловленной «синдромом обкрадывания». В стадии относительной компенсации операцию выполняют только в случае отсутствия каких-либо осложняющих моментов.
Реваскуляризация верхних конечностей может быть произведена с помощью ряда операций (табл. 7.3).
Таблица 7.3. Реконструктивные операции при хронической ишемии верхних конечностей
|
Вид операции |
Окклюзии подключичной артерии |
Окклюзии подмышечной, плечевой артерий и артерий предплечья |
|
Интрато- ракальные |
Пластика плечеголов-ного ствола (резекция с протезированием, тромбэндартерэкто-мия) Пластика подключичной артерии (аорто-подключичное шунтирование, резекция с протезированием, тромбэндартерэкто-мия) |
|
|
Экстраторакальные |
Резекция подключичной артерии с имплантацией в сонную Сонно-подключичное шунтирование Сонно-подкрыльцовое шунтирование Подключично-подклю-чичное перекрестное шунтирование |
Подключично-подмы-шечное шунтирование Подкрыльцовоплечевое шунтирование Плечелучевое или пле-челоктевое шунтирование Тромбэндартерэкто-мия с аутовенозной заплатой |
Описание принципов реконструкции плечеголовного ствола приведено в главе, посвященной хронической ишемии головного мозга. Для изолированной резекции первой порции левой подключичной артерии оптимальной является экстраторакальная операция имплантации левой подключичной артерии в левую общую сонную артерию, т. е. создание левого плечеголовного ствола (рис. 7.67). Кожный разрез проводят на 1 см выше ключицы и параллельно ей. Проксимальный его конец должен заходить за грудиноключично-сосцевидную мышцу, латеральный—до середины ключицы. Обнажают грудиноключично-сосцевидную мышцу, пересекают ее ключичную часть, затем обнажают и резецируют переднюю лестничную мышцу (следует помнить о диафраг-мальном нерве). Обнажают и выделяют вторую порцию подключичной артерии с ее ветвями. В проксимальном углу раны выделяют позвоночную артерию на видимом протяжении и проксимальный отдел подключичной артерии. Левую общую сонную артерию обнажают (используя тот же разрез) после отведения латерально грудиноключично-сосце-видной мышцы. Проксимальный сегмент подключичной ар-герии пережимают, пересекают и ее культю ушивают непрерывным обвивным швом. Дистальный отрезок подключичной артерии имплантируют в общую сонную артерию. Пережимают сонную артерию для измерения ретроградного
давления в ней. Если оно не ниже 60 мм рт. ст., то имплантацию подключичной артерии в сонную производят без внутреннего шунта. После внутривенного введения 5000 ЕД гепарина в латеральной стенке пережатой общей сонной артерии выкраивают «окно», куда имплантируют подключичную артерию. При необходимости перед этим из устья стенозированной позвоночной артерии производят эндар-терэктомию.
В тех случаях, когда имеется окклюзия второго сегмента подключичной артерии и имплантация невозможна, следует произвести операцию сонно-подключичного шунтирования аутовеной или протезом. При отсутствии сонной «артерии донора» на ипсилатеральной стороне можно сделать операцию перекрестного подключично-подключичного шунтирования или подмышечно-подмышечного шунтирования.
Шунтирование дистальных артерий верхних конечностей обычно производится аутовенозным трансплантатом, лучшим из которых является подкожная вена бедра. В тех случаях, когда этот трансплантат применить невозможно, используют латеральную подкожную вену другой руки или атромбогенный протез. Трансплантаты обычно проводят по ходу сосудисто-нервного пучка. Подкожно пересаживают трансплантаты реже. Для наложения анастомозов следует использовать проленовую нить 6/0. Лучший вид анастомоза—конец в бок.
Показания к лечению синдрома компрессии сосудисто-нервного пучка при выходе из грудной клетки.
Если симптомы болезни выражены слабо и состоят в преходящей парестезии и дискомфорте в руках и кистях, больному рекомендуют предохраняться от факторов внешней среды, провоцирующих обострение болезни. В ряде случаев полезно назначить анальгетики, транквилизаторы и мышечные релаксанты. Более раннее выявление синдрома компрессии и своевременно начатое лечение дают больше шансов на его успех. Рекомендуется похудеть тучным больным, часто лежать на животе со свисающими по бокам руками. Если установлен профессиональный фактор компрессии, целесообразно сменить профессию. Лекарственное лечение: витамины группы В, прозерин, галантамин, дибазол. Необходим специальный комплекс гимнастических упражнений. При безуспешности проведенного комплекса лечебных мероприятий показано хирургическое лечение. Если больной жалуется на бессонницу, снижение функции кисти, слабость в руке, ограничение профессиональной деятельности, то показано хирургическое лечение.
Наиболее распространенной операцией является трансак-силлярная резекция I ребра с резекцией передней и средней лестничных мышц, артериолизом, флеболизом и иссечением фибромускулярных тяжей между передней и средней лестничными мышцами.
Техника операции. Больной лежит на боку, ассистент поддерживает руку больного в приподнятом положении своими руками, сложенными в замок. Время от времени необходимо опускать руку больного, чтобы не создавать постоянного перерастяжения плечевого сплетения, поэтому ручное отведение руки следует предпочесть механической фиксации. Поперечный разрез делают в проекции III ребра ниже волосяной линии подмышечной впадины между передними пучками широчайшей мышцы спины и задними пучками большой грудной мышцы. Длина разреза у женщин должна быть 8—10 см, у мужчин—на 2—3 см длиннее. Следует максимально щадить переднюю ветвь межреберно-
679
I—расположение левых общей сочной и подключичной артерий; все артерии выделены, сонная артерия пережата, в «окно» предполагается имплантировать ствол левой подключичной артерии; II—создан «левый плечеголовной ствол».
7.68. Схематическое изображение этапов (I—III) операции трансаксиллярной резекции первого ребра.
I—анатомическое взаиморасположение элементов сосудисто-нервного пучка и костно-мышечного аппарата при выходе из грудной клетки; II—этап резекции передней лестничной мышцы; III—после перенесения средней лестничной мышцы производится резекция первого ребра. I — артерия; 2 — вена; 3—реберно-ключичная мышца; 4 — средняя лестничная мышца; 5 — передняя лестничная мышца; б — плечевое сплетение; 7—первое ребро.
680
плечевых нервов, так как ее травма вызывает послеоперационные боли, которые длятся несколько недель. После пересечения передней лестничной мышцы (рис. 7.68) у места прикрепления к I ребру осторожно выделяют подключичную артерию и вену, впереди которой пересекают подключичную мышцу и сухожилие. Под контролем пальцев левой руки распатором выделяют I ребро. Следует быть максимально внимательным, чтобы не повредить плечевое сплетение. После отсечения средней лестничной мышцы от задней поверхности 1/э первого ребра пересекают межреберную мышцу между I и II ребрами (не повреждая плевры), I ребро следует резецировать вместе с надкостницей максимально близко к поперечному отростку, чтобы избежать в дальнейшем сдавления плечевого сплетения на уровне тела I грудного позвонка. Переднюю лестничную мышцу следует максимально натянуть и резецировать.
Эффективность подобной операции зависит от ряда факторов: 1) устойчивый спазм передней и средней лестничной мышц устраняется при удалении I ребра; 2) в поднятом положении руки происходит компрессия сосудистого нервного пучка между I ребром и ключицей, если ребро удалено, компрессионный фактор ключицы устраняется; 3) при обычной скаленотомии лестничная мышца за счет рубцовых тканей может вновь прикрепляться к I ребру с естественным рецидивом заболевания в 60% случаев, при удалении I ребра опасность рецидива заболевания исключается; 4) после резекции I ребра хирург может видеть весь сосудисто-нервный пучок; визуальный контроль позволяет устранить все аномальные фибромускулярные тяжи.
При сопутствующей спастической артериальной недостаточности целесообразно одновременно сделать грудную симпатэктомию. В послеоперационном периоде не рекомендуется резко поднимать руку кверху. Ее можно поднять только до уровня плеча или вперед, чтобы снять напряжение мышц плечевого пояса.
Результаты операций. У больных с хорошим состоянием дистального русла адекватный артериальный кровоток восстанавливается в 85% случаев [Gordon R. et al., 1984]. Отдаленные тромбозы трансплантатов весьма редки, так же как и развитие аневризм аутовенозных трансплантатов, что доказано проведением ангиографии через 10 лет после операций [Gross W. et al., 1978]. Показатели выживаемости больных с атеросклерозом артерий верхних конечностей аналогичны таковым у больных после операций в связи с атеросклерозом нижних конечностей и составляют, по данным W. Gross и соавт. (1978), 62% в течение 5 лет. После декомпрессивных операций, по данным R. Devin и соавт. (1976), отличные и хорошие результаты отмечаются в отдаленные сроки после операции у 88% больных.
7.7. ХРОНИЧЕСКАЯ ИШЕМИЯ ОРГАНОВ ПИЩЕВАРЕНИЯ
Хроническая ишемия органов пищеварения обусловлена окклюзией висцеральных ветвей брюшной аорты и развивается в связи с дефицитом кровотока в том или ином сегменте желудочно-кишечного тракта на различных этапах пищеварения. Она начинается обычно с функциональных расстройств и приводит к органическим изменениям.
Первое сообщение об инфаркте кишечника, которому предшествовала хроническая ишемия кишечника, сделал Despre в 1834 г. Термин «angina abdominalis», сохранивший-
ся до наших дней, ввел в клиническую практику G. Bacelli (1905). Первую успешную операцию на верхней брыжеечной артерии (тромбэндартерэктомию) произвели в 1957 г. R. Shaw и соавт. (1958).
Вопрос о терминологии не устоялся до настоящего времени. Известно более 20 терминов, определяющих данный симптомокомплекс. Наиболее известными из них являются «брюшная ангина», «интестинальная ангина», «мезентсри-альная артериальная недостаточность», «хроническая ишемия кишечника», «абдоминальный ишемический синдром», «висцерально-ишемический синдром». Термин «хроническая ишемия органов пищеварения», введенный в 1974 г. Г. С. Кротовским, наиболее точно отражает суть заболевания.
Частота. Частота стенозирующих поражений висцеральных ветвей брюшной аорты, по данным вскрытий, составляет 19,2—70% [Derrick J. et al., 1958; Debray Ch. et al.. 1961 ], а по данным ангиографии,—4,1—53,5% [Minister W., 1967; Buchart-Hunsen H. et al., 1977]. Операции при этой патологии составляют лишь 2% от числа всех операций на брюшной части аорты и ее ветвях [Kieny R., 1973]. Кровоснабжение органов пищеварения осуществляется тремя непарными висцеральными ветвями брюшной части аорты (рис. 7.69): чревным стволом, верхней брыжеечной артерией и нижней брыжеечной артерией. Все три указанных самостоятельных артериальных бассейна тесно объединены между собой коллатералями. Наиболее важными из них являются чревно-брыжеечный анастомоз и межбрыжеечный анастомоз. Прямой межбрыжеечный анастомоз известен в литературе как дуга Риолана, встречающаяся в норме у 2/з людей [Moskowitz M. et al., 1964] (рис. 7.70). Важным связующим звеном верхней и нижней брыжеечных артерий является краевая, маргинальная артерия Дрюмонда. В селе-
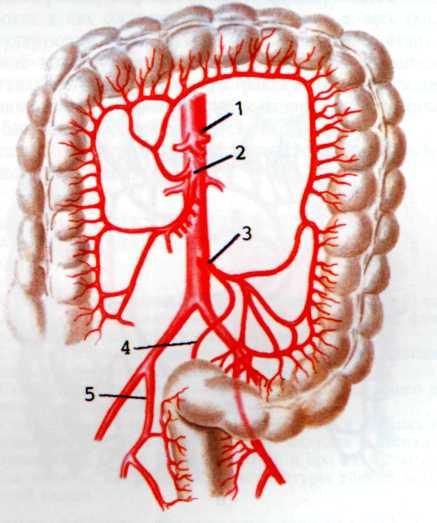
7.69. Схематическое изображение артериального кровоснабжения толстой кишки в норме.
1 — чревный ствол; 2 — верхняя брыжеечная артерия; 3 — нижняя брыжеечная артерия; 4 — верхняя артерия прямой кишки; 5 — внутренняя подвздошная артерия.
681
зеночном углу левая ободочная ветвь средней ободочной артерии из системы верхней брыжеечной артерии анастомо-зирует с левой ободочной артерией из системы нижней брыжеечной артерии. Это так называемая точка Гриффита— критический сегмент толстой кишки. У 5% людей кровоснабжение в этой точке разомкнуто, что создает предпосылки для ишемии именно селезеночного угла толстой кишки при любом снижении перфузионного давления в системе брыжеечных артерий (рис. 7.71).
Следует различать острую и хроническую ишемию органов пищеварения.
7.70. Схематическое изображение кровотока по извитой брыжеечной артерии (ИБА) в каудамном направлении (а) при окклюзии нижней брыжеечной артерии (НЕА) и в краниальном направлении (б) при окклюзии верхней брыжеечной артерии (ВБА).
Причинами острой ишемии могут быть тромбоз, эмболия, травма, лигирование висцеральных артерий, послеоперационный «синдром обкрадывания» висцерального кровотока при реваскуляризации артерий нижних конечностей, спазм или разрыв артериол в системе верхней брыжеечной артерии после резекции коарктации аорты. Причинами хронической ишемии органов пищеварения могут быть органические, функциональные и комбинированные изменения. К функциональным нарушениям следует отнести артерио-спазм, гипотензии центрального происхождения, гипогликемии, лекарственные заболевания, полицитемии. Органические изменения могут быть обусловлены внеартериальными компрессионными факторами (врожденные и приобретенные) и заболеваниями и аномалиями развития висцеральных ветвей. Врожденные компрессионные факторы: аномалии отхождения и положения артерий, серповидная связка диафрагмы, медиальные ножки диафрагмы, элементы солнечного сплетения. К приобретенным компрессионным факторам относятся опухоли, аневризмы брюшной аорты, пери-артериальный и ретроперитонеальный фиброз. Врожденные аномалии развития висцеральных ветвей: аплазия, гипоплазия артерий или самой аорты в интервисцеральном сегменте, фибромускулярная дисплазия, врожденные артериове-нозные свищи и гемангиомы. Факторами приобретенного характера являются атеросклероз, артерииты, расслаивающие аневризмы нисходящей части аорты, травматические артериовенозные свищи и аневризмы.
Патологическая анатомия. Наиболее часто висцеральные артерии поражаются атеросклерозом и неспецифическим аортоартериитом. Атеросклеротические бляшки, как правило, локализуются в проксимальных сегментах артерий. Чаще поражается самая дистальная артерия—нижняя брыже-
7.71. Схематическое изображение артериального кровоснабжения толстой кишки при окклюзии нижней брыжеечной (НЕА) и обеих внутренних подвздошных артерий (ПВПА и ЛВПА) в условиях разомкнутого кровообращения по маргинальной артерии. В данном случае в селезеночном углу толстой кишки в так называемой точке Гриффита (т. Г), возникает выраженная ишемия стенок кишки, приводящая к инфарктам этой зоны.
682
а—вид спереди; б— вид слева; ЧС—чревный ствол; НПВ — нижняя полая вена; ВБА—верхняя брыжеечная артерия; П— пищевод.
ечная. реже—чревный ствол. При неспецифическом аорто-артериите изолированных поражений висцеральных ветвей практически не бывает, они всегда поражаются вместе со средним сегментом аорты. Поражение обычно бывает более протяженным. Особого внимания заслуживает экстрава-зальная компрессия чревного ствола серповидной связкой диафрагмы. Аортальное отверстие диафрагмы образуется спереди и с боков сухожильными краями ножек диафрагмы, которые соединены серповидной связкой; сзади располагаются тела позвонков. По данным Л. В. Поташова и соавт. (1985), мышечные пучки ножек диафрагмы взаимно перекрещиваются и располагаются над чревным стволом в несколько слоев, образуя угол, открытый книзу от 10 до 90 . Сокращение ножек диафрагмы как бы низводит серповидную связку в каудальном направлении и создает временную компрессию чревного ствола при физической нагрузке или ходьбе; этим объясняется ослабление болей в положении больного на боку с согнутыми коленями (рис. 7.72).
Патологическая физиология. На долю сосудов органов брюшной полости приходится около 25% минутного объема крови. Около 1/з крови поступает при этом по печеночной артерии. Печень, таким образом, получает крови больше, чем любой другой крупный орган абдоминальной поло-
сти. Если бы все сосуды брюшной полости оказались одновременно расширенными в процессе пищеварения, то общий кровоток в них составил бы 4—5 л/мин, т. е. весь объем циркулирующей крови оказался бы в абдоминальном русле. Именно поэтому главной особенностью кровообращения в органах желудочно-кишечного тракта является последовательное участие в функциональном напряжении его различных бассейнов [Фолков Б.. Нил Э., 1976].
Различают четыре стадии развития хронической ишемии органов пищеварения.
КЛАССИФИКАЦИЯ ХРОНИЧЕСКОЙ ИШЕМИИ ОРГАНОВ ПИЩЕВАРЕНИЯ ПО СТАДИЯМ ЗАБОЛЕВАНИЯ
I. Стадия компенсации: а) бессимптомное течение; б) стадия микросимптоматики — ишемия в результате функциональной перегрузки органов пищеварения. II. Стадия субкомпенсации — ишемия вследствие функциональной нагрузки на органы пищеварения.
Стадия декомпенсации — ишемия функционального по коя органов пищеварения.
Стадия язвенно-некротических изменений в органах пи щеварения: особая популяция язв желудка и двенадца типерстной кишки [Поташов Л. В. и др., 1985], энтери ты, колиты, постинфарктные стриктуры тонкой и тол стой кишки.
Следует отметить, что стадия микросимптоматики является пограничной со стадией субкомпенсации. В этот период внимательный и детальный расспрос больного позволяет выявить ряд клинических признаков ишемии органов пищеварения, ускользающих из поля зрения. Эти
683
жалобы больные обычно связывают с «отравлениями», обильным приемом пищи и употреблением алкоголя. После пограничной стадии спорадических проявлений абдоминальных болей или дисфункции кишечника наступает стадия субкомпенсации, т. е. стадия постоянных клинических проявлений абдоминального симптомокомплекса. В этой стадии еще нет определенных клинических проявлений болезни и щадящий диетический режим, прием пищи малыми порциями избавляют больных от выраженных симптомов болезни. Нарастание циркуляторных расстройств приводит к декомпенсации кровотока в том или ином бассейне, когда после приема любой пищи и в любых количествах развивается абдоминальный синдром. Он может сохраняться и в состоянии «покоя» органов брюшной полости, что свидетельствует о развившихся органических изменениях в самих органах: гастродуоденитах, энтеритах, колитах и т.д. При этом отчетливо выявляется классический симптомокомплекс ишемии органов пищеварения: боли, дисфункция кишечника, похудание.
Анализ исследований Л. В. Поташова и соавт. (1985) показал, что при язвенных поражениях желудка и двенадцатиперстной кишки на фоне ишемии органов пищеварения отмечается снижение активности железистого эпителия желудка, что нехарактерно для обычной язвенной болезни. Установлено нарастание дегенеративно-атрофических изменений железистого эпителия одновременно с увеличением ишемии желудочной стенки. Л. В. Поташов и соавт. (1985) считают развитие язв в желудке и двенадцатиперстной кишке следствием этой ишемии и относят их к особой популяции язв. В поджелудочной железе развивается состояние дистрофической панкреатопатии.
Патоморфологические изменения в стенке кишки при хронических циркуляторных нарушениях многообразны. Во всех слоях стенки кишки выявляются дегенеративные процессы, характерные для вялотекущего энтерита с выраженной атрофией слизистой оболочки. Развивается дегенерация нервных интрамуральных образований, появляются грубые соединительнотканные элементы в подслизистом и мышечном слоях кишки. Эта структурная перестройка является компенсаторной, но очень грубые изменения влекут за собой функциональные расстройства—абсорбционную и моторную дисфункцию, которые обусловливают клинику алиментарных нарушений и энтероколитов.
Клиника. В понятие «хроническая ишемия органов пищеварения» объединены признаки ишемии трех различных.бас-сейнов: чревного ствола, верхней и нижней брыжеечных артерий. При полной изоляции этих бассейнов, по-видимому, клиническая картина ишемии каждого из них была бы более очерченной, яркой. Однако наличие единой системы висцерального кровообращения в значительной степени сме-
шивает клинику ишемии этих бассейнов, создает затруднения при проведении дифференциального диагноза за счет «синдромов обкрадывания». Тем не менее можно выделить по преимущественным клиническим проявлениям четыре формы заболевания: чревную (болевую), проксимальную брыжеечную (дисфункция тонкой кишки), дистальную брыжеечную (дисфункция толстой кишки) и смешанную.
Болевой синдром носит разнообразный характер при поражении различных висцеральных ветвей, различна и частота его (табл. 7.3').
Дисфункция кишечника—второй частый признак хронической ишемии органов пищеварения, особенно при окклюзии верхней брыжеечной артерии. Клинически она проявляется картиной динамической кишечной непроходимости: неустойчивый стул, неоформленный, жидкий, зловонный стул или мучительные поносы плохо переваренной пищей, позывы на дефекацию вскоре после еды, «капризность» аппетита, чувство переедания, ощущение дискомфорта в кишечнике, метеоризм. Проксимальная дисфункция тонкой кишки имеет три стадии: а) ишемическая функциональная энтеропатия, когда наблюдаются повышенная моторика, нарушение абсорбции и метеоризм на фоне усиленной перистальтики; б) ишемический энтерит с различными болями в животе, паралитической непроходимостью, рвотой, меленой, повышением СОЭ, лейкоцитозом, нейтрофилезом (изъязвление слизистой оболочки, отек подслизистого слоя, кровотечения); в) преходящая ишемия тонкой кишки, формирование стриктур; или мезентериальный инфаркт. Дистальная дисфункция толстой кишки также имеет три стадии развития процесса: а) функциональная ишемическая колопатия (вздутие живота, упорные запоры, овечий кал); б) ишемический колит (изъязвления слизистой оболочки, отек подслизистого слоя, кровотечения). Исходом этих процессов могут быть преходящий ишемический колит, ишемические стриктуры и гангрена толстой кишки. Трем клиническим формам поражения кишки соответствует глубина поражения ее стенки. Ишемия только слизистой оболочки приводит к обратимым процессам—энтериту и колиту, ишемия слизистой оболочки и мышечного слоя—к фиброзу, рубцеванию и стриктурам, трансмуральная ишемия—к необратимому повреждению стенки кишки с гангреной и перфорацией.
Третий классический симптом—похудание является следствием болевого синдрома и дисфункции кишечника. К нему приводят три основных фактора: а) алиментарный (из-за отказа от еды, страха перед едой и нарушений сек-реторно-абсорбционной и моторной функций кишечника); б) обезвоживание организма вследствие поносов, искусственно вызываемой рвоты, приема слабительных средств и в) болевой фактор. Н. Buchart-Hansen (1977) установил, что только у 16,6% больных диагноз хронической ишемии
Таблица 7.3'. Классификация болевого синдрома при хронической ишемии органов пищеварения
|
Форма |
Частота, % |
Источник болей |
Начало болей |
Локализация |
Характер |
|
Чревная |
76 |
Печень |
Через 15—20 мин |
Эпигастрий, правое |
Интенсивные судо- |
|
|
|
|
после приема пищи |
подреберье |
рожные |
|
Проксимальная |
40 |
Тонкая кишка |
Через 30—40 мин |
Мезогастрий |
Ноющие, тупые, |
|
брыжеечная |
|
|
после приема пищи |
|
диффузные |
|
Дистальная бры- |
8 |
Нисходящий отдел |
При дефекации |
Левая подвздошная |
Ноющие |
|
жеечная |
|
толстой кишки |
|
область |
|
684
органов пищеварения был поставлен при первом же стационарном обследовании. В остальных случаях этот диагноз был установлен лишь после повторных длительных обследований в поисках различных функциональных и органических заболеваний органов брюшной полости. Обычно больные «проделывают» до специализированного сосудистого стационара несколько вариантов обследования, чем бывает обусловлена и различная трактовка болезни: 1) длительные, повторные диагностические поиски общеизвестных незлокачественных процессов в органах пищеварения с безуспешной стандартной консервативной, санаторно-курортной терапией и тем не менее прогрессирующим течением болезни; 2) длительное обследование и нередко пробные лапарото-мии по поводу предполагаемого злокачественного новообразования органов желудочно-кишечного тракта (однако даже во время операции ревизия висцеральных артерий не производится, диагноз остается неясным); 3) детальное обследование больных, выявляющее язвенную болезнь желудка или двенадцатиперстной кишки (производится паллиативная или пластическая операция; клинический эффект операции невелик, послеоперационная клиническая картина трактуется как «пострезекцонный синдром», «агастральная астения», «демпинг-синдром», «постваготомический синдром», «язва культи желудка», «постхолецистэктомический синдром»); 4) из-за несоответствия предъявляемых жалоб и объективных данных хорошо известным заболеваниям желудочно-кишечного тракта больных причисляют к категории больных с абдоминальной формой психоневроза; 5) характерную для дистальной колопатии клиническую картину, обусловленную окклюзией нижней брыжеечной артерии, и больные, и врачи связывают с естественной инволюцией организма, старением и возрастными особенностями. Диагностика. Перечисленные характерные анамнестические данные, жалобы, признаки нарушения кровообращения в других артериальных бассейнах, а также выслушиваемый в проекции висцеральных ветвей брюшной аорты систолический шум позволяют предположить диагноз хронической ишемии органов пищеварения. Частота выявления систолического шума в проекции висцеральных артерий составляет 14—92,6% [Beger H., 1975]. Эпицентр шума при стенозе чревного ствола локализуется на 2—4 см ниже мечевидного отростка, при стенозе верхней брыжеечной артерии—на 2—3 см ниже. Шум свидетельствует о возможном поражении артерий, но его отсутствие не является поводом для исключения ишемии. Не следует прижимать плотно фонендоскоп к передней брюшной стенке, так как у истощенных больных это искусственно может вызвать появление систолического шума. Необходимо аускультировать больных в вертикальном положении и даже в положении на корточках, так как при экстравазальной компрессии в этих позициях может появиться шум в проекции чревного ствола. Алиментарные провокационные пробы основаны на тесной взаимосвязи болевого синдрома или дисфункции кишечника с приемом пищи: 1) проба Миккельсена [Mikkelsen W. et al., 1962]—в течение 1 ч больной должен выпить 1 л молока. Появление болей свидетельствует об ишемическом генезе заболевания. Проба применяется как дифференциальный тест хронической ишемии органов пищеварения и язвенной болезни желудка и двенадцатиперстной кишки; 2) проба «насильственного кормления» [Fry W. et al., 1963] основана на ежедневном приеме высококалорийной пищи (5000 ккал),
провоцирующей типичную клинику ишемии; 3) проба регулярного приема пищи обычной калорийности [Шальков Ю. Л., 1971] с исключением острых блюд (четы-рехразовое питание). Л. В. Поташов и соавт. (1985) предлагают проводить физические пробы—поднятие тяжестей, длительный физический труд в наклоненном положении (стирка белья, мытье полов), быстрая ходьба, бег, подпрыгивание на месте, велоэргометрическая проба для выявления экстравазальной компрессии чревного ствола. Существуют также лекарственные пробы, провоцирующие синдром (ва-зоспастические средства) и ликвидирующие его (вазодилата-торы).
Лабораторные методы исследования. Общепринятые биохимические методы исследования функционального состояния печени выявляют нарушение соотношения белковых фракций, снижение количества альбуминов и повышение содержания глобулинов. Повышена также плотность дифе-ниламиновой реакции (ДФА), увеличены показатели АЛТ, суммарной активности ЛДГ и 5-оксииндолуксусной кислоты в моче. Проба с а-ксилозой определяет состояние абсорбции в проксимальном отделе тонкой кишки. В дистальных отделах тощей кишки состояние абсорбции определяется методом выведения витамина Вп, меченного Со. Проба с а-ксилозой положительная у */з больных, а с витамином Вп—у 40% [Bragale G. et al., 1974]. Изучение желудочной секреции методом внутрижелудочной рН-метрии в состоянии покоя и на фоне максимальной стимуляции гистамином выявляет нарушение ощелачивающей функции привратнико-вой пещеры (угнетение функций пилорических желез у больных с поражением чревного ствола и верхней брыжеечной артерии). При гастроскопии Л. В. Поташов и соавт. (1985) отметили преобладание гастритов над дуоденитами. Частота атрофических гастритов и дуоденитов четко коррелирует со степенью стенозирования и ишемии проксимальных отделов желудочно-кишечного тракта. При атрофическом гастрите происходит перестройка желудочного эпителия, который становится похожим на кишечный. В 50% случаев обнаруживаются язвенные поражения слизистой оболочки желудка. При радиоизотопной гепатографии выявляется нарушение функции полигональных клеток у 54% больных. Ирригоскопия выявляет неравномерное распределение и фрагментацию взвеси сульфата бария, длительную задержку его в кишке, исчезновение гаустрации в стенозированных отделах кишки.
S. Schwartz и соавт. (1964) описали рентгенологические признаки ишемии стенки кишки: дефекты наполнения, вызванные отечностью слизистой оболочки и кровоизлияниями в подслизистом слое, которые напоминают «отпечатки пальцев» или «дымящую трубу». Между стенкой кишки и взвесью сульфата бария могут прослеживаться щелевид-ные участки просветления, обусловленные сегментарными спазмами и ригидностью кишки, находящейся в состоянии ишемии. Возможны сегментарные стенозы. В толстой кишке эти сегментарные стенозы выявляются в основном в селезеночном углу, в точке Гриффита. В стенозированных участках кишки исчезает гаустрация, резко замедляется опорожня-емость ее от взвеси сульфата бария. При колоноскопии обнаруживаются диффузный или сегментарный колит с избыточной продукцией слизи, атрофия слизистой оболочки и нередко полипы. Реже видны эрозии в месте перехода нисходящей кишки в сигмовидную, сегментарные стенозы
685
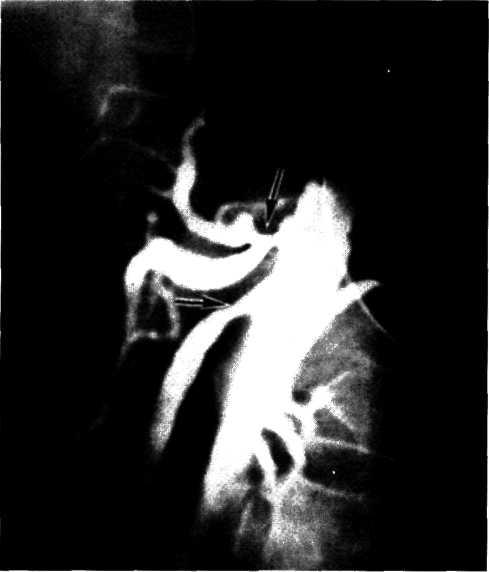
7.7S. Ангиограмма брюшной части аорты (боковая проекция) при хронической ишемии органов пищеварения вследствие атеросклеротических стенозов чревного ствола и верхней брыжеечной артерии (указано стрелками).
кишки с исчезновением гаустрации. Перифокальные изменения при эрозиях отсутствуют. При гистологическом исследовании биоптатов выявляются отек собственной пластинки слизистой оболочки, уменьшение количества крипт, развитие участков фиброза, дилатация и ангиоэктазия сосудов подслизистого слоя. Свидетельством диффузного хронического колита являются очаговые лимфоидно-клеточные инфильтраты в поверхностных слоях слизистой оболочки и подслизистого слоя. Копрологическое исследование свидетельствует о наличии в кале больных большого количества слизи, нейтрального жира, непереваренных мышечных волокон, соединительной ткани.
Заключительным и наиболее информативным методом диагностики является ангиография висцеральных ветвей. Метод выбора—трансфеморальная ангиография в двух проекциях. Селективная целиакография показана для выявления поражения трифуркации и ветвей чревного ствола. Селективная мезентерикография информативна при поражении дистального отдела верхней брыжеечной артерии, при наличии второго блока, перетоков в систему чревного ствола и нижней брыжеечной артерии. По состоянию чревно-брыжеечного анастомоза можно судить о гемодинамике в области стеноза чревного ствола. Для улучшения качества изображения провести ангиографию целесообразно, заполнив желудок газом. Для этого за 1—2 мин до исследования больной выпивает газообразующую смесь (4—5 г двууглекислой соды и 0,4—0,5 г лимонной кислоты растворяют
в 100 г воды комнатной температуры), после этого делают серию ангиограмм в двух проекциях.
Ангиографические признаки поражения висцеральных ветвей могут быть абсолютными (деформация, стенозы, окклюзии, аневризмы) (рис. 7.73) и косвенными, фиксирующими перестройку висцерального кровообращения, развитие коллатерального русла. При экстравазальной компрессии чревного ствола аорта и ее ветви обычно интактны. В боковой проекции ствол искривлен и образует угол, открытый кверху и кпереди. По переднему контуру фиксируется стеноз в виде выемки. Задний контур ствола обычно ровный. Ди-стальнее стеноза определяется постстенотическое расширение и возможен перегиб ствола, направляющегося краниаль-но. Данный вид ангиограмм характерен для компрессии чревного ствола срединной связкой диафрагмы. При сужении сосуда на протяжении можно предположить его компрессию медиальными ножками диафрагмы или нейрофиб-роматозной тканью и чревными ганглиями. Часть чревного ствола, располагающаяся проксимальнее сужения, как бы прижата к аорте, исчезает присущее ему в норме расположение параллельно верхней брыжеечной артерии. Признаки атеросклеротических стенозов, окклюзии и поражений, обусловленных неспецифическим аортоартериитом, не отличаются от таковых в других бассейнах, но при артериите обычно отмечается широкий и хорошо выраженный межбрыжеечный извитой анастомоз.
Косвенные признаки стеноза: 1) гипоконтрастирование пораженной артерии по сравнению с другими ветвями аорты; 2) компенсаторное расширение смежной коллатерали при ее интактности; 3) увеличение диаметра печеночной артерии по сравнению с диаметром селезеночной; 4) более длительное контрастирование дистальных отделов пораженной артерии; 5) расширение ветвей чревно-брыжеечного и межбрыжеечного анастомозов; 6) реверсированный кровоток по ветвям окклюзированной висцеральной артерии.
Хирургическое лечение. Показания к операции. При бессимптомном поражении висцеральных ветвей операции рекомендуются только при окклюзии в среднем или терминальном отделе аорты, вазоренальной гипертензии, поскольку нормализация артериального давления после рева-скуляризации почек или реваскуляризации нижних конечностей может привести к развитию ишемии органов пищеварения. Декомпрессия чревного ствола должна рассматриваться как профилактика ишемических гастритов, дуоденитов, хронических панкреатопатий, нарушений функции и морфологии печени [Поташов В. П. и др., 1985]. Рассматривая декомпрессию чревного ствола как патогенетическое лечение особой популяции язв желудка и двенадцатиперстной кишки ишемического генеза, мы считаем, что следует отметить новое направление в хирургии хронической ишемии органов пищеварения: если ранее оперативное лечение окклюзии висцеральных ветвей брюшной части аорты осуществлялось лишь в случаях полного исключения болезней органов пищеварения (язвы, энтериты, язвенные колиты, панкреатиты и гепатопатии), то в настоящее время установленные в результате исследований поражения магистральных сосудов, кровоснабжающих данные органы, являются показанием к реконструктивным операциям. Такой подход оправдан и логичен, так как практика гастроэнтерологии показывает, что определенный процент язвенных процессов желудка и двенадцатиперстной кишки не поддается консер-
686
вативному лечению на протяжении длительного времени. Если у данного контингента больных при ангиографии выявляется поражение висцеральных ветвей, то понятна бесперспективность консервативного лечения. Целесообразнее устранить ишемический фактор, затем на фоне восстановленного кровоснабжения попытаться провести консервативное лечение болезни и в случае неэффективности—оперативное лечение язвенной болезни желудка и двенадцатиперстной кишки.
Методы операций: 1) паллиативные; 2) операции декомпрессии чревного ствола; 3) реконструктивные.
Паллиативные операции спланхникганглионэктомии и пе-риартериальной десимпатизации выполняются при дисталь-ных формах поражения висцеральных артерий, вторичных изменениях поджелудочной железы, что основано на успешном проведении новокаиновых блокад (в случаях хронического панкреатита) в область полулунных ганглиев и больших и малых чревных нервов. Декомпрессионные операции составляют 55,7% от общего числа операций [Heberer G. et al., 1972].
Следует различать три вида таких операций: срединная лигаментотомия, круротомия, десоляризация и ликвидация различных приобретенных компрессионных факторов (удаление опухоли, аневризмы, фиброзных тяжей, резекция поджелудочной железы). Для декомпрессии чревного ствола используют два оперативных доступа: верхняя срединная лапаротомия и левосторонняя торакофренолюмботомия. Преимуществом лапаротомии является меньшая травматич-ность и возможность ревизии органов желудочно-кишечного тракта. Обязательным условием является переразгибание туловища с помощью валика на уровне мечевидного отростка. Желудок отводится вниз и влево. В бессосудистой зоне продольно рассекается печеночно-желудочная связка и вскрывается полость малого сальника. При ретроградном выделении чревного ствола обнаруживается одна из двух ветвей—печеночная или левая желудочная артерия. Их выделяют до трифуркации, рассекая нейрофиброматозные ткани, лимфатические узлы и коронарную вену желудка. Благодаря этому обнажается дистальная треть ствола. Рассечение связки—основной этап декомпрессии чревного ствола. Связка отводится от ствола, пережимается и рассекается на зажимах, а затем перевязывается. Если необходимо, то для освобождения ствола пересекается одна или обе ножки диафрагмы.
Операцию торакофренолюмботомии выполняют при глубоком расположении висцеральных ветвей и интраопераци-онных находках, требующих расширения объема операции с реконструкцией чревного ствола. При этом должна быть хорошая экспозиция для пластики. Разрез проводят по девятому межреберью от задней подмышечной до параректаль-ной линии на уровне пупка. Диафрагмотомия производится вплоть до аортального кольца. Брюшина и левая почка отводятся медиально, рассекается и резецируется левая медиальная ножка диафрагмы. Чревный ствол выделяется ан-теградно вплоть до трифуркации. При этом полностью резецируется серповидная связка диафрагмы.
Возможны три варианта реконструкции висцеральных ветвей брюшной части аорты: 1) восстановление антеградного кровотока путем тромбэндартерэктомии, резекции артерии с реплантацией в аорту или протезирования артерии ауто-грансплантатом или синтетическим протезом; 2) создание
обходных «шунтирующих» путей протока; 3) операция переключения (аортовисцеральные и артериовисцеральные анастомозы). Последняя операция выполняется редко—в случаях трудного выделения пораженных артерий и прилежащего сегмента аорты при кальцинозе или при повторных оперативных вмешательствах (аортоселезеночный анастомоз, почечно-селезеночный анастомоз, подвздошно-верхне-брыжеечный анастомоз).
Трансаортальная тромбэндартерэктомия производится при стенозировании устья чревного ствола или верхней брыжеечной артерии в проксимальном сегменте. При поражении одной из артерий можно сделать операцию из дугообразной задней аортотомии. При стенозе верхней брыжеечной артерии эта операция производится реже вследствие более протяженного участка поражения. При стенозе обеих ветвей идеальным вариантом тромбэндартерэктомии является использование при операции «люкообразного» доступа. При «люкообразном» доступе устья артерий как бы откидываются и отслоение бляшки значительно облегчается. После проверки ретроградного кровотока аортотомическое отверстие ушивается непрерывным швом проленовой нитью 4/0. Время пережатия аорты обычно не превышает 15— 20 мин. Это позволяет производить операцию в условиях нормотермии. Тромбэндартерэктомия из устья одной из висцеральных артерий может производиться при пристеночном отжатии аорты. Аналогичная операция из нескольких ветвей требует обязательного полного пережатия аорты выше и ниже реконструируемых артерий. Противопоказанием к подобным операциям являются хроническая ИБС, гипокинетический тип кровообращения, кальциноз аорты. При стенозировании ствола висцеральной артерии на протяжении наиболее адекватной операцией является резекция артерии с ее реплантацией в старое или новое устье аорты. При проксимальном поражении верхней брыжеечной артерии операцию целесообразно выполнять путем срединной лапаротомии (рис. 7.74). Артерию выделяют ниже поперечной ободочной кишки. Последняя отводится кверху и подтягивается. Благодаря этому поднимается ствол верхней брыжеечной артерии, который пересекает впереди нижнюю горизонтальную порцию двенадцатиперстной кишки. Отводят тонкую кишку вправо и рассекают задний листок брюшины над двенадцатиперстной кишкой у ее перехода в тонкую кишку. Разрез продолжают влево по нижнему краю поджелудочной железы. Мобилизуют левую почечную вену, после этого обнажают переднюю поверхность аорты. Реплантация верхней брыжеечной артерии в аорту производится в инфраре-нальном сегменте.
Пластика нижней брыжеечной артерии чаще всего производится одновременно с реконструкцией терминального сегмента аорты по поводу ее окклюзии или аневризмы. При этом оптимальным видом операции является метод реплантации устья артерии—на «венчике» из аортальной стенки. Преимуществом этой операции является то, что шов накладывается вне просвета самой нижней брыжеечной артерии. Автором этого метода является A. Carrel (1906).
При пролонгированном поражении висцеральных ветвей показана операция резекции и замещения пораженного сегмента артерии с помощью либо аутовенозного трансплантата, либо синтетического протеза. Для пластики верхней брыжеечной артерии, а также более мелких ветвей печеночной и селезеночной артерий используют шунтирующие опера-
687
688
I—полная срединная лапаротомия (намечена пунктирной линией); II—рассечение заднего листка брюшины (указано стрелкой); III—выделение аорты (Ао) и ствола верхней брыжеечной артерии (ВБА); IV—наложены оба анастомоза аутовенозного шунта между аортой и верхней брыжеечной артерией.
ции. Главным в создании адекватных аортоверхнебрыжееч-ных шунтирующих операций является наложение гемодина-мически адекватных анастомозов и исключение возможности перегибов протеза.
Результаты операций. По сводным данным G. Heberer и соавт. (1972), летальность среди оперированных 357 больных с хронической ишемией органов пищеварения была равна 6,5%. В отдельных сообщениях летальность сведена
к минимуму—2,4% [StoneyR., 1979]. В ИССХ им. А. Н. Бакулева АМН СССР при изолированной реконструкции висцеральных ветвей летальность равна нулю [Покровский А. В. и др., 1982]. Отдаленные результаты в 50—93% случаев свидетельствуют о полной ликвидации клинических проявлений абдоминальной ишемии, а в 6—22% случаев отмечается уменьшение жалоб. Неэффективность операции или частичная ликвидация проявлений хронической ишемии органов пищеварения объясняется рядом факторов: 1) отсутствием патогенетической связи поражения ветвей брюшной аорты с клиникой заболевания; 2) необратимыми органическими изменениями в органах пищеварения на фоне выраженной и длительной ишемии; 3) неадекватностью произведенной операции; 4) рестенозом или ретромбозом реконструированного сегмента артерии. Устранение этих факторов позволит улучшить результаты оперативного лечения хронической ишемии органов пищеварения.
7.8. ВАЗОРЕНАЛЬНАЯ ГИПЕРТЕНЗИЯ
Под термином «вазоренальная гипертензия» (ВРГ) подразумевают вторичную симптоматическую артериальную системную гипертензию, развивающуюся вследствие нарушения магистрального кровотока в почках без первичного поражения паренхимы и мочевыводящих путей.
Впервые о роли уменьшения кровотока в почечных артериях в патогенезе артериальной гипертензии сообщил С. В. Левашов (1884) — ученик С. П. Боткина. Первую успешную нефрэктомию по поводу ВРГ у ребенка 5 лет произвели W. Leadbetter и соавт. (1938), а реконструктивную операцию (спленоренальный анастомоз) — R. Smithwick в 1951 г. В нашей стране первую операцию по поводу ВРГ с длительным хорошим результатом осуществили А. Я. Пытель и соавт. (1961).
Частота. Вторичные хирургически излечиваемые симптоматические артериальные гипертензии распределяются следующим образом: коарктация аорты—0,1—0,2%; феохро-моцитома—0,1—0,2%; синдром Иценко—Кушинга— 0,1—0,2%; первичный альдостеронизм—0,5—3%; односторонние паренхиматозные заболевания почек—1%, вазоренальная гипертензия—5—10% [Kester R. et al., 1981].
Этнология. Нарушения магистрального почечного кровотока могут быть обусловлены врожденными (фибромуску-лярная дисплазия, врожденные артериовенозные свищи и аневризмы почечных сосудов, гипоплазия аорты и почечных артерий), а также приобретенными заболеваниями (атеросклероз, неспецифический аортоартериит, нефроптоз, инфаркт почки, отрыв устья артерии при расслоении аорты), ятрогенными повреждениями, экстравазальной компрессией. В среднем атеросклероз поражает почечные артерии в 30—83% случаев, артериит — в 8—26%, фибромускуляр-ная дисплазия—в 11—68% случаев. Другие причины более редки (4—24%) [Князев М. Д. и др., 1974; Арабидзе Г. Г. и др., 1985; Morris G. et al., 1966].
Патологическая анатомия. Фибромускулярная дисплазия относится к врожденным заболеваниям. Дефицит эластики на фоне почек и таких состояний, как беременность, нарушение эндокринного статуса, сопровождается фрагментацией внутренней эластической мембраны и разрастанием миоци-тов и соединительной ткани. Различают следующие типы процесса: 1) первичная и вторичная пролиферация внутренней оболочки; 2) дисплазия среднего слоя (гиперплазия среднего слоя, перимедиальная фиброзная дисплазия, дисплазия с образованием микроаневризм, расслоение среднего слоя); 3) субадвентициальная фиброплазия.
Морфологически важно отличать артерии! и фиброзную дисплазию, поскольку некоторые исследователи считают фибромускулярную дисплазию результатом перенесенного коллагеноза, артериита, эндартериита. Между тем артериит—воспаление, а фибромускулярная дисплазия—проявление регенерации гладкомышечных клеток.
Патологическая физиология. Сужение почечной артерии активирует юкстагломерулярный аппарат. Активация происходит двумя путями—снижение артериального давления в постстенотическом сегменте почечной артерии приводит к выделению ренина, а редуцированный кровоток в почке вызывает снижение концентрации натрия в петле нефрона, что также активирует юкстагломерулярный аппарат. Ренин превращает поступающий из печени ангиотензиноген в анги-отензин I (декапептид). Последний под воздействием конвертирующего фермента превращается в ангиотензин П.
7.75. Схематическое изображение пяти основных экспериментальных моделей вазоренальной гипертензии. а—супраренальная коарктация аорты; б—интерренальная коарктация аорты; в — стеноз обеих почечных артерий; г — стеноз одной из двух почечных артерий; д — стеноз единственной почечной артерии.
Ангиотензин II—сильный вазопрессор, который непосредственно воздействует на системные артериолы и резко увеличивает периферическое сопротивление. Опосредованно через корковое вещество надпочечников ангиотензин II приводит к гиперальдостеронизму, ретенции натрия в организме и повышению объема внеклеточной жидкости. Периферический спазм, гипернатриемия и гиперволемия вызывают артериальную гипертензию.
Одновременно конвертирующий фермент кининаза II превращает лизилбрадикинин в неактивную форму. Таким образом кининаза II реализует гипертензивный механизм почки и ликвидирует антигипертензивный механизм.
До настоящего времени мало учитывается влияние различных вариантов нарушения почечного кровотока на особенности развития вазоренальной гипертензии. При супра-ренальной коарктации аорты, стенозе аорты между устьями двух почечных артерий, одностороннем стенозе почечной артерии, двустороннем стенозе почечных артерий и при стенозе артерии единственной почки участие ренин-ангиотен-зиновой системы почек и депрессорной эндокринной системы почек будет различным (рис. 7.75). В одном случае обе почки находятся в режиме гипотензии, защищены от воздействия высокого артериального давления. Ситуация изменяется, когда одна из почек находится в режиме гипертензии (проксимальнее места коарктации). Почечный кровоток резко увеличен как за счет гипертензии, так и за счет чисто механического гемодинамического фактора. Эти условия вызывают переход почки на особый режим работы, «застав-
689
ляют» эту почку, по терминологии Ю. В. Постнова (1979), стать «почкой переключения». Высокое артериальное давление приводит к усилению диуреза с большими потерями организмом натрия. Однако почка «переключается» на новый режим работы и, несмотря на высокое артериальное давление, осуществляет экскрецию натрия и воды вполне адекватно и предохраняет организм от их потери. До развития нефросклероза и сопутствующей ему атрофии почечной паренхимы с уменьшением массы почки (первичное сморщивание) почка заметно гипертрофируется и масса ее увеличивается на 10—20%. Механизм ауторегуляции предохраняет «аппарат» фильтрации мочи от тонического сокращения приводящих артериол, обусловленного гипертензией. Не происходит нарушения проксимальной реабсорбции. Однако этот механизм не может быть абсолютным; проксимальная реабсорбция усиливается. Это и увеличивает массу почки. В петле Тепле (петля нефрона), расположенной в мозговом веществе почки, объем фильтрата мало увеличен. Однако кининпростагландиновая система подавляет реаб-сорбцию в этой петле. Экскреторный аппарат и определяет «переключение» почки: он обеспечивает нормальный объем экскреции при более высоком уровне артериального давления. Напомним, что кора почки обладает способностью ауторегуляции, а мозговое вещество не имеет такой функции. Если на фоне возникшего «переключения» почки снижается уровень артериального давления, то уже данная функционально перестроенная почка явится тем органом, который станет причиной гипертензии, отражающей целостность механизма водно-солевого гомеостаза.
При одностороннем стенозе почечной артерии причиной артериальной гипертензии являются ренопрессорные механизмы ишемизированной почки (гиперренинемия). Со временем контралатеральная (интактная) почка переключится на новый режим артериального давления и уже сама будет регулировать его уровень, поддерживая гипертензию даже в тех случаях, когда первоначальный источник гипертензии удален или реваскуляризирован. При двустороннем стенозе почечных артерий поэтапная их ликвидация приводит, как правило, к положительному эффекту операции? То же наблюдается и при адекватной реваскуляризации артерии единственной почки.
В данном разделе впервые ставится вопрос о дифференцированной оценке результатов хирургического вмешательства при различных клинических вариантах ВРГ. При указанных клинических моделях ВРГ создается различный гормональный уровень, а в ряде случаев предполагается неэффективность операции при необратимых изменениях в «почке переключения», а также возможность медленной нормализации артериального давления после адекватной реваскуляризации почки.
Клиника. В обширной литературе о вазоренальной гипертензии нарушения кровоснабжения почек не классифицируются по степени ишемии и клиническим проявлениям. Фактически сужения почечных артерий развиваются так же, как аналогичные в других артериальных бассейнах; при этом наблюдается несколько стадий: стадия компенсации (доклиническая), стадия относительной компенсации и стадия декомпенсации. Бессимптомное течение ВРГ может быть истинным, когда стеноз почечной артерии не приводит к повышению артериального давления и ложным, когда у больного имеет место «скрытая гипертензия», обусловленная пораже-
нием подключичных артерий и нисходящей части аорты или магистральных артерий нижних конечностей (табл. 7.4).
Таблица 7.4. Классификация вазоренальной гипертензии по стадиям болезни
|
|
Особенности тече- |
|
|
Стадия |
ния артериальной |
Функция почки |
|
|
гипертензии |
|
|
Компенсации |
Нормотензия |
Нормальная |
|
|
Умеренная гипер- |
|
|
|
тензия, корриги- |
|
|
|
руемая лекарст- |
|
|
|
вами |
|
|
Относительной |
Стабильная |
Умеренное снижение |
|
компенсации |
|
функции и размеров |
|
|
|
почки |
|
Декомпенсации |
Тяжелая, рефрак- |
Значительное сниже- |
|
|
терная к гипотен- |
ние функции и |
|
|
зивной терапии |
уменьшение разме- |
|
|
|
ров почки на 4 см |
|
|
Злокачественная |
Угнетение функции |
|
|
|
и уменьшение раз- |
|
|
|
меров почки на 5 см |
|
|
|
и более |
Жалобы больных можно сгруппировать следующим образом: 1) жалобы, характерные для церебральной гипертензии,—головные боли, чувство тяжести в голове, приливы к голове, шум в ушах, боли в глазных яблоках, снижение памяти, плохой сон, раздражительность, мелькание «мушек» перед глазами; 2) жалобы, связанные с перегрузкой левых отделов сердца и относительной или истинной коронарной недостаточностью—боли в области сердца, сердцебиение, одышка, чувство тяжести за грудиной; 3) чувство тяжести в поясничной области, неинтенсивные боли, гематурия в случаях инфаркта почки; 4) жалобы, характерные для ишемии других органов, магистральные артерии которых поражены одновременно с почечными артериями,—симптомы, характерные для хронической мозговой недостаточности, ишемия верхних и нижних конечностей, ишемия органов желудочно-кишечного тракта; 5) жалобы, характерные для синдрома общего воспаления (при неспецифическом аортоартериите); 6) жалобы, характерные для вторичного гиперальдостеронизма,—мышечная слабость, парестезии, приступы тетании, изогипостенурия, полиурия, полидипсия, никтурия; 7) жалобы, характерные для кризового надпочеч-никового течения артериальной гипертензии.
Рефрактерных к лекарственному лечению случаев ВРГ становится все меньше, так как появились гипотензивные препараты с выраженным антирениновым действием (кап-топрил). Наряду с этим современная комплексная патогенетическая терапия артериальной гипертензии позволила в значительной степени уменьшить число злокачественных форм течения вазоренальной гипертонии. Существуют «определяющие» и «сопутствующие» признаки злокачественности артериальной гипертензии. К «определяющим» относятся диастолическое артериальное давление 130—140 мм рт. ст., тяжелые поражения сосудов глазного дна типа ней-роретинопатии, органические изменения сосудов почек (фиб-риноидный некроз). К «сопутствующим» признакам относятся гипертоническая энцефалопатия, нарушения мозгового кровообращения, острая левожелудочковая недоста-
690
точность, почечная недостаточность. Злокачественное течение встречается в 17—20% случаев, но отмечается тенденция к уменьшению их числа. На приводимые критерии следует обратить внимание, так как в большинстве хирургических клиник за злокачественную форму гипертензии принимается рефрактерная стабильная артериальная гипер-тензия.
Для «злокачественной фазы» артериальной гипертензии типичны быстрое начало и прогрессирование всех проявлений: стойкое, не снижающееся артериальное давление, астения, бледность, отсутствие аппетита, тошнота, рвота, боли в животе, похудание. Отмечается выраженная гипертоническая энцефалопатия: резкие головные боли, неукротимая рвота, нарушения зрения, головокружения, судороги, вплоть до ступорозного коматозного состояния. Могут наблюдаться преходящие нарушения мозгового кровообращения с очаговой неврологической симптоматикой. Острая левожелудо-чковая недостаточность характеризуется выраженной одышкой, ритмом галопа, симптомами отека легких, кардиомегалией. Нарастающая почечная недостаточность сопровождается протеинурией, микро- и макрогематурией, цилиндрурией, увеличением содержания азота, мочевины и креатинина.
Диагностика. Важны следующие анамнестические данные:
развитие стабильной гипертензии у детей и подростков;
стабилизация и рефрактерность к лечению гипертензии у лиц старше 40 лет, у которых заболевание ранее протекало вполне доброкачественно, а гипотензивная терапия была эффективной, появление признаков перемежающейся хромо ты или хронической мозговой недостаточности; 3) связь на чала гипертензии с беременностью, родами (но без нефропа- тии); 4) связь начала гипертензии с инструментальными ис следованиями или манипуляциями в области почек, с операциями на брюшной аорте или почках; 5) развитие гипертензии после приступа болей в пояснице и гематурии у больных с пороком сердца, аритмиями или у больных с постинфарктным кардиосклерозом и эпизодами эмболии в других артериальных бассейнах.
При первичном осмотре больного необходимо измерить артериальное давление на руках и ногах, что позволит исключить коарктационный синдром и выявить поражения артерий верхних и нижних конечностей, а также в горизонтальном и вертикальном положении. Если в ортостатиче-ском положении оно увеличивается, то можно думать о не-фроптозе. Необходимы аускультация поверхностно расположенных артерий—сонных, подключичных и бедренных, а также пальпация всех доступных артерий—височных, сонных, подмышечных, бедренных, артерий стоп. Выслушивание шума в проекции почечных артерий и брюшной аорты производится в эпигастрии, в латеральных отделах эпигаст-рия, а также на 2 см выше пупка и на ладонь—от срединной линии живота. На этапе амбулаторного обследования больного целесообразна оценка результатов анализов мочи (сахар, белок, осадок, лейкоциты, эритроциты, соли) и анализов крови (сахар, гемоглобин, эритроциты, креатинин, мочевина, электролиты, холестерин, триглицериды, тироксин). Обязательны консультация окулиста и электрокардиографический контроль степени гипертрофии миокарда, выявление признаков коронарной недостаточности. На этапе стационарного специализированного обследования обязательно определение активности ренина в периферической венозной
крови, уровня катехоламинов в плазме и моче и альдостеро-на в моче.
В комплекс обязательных предварительных тестов включаются следующие методы диагностики: 1) функциональная урография, позволяющая улавливать при внутривенном введении контрастного вещества даже небольшие изменения функции почек на основании уменьшения продольных размеров почек на 1—1,5 см, снижения плотности фазы нефро-граммы по сравнению с контралатеральной почкой, запаздывания времени начального появления фазы урограммы на 3—4-й минуте, снижения плотности пиелограммы в первые минуты и увеличения степени контрастирования чашечек и лоханок и замедления выведения контрастного вещества из почки на 15—20-й минуте исследования; 2) радиоизотопная ренография, с помощью которой можно получить информацию о почечном кровотоке, секреции канальцевого эпителия и состояния мочевыводящих путей. При проведении гипотензивной пробы с арфонадом ренография позволяет выявить у больных с односторонним стенозом почечных артерий состояние функции контралатеральной почки и прогнозировать результаты операции; 3) сканирование почек, благодаря которому можно получить характерное для ишемии генерализованное равномерное уменьшение размеров почки при ровности наружных контуров; 4) сцинтиграфия почек, которая позволяет, помимо формы, размеров, положения и функционального состояния почек, выявить суммарный эффективный почечный кровоток. При стенозе почечной артерии кровоток в среднем составляет 376 мл/мин при норме 1226 мл/мин. Сцинтиграфия позволяет также диагностировать аномалии положения почек (нефроптоз, нефроторзию), наличие подковообразной почки. Радионук-лидная ангиография определяет среднее время циркуляции и индекс перфузии (отношение активности препарата, поступающего в почку, к суммарной активности препарата, поступающего в обе почки за определенное время). В норме среднее время циркуляции препарата от аорты до почки равно 2 с. При стенозе оно в среднем увеличивается в 5 раз; 6) рентгеноконтрастная ангиография, являющаяся заключительным методом диагностики (рис. 7.76). Большие перспективы открывает применение субтракционной ангиографии (рис. 7.77). Для увеличения информативности ангиографии возможно проведение управляемой гипотензии и селективной артериографии с введением в почку фармакологически вазоактивных препаратов (адреналин, ацетилхолин), а также рентгенокинематографии.
Изучение уровня активности ренина в венозной крови почки из периферической вены, взятой 5 раз в течение суток (6—10—14—18—22), свидетельствует о том, что содержание ренина в крови является периодической функцией. В отличие от гипертонической болезни и хронического гломеру-лонефрита при ВРГ показатели активности ренина имеют два пика—в 10 и в 22 ч [Арабидзе Г. Г. и др., 1981 ]; Поэтому в клинической практике можно заменить катетеризацию почечных вен троекратным определением содержания ренина в периферической венозной крови: в 6—10 ч и 22 ч. Вшерренинная форма ВРГ встречается лишь в */э случаев, наряду с этим в клинике наблюдаются случаи норморенин-ной и гипоренинной ВРГ. Ориентируясь на клинические модели ВРГ, следует считать, что при модели «две почки— один стеноз» чаще можно ожидать гиперренинемию, при модели «две почки—два стеноза»—норморенинемию,
697

7.76. Ангиограмма больной с атеросклеротической аневризмой инфраренального сегмента брюшной части аорты, стенозом правой почечной артерии и подвздошных артерий (указано стрелками).

7.77. Дигитальная субтракционная аортография больной с вазоренальной гипертензией.
Четко фиксируются атеросклеротический стеноз левой почечной и тубулярное поражение правой почечной артерий.
а при модели «одна почка—один стеноз»—гипорени-| немию.
Показания к операции. В настоящее время вопрос о пока-] заниях к операции при ВРГ в значительной мере изменился. | Это связано с появлением новых гипотензивных препаратов! и внедрением в клиническую практику метода баллонной] дилатации почечных артерий.
Однако лекарственная терапия, даже достаточно успеш-1 ная, не снимает остроты вопроса, поскольку снижение уровня артериального давления при стенозе почечной артерии] для почки нефизиологично. Оно приводит к декомпенсации I кровообращения в ней и сморщиванию. Таким образом, -длительное лекарственное лечение проводят только в случаях заболевания в пожилом возрасте и при системном поражении артериального русла, включая коронарное. Баллонная дилатация—метод перспективный, но в настоящее время еще трудно предсказать его истинную эффективность. Однако этот метод может быть хорошим диагностическим критерием последующей операции: если после адекватной. ■ дилатации происходит даже временная нормализация артериального давления, можно с уверенностью говорить о прямой зависимости стеноз почечной артерии—артериальная гипертензия.
Противопоказания к операции: двустороннее протяженное поражение почечных артерий, сморщивание обеих почек, общехирургические противопоказания, острый инфаркт миокарда (до 6 мес), инсульт с выраженным синдромом «неврологического дефицита» и терминальная стадия почечной недостаточности.
Показания к транслюминальной баллонной дилатации стенозов почечных артерий: 1) устойчивая к терапии артериальная гипертензия у больных старше 60 лет с ангиографи-чески выявленными стенозами почечных артерий; 2) факторы риска у больных (стеноз сонных, коронарных артерий, сердечная недостаточность, легочная недостаточность); 3) почечная недостаточность, обусловленная стенозами почечных артерий; 4) рестенозы почечных артерий после их реваскуляризации или трансплантации почек; 5) как диагностическая процедура для выяснения зависимости стеноза почечной артерии и артериальной гипертензии.
Методика. Трансфеморальная катетеризация брюшной аорты по Селдингеру с помощью катетера Эдиана—Леди-на. Измерение АД в аорте и почечной артерии дистальнее стеноза. Проведение специального проводника с тефлоно-вым покрытием по катетеру. Удаление катетера. Введение по проводнику специального баллонного катетера. Удаление проводника. Введение в почечную артерию 10000 ЕД гепарина, а также нитроглицерина для ее дилатации. Первое раздувание баллона рентгеноконтрастным веществом при давлении не более 2—3 атм, повторное раздувание—4 атм при фиброзной дисплазии и 5,5 атм при атеросклерозе. Ди-латацию производят в течение 10—15 с. Контрольное определение градиента и контрольная ангиограмма.
Механизм процедуры, по данным P. Block и соавт. (1980), заключается в том, что в результате дилатации возникают десквамация эндотелия, частичные разрывы бляшек, отрывы и смещение поверхностных слоев артерии. Предполагают также, что происходят уплотнение атеросклеротической бляшки и ее уплощение. Позднее происходит лизис пристеночных тромбов и реконструированный сегмент становится гладким. Подготовка к процедуре включает медикаментоз-
692
ный контроль АД, лечение антиагрегантами, а после процедуры рекомендуется введение гепарина в течение 4 дней с последующим переходом на непрямые антикоагулянты.
По данным Griintzig и соавт. (1984), процедура оказалась эффективной у 90% больных. Возможные осложнения: расслоения, перфорация, разрыв, тромбоз почечных артерий, острая почечная недостаточность. В связи с этим перед процедурой необходимо получить согласие больного на срочную операцию и возможное удаление почки. Процедуру можно производить только при наличии свободной экстренной операционной и бригады ангиохирургов.
Хирургические доступы к почечным артериям. В настоящее время используют два наиболее удобных доступа: боковую торакофренолюмботомию и срединную лапаротомию. То-ракофренолюмботомия показана при односторонних поражениях почечных артерий, особенно во II—III сегментах, при поражении ветвей почечных артерий, при одновременном поражении среднего сегмента аорты и висцеральных ветвей. Лапаротомия рекомендуется при одновременной реконструкции терминального отдела аорты и одномоментной пластике обеих почечных артерий.
В настоящее время основными операциями для пластики почечных артерий являются: 1) резекция артерии с реплантацией в аорту, резекция с анастомозом конец в конец или трансаортальная эндартерэктомия; 2) аутопластика почечных артерий свободными трансплантатами или путем спле-норенального анастомоза слева; 3) пластика синтетическими антитромбогенными протезами.
Реплантация (или реимплантация) почечной артерии в аорту может быть проведена не только после резекции первого сегмента артерии, но и при резекции третьего сегмента при тубулярном поражении всего проксимального участка. Главное для успеха операции—радикальное иссечение пораженного участка артерии. В таких случаях необходима мобилизация почки вместе с капсулой. Артерия пересекается косо и накладывается широкий косой анастомоз с окном в аорте. Следует накладывать анастомоз так, чтобы кровоток по артерии был гемодинамически адекватным. Задняя от оператора полуокружность анастомоза накладывается «на расстоянии» проленовой нитью 5/0, и лишь затем после приведения почки к аорте шов затягивается и циркулярным обвивным швом заканчивается передняя к оператору стенка анастомоза. Операция резекции артерии с анастомозом конец в конец показана при интактности устья артерии и ее бифуркации. Анастомоз при этом должен быть косым. При поражении ветвей почечной артерии можно сделать пластику почечной артерии по методу, разработанному в отделении сосудистой хирургии ИССХ им. А. Н. Бакулева АМН СССР.
Трансаортальная эверсионная эндартерэктомия, производимая отечественными хирургами из торакофренолюмбото-мии, имеет ряд преимуществ перед применяемыми за рубежом методами эндартерэктомии из продольных и поперечных аортотомий, а также перед трансартериальной эндартерэктомией с заплатой. Основные из этих преимуществ: широкий доступ; возможность удаления атеросклеро-тической бляшки, начинающейся в стенке аорты, и эверсии почечной артерии в связи с подвижностью почки, а также наложение шва вне пределов почечной артерии. Аорту пристеночно отжимают с таким расчетом, чтобы был сохранен
кровоток в аорте. По заднебоковой поверхности аорты производят дугообразную аортотомию, окаймляющую устье почечной артерии. Если бляшка начинается в аорте, то этот разрез лучше делать на расстоянии 6 мм от устья почечной артерии; если бляшка локализуется в первом сегменте почечной артерии, то разрез стенки аорты должен быть ближе к устью—на расстоянии 3—4 мм. После отделения бляшки от подлежащих слоев лопаточкой ассистент подает почку по направлению к оператору, артерию выворачивают и бляшку удаляют на глаз до тех пор, пока она не перейдет в интакт-ный участок интимы. После бужирования и проверки ретроградного кровотока из почки артерию промывают изотоническим раствором хлорида натрия с гепарином, удаляют минимальные обрывки интимы и аортотомическое отверстие ушивают однорядным непрерывным швом (пролен 4/0—5/0). 1ерметичность шва проверяют при давлении 170—180 мм рт. ст., что достигается путем пережатия аорты в инфраренальном отделе.
Для аутоаортальной пластики используют внутреннюю подвздошную артерию (если нужно, то с ветвями), глубокую артерию бедра, свободный сегмент селезеночной артерии, для аутовенозной пластики—чаще всего подкожную вену бедра. Однако опыт показывает, что в отдаленные сроки после операции у 6—10% больных развиваются дилатация и аневризма аутовенозного трансплантата, причинами которых являются мощный кровоток в почках, исходный или возникший в отдаленные сроки после операции стеноз анастомозов, забор исходно варикозно-расширенного трансплантата, а также грубые манипуляции с аутовеной, в частности ее избыточная гидравлическая дилатация. При аорто-ренальном шунтировании его ход и направление играют важную роль: проксимальный сегмент трансплантата должен лежать по ходу кровотока.
При двустороннем поражении почечных артерий и висцеральных ветвей мы применяем метод ретроаортального выделения правой почечной артерии путем левостороннего доступа (разработан в институте) и люкообразную аортотомию, позволяющую производить адекватную тромбэндар-терэктомию из аорты и всех перечисленных ветвей аорты (рис. 7.78).
Число нефрэктомий при хирургическом лечении вазоре-нальной гипертензии составляет 16—20%, что объясняется либо невозможностью, либо нецелесообразностью пластических операций.
В последние годы лечение больных с поражением почечных артерий в значительной степени видоизменилось в основном благодаря применению баллонной ангиопластики и стентирования почечных артерий как эффективного метода реваскуляризации почек. Особенно ценна ангиопластика у пожилых больных, больных молодого возраста с поражением ветвей почечной артерии, больных с почечной недостаточностью. Ангиопластика наиболее показана при атероск-леротических стенозах, не локализующихся в области устья почечной артерии, и фиброзной дисплазии магистрального ствола почечной артерии. При атеросклеротических стенозах устья почечной артерии предпочтительнее хирургическое лечение, которое также более эффективно у больных с поражением ветвей почечной артерии, при аневризмах почечных артерий, окклюзиях и рестенозах после ангиопластики. Наилучшие результаты наблюдаются в тех клиниках, где тактика хирургического и рентгенохирургического методов но-
693
7.7$. Схематическое изображение этапов (I—IV) тромбэнд-артерэктомии из аорты и ее абдоминальных ветвей из люко-образного аортотомического разреза.
Мобилизация брюшной части аорты путем перевязки поясничных артерий с целью адекватной мобилизации правой почечной артерии из левостороннего доступа.
сит четко дифференцированный характер, применяют их по строгим показаниям и не на конкурирующей основе [Новик Э., 1994].
Результаты операций. За последние годы значительно улучшены результаты операций на почечных артериях. Летальность при изолированных реконструкциях почечных артерий равна нулю, при сочетанных реконструкциях (одновременно с брюшной аортой) летальность, по данным R. Dean и соавт. (1984), составляет 6%. В кооперативном исследовании отдаленных результатов двух учреждений— ВКНЦ и ИССХ им. А. Н. Бакулева АМН СССР [Шхваца-бая И. К., Арабидзе Г. Г., Спиридонов А. А., 1985]—положительные результаты операций при атеросклерозе наблюдались у 62% больных и 73%—при фибромускулярной дисплазии.
По сводным данным A. Novick (1994), хирургическое лечение больных (523) с атеросклеротическим стенозом почечных артерий в 26% привело к излечению, в 64%—к улучшению и в 10% случаев оказалось неэффективным. По тем же данным, ангиопластика (391 случай) привела к излечению в 28% случаев, к улучшению—в 49%; отсутствие эффекта отмечено в 23% случаев. Значительно лучше результаты при ангиопластике стенозов почечных артерий, обусловленных
фиброзной дисплазией: у 50% больных наступило выздоровление, у 42%—улучшение, у 9%—эффекта не отмечено.
Проблема стентирования почечных артерий при стенозах устьев почечных артерий до настоящего времени не решена. При изучении отдаленных результатов установки стентов Пальмаца С. R. Rees и соавт. (1991) уже через 6 мес у 39% больных ангиографически выявили рестеноз. Дальнейшее совершенствование операций зависит от ранней диагностики вазоренальной гипертензии, выявления сопутствующих паренхиматозных и нефроангиосклеротических изменений, правильных показаний к реконструктивным и органоунося-щим операциям, а также к адекватной реконструкции почечных артерий.
7.9. ХРОНИЧЕСКАЯ ИШЕМИЯ НИЖНИХ КОНЕЧНОСТЕЙ
Клиническая картина хронической ишемии нижних конечностей может быть обусловлена как изолированными, так и сочетанными окклюзиями брюшной части аорты, ее бифуркации, подвздошных и бедренных артерий, а также артерий голени и стоп.
Показатели частоты поражения указанных магистральных артерий представлены на рис. 7.79.
Окклюзию бифуркации аорты как причину ишемии нижних конечностей описал в 1814 г. Graham. P. Лериш (R. Leriche) в 1923 г. описал, а в 1940 г. детально проанализировал серию наблюдений за больными молодого возраста, у которых ряд клинических симптомов был обусловлен окклюзией терминальной части аорты. Это заболевание он назвал «aortitis terminalis» и обосновал оптимальный метод лечения — резекцию облитерированного сегмента аорты с последующей пластикой. Описанный Р. Леришем симп-томокомплекс включал пять признаков: 1) нестабильная и неполная эрекция; 2) выраженная утомляемость нижних конечностей; 3) диффузная мышечная атрофия нижних конечностей; 4) отсутствие трофических расстройств; 5) бледность голеней и стоп даже в вертикальном положении больного. J. Oudot (1950) первым осуществил резекцию бифуркации аорты с пластикой ее гомотрансплантатом. В 1913 г. W. Jeger описал принцип шунтирования при периферических аневризмах, а в 1948 г. G. Kunlin воплотил идею аутовеноз-ного шунтирования при окклюзии бедренной артерии. Первую тромбэндартерэктомию из аортоподвздошного сегмента произвел в 1946 г. Y. Dos Santos. В нашей стране пионерами подобных операций были А. Н. Филатов и соавт. (1958). Первую резекцию бифуркации брюшной части аорты с протезированием произвели В. С. Савельев и соавт. в 1960 г.
Частота. По данным Н. Haimovici (1984). атеросклероз артерий нижних конечностей ежегодно выявляется у 1,8 мужчин и 0,6 женщин (на 1000 обследованных) в возрасте 45—54 лет, 5.1 и 1,9 соответственно — возрасте 55—64 лет и 6,3 и 3,8 — в возрасте 65—74 лет.
Этиология. Основными причинами ишемии нижних конечностей является атеросклероз (около 90%), неспецифический аортоартериит, облитерирующий тромбангиит. диабетическая ангиопатия, постэмболические и травматические окклюзии. Реже встречаются врожденные заболевания: гипоплазия брюшной части аорты и наружных подвздошных артерий.
Патологическая анатомия. Чаще всего окклюзия возникает в области бифуркации брюшной части аорты и общей подвздошной артерии. Проксимальное развитие тромбоза приостанавливается на уровне бифуркации до тех пор, пока не произойдет резкого стенозирования и снижения кровотока по контралатеральной подвздошной артерии. Лишь при
694
громбозе противоположной подвздошной артерии создаются условия для окклюзии бифуркации брюшной части аорты и восходящего тромбоза аорты по мере редукции кровотока в поясничных артериях. Считается, что «излюбленная» локализация атеросклероза в области бифуркации аорты и подвздошных артерий, а также в инфраренальном сегменте брюшной части аорты обусловлена тем, что дистальнее почечных артерий происходит значительное уменьшение кровотока, а также тем, что развивается хроническая травма аортальной и артериальной стенок сосудов из-за «систолических ударов» о близко расположенные жесткие ткани (promontorium), а также в местах разветвлений сосудов при артериальной гипертонии с поражением vasa vasorum, ишемией стенки аорты и артерий и дегенеративными изменениями в ней.
Для тромбангиита в отличие от атеросклероза характерен восходящий тип окклюзионного поражения от дистальных отделов к более проксимальным. Морфологическая картина характеризуется тромбами в просвете сосудов и полинукле-арной инфильтрацией стенок артерий и вен, а также околососудистой клетчатки. Вокруг тромба обычно выявляются разрастания эндотелия и милиарные гранулемы. Макроскопически тромбы имеют вид плотного тяжа, далеко распространяющегося в коллатеральные ветви.
Патологическая физиология. При окклюзии магистральной артерии главную роль в компенсации кровотока играют мышечные коллатерали, которые должны не только увеличивать фильтрационную поверхность, но и обеспечивать переток крови к более дистально расположенным тканям. Ф. Протези (1980) считает, что одним из наиболее важных факторов прогрессирования ишемического синдрома является сокращение объемной скорости кровотока. Обмен между капиллярами и клетками происходит только при «надкритическом» давлении в магистральных артериях (больше 60 мм рт. ст.).
При снижении перфузионного давления, способного преодолеть периферическое сопротивление, исчезает градиент давления между артериальным и венозным руслом и нарушается процесс микроциркуляции. При снижении перфузионного давления ниже 20—30 мм рт. ст. обменные процессы между кровью и тканями прекращаются, развивается атония капилляров, в мышечных тканях накапливаются продукты метаболизма и развивается ацидоз, что оказывает раздражающее действие на нервные окончания и обусловливает болевой симптомокомплекс, а затем и трофические нарушения. Просвет большинства капилляров становится неровным, с участками облитерации, выявляются гипертрофия эндотелия капилляров, утолщение базальной мембраны, что нарушает проницаемость сосудистой стенки. Однако нарушения микроциркуляции обусловлены не только поражением капиллярного русла, но и выраженными нарушениями гидродинамики крови. Снижается деформирующая способность эритроцитов. Их жесткость наряду с замедлением скорости тока крови приводит к динамической агрегации, увеличению периферического сопротивления, уменьшению снабжения тканей кислородом. Компенсация местной ишемии за счет усиления анаэробного гликолиза, увеличения образования лактата и пирувата в сочетании с местными тканевым ацидозом и гиперосмолярностью еще больше усиливает жесткость мембраны эритроцитов. Таким образом, регионарное кровообращение конечностей представляет со-
7.79. Частота стенозирующих и окклюзирующих поражений артерий нижних конечностей атеросклеротическим процессом.
Сегменты: I—аортоподвздошный; И—бедренно-подколен-ный; III—артерии голени; IV—подвздошно-бедренный; V— подколенный.
бой суммарную величину, определяемую степенью нарушения магистрального, коллатерального кровотока и состоянием микроциркуляции.
Клиника. Клиническая картина ишемии нижних конечностей зависит от степени ишемических расстройств. Выделяют 4 стадии процесса: 1) начальных проявлений окклюзии (зябкость, чувство похолодания, парестезии, бледность кожных покровов, повышенная потливость); 2) недостаточности кровообращения при функциональной нагрузке конечностей (главный симптом—перемежающаяся хромота); 3) недостаточности кровообращения в покое; 4) язвенно-некротических изменений конечностей. Третья и четвертая стадии относятся к стадиям декомпенсации кровообращения. Стадию перемежающейся хромоты оценивают по степени субъективной выраженности.
Степень А. Больной проходит без болей определенную дистанцию, после чего отмечает незначительные боли, чаще в икроножных мышцах, но это не ограничивает темпа ходьбы. Больной продолжает ходьбу с прежней скоростью, после чего боли самостоятельно прекращаются. Это свидетельствует о хорошем развитии коллатеральной системы, компенсирующей метаболические потребности тканей в конечности.
Степень Б. Больной проходит в определенном темпе до появления болей в мышцах, что заставляет его замедлить скорость продвижения. Снижение темпов ходьбы приводит к исчезновению болей, что свидетельствует о функциональной недостаточности коллатеральной системы.
Степень В. Больной проходит определенную дистанцию до момента появления выраженных болей, вынуждающих его останавливаться и отдыхать до момента исчезновения болей. Это свидетельствует не только о функциональной, но
695
и об анатомической недостаточности контралатерального русла.
Болевой синдром в нижних конечностях может провоцироваться форсированной физической нагрузкой: быстрой ходьбой, бегом, подъемом в гору или по лестнице. Симптом «перемежающейся хромоты» описал молодой французский студент-ветеринар G. Bouley (1831) у лошади, вынужденной при беге переходить на медленную ходьбу и начинавшей хромать. Автор правильно установил причину этой хромоты— окклюзию бедренной артерии и применил впервые термин «клаудикация» от латинского claudicare—хромота.
При декомпенсации кровообращения возникают боли в покое. Вначале они возникают при небольшой физической нагрузке, затем по ночам, в горизонтальном положении нижних конечностей, сопровождаются чувством онемения. Постепенно боли усиливаются, пациент вынужден постоянно массировать стопу, спать сидя или с опущенной ногой, что вызывает венозный стаз, отечность стопы и голени. Эти явления сначала играют роль компенсирующего фактора, но в дальнейшем усугубляют ишемию. Кожа пальцев стопы в этой стадии болезни имеет мраморный оттенок, синюшная, багровая (атония капилляров). Боли объясняются ишемическим или воспалительным (при тромбангиите) невритом, изменениями рецепторного аппарата чувствительных нервов.
Нарастают трофические нарушения кожи: выпадение волос, появление болезненных трещин, дистрофия ногтей, атрофия мышц. В этих условиях минимальная травма (механическая или физическая—переохлаждение, гипертермия) приводит к некротическим изменениям пальцев, а затем и стопы. Некроз кожи, как правило, осложняется инфекцией, прогрессирующим воспалением тканей. Присоединяющийся лимфангиит вблизи некротических очагов усиливает ишемию тканей и болевую реакцию. Язвенно-некротический процесс носит вялотекущий характер. Вторичная инфекция и воспаление могут привести к вторичному тромбофлебиту, общей интоксикации, быстрому .прогрессированию гангренозного процесса.
Атеросклероз нижних конечностей чаще наблюдается у мужчин (соотношение мужчин и женщин 10:1) в возрасте старше 45—50 лет, курящих, ведущих малоподвижный образ жизни, имеющих избыточную массу тела. Болезнь протекает медленно, одновременно с развитием ИБС, артериальной гипертензией, мозговой артериальной недостаточностью, эректильной импотенцией. Локализация процесса обычно проксимальная: аортоподвздошный сегмент и бедренные артерии.
Неспецифическим аортоартериитом мужчины и женщины болеют примерно одинаково часто. Возраст больных обычно не превышает 40 лет, профессия часто связана с влиянием вредных веществ (ксенобиотиков), течение процесса волнообразное, в анамнезе отмечают синдромы общего воспаления, реакции на аллергические факторы. Из сопутствующих болезней часто выявляют полиартриты, полиневриты, плевриты, пневмонии, миокардиты. Поражаются средний сегмент аорты, ее бифуркация и подвздошные артерии. Явления перемежающейся хромоты всегда симметричны, выражены мало. Часто наблюдается асимметрия артериального давления на руках и скрытая артериальная гипертония.
Облитерирующим тромбангиитом болеют только мужчины моложе 30 лет, много курившие. В анамнезе они отмечают переохлаждение, инфекцию, интоксикацию, травму
головы, психическую травму. Профессия нередко связана с воздействием вредных веществ. Течение болезни волнообразное, в анамнезе имеются указания на ее связь с аллергическими факторами. Из сопутствующих болезней часто имеет место язвенная болезнь желудка и двенадцатиперстной кишки. Нередко отмечают психические отклонения, наркоманию. Часто наблюдаются тромбофлебиты. Процесс локализуется в основном в дистальных артериях стопы и голени, поражение, как правило, симметричное. Перемежающаяся хромота носит «низкий» характер, рано появляется, больные жалуются на судорожные боли при ходьбе.
Диабетические ангиопатии одинаково часто наблюдаются у лиц обоего пола старше 50 лет. Течение болезни прогрессирующее, сочетается с диабетом, выражены почечные и глазные симптомы. Поражение обычно захватывает ди-стальные отделы артерий, симметричное, прогрессирующее.
Диагностика. При осмотре нижних конечностей больного констатируют симметричность изменений окраски кожи, атрофию мышц, трофические расстройства, изменения формы ногтей и выпадение волос. Бледность кожных покровов обусловлена спастическим состоянием капилляров. При атонии капилляров кожные покровы принимают багровоци-анотичную окраску, особенно при диапедезе эритроцитов через стенку паретичных капилляров. Функциональные пробы, проводимые при осмотре, позволяют оценить состояние кровообращения в конечностях.
После поднятия ноги под углом 45° при одновременных сгибательно-разгибательных движениях в голеностопных суставах со скоростью одно движение в секунду через 5—10 с при ишемии конечностей выявляется побледнение кожи стоп и голеней. При последующем опускании ноги вниз заполнение подкожных вен стопы (которое в норме происходит через 5—7 с) запаздывает, а гиперемия кожных покровов держится более 3 с.
Важным диагностическим критерием является быстрота появления болевых ощущений при поднятии ноги и проведении сгибательно-разгибательных движений в голеностопном суставе. Если боли появляются через 60 с, это свидетельствует о стенозирующем поражении магистральных артерий, если через 20 с—о диффузном и выраженном поражении.
В норме при пальцевой компрессии пальцев стопы белое пятно после декомпрессии исчезает через 2—4 ч. Если для этого требуется более длительный промежуток времени, это свидетельствует о снижении циркуляции в капиллярах. Если при цианотичной окраске кожных покровов пальцев стопы компрессия не вызывает побледнения, значит имеется выраженная декомпенсация капиллярного кровотока.
Компрессия тканей позволяет выявить уровень дисталь-ной окклюзии: после проведения тупым предметом по передней поверхности ноги дистальнее уровня окклюзии артерии остается белая линия. Изучение зоны побледнения кожных покровов позволяет выявить участок поражения: при окклюзии передней болыпеберцовой артерии бледнеют тыл стопы и область предплюсны, при окклюзии задней болыпеберцовой артерии—пяточная область. Симптом мышечной атрофии сопровождается снижением мышечного тонуса, мышечной силы и работоспособности. Степень атрофии мышц может привести к уменьшению периметра голени на 3—5 см.
Изучение пульсации артерий нижних конечностей производится поэтапно: бедренные, подколенные артерии, арте-
696
рии стопы. При стенозе подвздошных артерий в проекции бедренных артерий выявляется дрожание. Пульсацию следует определять симметрично. Необходимо помнить, что у 6—24% людей пульсация тыльной артерии стопы может отсутствовать. Обязательно сравнивают характер пульсации артерий на стопах с пульсацией лучевых артерий. Ау-скультируют брюшную часть аорты, подвздошные артерии, бедренные, сонные, позвоночные, подключичные артерии и нисходящую часть аорты. Обязательно измерение артериального давления на руках и ногах.
Методы функциональной диагностики. Электротермометрия уже на ранних стадиях ишемии выявляет асимметрию температуры, а также ее снижение при физической нагрузке. В норме асимметрия температуры не превышает 1,5° С. Участок ишемии хорошо фиксируется с помощью тепловидения, улавливающего инфракрасное излучение кожной поверхности. С помощью реовазографии фиксируют регулярность пульсовых колебаний, реографиче-ский индекс, реографический коэффициент. В норме реог-рафический индекс равен 0,8—0,9%, а реографический коэффициент—10,5—11%. Артериальная осциллография отражает состояние магистрального кровотока. Следует оценивать, кроме абсолютной величины показателей осциллограммы, показатели симметричных участков ног. Асимметрия может достигать 4 мм в верхней трети голени и 1,5 мм—в нижней трети голени. Для определения спастического компонента применяется нитроглицериновый тест с повторной осциллографией. С помощью капилляроскопии и капиллярографии можно выявить поражение капиллярного звена системы кровообращения. Оцениваются индекс открытых капилляров (в норме он равен 60%), синдром запустева-ния капилляров, степень реактивности капилляров на холод и тепло.
Объемная сфигмография регистрирует пульсовые колебания артерий и объем тканей конечностей с помощью пневматической манжеты с четырех уровней: средней трети бедра, верхней и средней трети голени и стопы. Основные показатели сфигмограммы: форма, амплитудный градиент пульса, скорость распространения пульсовой волны, время анакроты. За единицу амплитуды берется показатель сфигмограммы, регистрируемой с плеча. Для определения состояния перферического русла проводится проба с нитроглицерином, которая выявляет замедление сосудистой реакции при атеросклерозе и ее отсутствие при тромбангиите (сосудистая арефлексия).
Ультразвуковая допплерография на основании аускульта-тивной картины и морфологии доплерографической волны, а также величины линейной скорости кровотока и регионарного артериального давления и индекса давления обеспечивает точную топическую диагностику окклюзии артерий нижних конечностей. При ишемии II степени индекс давления в дистальных отделах нижних конечностей составляет 0,59 ± 0,04, при ишемии III степени—0,41+0,03, при IV— 0,22+0,06. Определение тканевого кровотока по клиренсу радиоактивного 133Хе является чрезвычайно важным, так как его количественные показатели (количество крови, протекающее через единицу массы ткани) являются одним из главных факторов, определяющих степень нарушения кровообращения. В норме клиренс шХе равен 2,5 мл/ (10 г • мин). Особенно ярко фиксируются сниженные компенсаторные возможности тканей при физической нагрузке и ре-

7.50. Ангиограмма больного с высокой окклюзией брюшной части аорты с одновременным стенотическим поражением устьев обеих почечных артерий.
активной гиперемии, когда он должен значительно увеличиваться.
Для получения полноценной информации целесообразно проведение рентгеноконтрастной аортоартериографии всей брюшной части аорты и артерий нижних конечностей, вплоть до стопы. А. В. Покровский и А. А. Спиридонов (1982) различают три уровня окклюзии аорты: высокую (на уровне почечных артерий) (рис. 7.80), среднюю (проксималь-нее устья нижней брыжеечной артерии) и нижнюю (дисталь-нее устья нижней брыжеечной артерии).
Окклюзии магистральных артерий нижних конечностей атеросклеротического характера и вследствие облитериру-ющего тромбангиита имеют различную ангиографическую картину, что важно учитывать при дифференциальной диагностике этих заболеваний (табл. 7.5).
Таблица 7.5. Ангиографические признаки атеросклероза и тромбангиита
|
Признак |
Атеросклероз |
Тромбангиит |
|
Поражение аорто- |
Часто |
Редко |
|
подвздошного сег- |
|
|
|
мента |
|
|
|
Извитость и рас- |
|
|
|
ширение прокси- |
» |
Нет |
|
мальных сегментов |
|
|
|
аорты и подвзош- |
|
|
|
ных артерий |
|
|
|
Равномерное су- |
Нет |
Часто |
|
жение проксималь- |
|
|
|
ных сегментов |
|
|
|
Состояние бедрен- |
Неровность кон- |
Равномерное суже- |
|
ных артерий |
туров, стеноз бифуркации Сегментарный |
ние |
|
Характер окклюзии |
Диффузный | |
|
Проходимость арте- |
Чаще сохранена |
Отсутствует |
|
рий голени |
|
|
|
Форма культи |
Булавовидная |
Коническая |
|
Коллатерали |
Крупные, прямые |
Мелкие, извитые |
|
|
хорошо развитые |
|
697
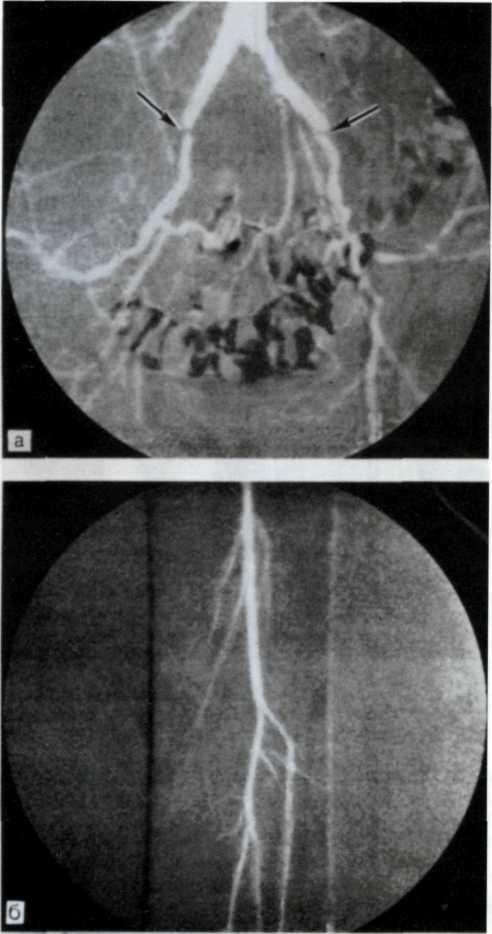
7.81. Дигиталъная суотракционная ангиография брюшной части аорты и артерий нижних конечностей (а, 6) с клинической картиной синдрома Лериша.
Окклюзия обеих наружных подвздошных артерий, стено-зирование устьев обеих внутренних подвздошных артерий (указано стрелками) и проходимые бедренно-подколенные сегменты.
Развитие метода дигитальной субтракционной ангиографии позволит проводить панаортоартериографию нижних конечностей, а также тотальную ангиографию, что даст возможность выявлять сочетанные поражения коронарных. и мозговых артерий.
Последнее обстоятельство играет большую роль в определении прогноза болезни и показаний для операции (рис. 7.81).
Прогноз естественного течения окклюзионных процессов в артериях нижних конечностей малоблагоприятен. По
данным Н. Heine (1972), через несколько лет после появления первых признаков ишемии нижних конечностей 2—3 больных либо умирают, либо подлежат хирургическому лечению—ампутации конечности.
Показанияк операции в настоящее время значительно расширены (табл. 7.6). Абсолютным показанием являются боли в покое и язвенно-некротическая стадия ишемии нижних конечностей, а также выраженная перемежающаяся хромота ИВ степени, свидетельствующая об анатомической и функциональной недостаточности коллатерального русла. При ишемии I—ПА и ПБ стадии показаны консервативное лечение и наблюдение. Ориентировка на степень выраженности перемежающейся хромоты по длительности прохождения расстояния без боли 200 м достаточно условна и зависит от образа жизни, профессии и даже характера больного.
Таблица 7.6. Виды реконструктивных операций при хронической ишемии нижних конечностей

Противопоказания к операции: инфаркт миокарда (давностью менее 3 мес), недостаточность кровообращения III степени, выраженная легочная недостаточность, цирроз печени, почечно-печеночная недостаточность. Возраст больных не может служить противопоказанием. В ряде случаев можно пересмотреть противопоказания в зависимости от общего статуса больных в связи с возможностью проведения внеполостных реконструктивных операций.
Операцию реваскуляризации нижних конечностей при окклюзии аортоподвздошного сегмента следует начинать с обнажения бедренных артерий с целью их ревизии, выяснения характера дистального анастомоза и производства интра-операционной артериографии дистального отдела.
При высокой резекции брюшной части аорты наилучшие условия создает левосторонняя торакофренолюмботомия в девятом—десятом межреберье.
Приводим описание операции высокой резекции брюшной части аорты с бифуркационным протезированием, тромбэн-дартерэктомией из чревного ствола, обеих почечных артерий и супраренального сегмента аорты, с протезированием верхней брыжеечной артерии.
Произведена левосторонняя торакофренолюмботомия по девятому межреберью с продолжением разреза параректа-льно вниз. После рассечения диафрагмы выявлена окклюзия брюшной части аорты на уровне почечных артерий, паль-паторно определены бляшки в устье обеих почечных артерий и чревном стволе. Верхняя брыжеечная артерия полностью окклюзирована. Произведена электроманометрия в чревном стволе и в аорте: градиент артериального давления составил 50 мм рт. ст. Аорта пережата выше уровня чревного ствола и пересечена на 2 см дистальнее почечных артерий. Продольная заднелатеральная аортотомия в краниальном направлении до уровня чревного ствола. В просвете аорты—атероматоз и старый организованный тромб, устья обеих почечных артерий и чревный ствол стенозирова-ны атеросклеротическими бляшками. Выполнена тромбэн-дартерэктомия из супраинтерренального сегмента аорты, чревного ствола и обеих почечных артерий. Получен хороший ретроградный кровоток. Аортотомический разрез ушит наглухо, зажим перенесен дистальнее почечных артерий. Время пережатия аорты выше чревного ствола составило 45 мин. При восстановлении кровотока наложен косой проксимальный анастомоз бифуркационного (длиной 16 мм) протеза с аортой по типу конец в конец. Резецирована верхняя брыжеечная артерия на протяжении 1,5 см от ее устья и наложен дистальный анастомоз (6 мм) протеза с ди-стальной частью верхней брыжеечной артерии по типу конец в конец. Проксимальный конец протеза вшит в основную браншу бифуркационного протеза. Пущен кровоток по верхней брыжеечной артерии, пережаты раздельно бранши бифуркационного протеза. Дренирована левая плевральная полость, ушиты диафрагма и торакотомный разрез. Наложены провизорные швы на разрез передней брюшной стенки. Больной повернут на спину, обнажены бедренные артерии. Бранши протеза выведены забрюшинно на бедра и анасто-мозированы по типу конец в бок с общими бедренными артериями. Послеоперационное течение гладкое.
При средних окклюзиях брюшной части аорты оптимален доступ посредством полной срединной лапаротомии или косой внебрюшинный доступ слева. Латеральный край разреза при этом начинается от XII ребра. Разрез идет косо вниз и медиально, пересекает левую прямую мышцу живота и доходит до срединной линии живота ниже пупка на 2 см (рис. 7.82). Использование внебрюшинных доступов не вызывает парезов кишечника, обеспечивает раннюю активизацию больных, не ограничивает брюшное дыхание, реже наблюдается эвентрация. Экспозиция инфраренального сегмента аорты при этом хорошая.
При низких стенозах и окклюзиях брюшной части аорты (ниже нижней брыжеечной артерии) следует оперировать больных, пользуясь доступом путем полной срединной лапаротомии. По вскрытии брюшной полости вся тонкая кишка изолируется либо влажной пеленкой, либо помещается в целлофановый пакет и отводится вправо и вверх. Сигмовидную кишку отводят влево (рис. 7.83). Рассекают задний листок брюшины, пересекают трейтцеву связку и мобилизуют дистальную порцию двенадцатиперстной кишки. Аорта должна быть выделена по передней и боковым поверхностям. Подвздошные артерии также полностью не выделяют и не мобилизуют из-за опасности ранения одноименных вен. Пережимают аорту и обе подвздошные артерии. Осуществляют продольную аортотомию на уровне нижней брыжеечной артерии длиной, превышающей в 2 раза диаметр аорты. Лучше создать эллипсовидное окно в аорте. Производят тщательную тромбэндартерзктомию из аорты. Анастомоз начинают с каудальной части. Иглу вкалывают
7.82.
Схематическое изображение левостороннего
бокового жстраперитонеалыюго
доступа для операций на инфраре-нальном
сегменте брюшной части аорты. I—кожный
разрез; II—жстраперитонеалыш
обнажены брюшная
часть аорты и нижняя
брыжеечная
артерия (НБА);
III—при
расширении доступа к аорте вправо
возможно
адекватное обнажение левой почечной
вены (ЛПВ), нижней
полой вены и бифуркации брюшной части
аорты. В
верхнем углу рапы видны левая почечная
вена и жировая капсула
левой почки (ЛПК).


7.53. Схематическое изображение этапов (I—IV) обнажения инфраренального сегмента брюшной части аорты с использованием лапаротомного доступа.
I—пунктирная линия показывает направление рассечения заднего листка брюшины; II—выделение инфраренального сегмента аорты с рассечением преаорталыюй клетчатки; III и IV—пересечение связки Трейтца (сТ), являющейся «ключом» при выделении инфраренального сегмента аорты для мобилизации двенадцатиперстной кишки и левой почечной вены как при окклюзионных, так и при аневризматических поражениях брюшной аорты дистальнее почечных артерий.
из просвета аорты, что позволяет фиксировать внутреннюю оболочку и накладывать выворачивающий шов. Проверка анастомоза на герметичность производится путем снятия зажимов с подвздошных артерий, а затем и с аорты. Снятие зажимов с аорты следует делать не одномоментно с целью поддержания стабильной гемодинамики. Бранши протеза выводят ретроперитонеально на бедра. Они должны идти под мочеточниками. Важно не травмировать брыжейку сигмовидной кишки. После пережатия бедренных артерий вскрывают продольно общую бедренную артерию, причем разрез должен быть длиной не менее 2,5—3 см. После тромб-эндартерэктомии, если в этом есть необходимость, просвет артерии промывают и заполняют изотоническим раствором хлорида натрия с гепарином. Перед промыванием обязательно проверяют адекватность ретроградного кровотока.
700

Анастомоз осуществляют проленовой нитью 5/0. После пуска кровотока и стабилизации гемодинамики производится аналогичная операция на противоположной стороне. Тщательно ушивают задний листок брюшины и, если необходимо, изолируют протез от кишки сальником. Раны послойно ушивают наглухо. Необходимо активное дренирование в области послеоперационной раны.
При полной окклюзии аорты проксимальный анастомоз целесообразнее накладывать по типу конец в конец. При окклюзии бедренной артерии дистальный анастомоз также должен выполняться по типу конец в конец либо с бедренной артерией, либо с глубокой артерией бедра (при непроходимости поверхностной), причем данный анастомоз лучше накладывать с площадкой из стенки бедренной артерии.
Одностороннее аортобедренное или подвздошно-бедрен-ное шунтирование или протезирование показано при окклюзии общей и наружной подвздошной артерий с проходимыми сосудами контралатеральной стороны. При наличии клинически компенсированного стеноза противоположных подвздошных артерий показана двусторонняя реконструкция.
Тромбэндартерэктомию из аортоподвздошного сегмента выполняют при ограниченной окклюзии дистального сег-
мента аорты или общей подвздошной артерии. Абсолютным противопоказанием являются аневризматическое расширение данного сегмента и кальциноз (рис. 7.84).
Непрямые реконструктивные операции при окклюзиях аортоподвздошного сегмента выполняют при: 1) тотальном кальцинозе аорты и подвздошных артерий; 2) проксимальном тромбозе аорты, когда ее выделение затруднено и представляет определенный риск; 3) гнойно-воспалительных процессах в паховой области, передней брюшной стенке, брюшной полости и забрюшинном пространстве; 4) общих противопоказаниях к выполнению прямой операции (тяжелый сердечный или легочный статус) у больных с ишемией нижних конечностей III—IV стадии. Обязательным условием является абсолютная интактность артерии донора (подключичной или бедренной). Первой обнажается бедренная артерия на стороне ишемии для выяснения состояния путей оттока и операбельности больного. При бедренно-бедрен-ном шунтировании возможны два варианта проведения трансплантата—подкожное или более глубокое—в залоб-ковом пространстве (пространство Ретциуса).
Доступ к подключичной артерии. Подмышечную артерию обнажают на протяжении 5 см. После продольной артери-отомии (длина разреза 1,5—2 см) вшивается протез диамет-
701
7.85. Схематическое изображение этапов (I, II) проведения подмышечно-бедренного шунта.
I—протез вшит (конец в бок) в подмышечную артерию. В подкожной клетчатке проводится специальный инструмент для создания тоннеля: II—в паховой области протез должен проходить под наружной косой мышцей живота (НКМ) в рану на бедре, где накладывают анастомоз с бедренной артерией.
ром 8 мм по типу конец в бок. Протез проводится позади вены в туннель между большой и малой грудными мышцами в отдельный разрез по нижнему краю большой грудной мышцы по среднеподмышечной линии и далее подкожно на бедро (рис. 7.85).
Реконструктивные операции при поражениях бедренно-под-коленного сегмента. Различают несколько типов поражения бедренно-подколенного сегмента: 1) сегментарная окклюзия поверхностной бедренной артерии в дистальной части приводящего канала (гунтеров канал); 2) сегментарная окклюзия проксимального сегмента поверхностной бедренной артерии; 3) окклюзия поверхностной бедренной артерии на всем протяжении; 4) окклюзия поверхностной бедренной и подколенной артерий в проксимальном сегменте последней, но без поражения бифуркации подколенной артерии; 5) окклюзия поверхностной бедренной и подколенной артерий, включая бифуркацию последней; 6) окклюзия поверхностной бедренной артерии и устья глубокой артерии бедра; 7) диффузное стенотическое поражение бедренных, подколенной артерий и артерий голени.
В большинстве случаев окклюзионные поражения бедренно-подколенного сегмента сочетаются со стенозирующими поражениями аортоподвздошного сегмента, его извитостью и аневризмами, которые могут носить «скрытый» характер, но обязательно должны быть выявлены, так как меняют хирургическую тактику. Показания к реконструктивной операции в бедренно-подколенной зоне: 1) ишемия III—IV
стадии и выраженная перемежающаяся хромота; 2) ограничение активности и выполнения профессиональных обязанностей; 3) неэффективность проведенной консервативной терапии. Риск операции невысокий при хороших анатомо-ангиографических условиях.
Операция бедренно-подколенного шунтирования может быть произведена с помощью аутовены [Шалимов А. А. и др., 1979], современных антитромбогенных протезов, гетерогенных трансплантатов, вены пуповины. Наиболее распространен метод аутовенозного шунтирования реверсированным трансплантатом. Первым следует накладывать ди-стальный анастомоз с интактным участком подколенной артерии. Проксимальный анастомоз накладывают с бедренной артерией. Обе раны дренируют и экссудат отсасывают. Следует помнить некоторые правила: 1) трансплантат проводится подкожно; 2) после иссечения аутовены она сокращается на lU—llb часть; 3) длина трансплантата не должна быть избыточной или короткой; в норме при сгибании коленного сустава подколенная артерия сокращается на 4 см; 4) минимально пригодный диаметр трансплантата из аутовены 4 мм; 5) трансплантат следует проводить в тоннеле после заполнения аутовены изотоническим раствором хлорида натрия с гепарином; 6) адекватность операции подтверждают данными флоуметрии и ангиографией после завершения анастомозов.
В 1989 г. в Берлине был составлен 1-й Согласительный документ по лечению критической ишемии нижних конеч-
702
ностей, который был уточнен в апреле 1991 г. и утвержден как 2-й Согласительный документ. В нем представлены все аспекты распространения, эпидемиологии, патофизиологии и тактики лечения хронической критической ишемии нижних конечностей. Следует обратить внимание на тот факт, что только в США ежегодно производят 200 ампутаций по поводу атеросклеротической ишемии и 3900 ампутаций в связи с диабетической ишемией на 1 млн населения.
Столь распространенная инвалидизация населения привела к необходимости разработки хирургического, рентгенохи-рургического и консервативного методов реваскуляризации дистальных форм поражения на уровне артерий не только голени, но и стопы.
В последние годы дистальные реконструкции артерий нижних конечностей получили широкое распространение в связи с применением метода аутовенозного шунтирования in situ. С этой целью был создан специальный эффективный инструмент «инситукат», с помощью которого разрушают клапанный аппарат большой подкожной вены на уровне бедра и голени и создают условия для наложения дисталь-ного анастомоза практически на любом уровне, вплоть до стопы. В некоторых случаях можно применить комбинированные шунты: бедренно-подколенный шунт из синтетического протеза ПТФЭ («Гор—Текс», «Импра») и подколенно-педальный шунт из аутовены. Подобный характер шунтирования носит название «прыгающий, или секвенциальный, шунт».
Показания к пластике глубокой артерии бедра: 1) окклюзии бедренно-подколенного сегмента на всем протяжении с поражением дистального русла; 2) реконструкция аортопод-вздошного сегмента при одновременном поражении бедренно-подколенного сегмента, если одномоментная операция невыполнима по каким-либо причинам; 3) операции бедренно-бедренного шунтирования, если имеется одновременное поражение поверхностной бедренной артерии на стороне ишемии, а также при выполнении внеполостной операции при подмышечно-бедренном шунтировании в аналогичной ситуации. Варианты восстановления проходимости проксимального сегмента глубокой артерии бедра различны и включают в себя: 1) тромбэндартерэктомию (эверсионную или открытую последующей пластикой заплатой), 2) расширение ствола артерии аутовенозной заплатой, аутоарте-риальным трансплантатом из поверхностной артерии бедра; 3) резекцию ствола глубокой артерии бедра с замещением его аутоартерией или аутовеной. Существенным недостатком изолированной пластики глубокой артерии бедра является сохранение после операции высокого периферического сопротивления в ее системе, что приводит в отдаленные сроки после операции к рецидиву ишемии у 60% больных. Только у '/з больных после подобных операций ликвидируется перемежающаяся хромота. При сочетанных поражениях аортоподвздошного и бедренно-подколенного сегментов операциями выбора в настоящее время следует считать одновременную реконструкцию как проксимального, так и дистального блока.
Не следует забывать и о возможности эндартерэктомии из поверхностной бедренной артерии. Van der Heijden и соавт. (1992) несколько видоизменили методику Вольмара и производят процедуру ретроградно из артериотомии в подколенной области. Артериотомические резервы в подколенной и бедренной областях закрывают аутовенозными заплата-
ми. На 231 случай применения подобного метода реканали-зации поверхностной бедренной артерии к 5-му году были проходимы 70% артерий.
Этот метод не следует исключать из практики ангиохирур-гов, так как аутовенозный материал может понадобиться для дальнейшей дистальной реваскуляризации (бедренно-тибиальной или бедренно-педальной).
Результаты операций. Летальность после операций составляет 2—13%, а частота ампутаций после реконструктивных операций—10% [De Wfeese G. et al., 1972]. В сроки до 10 лет проходимость протезов сохраняется в аорто-подвздошном сегменте у 80—90% больных. Результаты внеполостных операций при данной локализации окклюзии хуже: через 3 года проходимы 60—70% бедренно-бедренных шунтов и 64% подмышечно-бедренных шунтов [Kester R. et al., 1981]. Реконструктивные операции в бедренно-подколенной зоне свидетельствуют о том, что при соблюдении основных правил определения показаний и условий операции проходимость аутовенозных трансплантатов сохраняется у 80—85% больных через 3 года после операции [Kester R. et al., 1981 ].
Отдаленные результаты наложения бедренно-педальных шунтов таковы: к концу 1-го года проходимы 68% шунтов, а через 2 года—40%. Однако уже этот начальный опыт свидетельствует о перспективности данного направления.
По данным 2-го Согласительного документа (1991), при критической ишемии нижних конечностей через 1 год после аортоподвздошно-бедренного протезирования проходимы 90% протезов, после бедренно-подколенного шунтирования аутовеной—75%, протезом—65%. После бедренно-подколенного шунтирования ниже колена проходимы 70% ауто-вен и 60% протезов, после бедренно-тибиального шунтирования—70% аутовен и 40% протезов. Это свидетельствует о нецелесообразности применения для реконструкции артерий голени и стопы даже самых качественных синтетических протезов. Результаты ангиопластики показывают, что через 2 года проходимы 85% подвздошных артерий и лишь 50% бедренных и подколенных.
7.10. ОСТРАЯ АРТЕРИАЛЬНАЯ НЕДОСТАТОЧНОСТЬ КРОВООБРАЩЕНИЯ КОНЕЧНОСТЕЙ
Острая недостаточность кровообращения конечностей, как правило, обусловлена острыми тромбозами и эмболиями бифуркации аорты и артерий конечностей и травматическими повреждениями магистральных сосудов.
7.10.1. ОСТРЫЕ ЭМБОЛИИ И ТРОМБОЗЫ БИФУРКАЦИИ АОРТЫ И АРТЕРИИ КОНЕЧНОСТЕЙ
В 1856 г. R. Virchov ввел понятие «эмболия» и теоретически обосновал эмболическую непроходимость артерий. Вирхов-ская триада тромбообразования (замедление тока крови, изменение или повреждение внутренней оболочки сосуда и повышение свертываемости крови) до сих пор сохраняет свое патогенетическое значение.
В России в 1863 г. появилось сообщение (диссертация) И. Ф. Клейна «О тромбозе, эмболии и ихоремии», в котором автор рассматривает данную патологию не как механическое нарушение кровотока в магистральных сосудах, а как общее заболевание. В 1895 г. И. Ф. Сабанеев попытался уда-
703
лить эмбол из бедренной артерии в клинике; к сожалению, попытка окончилась неудачно, пришлось ампутировать конечность. Через 2 года русский хирург Р. Р. Вреден успешно осуществил ретроградную эмболэктомию из бифуркации аорты через бедренную артерию. В 1936 г. шведский хирург Е. Key собрал в литературе материал о 382 эмболэктомиях, правда, результаты этих операций были малоутешительными— выздоровели лишь 22,5% больных, гангрена развилась у 18,1%, а летальность составила 59,4%. В нашей стране наибольшим клиническим материалом по эмболэктомиям располагает факультетская хирургическая клиника II ММИ. Лучшие результаты лечения удается получить при адекватном сочетании консервативного и хирургического лечения; и даже в этой ситуации ампутации по поводу развившейся гангрены выполняют у 20% больных, а летальность больных достигает 20—35% [Савельев В. С, 1975].
Частота. Наиболее часто поражаются бедренные артерии (33,7% от числа всех эмболии), затем подвздошные артерии (24,3%), бифуркация аорты (17,3%), подколенная артерия (10,5%), плечевая (4,5%) и т. д. [Князев М. Д., Белорусов О. С, 1977]. Множественные эмболии наблюдаются в 12,8% случаев. Эмболии чаще встречаются у женщин, особенно в возрасте 40—60 лет.
Этиология. Основной причиной артериальной эмболии считают мигрирующие тромбы, образующиеся в левых отделах сердца, артериальном русле или же в легочных венах. Кроме перечисленных заболеваний, эмболия артерий может возникать в результате аневризмы сердца, септического эндокардита. Среди причин острого артериального тромбоза в первую очередь следует назвать атеросклероз, особенно в сочетании с сахарным диабетом. Другой причиной острых артериальных тромбозов является облитерирующий эндар-териит (20% случаев).
Патогенез артериальной эмболии известен хорошо. Обычно после образования тромба в том или ином отделе сердечно-сосудистой системы происходят его частичный или полный отрыв и дальнейшее передвижение уже в виде эмбола в какую-то часть сосудистой системы, где он фиксируется и постепенно наращивается; в результате наступает острая непроходимость артерии с развитием ишемических изменений в конечности.
Клиника. Клиническая картина эмболической закупорки артерий конечности имеет характерные признаки: сильные боли в пораженной конечности, резкая бледность и похолодание кожных покровов ее, изменение сначала поверхностной чувствительности, а затем глубокой, нарушение функции, исчезновение пульса дистальнее места закупорки. Боль при эмболии беспокоит 95% больных. Обычно она появляется внезапно и интенсивность ее постепенно нарастает. При эмболии бифуркации аорты боль может вызывать шок. Цвет кожных покровов пораженной конечности меняется. Вначале возникает резкая бледность, затем появляются цианоз и мраморность. Кожная температура снижается на несколько градусов (до 8°), и разница в температуре здоровой и пораженной конечностей легко определяется на ощупь. Обычно кожная температура снижается не с уровня эм-болизации, а сантиметров на 10 ниже его локализации. Изменения чувствительности также выявляются почти у всех больных. Сначала появляется поверхностная гиперестезия, затем исчезают тактильная температурная и болевая чувствительность и, наконец, наступает почти полная поверхностная и затем глубокая анестезия. Исчезают также поверхностные и глубокие рефлексы. Функция конечности нарушается по-разному: от ограничения движения в пальцах до контрактуры всей конечности. Мышечная контрактура
развивается, как правило, в первые 8—12 ч болезни. К постоянным симптомам артериальной эмболии относится исчезновение пульса дистальнее закупорки сосуда, при неполной блокаде пульс не исчезает, а значительно ослабевает. Выше эмболии пульсация сосуда, наоборот, усилена.
Клиническая картина острых тромбозов артерий конечности связана с развитием типичного ишемического синдрома и поэтому имеет ту же симптоматику, что и эмболия, но развивается она не так бурно, зависит от вида поражения сосудов, возможности развития коллатеральной сети. Известно несколько классификаций данной патологии. В. С. Савельев и соавт. (1970) различают ишемию напряжения и ишемию I, II, III степени, каждая из которых подразделяется на стадии А и Б. Кроме того, по клиническому течению выделяют: 1) прогрессирующую ишемию с исходом в гангрену; 2) умеренно стабильную и 3) регрессирующую с переходом в хроническую артериальную недостаточность. М. Д. Князев и О. С. Белорусов (1977) выделяют три степени ишемии и три степени компенсации острого нарушения кровообращения: компенсацию, субкомпенсацию и декомпенсацию, А. А. Шалимов и Н. Ф. Дрюк (1979) выделяют четыре степени ишемии тканей конечности: I—легкую, II—среднюю, III—тяжелую и IV—гангрены, или необратимых изменений тканей. Основная идея состоит в том, что характер нарушения кровообращения конечности определяется главным образом локализацией эмбола. Так, по данным М. Д. Князева и О. С. Белорусова (1977), при закупорке бифуркации аорты, подвздошно-бедренного сегмента артерий, подключичной и плечевой артерий кровообращение в конечности, как правило, нарушается. В работе авторы приводят схему наиболее типичных эмболических закупорок и примерный верхний уровень ишемии конечностей (рис. 7.86, табл. 7.7).
Та блица 7.7. Максимальный верхний уровень ишемии конечности в зависимости от локализации эмбола

При эмболических закупорках бифуркации аорты могут наблюдаться нарушения функции тазовых органов. В ряде случаев восходящий тромб может перекрыть нижнюю брыжеечную и даже почечные артерии, в результате развиваются некроз толстой кишки и почечная недостаточность.
Диагностика. Если клинические данные не позволяют установить диагностические критерии данной патологии, то используют комплекс инструментальных методов исследования. Наиболее ценным из них является ангиография.
Ангиографическая семиотика при эмболиях артерии достаточно характерна: при полной закупорке отмечается резкий обрыв тени сосуда с выпуклой верхней поверхностью эмбола. При неполной обтурации артерии эмбол на артерио-
704
грамме имеет вид овального или круглого образования (см. раздел «Повреждение сосудов»). При невозможности трактовки единственной ангиограммы необходима серия ангио-грамм.
В последние годы в клиническую практику все шире внедряется неинвазивный метод ультразвуковой и электромагнитной флоуметрш, позволяющий определить линейную скорость кровотока, установить локализацию закупорки и определить степень проходимости магистральных сосудов ниже окклюзии, вплоть до артерий стопы и кисти. Метод очень удобен в экстренной сосудистой хирургии, так как двигающийся на коже вдоль сосуда датчик издает звуковой сигнал, прекращение которого при закупорке артерии легко улавливается на слух исследователем. Кроме того, звуковые сигналы сопровождаются соответствующей графической записью. Электромагнитные флоуметры определяют объемный кровоток и необходимы для оценки восстановительных операций и выявления «многоэтажных» окклюзии. В подвздошных артериях нормальный объемный кровоток составляет 600—700 мл/мин, в общей бедренной артерии— 400—450 мл/мин, в подколенной артерии—около 100 мл/ мин. Уменьшение объемного кровотока в оперированном сосуде на 40—50% должно настораживать хирурга, так как свидетельствует о возможности развития ретромбоза в таком сосуде.
Как дополнительные методы исследования при острых артериальных эмболиях и тромбозах могут быть использованы объемная сегментарная сфигмография и продольная сегментарная реография.
Лечение. Лечение острых артериальных тромбозов и эмболии представляется трудной задачей, и, хотя большинство хирургов считают методом выбора оперативное лечение, использование лекарственных средств должно быть одним из этапов этого лечения. В настоящее время существует единое мнение, что консервативную терапию в качестве пробного лечения следует проводить в течение 2—4 ч при субкомпенсации кровообращения конечности. Для снятия болей, ангиоспазма, раскрытия коллатералей и профилактики развития продолжительного тромбоза больному сразу же после установления диагноза вводят 1—2 мл 2% раствора промедола или морфина, 4 мл 1 % раствора но-шпы. 2 мл 2% раствора папаверина гидрохлорида, 15 000— 20000 ЕД гепарина и 15000—30000 ЕД фибринолизина. Если наступило видимое улучшение кровообращения конечности, то следует продолжить такую терапию до ликвидации ишемических проявлений. Если же за это время явного улучшения не наступило, следует ставить вопрос о немедленном оперативном лечении. Как самостоятельный плановый вид лечения консервативную терапию сразу же можно назначить больным при острой артериальной закупорке в тех случаях, когда имеется компенсированное кровообращение в конечности. Наконец, консервативная терапия как вынужденный самостоятельный вид лечения применяется у крайне тяжелых больных, у которых операция невыполнима.
Профилактика восходящего и нисходящего вторичного тромбоза осуществляется э основном при помощи антикоагулянта прямого действия—гепарина. Назначают также антикоагулянты непрямого действия (фенилин, пелентан, неодикумарин) под контролем индекса протромбина, содержание которого должно быть не выше 30—40%. Для лизиса
7.86. Локализация наиболее типичных эмболических закупорок и примерный верхний уровень ишемии конечностей [Князев М. Д., Белорусов О. С, 1977].
эмбола или тромба применяют препараты, повышающие фибринолитическую активность крови. Наибольшим распространением пользуется фибринолизин, который успешно применяется как при острых артериальных тромбозах, так и при эмболиях. Препарат применяют в суточной дозе 20000—40000 ЕД. При необходимости дозу можно увеличить до 70000—80000 ЕД. Препарат применяют в течение 2—4 сут. В последнее время в клиническую практику все шире внедряется для лечения острых артериальных закупорок активатор профибринолизина—стрептокиназа (стреп-таза). По данным Е. И. Чазова (1966), стрептокиназа медленнее, но более стойко, чем фибринолизин, повышает фибринолитическую активность крови. Поэтому для ускорения повышенной фибринолитической активности рекомендуется введение \'4 разовой дозы быстро, в течение 20—30 мин. Стрептокиназа вводится внутривенно капельно в дозе 200000—300000 ЕД с 10000—15000 ЕД гепарина в течение 3—4 ч. Суточная доза составляет 500000—750000 ЕД.
Хирургическое лечение. Операции у больных с острыми артериальными окклюзиями конечностей, к сожалению, дают много неудовлетворительных результатов. И если вопрос о методе восстановительных и реконструктивных операций решен окончательно, то сроки их выполнения до сих пор четко не определены, хотя общая тенденция к проведению операций в ранние сроки не вызывает споров. Многие хирурги считают, что предельным сроком для выполнения операций является 12 ч после возникновения эмболии. R. Fontaine приводит такие цифры: в сроки до 10 ч с момента закупорки артерии кровоток удалось восстановить у 66% больных, вторичная ампутация произведена у 25,9%; в сроки от 10 до
705
24 ч восстановлен кровоток у 43% больных, вторичная ампутация сделана 19% больным; после 24 ч кровоток восстановлен у 31%, а вторичная ампутация выполнена также у 31% больных.
Операцией выбора при эмболиях является эмбоджтолшя в «чистом» виде, хотя чаще приходится выполнять эмбол-тромбэктомию, так как почти всегда имеется вторичный тромб на значительном протяжении сосуда. При склеротически измененных сосудах эмболтромбэктомия может сочетаться с эндартерэктомией. боковой пластикой артерии или даже операцией шунтирования. Долгое время хирурги применяли метод прямой эмболэктомии. Однако прямая э м -болэктомия возможна при поражении поверхностно расположенных сосудов, бедренных, подмышечных и плечевых артерий. При закупорке глубоко лежащих сосудов—бифуркации аорты, подвздошных, подколенных и подключичных артерий—прямая эмболэктомия сложна и трудоемка, так как требует выделения и обнажения этих сосудов. Эти факторы и способствовали разработке методики непрямой эмболэктомии. когда ретроградно или антеградно удаляется эмбол из труднодоступного сосуда через поверхностно расположенную непораженную артерию. Так, обычно при непрямой эмболэктомии из бифуркации аорты, подвздошных артерий и подколенной артерии эмбол удаляют через бедренную артерию, а на верхних конечностях—через плечевую или подмышечную. Методы непрямого удаления эмболов различны: используются зонды, катетеры, пинцеты, зажимы, петли и т. п.
Большим достижением в сосудистой хирургии явилось внедрение в практику атравматических баллонных катетеров [FogartyT., 1963].
Эмболэктомия из бифуркации аорты и подвздошных артерий в настоящее время чаще выполняется с использованием катетера Фогерти (доступ чрезбедренный).
Операцию можно выполнить под наркозом или под местной анестезией (рис. 7.87). Делают продольные разрезы под пупартовой связкой, достаточно широко выделяют общую, глубокую и поверхностную бедренную артерии с обеих сто-
рон. Производят периартериальную симпатэктомию. После пережатия сосудистыми зажимами или турникетами осуществляют поперечную артериотомию общей бедренной артерии на '/з ее окружности, в просвет сосуда вводят катетер Фогерти и продвигают его в центральном направлении на 20—25 см. При прохождении катетера через эмбол хирург ощущает небольшое препятствие. После этого баллончик катетера раздувают путем введения в катетер 3—4 мл изотонического раствора хлорида натрия или новокаина и катетер медленно извлекают из артерии вместе с эмболом. Иногда для полного удаления эмбола и получения пульсирующего кровотока данную манипуляцию повторяют. При восстановлении кровотока по подвздошной артерии катетер поочередно вводят в глубокую и поверхностную бедренные артерии до получения хорошего ретроградного кровотока. То же самое делают и на противоположной стороне. Стенку артерии ушивают непрерывными швами атравматическими иглами.
При эмболии общей бедренной артерии операцией выбора является прямая эмболэктомия. Доступ к артерии на уровне и ниже пупартовой связки. Обнажают общую поверхностную и глубокую бедренную артерии и каждую из них берут на держалки. Затем общую бедренную артерию пережимают выше места расположения эмбола и поперечно ее рассекают на 1/з диаметра. Зажим на бедренной артерии приоткрывают—эмбол может «вымыться» из сосуда током крови; если этого не произойдет, его осторожно удаляют каким-либо инструментом или выдавливают. Артериометрическое отверстие ушивают непрерывным обвивным швом с использованием атравматических игл 4/0.
При эмболии поверхностной бедренной артерии в ее средней трети, а также глубокой артерии бедра и подколенной артерии методом выбора является эмболэктомия катетером Фогерти через бедренную артерию (рис. 7.88). Возможна и прямая эмболэктомия из подколенной артерии, которая осуществляется из заднего доступа на бедре и внутренней поверхности верхней трети голени.
Эмболэктомия из артерий верхних конечностей принципи-
706
ально ничем не отличается от таковой на нижних конечностях. Как правило, при закупорке плечевой и подмышечной артерии операцией выбора является прямая эмболэк-томия. При эмболиях подключичной артерии эмболэктомия осуществляется зондом Фогерти через плечевую и подмышечные артерии.
Результаты лечения. Результаты эмболэктомии значительно улучшились с применением катетера Фогерти. Так, М. Д. Князев и О. С. Белорусов (1977) отметили, что до использования метода баллонной эмболэктомии они имели 8,6% ампутаций и 27,2% летальных исходов, а после эмболэктомии катетером Фогерти число ампутаций снизилось до 3,1%, а летальность до 18%.
По данным этих же авторов, эмболэктомия, выполненная в первые 12 ч от момента закупорки артерии, дала хорошие результаты в 76% случаев (ампутации составили 2.1%). При эмболэктомиях через 12—24 ч хорошие результаты получены у 69% больных (ампутации выполнены у 4,6% больных).
При эмболэктомиях, выполненных через 24 ч, хорошие результаты составили 56% (выполнены у 15% больных). Общая летальность при эмболэктомиях артерий независимо от их локализации составляет 20,3%.
При операциях по поводу острых тромбозов аорты и артерий верхних и нижних конечностей хорошие результаты получены у 60,5% больных, летальность составила 10.3%.
А. А. Шалимов и Н. Ф. Дрюк (1979) при лечении больных с острой артериальной ишемией верхних и нижних конечностей с использованием для эмболэктомии баллонных катетеров получили хорошие результаты у 76,4% больных, послеоперационная летальность составила 18%.
7.11. ПОВРЕЖДЕНИЯ МАГИСТРАЛЬНЫХ СОСУДОВ
Частота и характер повреждения сосудов. До недавнего времени сосудистый травматизм считался прерогативой военного времени. Тем не менее многие отечественные и зару-
бежные авторы — Я. В. Волколаков. С. Н. Тхор (1979): А.А.Шалимов. Н. Ф. Дрюк. И.И.Сухарев (1979, 1984): М. Д. Князев. А. В. Алексеев (1980); Н. А. Шор (1984); D. Linder. J. Vollmar (1965)—приводят убедительные данные о значительном росте сосудистого травматизма в мирное время, который в общей структуре травматизма составляет до 2%. Среди причин травматизма 51.1% приходятся на колото-резаные раны, в большинстве случаев полученные в быту такими предметами, как нож. стекло, гвоздь, и 35,5% составляют тупые травмы. Более половины травм имеет закрытый характер [Шор Н. А.. 1984]. В мирное время повреждение сосудов носит ятрогенный характер и у детей встречается в 50% случаев от общего числа травм сосудов [Комаров Б. Д., Леменев В. Л., 1975]. Огнестрельные ранения в мирное время встречаются в 13,9% случаев, большинство из них—это ранения сосудов дробью, мелкими осколками детонаторов и редко—пулями.
В целом в мирное время на долю повреждений магистральных сосудов верхних конечностей приходятся 32,3%, нижних конечностей—58.8%, шеи—5,63%, груди—0,3%, живота и забрюшинного пространства—2.97%.
Классификация. Большинство известных классификаций не соответствует современному уровню развития сосудистой хирургии, они построены на материалах военных лет и отражают в основном патологию огнестрельных ранений [Плоткин Ф. М.. 1946: Арутюнов А. И.. 1949; Петровский Б. В.. 1949]. Наибольший интерес представляет классификация М. И. Лыткина и В. П. Коломейца (1973).
Варианты наиболее типичных повреждений сосудов, по М. И. Лыткину и В. П. Коломейцу: 1) травматическая ди-стония артерии с артериальным спазмом; 2) слепое огнестрельное ранение, проникающее в просвет сосуда; 3) контузия артерии с кровоизлиянием в стенку сосуда; 4)сквозное огнестрельное ранение с разрушением всех слоев противоположных участков стенки сосуда: 5) ранение стенки сосуда с образованием пульсирующей гематомы: 6) ранение близлежащих артерий и вены с образованием свища.
Интерес представляет и классификация Н. А. Шора. Ав-
707
тор различает ранения и закрытые повреждения сосудов, которые по клиническому течению могут быть свежими и осложненными. Кроме того, он выделяет последствия повреждений магистральных сосудов: травматические артериальные и артериовенозные аневризмы (артериовенозные свищи), болезнь перевязанного сосуда, ишемическую («фолькмановскую») контрактуру.
Клинические признаки повреждения сосудов. Это прежде всего кровотечение, появление гематомы, отсутствие пульса дистальнее области повреждения, различные ишемические проявления. Однако частота всех этих симптомов неодинакова, некоторые из них в ряде случаев выражены слабо. Кроме того, следует учитывать, что диагностика сосудистой травмы почти всегда связана с экстренной ситуацией. Очевидно, в силу этого как в военное, так и в мирное время часто допускаются роковые ошибки при диагностике травмы магистральных сосудов. Так, по данным Б. В. Петровского (1949), во время Великой Отечественной войны у 34% раненых диагноз повреждения магистральных сосудов был поставлен лишь тогда, когда образовались пульсирующие гематомы или аневризмы. В мирное время при сосудистой травме количество диагностических ошибок также превышает 30% [Ратнер Г. Л., 1965; Захарова Г. Н., 1975].
Наличие раны в проекции сосуда является одним из частых и постоянных симптомов повреждения магистральных сосудов. Этот признак при открытых повреждениях наблюдается в 76—83% случаев. Расположение раны в зоне сосудистого пучка в большинстве случаев является одним из вероятных признаков повреждения.
Кровотечение из раны—следующий наиболее часто встречающийся симптом повреждения магистрального сосуда при открытых травмах. Данный признак наблюдается у 50—80% пострадавших. Но следует учитывать тот факт, что при поступлении в стационар кровотечения уже может не быть, поэтому необходимо всегда тщательно расспросить пострадавшего или сопровождавших его лиц о наличии и величине кровотечения на месте происшествия и правильно оценить полученные данные.
Гематома является характерным признаком повреждения магистрального сосуда и встречается в 43—56% случаев как при открытой, так и при закрытой травме. Как правило, непосредственно после травмы гематома имеет разлитой характер и не пульсирует, хотя встречаются пульсирующие гематомы и непосредственно после повреждения сосуда. Однако в большинстве случаев пульсирующая гематома с четкими контурами формируется через несколько дней после ранения сосуда.
Над областью поврежденного сосуда выслушивается шум, что также является одним из достоверных признаков повреждения. Как правило, шум наиболее отчетливо выслушивается в период формирования пульсирующей гематомы, однако в ряде случаев он аускультативно определяется и при свежих ранениях сосудов.
Изменение пульса дистальнее места повреждения является, пожалуй, наиболее постоянным симптомом как открытых, так и закрытых повреждений сосудов и встречается в 85—96% случаев. Однако отсутствие или ослабление пульса в каждом отдельном случае следует оценивать дифференцированно.
Ишемические проявления при повреждении сосудов складываются из ряда отдельных симптомов, указывающих на
нарушение кровоснабжения в поврежденной конечности! К подобным симптомам относятся бледность кожных noJ кровов, их похолодание, снижение чувствительности, больл ишемическая контрактура и, наконец, гангрена дистальныи отделов конечности. Подобные симптомы встречаются у 49% больных при открытой травме и у 70%—при закры-1 тых повреждениях.
Диагностика. В последние годы такие методы исследова-] ния, как осциллография, кожная термометрия, капилляро-j скопия, используются редко. Возрастает роль и расширяют-1 ся показания к применению высокоинформативных методов] исследования, таких, как контрастная ангиография, ультра-] звуковая допплерография.
Рентгеноконтрастные методы исследования рекоменду-1 ются во всех сомнительных случаях, особенно при закрытой травме, сочетающейся с повреждением костей и мягких | тканей.
Наиболее достоверным признаком нарушения целостности сосуда и его проходимости является отсутствие его контрастирования на определенном уровне. При полном пересечении сосуда отмечают полное прекращение поступления контрастного вещества, которое как бы обрывается по прямой поперечной линии; при травматическом же тромбозе линия обрыва контрастного вещества имеет неровный характер за счет «обтекания» контрастированной кровью тромба. Причем в обоих случаях при ангиографии выявляют сеть хорошо выраженных коллатералей, идущих дистальнее места повреждения (обрыва). Достоверным ангиогра-фическим признаком повреждения сосуда является поступление контрастного вещества за пределы сосуда и скапливание его в мягких тканях в виде «депо» (рис. 7.89).
При сочетанном повреждении артерии и вены и образовании между ними фистулы оба сосуда контрастируются одновременно (рис. 7.90).
Ультразвуковая допплерография позволяет определить линейную скорость кровотока в исследуемом сосуде на слух или записать соответствующие кривые и измерить их высоту. Сам по себе данный неинвазивный способ весьма прост, может неоднократно использоваться у одного и того же больного на различных этапах исследования. Этот метод позволяет измерить и регионарное кровяное давление в различных сосудах конечности.
Географические исследования также относят к числу неин-вазивных методов, хорошо изученных и применяемых при обследовании больных с патологией сосудов.
Хирургическое лечение. Хирургическая тактика в лечении повреждений сосудов прежде всего должна зависеть от сроков и особенностей травмы. Принципиально следует различать свежие повреждения сосудов, которые встречаются значительно чаще—в 65—76% случаев [Бабовников В. Г., 1975], и осложненные повреждения сосудов и их последствия. По данным М. Д. Князева (1975), показаниями к экстренной операции являются продолжающееся кровотечение, острый тромбоз артерий с выраженной ишемией конечности. По данным Б. Д. Комарова и В. Л. Леменева (1975), наиболее благоприятные исходы от восстановительных операций можно получить в сроки до 6 ч. Если же с момента травмы прошло 8—10 ч и при этом имеются частичная потеря чувствительности, отек и контрактура мышц, то результаты оперативного лечения, как правило, бывают неудовлетворительными; порой развивается тяжелая смер-
708
тельная интоксикация, а операции, выполненные через 10— 12 ч, как правило, не могут восстановить жизнедеятельность конечности. Американские хирурги L Bizer (1969) и R. Hewitt (1969) также считают 6-часовую отсрочку максимальной для хорошего эффекта при восстановительных операциях. Эти данные, несомненно относятся и к ятроген-ным повреждениям сосудов, особенно связанным с катетеризацией сосудов в диагностических и лечебных целях. На основании собственного опыта Л. И. Клионер, В. Р. Маму-лашвили (1985) считают, что раннее оперативное лечение ятрогенного повреждения сосуда необходимо. Так. среди оперированных 56 больных с ятрогенным повреждением сосудов среднее время до начала операции составило 4,8 ч. У 49 больных удалось выполнить «чистую» тромбэктомию, у 2—резекцию бедренной артерии с анастомозом конец в конец и у 5—тромбэктомию с резекцией бедренной артерии и ауто- или аллопротезированием последней.
В настоящее время во многих клиниках проводят регионарную перфузию, направленную на удаление и нейтрализацию токсических веществ из ишемизированной конечности. Г. Н. Захарова (1975) сообщает о целесообразности сочетания изолированной регионарной перфузии с одновременным включением в замкнутую систему аппарата «искусственная почка».
В последние годы благодаря работам Ю. М. Лопухина и его школы для дезинтоксикации успешно используется метод гемосорбции.
Особенно сложен вопрос о хирургической тактике при сочетанных повреждениях сосудов, костей, нервных стволов. Считается, что при переломе костей целесообразно выполнять остеосинтез до восстановления магистрального кровотока, так как прочное скрепление костных фрагментов облегчает выполнение последующих этапов восстановительных операций. При небольших сочетанных повреждениях сосудов и нервов многие авторы применяют первичный шов нервов [Шалимов А. А., Дрюк Н. Ф., 1979]. При значительных сочетанных повреждениях первичный шов нервов можно накладывать через 8—10 дней [Шор Н. А., 1984]. В последние годы с развитием микрохирургической техники стали возможны операции реимплантации отторгнутой верхней конечности, пальцев и кисти. В нашей стране накоплен достаточный опыт подобных операций [Петровский Б. В.. Крылов В. С, 1976].
Общие принципы оперативной техники при повреждении артериальных сосудов. Даже при небольших повреждениях и ранениях в области проекции сосудов тактика хирурга должна оставаться активной и экстренной. Следует стремиться к выполнению операции до развития тяжелых ишемических и интоксикационных расстройств. Все подобные раны подлежат первичной хирургической обработке с ревизией сосудистого пучка. Иногда следует широко рассечь мягкие ткани и провести тщательную ревизию прилежащих сосудов. В сомнительных случаях необходимо прибегнуть к использованию специальных диагностических методик и прежде всего ангиографии. Хирург в любых случаях должен стремиться к выполнению восстановительной операции на сосудах, естественно при правильной оценке всех элементов данного повреждения. Противопоказанием к ре-конструктивно-восстановительной операции на сосудах, особенно с использованием синтетических материалов, является гнойная инфекция в ране [Князев М. Д., Белорусов О. С,
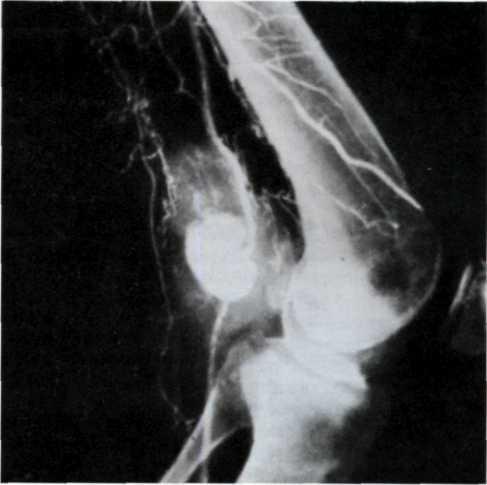
7.89. Ангиограмма при повреждении магистральных сосудов.
Определяется выхождение контрастного вещества из поврежденного сосуда с формированием депо.
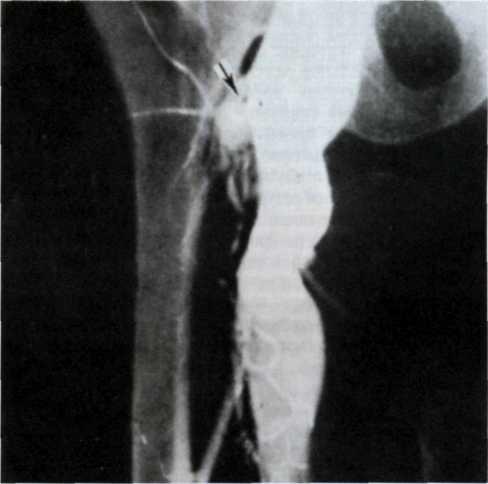
7.90. Ангиограмма при повреждении магистральных сосудов. Одновременно контрастирующей артерии и вены при соче-танном повреждении и наличии травматического свища (указано стрелкой).
709
1975]. Инфицированная рана, как правило, вызывает вторичные эрозивные кровотечения, смертельные исходы.
Оперативная тактика при повреждениях артериальных сосудов начинается с выделения артерий выше и ниже места повреждения и наложения на нее сосудистых зажимов. В ряде случаев при наличии обширной гематомы, особенно с признаками пульсации, артерию с проксимального конца следует вьщелить на протяжении и взять на держалку или в турникет. Затем производят тщательную ревизию сосудов, прилежащих к ране.
Если травма закрытая, то, используя соответствующий типичный доступ, обнажают сосудистый сегмент и после остановки кровотечения осуществляют тщательную ревизию поврежденного сосуда. При ревизии сосуда необходимо определить протяженность его повреждения, наличие и величину тромба, состояние окружающих тканей. Если имеется подозрение на повреждение внутренней оболочки сосуда, необходимо произвести частичную или циркулярную арте-риотомию и соответствующую ревизию. Если повреждение сосуда сопровождается тромбозом, необходимо выполнить тромбэктомию из проксимального и дистального концов сосуда до получения хорошего анти- и ретроградного кровотока. Тромбы, как правило, удаляют баллонными катетерами типа катетера Фогерти, а из мелких сосудов (а также у детей)—катетерами типа Грюнцига, т. е. баллонами меньшего диаметра. Все эти манипуляции, начиная с первого этапа, следует проводить после введения 5000 ЕД гепарина во избежание вторичного тромбоза поврежденного сосуда. Само оперативное вмешательство на поврежденном артериальном сосуде заключается чаще всего в наложении бокового или циркулярного шва. Так, при боковых (пристеночных) ранениях без размозжения сосуда накладывается боковой поперечный или продольный шов; если он суживает просвет сосуда, то на рану в нем целесообразнее наложить аутове-нозную заплату. При полном разрыве сосуда и незначительном размозжении краев последние должны быть экономно освежены и соединены при помощи циркулярного шва по принципу конец в конец. Если имеется значительное натяжение сосуда, то перед наложением анастомоза сосуд следует достаточно иммобилизовать и перевязать мелкие ветви. При значительном повреждении сосуда на протяжении более 3—5 см показана реконструктивная операция путем пластического замещения дефекта аутовенозным трансплантатом или синтетическим сосудистым протезом. При подозрении на возможное инфицирование раны синтетические протезы лучше не делать; применение аутовенозного трансплантата допустимо. При наложении анастомозов между артериями среднего калибра лучше формировать «скошенные» анастомозы для увеличения их диаметра.
Общие принципы оперативной тактики при повреждении магистральных вен. До недавнего времени при ранениях магистральные вены перевязывают. Но перевязка магистральных вен, особенно в бассейне нижней полой вены, влечет за собой тяжелые осложнения (развитие хронической венозной недостаточности конечностей). При перевязке самого ствола нижней полой вены ниже почечных вен развивается тяжелейший «синдром нижней полой вены», практически не поддающийся хирургическому лечению. Поэтому в настоящее время признано необходимым восстанавливать проходимость вен как при изолированном повреждении ствола, так и при одновременном по-
вреждении артерий. Характер восстановительных операций на венах принципиально не отличается от операций восстановления артериальных стволов, хотя и имеет свои особенности. При пристеночных ранениях вены также накладывают боковой шов в поперечном или продольном направлении; правда, в данном случае опасность сужения просвета вены невелика, поскольку ее диаметр намного больше, чем диаметр артерии.
Циркулярное пересечение вены и дефект в ее стенке устраняются наложением циркулярного шва и соединением концов поврежденной вены по принципу конец в конец. При значительном дефекте в одной из венозных стенок его закрывают при помощи аутовенозной «заплаты». Гораздо сложнее осуществить пластическое замещение участка вены при ее обширном повреждении. В данном случае особенности венозной гемодинамики не позволяют применять аллопротезы из-за их раннего тромбирования. Аутовеноз-ные трансплантаты более пригодны для пластики вен, но их часто нельзя использовать вследствие небольшого диаметра и протяженности. Тем не менее существует ряд стандартных операций, главным образом аутовенозного шунтирования, которые применимы при значительных нарушениях магистральных венозных стволов. При одновременном поражении артерий и вен вопрос о последовательности восстановления сосудов окончательно не решен. Очевидно, в данном случае это зависит от степени ишемии конечности. При тяжелых формах ишемии III степени в первую очередь восстанавливают артерии. При нерезко выраженной ишемии I—II степени можно в первую очередь восстановить венозный отток. В послеоперационном периоде при ранении вен важны ранняя активизация больного и антикоагулянтная терапия, которая, как и при артериальной травме, должна продолжаться длительное время после выписки больного из стационара. При невозможности выполнения реконструктивной операции, что чаще всего наблюдается при инфицированных, размозженных ранах с повреждением артерий и вен на протяжении, приходится перевязывать артерии. При этом в ряде случаев развивается острая артериальная недостаточность с переходом в гангрену конечности. Гангрена конечности может развиться при перевязке наружной подвздошной артерии (у 20—25% больных), бедренной (у 6—10%), подколенной (у 10—26% больных). При лигировании подключичной артерии гангрена развивается реже—у 8—9% больных, подмышечной—у 9—10%, плечевой—у 2—3%.
Последствия повреждения сосудов бывают ранними, выявляющимися в сроки от 3 дней до нескольких недель (пульсирующие гематомы, вторичное кровотечение, нагноение), и относительно поздними, возникающими в результате нераспознанного свежего дефекта сосуда и неправильно выбранного метода консервативного метода лечения [Шор Н. А., 1984].
Артериальная аневризма, как правило, бывает ложной, развивающейся из пульсирующей гематомы. Аневризмы сдавливают окружающие ткани, а также нервные стволы, что может вызвать нарушение функции конечности. Главная опасность состоит в их внезапном разрыве и профузном угрожающем жизни кровотечении. Поэтому хирургическое лечение травматической артериальной аневризмы должно быть ранним—сразу же после установления диагноза. В настоящее время, как правило, выполняют реконструктивные
770
операции с резекцией аневризмы и восстановлением целостности сосуда.
Артериовенозные фистулы или аневризмы, возникающие вследствие сочетанного повреждения артерий и вен, также развиваются через определенное время после ранения сосудов. Клинические признаки артериовенозной фистулы: сис-толодиастолический шум над фистулой, симптом Добровольской, нарушения венозного оттока различной степени выраженности. Восстановительная операция при данной патологии заключается в перевязке артериовенозного свища или резекции артериовенозной аневризмы. Если у больного уже развилась хроническая венозная недостаточность, то вторым этапом можно сделать операцию на венах (типа операции Линтона).
Посттравматическая окклюзия, развивающаяся при перевязке сосуда или его тромбозе, как правило, занимает обширную зону, гораздо большую, чем зона первичного повреждения. Локализация и протяженность посттравматической окклюзии определяются на ангиограммах. При выраженных клинических симптомах хронической ишемии конечности в виде перемежающейся хромоты, болей, различных видов нарушения трофики показано оперативное лечение. Используют различные варианты шунтирования или, реже, протезирование непроходимого участка сосуда (как при хронических облитерирующих процессах в артериях).
Непосредственные и отдаленные результаты. Лечение повреждений магистральных сосудов сопровождается многочисленными осложнениями, частота которых достигает 27— 50%. Так, по данным Н. А. Шора (1984), непосредственно в послеоперационном периоде у 32,3% больных наблюдались различные осложнения: шок, интоксикация, кровотечение, ишемическая гангрена конечности, тромбозы оперированного сосуда, тромбофлебит, нагноение раны.
По данным А. А. Шалимова и Н. Ф. Дрюка (1979), из 70 оперированных ампутировать конечности пришлось у 28,5% больных, умерли 7,1%.
В отдаленные сроки наблюдения (до 12 лет) проходимость сосуда сохранялась у 85,1% больных, а тромбоз сосуда с коллатеральной компенсацией—у 14,9%. Функциональные результаты были хорошие у 75,2% пострадавших, удовлетворительные—у 20,8% и плохие—у 4% [Шор Н. А., 1984].
7.12. КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЙ ВЕНОЗНОЙ СИСТЕМЫ
Какой-либо общей классификации заболеваний вен в настоящее время не существует. Многие предложенные классификации [Кузин М. И., Васютков В. Я., 1966; Аскерха-нов Р. П., 1969; Клионер Л. И., 1969; Савельев В. С. и др., 1972; Климов В. Н. и др., 1979; Шалимов А. А., Сухарев И. И., 1984] отражают отдельные стороны патологического процесса при острых и хронических заболеваниях различных уровней венозной системы. Такие классификации оправданы, они нужны для практической работы врачей многих специальностей и особенно хирургов-флебологов. Однако для правильной ориентации в многообразии форм патологических процессов в венах предлагается общая классификация, в которой вся венозная система разделена на две
части—систему верхней полой вены и ее магистральных притоков и систему нижней полой вены (схема 7.3). Обе венозные системы патологии поражаются различно.
Нижняя полая вена и ее магистральные притоки отличаются значительно большим числом заболеваний. Патологические процессы в ней характеризуются острыми тромбозами. Последние имеют тенденцию трансформироваться в посттромбофлебитический синдром (ПТФС)—хроническую стадию. При этом поражаются глубокие и поверхностные сегменты системы, что приводит к развитию хронической венозной недостаточности нижних конечностей. Кроме того, острые тромбозы глубокой системы нижней полой вены в ряде случаев вызывают тяжелейшие осложнения, к которым в первую очередь относятся эмболия легочной артерии и венозная гангрена, так называемая синяя флегма-зия. Другим очень распространенным заболеванием системы нижней полой вены является варикозное расширение поверхностных вен нижней конечности, которое также может вызвать хроническую венозную недостаточность.
Верхняя полая вена и ее магистральные притоки поражаются значительно реже. Непроходимость этих вен чаще связана не с острым тромбозом, а с внесосудистыми факторами. В большинстве случаев опухоли, располагающиеся в верхних долях легкого или средостения и постепенно сдавливающие ствол верхней полой вены или безымянные вены, вызывают так называемый синдром верхней полой вены. Пожалуй, единственным венозным сегментом системы верхней полой вены, в котором развивается острый тромбоз, является подключично-подмышечный. Острый тромбоз этого сегмента, называемый синдромом Педжета—Шретте-ра—наиболее часто встречающееся поражение системы верхней полой вены. Однако его острое начало не всегда бывает отчетливо выражено, и часто больные обращаются за помощью уже в хронической стадии этого заболевания, т. е. в стадии ПТФС верхних конечностей. Таким образом, при непроходимости самого ствола верхней полой вены и безымянных вен, т. е. при «синдроме верхней полой вены», так же, как и при синдроме Педжета—Шреттера, в целом ряде случаев отсутствует острое начало, характерное для острого тромбоза с четким разграничением хронической стадии. Поэтому разделить окклюзирующие заболевания верхней полой вены и ее магистральных притоков на острые и хронические трудно. Наиболее правильно объединять их под названием «окклюзии системы верхней полой вены».
Кроме указанных выше заболеваний, выделяют врожденные заболевания сосудов (ангиодисплазии) вообще и венозной системы в частности. К ним относятся чисто венозные формы (гемангиомы, аплазии и гипоплазии венозных стволов, венозные аневризмы), а также артериовенозные формы (гемангиомы, микро- и макрофистулы). Такие врожденные заболевания могут наблюдаться в обеих венозных системах и их магистральных протоках. Наконец, в равной степени могут быть поражены обе венозные системы и при повреждении сосудов вообще и вен в частности. Наиболее часто это отмечается при различного рода травмах, послеоперационных повреждениях и ятрогенных, которые особенно участились в настоящее время в связи со сложными методами исследования сердечно-сосудистой системы и длительным использованием вен для трансфузии крови и кровезамеща-ющих жидкостей.
711
7.13. ОСТРЫЕ ТРОМБОЗЫ СИСТЕМЫ НИЖНЕЙ ПОЛОЙ ВЕНЫ
Идею тромбэктомии при остром подвздошно-бедренном тромбозе предложил R. Leriche 1928 г., однако она была осуществлена лишь в 1937 г., когда Lawen выполнил операцию 3 больным с этой локализацией тромбоза с хорошим послеоперационным результатом. В настоящее время над данной проблемой активно работают многие клиники.
Этиология и патогенез. Венозный тромбоз является, как правило, острым заболеванием, в основе которого лежит образование тромба в просвете вены, связанное с воспалительным процессом (тромбофлебит) и нарушением оттока венозной крови. Для возникновения тромба в вене необходимы три условия: 1) замедление тока крови; 2) изменения состава крови и 3) повреждение сосудистой стенки. Однако степень значимости каждого из них трактуется по-разному. Одной из причин тромбофлебита является инфекция. По данным различных авторов, связь тромбозов с инфекцией выявлена у 37,2—84% больных [Сидорина Ф. И., 1959]. Многие клиницисты придают большое значение фактору аллергии при тромбофлебите. Пример аллергического тромбофлебита—болезнь Бюргера. Считается, что она развивается в результате сенсибилизации организма каким-либо аллергеном, в связи с чем возникают спазм сосудов и пролиферация эндотелия. Не менее важным в этиологии тромбофлебита является повреждение сосудистой стенки. Оно возникает не только при травме, но и при воспалении или изменении сосудов эндотелия в ответ на резорбцию раздражителя. В свою очередь состояние эндотелия вен имеет большое значение в этиологии тромбофлебита, так как эн-дотелиальные клетки выделяют в кровяное русло гепарин, а при повреждении сосудистой стенки эта функция нарушается. В ряде случаев решающим этиологическим фактором в развитии тромбофлебита может стать изменение физико-химического состава крови [Александрова Н. П. и др., 1977]. Нередко приходится наблюдать возникновение тромба и при нормальных показателях свертываемости крови и протромбина.
Важную роль в патогенезе тромбофлебитов, особенно в тканевом обмене, играет состояние лимфатической системы. А. Т. Лидский (1958) считает, что речь идет не столько о нарушении оттока крови от конечности, сколько о глубоких нарушениях лимфообразования.
Частота первичной локализации процесса тромбообразова-ния и пути его распространения. Большинство авторов считают, что при любой локализации тромбоза в системе нижней полой вены исходной точкой тромботического процесса являются вены, дренирующие мышцы голени [Зеленин Р. П., 1964; Фишман А.Г., 1964].
Так, например, A. Ochsner (1948) категорически утверждает, что не существует тромбоза бедренной вены без тромбоза задней большеберцовой вены. Другие авторы [Sapirstein W. et al., 1964], наоборот, считают, что в большинстве случаев тромбоз начинается в тазовых венах, и в дальнейшем процесс имеет нисходящий характер. Е. Г. Яблоков (1967), Л. И. Клионер (1969) полагают, что возможны оба пути развития этого заболевания. И наконец, ряд авторов [Courty L. et al., 1962] считают возможным «биполярный тромбоз», когда тромбоз одновременно начинается в венах голени и таза.
Распространение тромботического процесса с поверхностных и глубоких вен голеней на бедренную вену можно представить таким образом. Прежде всего оно может произойти с поверхностной венозной системы голеней на бедренную вену либо через большую подкожную вену бедра, либо через коммуникационные вены. Такой тромб имеет первоначально меньший диаметр, чем просвет бедренной
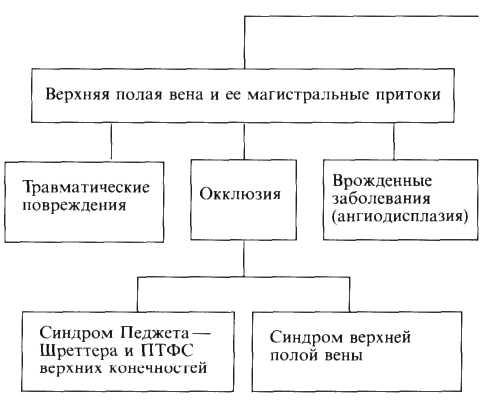
вены. Он не обтурирует вену и приобретает характер «флотирующего тромба», длина которого может достигать 15— 20 см. В этот период «флотирующий тромб» не дает клинической картины развития подвздошно-бедренного тромбоза, так как кровоток в этих венах сохранен. Однако в данной стадии процесса имеется высокая степень вероятности эмболии. S. Gjores (1962) считает, что при данной форме тромба легочные эмболии наблюдаются в 12,5% случаев, а летальность составляет до 5%. При первичном тромботиче-ском процессе в глубоких венах голеней и развитии восходящего тромбоза наиболее опасен момент перехода тромбоза с глубоких вен голеней на подколенную вену, так как диаметр тромба меньше подколенной вены, что создает условия для легочной эмболии. «Флотирующие тромбы» в системе нижней полой вены являются основной причиной массивной тромбоэмболии легочной артерии, причем наиболее часто такой тромб локализуется в илеокавальном сегменте (76,9%), реже в подколенно-бедренном сегменте (23,1%). Савельев В. С. и соавт. отмечают, что первичный тромботический процесс может локализоваться в общей, наружной или внутренней подвздошных венах. В то же время большой диаметр общей подвздошной вены (1,5— 1 см) и высокая скорость кровотока в ней (400 мл /мин) создают неблагоприятные условия для ее тромбирования. По-видимому, для тромбоза этой вены должны существовать дополнительные местные факторы, препятствующие кровотоку. Из внутрисосудистых факторов, способствующих первичному тромбозу общей подвздошной вены, прежде всего следует отметить перегородки и спайки, нарушающие кровоток в ней. Однако эти факторы являются только предрасполагающими, а не вызывающими тромбоз, так как для его развития необходимо сочетание ряда факторов (нарушение свертывающей и антисвертывающей систем крови, повреждение сосудистой стенки, нарушение гемодинамики и пр.). И наконец, последним фактором, от которого зависит локализация первичного тромботического процесса в системе нижней полой вены, является сама вена.
772
СХЕМА 7.3. КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЙ ВЕНОЗНОЙ СИСТЕМЫ
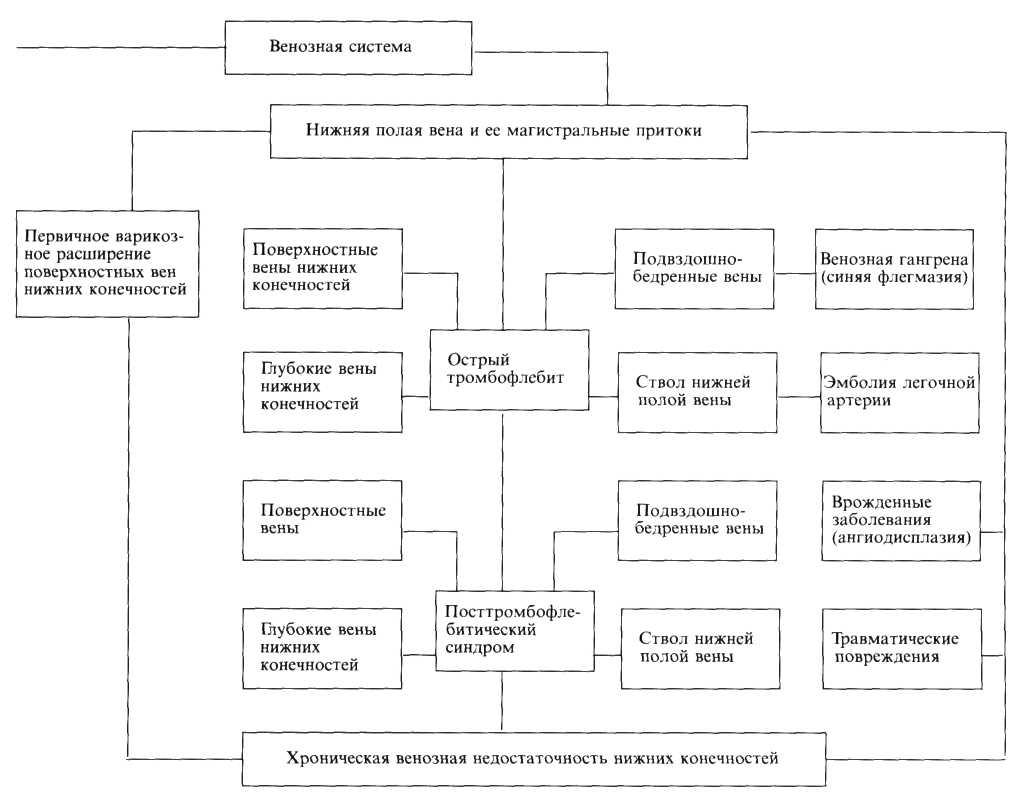
Классификация тромбофлебита н стадии развития тромбо-гического процесса. Наиболее распространенной является классификация тромбофлебитов по клиническому течению. Выделяют острую, подострую и хроническую стадии тромбофлебита [Лидский А. Т., 1958; Алексеев П. П., 1967]. Спорным остается вопрос о сроке, в течение которого тромбофлебит следует считать острым. В настоящее время основными критериями для определения тромбофлебита как острого процесса должны быть хирургическая тактика и локализация первичного тромботического процесса, так как в острой стадии болезни можно выполнить тромбэктомию без значительного повреждения внутренней оболочки сосуда
и повторного ретромбоза. Продолжительность этой стадии крайне индивидуальна у различных больных и зависит прежде всего от локализации первичного тромботического процесса. По мнению В. С. Савельева (1972), она может длиться от нескольких дней до 1 мес. А. А. Шалимов, И. И. Сухарев (1984) считают, что продолжительность острой стадии обычно 7—14 дней, затем она переходит в подострую и через 3 мес начинается хроническая стадия. Л. И. Клионер (1969) предложил более широкую трактовку этиопатогенеза и клиники тромбофлебита, обобщив свои наблюдения в новой классификации:
I. По локализации первичного тромботического процесса и путям его распространения.
Система нижней полой вены: а) вены, дренирующие мышцы голени; б) илеофеморальный сегмент; в) подпочеч ный, почечный, надпочечный сегменты и т. д. или весь ствол нижней полой вены; г) сочетанный каваилеофеморальный отдел; д) сочетанный тотальный тромбоз всей глубокой венозной системы нижней конечности.
Система верхней полой вены: а) сегменты выше устья ствола верхней полой вены, на его уровне, ниже устья; б) весь ствол верхней полой вены; в) ствол верхней полой вены и безымянные вены (одно- и двустороннее поражения);
773
г) подмышечно-подключичный сегмент; д) сочетанный тотальный тромбоз всей глубокой венозной сети верхней конечности.
II. По этиологическому признаку. Тромбозы в результате: 1) инфекций; 2) травм; 3) операций; 4) родов; 5) варикозно измененных вен; 6) аллергических состояний и обменных нарушений процессов; 7) интравазальных врожденных и приобретенных факторов (перегородки, диафрагмы, спай ки, атрезии); 8) экстравазальных врожденных и приобретен ных факторов (сдавления венозной стенки артериями, опухо лями, аневризмами аорты, медиастиниты).
III. По клиническому течению.
Острый тромбофлебит.
Подострый тромбофлебит.
Посттромбофлебитический синдром (ПТФС).
Острый тромбофлебит, развивающийся на фоне ПТФС.
IV. По степени возникновения трофических нарушений и расстройства гемодинамики.
Легкая форма.
Средняя форма.
Тяжелая форма.
В. С. Савельев и соавт. (1972) предлагают различать острый тромбоз:
По локализации: а) тромбоз магистральных вен нижних конечностей — нижний сегмент; б) тромбоз наружной и об щей подвздошных вен — средний сегмент; в) тромбоз ниж ней полой вены — верхний сегмент.
По этиологическому фактору: первичный и врож денный.
По клиническому течению: стадия компенсации и ста дия декомпенсации.
Приведенные выше классификации, хотя их нельзя назвать универсальными, отражают основные этиологические и клинические особенности болезни и могут быть использованы в повседневной практике.
Клиника. Клиническая картина острых тромбозов системы нижней полой вены зависит прежде всего от первичной локализации тромба.
Клиническая картина острого тромбоза глубоких вен голени довольно бедна, так как при непроходимости одной или двух вен остальные глубокие вены голени остаются проходимыми и значительных расстройств гемодинамики не наступает. Наиболее часто возникают боли в икроножных мышцах, усиливающиеся при движениях в голеностопном суставе. Частым и важным симптомом заболевания является повышение температуры кожных покровов пораженной голени за счет усиления кровотока по поверхностным венам. Наиболее типичный клинический признак—болезненность при пальпации мышц голени. Из клинических проб наиболее характерен симптом Хоманса: при движении стопами в тыльном направлении появляются боли в икроножных мышцах. Однако этот симптом не всегда достоверен. W. Moses (1946) предложил тест для диагностики тромбоза глубоких вен голени: при сдавлении голени в пе-реднезаднем и боковых направлениях возникает боль. R. Lowenberg (1955) с этой целью использовал манжету сфигмоманометра. Если боль появляется в икроножных мышцах при давлении ниже 150 мм рт. ст., то симптом считается положительным. Вторым по частоте признаком тромбоза глубоких вен голени является отек стопы, лодыжек и голени. При сомнительных клинической картине и клинических пробах больному показано флебографическое исследование (дистальная флебография), которое помогает поставить правильный диагноз.
Клиническая картина острого подвздошно-бедренного тромбоза зависит от стадии болезни. В. С. Савельев и соавт. (1972) выделяют стадии компенсации и декомпенсации. В стадии компенсации, как правило, гемодинамических нарушений не бывает. Обычно наблюдается как бы беспричинное повышение температуры, боли в пояснично-крестцовой области, внизу живота или в нижней конечности на стороне тромбоза. Одним из грозных осложнений этого периода являются эмболии легочной артерии. Е. Г. Яблоков (1977) сообщает, что, по данным илеокавальной флебографии, «флотирующие тромбы» наиболее часто (29,9%) располагаются в нижней полой вене и исходят из устья левой общей подвздошной вены в 29,9%, а в 7,6% случаев—из правой подвздошной вены. Длительность стадии компенсации зависит от локализации тромба и может продолжаться от 1 сут до 1 мес. Клиническая диагностика этого периода сложна.
В стадии декомпенсации боли резко усиливаются, локализуются либо в паховой области, либо на медиальной поверхности бедра и в икроножных мышцах. Выражен резкий отек всей нижней конечности, вплоть до паховой складки. У некоторых больных он распространяется на мошонку, ягодицу и переднюю брюшную стенку на стороне поражения. Резко меняется окраска кожи на пораженной конечности, она может быть либо бледно-молочной, либо фиолетово-цианотич-ной. Подкожные вены на бедре, особенно в паховой области, и на передней стенке на стороне поражения могут быть расширенными. По данным В. С. Савельева и соавт. (1972), острые подвздошно-бедренные венозные тромбозы могут протекать в легкой, среднетяжелой и тяжелой формах.
Клиника острых тромбозов нижней полой вены достаточно яркая и характерная. На первое место выступают отеки нижних конечностей, половых органов, нижней половины туловища. Поверхностные вены передней брюшной стенки резко расширяются. Степень выраженности симптомов зависит от уровня тромбоза ствола нижней полой вены. Обычно выделяют тромбозы подпочечного, почечного и печеночного сегментов нижней полой вены. При остром неполном тромбозе подпочечного сегмента нижней полой вены болезнь вначале может протекать почти бессимптомно. Этот период очень опасен тем, что сохраненный венозный кровоток в тромбированной вене создает благоприятные условия для возникновения эмболии легочной артерии. Клинические признаки тромбоза подпочечного (дистального) сегмента нижней полой вены появляются, когда нисходящий тромбо-тический процесс распространится на другую подвздошную вену. При тромбозе почечного сегмента нижней полой вены, часто приводящем к смерти больных, первым клиническим признаком является боль в области поясницы в проекции почек. Затем присоединяются олигурия, иногда анурия с признаками уремии. Тромбоз печеночного сегмента нижней полой вены приводит к развитию тяжелой клинической картины, обусловленной нарушением функции печени, портальной гипертензией, тромбозом воротной вены, т.е. к симптоматике так называемой болезни Хиари, которая развивается при первичном тромбозе печеночных вен. Клиническая симптоматика при тромбозе печеночного сегмента нижней полой вены характеризуется увеличением печени, селезенки, асцитом, выраженным расширением поверхностных вен передней брюшной стенки и нижней половины грудной клетки, отеками нижних конечностей, изменением
774
окраски кожи, вплоть до желтухи, диспепсическими расстройствами.
Диагностика. Основным методом специальной диагностики остается рентгеноконтрастная флебография. Флебографи-ческие признаки тромбоза: блокада вен, дефект наполнения вен, «ампутация» глубоких вен, обтекание тромба, отсутствие контрастированных магистральных вен, окольный кровоток. По массивности тромботического процесса различают флотирующий окклюзионный и неокклюзионный тромбы. Свежий неорганизованный тромб на флебограмме не обтурирует просвет вены, а свободно «плавает» в ней. Частично организованный тромб суживает просвет вены, а организованный окклюзирует венозный просвет. По данным А. А. Шалимова, И. И. Сухарева (1984), наиболее характерным признаком острого тромбоза, выявленного у 62% больных, был флотирующий тромб, при котором на флебограммах определялись интенсивные пристеночные контрастиро-ванные вены с наличием участков негомогенного распределения контрастного вещества. У 6,5% больных выявлен симптом окклюзии, у 7,2%—симптом дефекта наполнения вен. У 20,1% было сочетание симптомов флотации и окклюзии вен, у 3,6%—симптомов окклюзии и дефекта наполнения вен. Кроме того, у 97% больных выявлено нарушение регионарного кровообращения, выражающееся в замедленной эвакуации контрастного вещества из вен конечностей при дозированной мышечной нагрузке, что косвенно свидетельствует о нарушении функции «мышечного насоса» и венозной системы в целом.
В последние годы применяются и другие высокоинформативные функциональные методы диагностики острых венозных тромбозов. К ним прежде всего относятся радиоиндикационный метод с использованием меченого фибриногена. Тест считается достоверным в 96% случаев. Особая его ценность заключается в том, что он выявляет ранние стадии тромбоза [Савельев В. С. и др., 1979].
Ультразвуковые методы диагностики острого венозного тромбоза используются с 1967 г. [Strandner D. ]. Методы неинвазивные, основаны на эффекте Допплера. Ультразвуковой датчик, состоящий из двух пьезоэлектрических кристаллов, двигается по коже больного в проекции лоцируемых вен—подвздошной, бедренной и др. При этом один кристалл посылает ультразвуковой сигнал в ткани, а другой принимает отраженную волну от движущейся крови. Частота отраженного сигнала от движущейся крови в венах изменяется в зависимости от скорости ее движения. Эти звуковые сигналы можно изобразить графически. Существует ряд неинвазивных диагностических методов, ценность которых неодинакова. Так, А. А. Шалимов, И. И. Сухарев (1984) дают высокую оценку импедансной окклюзионной плетизмографии, основанной на том, что изменение объема венозной крови в нижней конечности приводит к изменению электрического сопротивления, регистрируемого графически.
Лечение. Основным методом лечения венозных тромбозов является консервативный. Однако даже при использовании фибринолизин-гепариновой терапии положительный результат наблюдается лишь у 36—39,7% больных [Климов В. Н., 1977]. По данным А. А. Шалимова и соавт. (1984), при этой терапии у 27% больных развилась эмболия легочной артерии со смертельным исходом. А. В. Покровский, Л. И. Клионер (1977) после консервативной терапии у 70— 95% больных отметили развитие посттромботического син-
дрома. Однако при оперативном лечении с летальным исходом тромбоэмболия наблюдалась в 10 раз реже, чем при консервативном. В. С. Савельев и др. (1979) считают хирургическое лечение острого тромбоза глубоких вен системы нижней полой вены методом выбора, причем тромб-эктомия является основным методом лечения тромбоза глубоких вен, развившегося в результате эмболии. Спорным остается вопрос о сроках выполнения тромбэктомии, и все же, по мнению большинства хирургов, тромбэктомия при остром подвздошно-бедренном тромбозе показана через 4—7 дней с момента его возникновения [Савельев В. С. и др., 1972]. В результате тромбэктомии, выполненной в эти сроки, у 80—90% больных наблюдаются хорошие результаты.
Доступы к магистральным глубоким венам для тромбэктомии разные и зависят от локализации тромботического процесса. При его локализации в подвздошных и бедренных венах рекомендуется применять бедренный доступ или сочетать его с лапаротомией [Савельев В. С. и др., 1972]. А. А. Шалимов, И. И. Сухарев (1984) в данных ситуациях сочетают бедренный доступ с забрюшинным, который, по их мнению, позволяет лучше видеть подвздошные вены.
При хирургическом лечении острого тромбоза самого ствола нижней полой вены всегда следует учитывать, что флотирующий тромб в нижней полой вене является потенциальным эмболом легочной артерии и в любое время может вызвать ее тромбоэмболию. Поэтому наличие флотирующего тромба является абсолютным показанием для хирургического лечения. Операция при остром тромбозе ствола нижней полой вены может быть радикальной и паллиативной.
При радикальной операции выполняют тромбэктомию из нижней полой вены с восстановлением кровотока по ней. Доступ к нижней полой вене либо забрюшинный, либо лапаротомный. Тромбэктомия производится при помощи катетера Фогерти. Первые подобные операции в нашей стране выполнил В. С. Савельев в 1964 г.
Паллиативные операции, применяемые при остром тромбозе нижней полой вены, прошли несколько этапов развития—от полной перевязки нижней полой вены до современных методов ее частичной окклюзии. Перевязка нижней полой вены выполнена впервые в 1906 г. Тренделенбургом. Летальность при этой операции достигала 39%, поэтому в настоящее время она практически не применяется. С 60-х годов началось новое прогрессивное направление в хирургии—пликация нижней полой вены. Сущность операции состоит в создании в вене «фильтров», сохраняющих магистральный кровоток и задерживающих продвижение к легочной артерии крупных эмболов. Первым эту операцию осуществил F. Spencer в 1959 г., предложив прошивать нижнюю полую вену в поперечном направлении 3—4 матрацными швами с интервалом 5 мм один от другого. Позже было предложено множество модификаций этой операции (рис. 7.91). В настоящее время наиболее принятой является имплантация кавафильтра конусовидной формы, фиксирующегося к стенке вены при помощи специальных крючков. Этот фильтр, созданный L. Greenfield (1978), можно имплантировать через яремную и бедренную вены. При его имплантации только у 5% пациентов в отдаленном периоде после операции наблюдалось развитие окклюзии нижней полой вены.
715
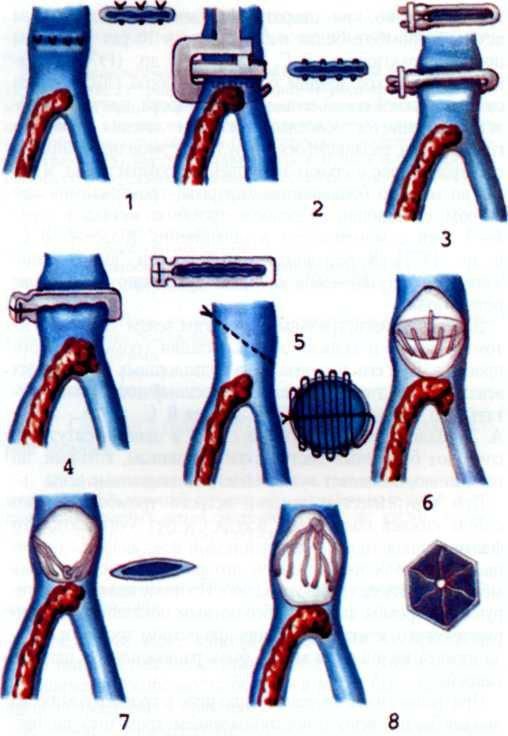
7.91. Схематическое изображение различных способов парциальной окклюзии нижней полой вены [Шалимов A. A., Суха-рев И. И., 1984].
Прошивание нижней полой вены в поперечном направлении тремя-четырьмя матрацными швами (1) или механическими швами с помощью аппарата УКБ-25 (2). Пликация нижней полой вены при помощи наружного зажима из гладких теф-лоновых клемм (3): наружного зажима с зубчатыми клеммами (4); сетки-фильтра, имплантируемой в просвет нижней полой вены (5); зонтичного кава-фильтра (6); стальной пружины с дакроновым покрытием (7); кава-фильтра конусовидной формы со специальными крючками для фиксации (8).
Техника имплантации зонтичного фильтра состоит из выделения правой внутренней яремной вены, через разрез в ее стенке вводят капсулу с фильтром, которую проводят через безымянную верхнюю полую вену, правое предсердие в нижнюю полую вену под рентгенологическим контролем на уровень между II—III поясничными позвонками.
Консервативное лечение тромбоза глубоких вен нижних конечностей и таза преследует ту же цель, что и хирургическое. Обычно консервативную терапию делят на активную с применением тромболизирующих препаратов и пассивную с использованием антикоагулянтов прямого и непрямого действия, низкомолекулярных декстранов, противовоспалительных препаратов и компрессионных повязок.
Результаты. Большинство авторов считают, что тромбэк-томия из глубоких вен системы нижней полой вены, проведенная при помощи катетера Фогерти, дает 58—90% хороших и удовлетворительных непосредственных результатов [Ермолаев В. Л., 1975]. В то же время другие авторы определяют неудовлетворительные результаты у 30—32% больных, считая их причиной поздние сроки операции. Таким образом, успех операции обратно пропорционален времени, прошедшему от начала тромбоза [Сепп Э. И. и др., 1977]. По данным А. А. Шалимова, И. И. Сухарева (1984), наилучшие результаты наблюдаются при тромбэктомии в первые 24—120 ч болезни (у 81,5% больных отмечено полное восстановление кровообращения в конечности). При тромбэктомии из ствола нижней полой вены в случае эмболических тромбозов в ближайшем послеоперационном периоде ре-тромбоз развивается у 5,5% больных.
При отдаленном наблюдении в сроки от 3 мес до 6 лет хроническая венозная недостаточность нижних конечностей развивается у 30,8% больных. При операциях парциальной окклюзии нижней полой вены с целью профилактики тромбоэмболии легочной артерии хорошие результаты наблюдаются у 80% больных, послеоперационная летальность составляет 3,7%, рецидив смертельной тромбоэмболии легочной артерии достигает 1,6%, хроническая венозная недостаточность определяется у 13,3% больных [Савельев В. С. и др., 1979].
7.13.1. ТРОМБОФЛЕБИТ ПОДКОЖНЫХ ВЕН СИСТЕМЫ НИЖНЕЙ ПОЛОЙ ВЕНЫ
В 1939 г. A. Ochsner и М. Debakey предложили термин «тромбофлебит» для обозначения тромботического процесса в подкожных венах, связанного с воспалительным процессом венозных стенок. Данный термин «привился» в литературе и практической медицине именно для характеристики тромботического процесса в подкожных венах в отличие от термина «тромбоз», который чаще применяется при тромбофлебитах глубоких вен. Тромбофлебит подкожных вен является очень частым заболеванием. Считается, что он может наблюдаться у 55,9—69,6% больных [Аскерханов Р. П.. 1973].
Этиология и патогенез. Этиология и патогенез тромбофлебита подкожных вен практически не отличаются от таковых при тромбозе глубоких вен. Развитию тромбофлебита способствуют в первую очередь всевозможные травмы, в том числе и операционные, инфекция, гинекологические заболевания, новообразования. В частности, послеоперационный тромбофлебит наблюдается у 13—21,3% больных. Заболевание чаше наблюдается у женщин в системе большой подкожной вены бедра — в 30% случаев, на голени — в 56,4%. Малая подкожная вена поражается гораздо реже — в 5,5% случаев. Основная опасность восходящего тромбофлебита большой подколенной вены — его распространение через сафенобед-ренное соустье на бедренную вену с образованием эмбологен-ного тромба. Недаром устье большой подкожной вены называют «инкубатором» смертельной легочной эмболии.
Клиника. Наиболее часто встречаются такие формы заболевания, как острый травматический тромбофлебит, острый тромбофлебит варикозно расширенных вен, мигрирующий тромбофлебит.
Клиническая симптоматика травматического тромбофлебита характеризуется появлением плотного болезненного тяжа по ходу вены в области травмы. Над областью тяжа видны выраженные воспалительные изменения: гиперемия, припухлость, болезненность.
716
Острый тромбофлебит варикозно расширенных вен, как правило, осложняет варикозную болезнь у 33,6—64,8% больных [Аскерханов Р. П., 1973]. Развитие данного вида тромбофлебита связано также с травмой или инфекцией. Но у некоторых больных он возникает как бы самостоятельно в местах с выраженным варикозным расширением вен, что, очевидно, связано со стазом крови. Клинические признаки также довольно характерны. В области ранее мягких узелков варикозно расширенных вен появляется плотный болезненный тяж или инфильтрат, кожа над которым гипереми-рована, уплотнена. Клиническая картина мигрирующего тромбофлебита также достаточно характерна: обычно внезапно по ходу подкожных вен, чаще вен нижних конечностей, появляются небольшие уплотнения длиной 2—3 см, овальной формы, болезненные, с признаками воспаления кожи над ними. Конечности могут поражаться поочередно.
Наблюдаются и другие более редкие формы острых тромбозов поверхностных вен. Это прежде всего острый тромбофлебит подкожных вен передней грудной стенки и молочной железы—болезнь Мондора, впервые описавшего данную патологию в 1939 г. Она встречается редко, причины ее появления связывают с опухолями органов грудной полости, молочной железы, инфекциями, травмами. Болезнь Мондора поражает чаще женщин молодого и среднего возраста и клинически проявляется образованием плотных болезненных тяжей с перифокальным воспалением в надчревной области и по реберному краю, а также на переднелатераль-ной области молочных желез.
Лечение. Большую часть больных лечат консервативно.
Консервативное лечение направлено на снятие болей и пе-рифокального воспаления, предотвращение развития эмболии легочной артерии. Важнейшим условием лечения данной патологии являются активный режим и эластическое бинтование конечности, соблюдаемые с первых дней болезни. Длительное содержание таких больных в постели является ошибкой. Крайне важна и противовоспалительная терапия. Обычно назначают внутрь бутадион, реопирин по 3 таблетки в день или 5 мл 30% раствора реопирина внутримышечно 2—3 раза в день в течение 7—10 дней. Эффективен венорутон (троксевазин) по 1 капсуле в день в течение месяца. Антибиотики, как правило, не применяют. Антикоагулянты непрямого действия назначают только при осложненных формах заболевания. Местно полезно применять антивоспалительные повязки с гепариновой, бутадиеновой, венорутоновой мазями или спиртовые компрессы. Показанием к хирургическому лечению являются: 1) острый прогрессирующий тромбофлебит большой подкожной вены на уровне бедра; 2) острый тромбофлебит малой подкожной вены на уровне верхней трети голени; 3) острый тромбофлебит варикозно расширенных подкожных вен бедра и верхней трети голени; 4) острый тромбофлебит подкожных вен, не поддающийся консервативной терапии. В нашей стране хирургическое лечение острого тромбофлебита подкожных вен начато с 1930 г. В. А. Оппелем, который рекомендовал перевязывать вену выше тромба и удалять ее на всем протяжении вместе с тромбом. Эти хирургические приемы по существу сохранились и выполняются в настоящее время. После хирургического лечения острых тромбофлебитов подкожных вен хорошие результаты получены у 90% больных [Клемент А. А., 1976].
7.13.2. ОСЛОЖНЕНИЯ ОСТРЫХ ТРОМБОЗОВ МАГИСТРАЛЬНЫХ ВЕН
Венозная гангрена считается крайне тяжелым и редко встречающимся осложнением острого подвздошно-бедрен-ного тромбоза. Впервые венозную гангрену описал Lee в 1834 г. За прошедшие годы эта патология имела множество названий: «голубой флебит», «псевдоэмболический флебит», «венозная гангрена», «массивный венозный тромбоз», «ишемизирующий тромбоз». Однако наиболее распространенным в литературе является термин «синяя флегмазия» (phlegmasia caerulea dolens), предложенный в 1938 г. R. Gregoire. Практически до сих пор ряд авторов рассматривают синюю флегмазию как одну из клинических форм подвздошно-бедренного венозного тромбоза. Но на основании патогенетических особенностей данную патологию правильнее отнести не к форме или стадии острого подвздошно-бедренного тромбоза, а к его осложнению, т. е. точно так же, как и эмболию легочной артерии.
Частота н этнология. По данным различных авторов, синяя флегмазия встречается в 1,7—15,7% случаев острых венозных тромбозов глубоких вен нижних конечностей и таза. И. И. Сухарев (1977) наблюдал данную патологию у 8,2% больных с тромбозом системы нижней полой вены. В основе венозной гангрены лежит тотальная окклюзия как магистральных, так и коллатеральных путей венозного оттока из пораженной конечности. При тяжелых формах острого подвздошно-бедренного венозного тромбоза некоторые коллатеральные пути сохраняются. Это и является основным отличием данной патологии от венозной гангрены или синей флегмазии. Чаще венозная гангрена встречается у пациентов 40—70 лет.
Одним из факторов, предрасполагающих к развитию тромбоза, осложненного венозной гангреной, могут быть злокачественные заболевания у этих больных. В других случаях синяя флегмазия наблюдается после операций, родов, травм, инфекций. По данным А. А. Шалимова и И. И. Сухарева (1984), причиной развития синей флегмазии у 33,3% больных были гинекологические операции, у 26,3%—роды, у 20% — хирургические операции и у 20,4%—новообразования.
Патологическая физиология. В основе патофизиологических изменений при синей флегмазии лежит тотальный тромбоз магистральных глубоких вен нижних конечностей и таза и основных коллатеральных путей оттока венозной крови, вследствие чего резко повышается гидростатическое давление в капиллярной венозной сети, уровень его превышает коллоидно-осмотическое давление, и происходит фильтрация плазмы крови в интерстициальное пространство. Далее изменяется или исчезает систолический градиент между артериальной и венозной системами. Если венозное давление повышается в среднем в 10 раз, то сокращается артериальный приток и прекращается капиллярный кровоток. Жидкость накапливается в тканях, что ведет к повышению тканевого давления и уменьшению трансмурального давления. В последующем развивается коллапс артериального колена капилляра.
При нарушении внутриартериального давления нарушается и лимфообразование. При переходе большого количества плазмы крови в интерстициальное пространство происходит депонирование крови, резко сокращается объем циркулирующей крови, что в свою очередь приводит к гиповолемичес-кому шоку у 20—30% больных. В пораженной конечности при синей флегмазии может накопиться до 4—5 л жидкости.
777
По данным Т. Fogarty (1963), при синей флегмазии у 40,8% больных наблюдается тромбоэмболия легочной артерии, которая у 6,8% заканчивается смертью.
Клиника. Клиническая картина венозной гангрены обычно складывается из симптомов тяжелой формы острого под-вздошно-бедренного венозного тромбоза с наличием некротических изменений в различных, чаще дистальных, отделах нижней конечности. Общее состояние больных, как правило, тяжелое.
Наиболее распространенными симптомами являются цианоз, отеки, боль, гангрена дистальных отделов конечности. Цианоз—характерный и наиболее постоянный признак венозной гангрены. Обычно цвет кожных покровов пораженной конечности может варьировать от красно- или багрово-синего до темно-синего. Отеки нижних конечностей также бывают резко выраженными, распространяются на мошонку, ягодицы, переднюю брюшную стенку. Отек может сопровождаться различного рода серозно-геморрагическими высыпаниями. Боли интенсивные, мучительные, наблюдаются почти у всех больных, причем у большинства из них боли появляются остро. Некротические изменения тканей пораженной конечности появляются на 3—7-й день заболевания. Чаще наблюдается влажная гангрена, реже—сухая. Наиболее часто поражаются стопа и пальцы стоп, реже— голень и очень редко—бедро. Иногда наблюдается поверхностная очаговая гангрена.
По сводным статистическим данным В. С. Савельева и со-авт. (1972), гангрена развивается у 62% подобных больных. А. А. Шалимов и И. И. Сухарев (1984) наблюдали гангренозные изменения у 13,4% больных синей флегмазией. Венозная гангрена часто сопровождается артериальной недостаточностью.
Лечение. Лечение синей флегмазии расценивается всеми авторами как весьма трудное, зависящее от его своевременности и радикальности. Так, J. Alemany, L. Helmin (1977) считают тотальную тромбэктомию методом выбора. В свою очередь'Фогерти, выполняя тромбэктомию, сочетает ее с пликацией нижней полой вены. Г. Л. Ратнер, И. И. Стрельников (1970) выполняют ампутацию конечности при синей флегмазии для спасения жизни больного, А. А. Шалимов, И. И. Сухарев (1984) считают, что в ком-таекс лечения синей флегмазии должны быть включены герапевтические и хирургические методы. Консервативное лечение следует проводить в порядке неотложной помощи; хирургическое лечение при данной патологии абсолютно показано всем больным. Авторы, имеющие опыт в лечении венозной гангрены [Савельев В. С. и др., 1972], считают, что при наличии признаков начинающейся венозной гангрены (поверхностные некрозы, нарушение питания и иннервация дистальных отделов конечности) тромбэктомия не показана, поскольку она не избавляет от тромбоза венозные капилляры, венулы и мелкие вены, следовательно, не восстанавливает венозный отток. При наличии напряженного отека показана фасциотомия.
Консервативное лечение заключается в придании конечности возвышенного положения, местной гипотермии, выведении больного из шока, улучшении микроциркуляции путем введения одного из препаратов декстрана. Если эти мероприятия по выведению больного из шока не дают эффекта, показана ампутация конечности. В случае относительно удовлетворительного состояния больного ампутация
при венозной гангрене показана лишь после появления демаркационной линии.
Результаты лечения. По данным ряда авторов [Haimovici H., 1962], летальный исход наступает у 17% больных еще до появления признаков некроза конечности. В случае развившейся гангрены летальность составляет 62%. При лечении синей флегмазии антикоагулянтами гангрена развивается у 73% больных, 43% из которых необходима ампутация, у 30% наступает смерть.
В то же время отечественные хирурги приводят более оптимистичные данные. Так, А. А. Шалимов и И. И. Сухарев (1984) успешно выполнили радикальную тромбэктомию у 13 из 15 больных, поступивших в первые 7 сут болезни, сохранив больным не только жизнь, но и конечность; 2 больным пришлось выполнить ампутацию конечности на уровне бедра, впоследствии один из них, поступивший на 16-е сутки болезни, умер от интоксикации.
7.13.3. ТРОМБОЭМБОЛИИ ЛЕГОЧНЫХ АРТЕРИЙ
Впервые тромбоэмболию легочной артерии в сочетании с инфарктом легкого описал J. Cruveilhier (1829), а геморрагический инфаркт легкого под названием «легочная апоплексия»— R. Laennec в 1919 г.
Частота и этиология. Тромбоэмболия легочной артерии как причина смерти, по данным различных авторов, составляет 2—15% [Савельев В. С. и др., 1979; Шалимов А. А., Сухарев И. И., 1984; Gray F., 1979]. В США от тромбоэмболии легочной артерии ежегодно умирает 200000 человек [Dalen J., Alpert J., 1975].
Основным источником эмболии легочной артерии являются тромбоз глубоких вен конечностей, правых отделов сердца, легочной артерии, а также септические и жировые эмболы. В. С. Савельев и соавт. (1979) при изучении 731 случая тромбоэмболии легочной артерии выявили следующие источники эмболизации: система верхней полой вены — 0,4%; правые отделы сердца —10,4% и система нижней полой вены — 84,5%. Эти же авторы считают, что по локализации эмболия мелких ветвей легочной артерии наблюдается в 27,1%, долевых и сегментарных ветвей — в 17,1% и массивная эмболия ствола и главных ветвей — в 55,8% случаев.
Причем эмболия мелких ветвей, как правило, не вызывает смертельного исхода, эмболия сегментарных и долевых ветвей была причиной смерти у 6,4% больных. Массивная же эмболия легочной артерии вызывает молниеносную смерть у 61,3% больных.
Патологическая анатомия. В большинстве случаев при па-тологоанатомическом обследовании в том или ином отделе легочной артерии выявляется тромб. Иногда удается обнаружить его остаток в каком-либо венозном сегменте— истинный источник эмболии. К эмбологенным формам тромбоза обычно относят флотирующий (плавающий) тромб. Он имеет одну точку фиксации в дистальном отделе, а остальная, большая, часть тромба свободно плавает в вене и не связана с ее стенкой. Длина таких тромбов может достигать 20 см и более. Форма тромба—цилиндрическая, с закругленной верхушкой. Диаметр основания флотирующего тромба меньше, чем свободной части, что, собственно, и придает тромбу подвижность.
Патологическая физиология. В основе патофизиологических изменений при эмболии легочной артерии лежит об-
778
турация (эмболом или тромбом) легочной артерии с развитием гипоксемии и легочной артериальной гипертензии. В результате этого происходит перегрузка правой половины сердца с исходом в острую или подострую право-желудочковую недостаточность. Патофизиологической основой инфаркта легкого является также обтурация легочной артерии и ее мелких ветвей при отсутствии выраженного коллатерального кровотока. В ряде случаев, очевидно, инфаркт легкого развивается при обтурации бронхиальных артерий и их ветвей. В клинической практике эмболия легочной артерии и ее ветвей чаще наблюдается без инфаркта легкого. А. А. Шалимов и И. И. Сухарев (1984) наблюдали инфаркт легкого у 25% больных с эмболией легочной артерии и ее ветвей. Инфаркт легкого, как правило, развивался в среднем через 24—48 ч после эмболии легочной артерии. Спустя 7 дней начиналась его организация, которая у 90% больных закончилась пневмонией, у 30%—ателектазом легких, у 5—10%—абсцедированием и развитием эмпиемы плевры.
Клиника. Клиническая картина эмболии легочной артерии разнообразна, что и создает большие диагностические трудности. По данным В. С. Савельева и Е. Г. Яблокова (1982), у 60% больных эмболия легочной артерии возникает раньше, чем проявляются клинические признаки тромбоза. Каких-либо специфических клинических признаков для эмболии легочной артерии не существует. В ряде случаев она вообще протекает бессимптомно. Поэтому при клинической диагностике данного заболевания следует ориентироваться на совокупность симптомов. Так, В. С. Савельев, Е. Г. Яб-локов, А. И. Кириенко (1979) выделяют следующие наиболее характерные синдромы: легочно-плевральный, кардиальный и церебральный. Легочно-плевральный синдром характеризуется в первую очередь одышкой, которая, очевидно, связана с нарушением перфузии и вентиляции легких. Исключение составляют лишь одышка и цианоз, являющиеся ранним признаком эмболии. Цианоз лица, шеи и верхней половины туловища является характерным симптомом массивной эмболии и наблюдается у 44,4—75% больных [Мазаев П. К., Куницын Д. В., 1973; Шалимов А. А., Сухарев И. И., 1984]. Боли—также частый симптом тромбоэмболии легочной артерии. По данным Н. А. Малиновского и В. А. Козлова (1976), они наблюдаются у 20—87% больных, носят острый характер и локализуются в задненижних отделах грудной клетки. Кашель наблюдается гораздо реже, приблизительно у 20% больных, обычно он сопровождается выделением кровянистой мокроты.
Физикальные данные при легочно-плевральном синдроме—притупление перкуторного звука при инфарктной пневмонии или плевральном выпоте, влажные хрипы в легком и шум трения плевры—обычно непостоянные и появляются достаточно поздно, на 3—4-е сутки, так как в основном являются следствием развития инфаркта легкого. Кардиальный синдром характеризуется болью и чувством дискомфорта за грудиной, тахикардией и гипотонией, вплоть до кол-лаптоидного состояния. Эти симптомы большинство авторов объясняют коронарной недостаточностью и повышением давления в легочной артерии. Абдоминальный синдром встречается реже и не является типичным для эмболии легочной артерии. Он характеризуется болями в верхней правой половине живота и, очевидно, зависит от
раздражения правого купола диафрагмы при плевральном выпоте или от растяжения глиссоновой капсулы печени при развитии правожелудочковой недостаточности. Церебральный синдром характеризуется потерей сознания, гемиплеги-ей и судорожными явлениями. Он наблюдается чаще у пожилых больных и зависит от гипоксии мозга. Почечный синдром (секреторная анурия) чаще наблюдается после выведения больных с эмболией легочной артерии из шока. Анурия, как правило, зависит от длительной гипоксии почек, встречается довольно редко. Таким образом, эмболия легочной артерии постоянно имеет ряд характерных симптомов, но классическая клиническая картина (одышка, цианоз лица и верхней половины туловища, ангинозные боли, системная гипотензия) встречается лишь у 16% больных. Поэтому ошибки при диагностике эмболии мелких ветвей легочной артерии наблюдаются в 36,2% случаев, а при массивной эмболии—в 29,9%. W. Kapral (1978) по степени тяжести различает четыре формы эмболии легочной артерии: I—скоротечная, злокачественная (заканчивается смертью в течение 15 мин); II—смертельная (заканчивающаяся смертью от правосторонней сердечной недостаточности в течение нескольких часов или дней); III—несмертельная с сокращением сердечно-легочного резерва; IV— несмертельная без сокращения сердечно-легочного резерва. Наиболее распространенной является классификация В. С. Савельева, Е. Г. Яблокова, А. И. Кириенко (1979). Авторы в зависимости от объема и тяжести поражения легочной артерии делят тромбоэмболии на 3 группы: I—массивная эмболия ствола и главных ветвей легочной артерии; II—субмассивная эмболия долевых и более мелких ветвей легочной артерии, которая по объему поражения, т. е. по степени перфузии, соответствует массивной; III—эмболия ветвей легочной артерии (долевых, сегментарных и более мелких).
Данная классификация в каждом конкретном случае определяет тактику лечения больных.
Диагностика. Обычно при тромбоэмболии и инфаркте легкого наблюдается ряд типичных рентгенологических признаков. Характерно для инфаркта легкого расширение корня легкого и обеднение сосудистого рисунка на всем протяжении легочного поля в зоне разветвления затромбированных артерий—симптом Вестермарка [Westermark N., 1958]. Этот симптом, по мнению Н. П. Мазаева, Д. В. Куницына (1979), наблюдается в 16,5% случаев, а изменение корня легкого на стороне поражения—в 78% случаев. Патологические тени в легких некоторые авторы считают наиболее патогномоничными и постоянными признаками инфаркта легкого. Это, например, широко известная тень треугольной формы; однако при инфаркте она может выглядеть различно: от дисковидных ателектазов Флейшнера до довольно больших затемнений. Плевральный выпот часто сопровождает инфаркт легкого и находится в костодиафрагмальном синусе. Это так называемый медиастинальный плеврит, хотя жидкость может располагаться и в междолевой борозде при интерлобарном плеврите. Высокое стояние купола диафрагмы и ограничение ее подвижности—также характерный признак тромбоэмболии легочной артерии.
По данным В. С. Савельева и соавт. (1979), наиболее достоверные признаки тромбоэмболии легочной артерии на ЭКГ отмечены у 14% больных. К ним относятся синдром Мак-Джина—Уайта (5,1%), остро возникшая блокада пра-
779
7.92.
Ангиопульмонограмма при тромбоэмболии
легочной артерии. Дефекты наполнения
в верхнедолевой ветви правой легочной
артерии и нижнедолевой—левой
легочной артерии при
тромбоэмболии [Савельев В. С. и др.,
1979].
7.93.
Ангиопульмонограмма при тромбоэмболии
легочной артерии.
«Ампутация» долевых и сегментарных
ветвей правой и
левой легочных артерий [Савельев В. С.
и др., 1979].
вой
ножки предсердно-желудочкового пучка
(5,1%), перегрузка
правого предсердия (3,8%).
Ангиопульмонография
является
одним из самых информативных
методов диагностики тромбоэмболии
легочной артерии. К наиболее достоверным
прямым признакам эмболии
относится дефект наполнения в тех или
иных ветвях легочной
артерии. Центральный дефект наполнения
характерен
для свежего эмбола, краевой—для старого
эмбола, спаянного
с сосудистой стенкой (рис. 7.92). О давности
поражения
также свидетельствует извитость
легочных сосудов, изъеденность
их контуров. Другой прямой признак
эмболии легочной
артерии—«ампутация» ветвей легочной
артерии
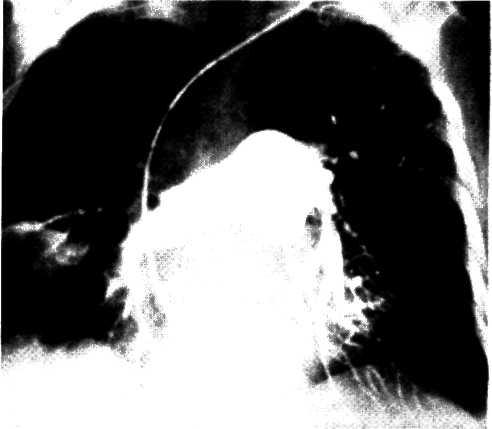
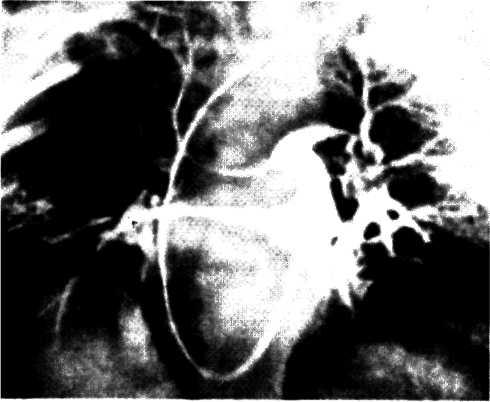
При измерении давления в легочной артерии и правых полостях сердца выявлено его увеличение у большинства больных. Величина систолического давления в легочной артерии и правом желудочке колеблется в широких пределах—от 35 до 80 мм рт. ст. Диастолическое давление повышено незначительно.
Метод инфузионного сканирования легких менее травматичен и проще, чем ангиопульмонография, он позволяет оценить состояние легочного кровотока. Обычно при зондировании ветвей легочной артерии на перфузионной сканограм-ме видны очаги неравномерного распределения радиоактивности, чаще имеющие двустороннюю локализацию. Радиоактивность неизмененных отделов легких бывает выше, чем в норме, за счет неперфузируемых участков, т. е. эмболия легочной артерии и ее ветвей на сканограммах характеризуется снижением радиоактивности или образования «немых зон» (рис. 7.94).
Опыт хирургического лечения тромбоэмболии легочной артерии небольшой. В 1907 г. впервые в мире эмболэкто-мию из легочной артерии выполнил Ф. Тренделенбург. Впервые в нашей стране операцию по методу Тренделенбур-га сделал Н. Н. Малиновский (1967).
Показания к эмболэктомии из легочной артерии делят на абсолютные и относительные. Абсолютные показания: а) тромбоэмболия ствола и главных ветвей легочной артерии; б) тромбоэмболия главных ветвей легочной артерии (с одной и обеих сторон) при стойкой системной гипотензии, не поддающейся коррекции.
Относительным показанием служит тромбоэмболия главных ветвей легочной артерии при достаточно стабильной гемодинамике большого круга кровообращения и выраженной гипертензии в легочной артерии и правых отделах сердца.
Методы эмболэктомии. Операция Тренделенбурга, выполняемая с использованием внеплеврального доступа, с пережатием аорты и легочной артерии в настоящее время не применяется.
В 1956 г. P. Marion, К. Estanove предложили метод эмболэктомии через ветви легочной артерии. Операция выполняется из левосторонней переднебоковой торакотомии по третьему межреберью или правосторонней по четвертому межреберью. Внутриперикардиально выделяется правая легочная артерия и внеперикардиально—левая легочная артерия. Далее выделяются долевые ветви, и кровообращение во всех сосудах прекращается путем наложения и затягивания турникетов. Эмболэктомия осуществляется через продольный или косой разрез, произведенный на правой или левой легочной артерии. В 1959 г. К. Vosschulte и Н. Stiller предложили производить эмболэктомию из легочной артерии в условиях временного пережатия полых вен. Это позволяло избежать дилатации правого желудочка и провести операцию под контролем зрения.
720
Операцию выполняют из срединной стернотомии. Подводят турникеты под полые вены и пережимают их. Вскрывают легочный ствол продольно и удаляют эмболы. Зажимом производят краевое отжатие области разреза на легочном стволе и восстанавливают кровообращение. Ушивают разрез на легочном стволе. Операцию заканчивают обычным путем.
Из-за ограниченности допустимого времени выключения сердца из кровообращения в последнее время эта операция выполняется в условиях ИК (рис. 7.95). Проведение операции в условиях ИК позволяет избежать дилатации правого желудочка, нормализовать центральную гемодинамику и сердечный выброс, восстановить и нормализовать напряжение артериальной крови кислородом, исключить гипопер-фузию жизненно важных органов, нормализовать метаболизм в тканях организма и, наконец, сама операция может быть выполнена в оптимальных условиях с удалением всех тромбов.
Торакотомию производят после канюлирования бедренной артерии и вены и начала ИК. Затем канюлируют полые вены и переходят на полное ИК. Легочный ствол окклюзи-руют турникетом и через продольный разрез в нем производят удаление эмболов отсосом, массажем легких и т. д.
Продолжается также разработка методов трансвенозной эмболэктомии. Для этого через бедренную вену в легочный ствол и легочные артерии под контролем экрана проводят катетер с двойным просветом, баллончиком и чашечным устройством на конце. Эмболэктомия осуществляется всасыванием эмбола в чашечку и обратной тракцией катетера.
Консервативное лечение. Консервативные методы лечения при эмболии долевых, сегментарных и субсегментарных ветвей легочной артерии должны занять соответствующее место. Они должны быть комплексными, включающими в себя мероприятия, направленные на предупреждение развития тромбоза, лизиса эмбола, на улучшение деятельности сердечно-сосудистой и дыхательной систем. Очевидно, всем этим требованиям отвечают антикоагулянтная, тромболи-тическая и неспецифическая терапия. Антикоагулянтная терапия включает в себя прямые и непрямые антикоагулянты. Среди антикоагулянтов прямого действия наиболее употребим и эффективен гепарин. Начальная его доза чаще всего бывает равной 5000 ЕД, но при показаниях может быть увеличена до 10000 ЕД и даже до 20000 ЕД. В дальнейшем в течение 7—10 дней поддерживающая суточная доза его должна быть не менее 30000—40000 ЕД и вводиться внутривенно непрерывно, лучше всего в физиологическом растворе или растворе реополиглюкина (800 мл), снижающего агрегацию эритроцитов. В последние дни лечения гепарином обычно назначают непрямые антикоагулянты, дозы которых регулируют снижение индекса протромбина до 30—50%. При данном низком индексе протромбина постепенно через 10—12 дней отменяют прямые антикоагулянты, оставляя непрямые на многие месяцы и после выписки из стационара.
Тромболитическая т е р а п и я показана при наиболее тяжелых случаях субмассивной эмболии легочной артерии. Все имеющиеся в настоящее время тромболитические средства можно разделить на препараты, обладающие непосредственным литическим действием (фибринолизин, аспер-гамин) и на активаторы эндогенного фибринолизина (стреп-таза, урокиназа, никотиновая кислота). Фибринолизин с гепарином обычно вводят внутривенно в течение 3—4 дней.

7.94. Сканограмма легких при тромбоэмболии легочной артерии. Зоны снижения радиоактивности слева при эмболии ветвей легочной артерии [Савельев В. С. и др., 1979].
Многие авторы считают, что наиболее целесообразно фибринолизин вводить непосредственно в область локализации тромба.
Суточная доза фибринолизина составляет 80000— 100000 ЕД, причем гепарин добавляют из расчета 5000 ЕД на 10000 ЕД фибринолизина. Через 4—5 ч после окончания введения фибринолизина назначают гепарин на 7—10 дней. Его суточная доза должна быть не менее 30 000—40 000 ЕД. Однако наибольшим литическим действием при эмболии легочной артерии обладают активаторы эндогенного фибринолизина—стрептокиназа (стрептаза) и урокиназа. Тром-болитический эффект этих препаратов более выражен при раннем применении. В первые несколько суток заболевания тромболитический эффект наблюдается у 75% больных. Препарат может быть введен как внутривенно, так и регионарно в легочную артерию. Обычно после восстановления стабильного кровообращения назначают капельное введение стрептокиназы или стрептазы в течение 1—3 сут. Предварительно в течение 30 мин вводится пробная доза (250000—750000 ЕД). Постоянно поддерживающей дозой является 100000 ЕД/ч. После курса стрептокиназы в течение 7—10 дней вводят гепарин в суточной дозе не менее 30000— 40000 ЕД, а затем в течение 1 мес и более—непрямые антикоагулянты. Положительный эффект от введения стрептокиназы отмечают в 73—76% случаев; летальность снижается на 7—9% [Натрадзе Д. А., 1975; В. С. Савельев и др., 1979; А. А. Шалимов и др., 1984]. Однако, по данным тех же авторов, наряду с положительным действием стрептокиназа в 50—72% случаев вызывает кровотечение.
Другим эффективным препаратом тромболитического действия является урокиназа, которая значительно легче переносится больным, чем стрептокиназа. Урокиназа, как правило, вводится регионарно в легочную артерию через катетер. Пробная доза составляет 50000—100000 IE, поддерживающая доза—40000 IE и обычно вводится в течение 8—24 ч. Урокиназу целесообразно вводить вместе с гепарином.
Неспецифическая терапия включает в себя комплекс меро-
727
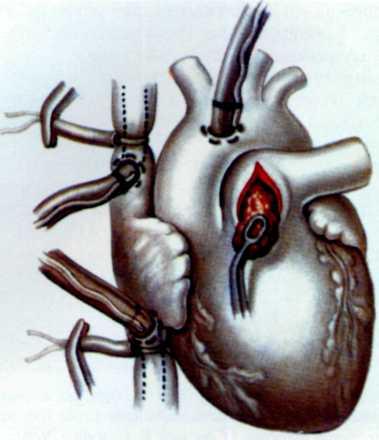
7.95. Схематическое изображение эмбо.пктомии из легочной артерии в условиях искусственного кровообращения.
приятии и препаратов, которые применяют в зависимости от состояния сердечно-сосудистой и легочной систем организма. На основании всех приведенных выше данных комплексность терапии эмболии легочной артерии не вызывает сомнений, тем более что даже при правильном и всестороннем лечении у 43% больных, благополучно перенесших тромбоэмболию легочной артерии, существует вероятность ее повторения.
7.14. ХРОНИЧЕСКАЯ ВЕНОЗНАЯ НЕДОСТАТОЧНОСТЬ НИЖНИХ КОНЕЧНОСТЕЙ
Хроническую венозную недостаточность нижних конечностей вызывают в основном два заболевания—варикозное расширение вен нижних конечностей и посттромбофлебити-ческий синдром нижних конечностей и таза. Другие заболевания— врожденные ангиодисплазии и повреждения вен, которые могут сопровождаться хронической венозной недостаточностью нижних конечностей,—описаны в соответствующих главах.
7.14.1. ВАРИКОЗНОЕ РАСШИРЕНИЕ ВЕН НИЖНИХ КОНЕЧНОСТЕЙ
Варикозным расширением вен называется их необратимое расширение и удлинение, наступающее в результате грубых патологических изменений венозных стенок и клапанного аппарата. В организме человека подобное варикозное расширение вен может наблюдаться в любой области, но чаще ему подвергаются поверхностные вены нижних конечностей. По данным массовых обследований населения [Червяков И. В.. 1958; Мамаматаврашвили Д. Г.. 1964]. варикозное расширение вен нижних конечностей встречается у 9— 22% всех обследованных. Наиболее выраженное клиническое проявление болезни наблюдается преимущественно у лиц 25—55-летнего возраста.
Этиология и патогенез. Этиология и патогенез варикозного расширения поверхностных вен нижних конечностей до настоящего времени полностью не раскрыты. Однако почти всеми авторами признается влияние ряда факторов: неустойчивость стенок вен. выражающаяся в истончении их мышечных и соединительнотканных элементов; расстройство иннервации с потерей тонуса и первичной или вторичной недостаточностью клапанов вен, а также повышением внутривенного давления. Некоторые авторы [Шайнис В. Н.. 1958] считают возможным наследственную передачу неполноценного строения вен и их варикозного расширения. И. А. Кострамов (1951) отмечает появление врожденной слабости соединительной ткани всего организма, когда варикозное расширение вен нижних конечностей сочетается с грыжами, геморроем, плоскостопием. Третьи авторы большое значение в этиологии варикозного расширения вен нижних конечностей придают эндокринному фактору. Как уже отмечалось выше, женщины в зрелом возрасте гораздо чаще имеют первичное варикозное расширение вен нижних конечностей, чем мужчины. Это объясняется анатомическими и функциональными особенностями женского организма: более широкий таз у женщин с большим перегибом вен конечностей при впадении их в тазовые вены, переполнение тазовых вен кровью во время менструации. Тонкостенные вены у женщин имеют «слабую опору» со стороны окружающих мягких тканей, что ведет к более частому заболеванию женщин. Основным фактором является беременность и особенно частая беременность с коротким интервалом.
Патологическая анатомия. Варикозному расширению подвергаются преимущественно подкожные вены нижних конечностей, входящие в систему большой подкожной вены. Очень редко варикозному расширению подвергаются ветви малой подкожной вены. В начале болезни происходят гипертрофия и новообразование клеточных элементов, что приводит к значительному утолщению венозной стенки. В дальнейшем параллельно с гипертрофией мышечных элементов происходит их гибель с последующим размножением соединительных клеток. Растяжение венозной стенки, возникающее в результате гибели мышечных клеток подкожных вен. стимулирует продуцирование коллагеновых волокон фибро-бластами. Нервные элементы, расположенные в стенке вены, вовлекаются в процесс вторично и создают новый отрицательный фактор, приводящий к потере функции гладкой мускулатуры венозной стенки—атонии. Стенка варикозной вены резко утолщается, но это утолщение неравномерно и чередуется со значительным истончением стенки в отдельных местах. Вена удлиняется, делается извилистой, в ней образуются множественные выпячивания, достигающие иногда диаметра 2—3 см. Кроме того, у подавляющего большинства больных (85%) с варикозным расширением вен нижних конечностей имеется выраженная недостаточность клапанов по всему стволу большой подкожной вены.
Патологическая физиология. Давление в венах нижних конечностей значительно изменяется с изменением положения тела при движении. В начальных стадиях расширения вен, когда отсутствуют признаки недостаточности клапанов, венозное давление, определяемое при вертикальном положении больного, соответствует нормальным цифрам—75— 120 мм вод. ст. При дальнейшем течении болезни и особенно при наличии признаков клапанной недостаточности давление в варикозных венах возрастает до 500—800 мм вод. ст. и более. Повышение венозного давления в поверхностных венах ведет к дальнейшему раскрытию физиологически неактивных артериовенозных прекапиллярных анастомозов, через которые происходит сброс артериальной крови в вены, что в свою очередь еще более повышает венозное давление.
722
В положении стоя и при ходьбе у этих больных возникает нарушение оттока крови из вен нижних конечностей, застой ее в венах в количестве до 500—1000 и даже 2000 мл. Давление в венах голеней и стоп может быть выше артериального давления. Это приводит к затруднению перехода крови из капилляров кожи и подкожной клетчатки в венулы и вены с развитием стаза в артериолах и капиллярах и переходом жидкой части крови в ткани, кожу и в подкожную клетчатку с последующим развитием трофических изменений на голенях и стопах.
Клиника. Клиническая картина варикозного расширения вен нижних конечностей различна и зависит главным образом от стадии заболевания. Выделяют две стадии варикозного расширения поверхностных вен нижних конечностей: стадию компенсации (А, Б) и стадию декомпенсации (без трофических нарушений, с трофическими нарушениями) [Савельев В. С. и др., 1972]. В стадии компенсации, которая может длиться годами и десятилетиями, больные обычно не предъявляют жалоб или же их жалобы незначительны и сводятся к ощущению тяжести и полноты в ногах, иногда ноющих болей, судорожных сокращений мышц ночью. У некоторых больных после длительной ходьбы появляется пастозность на внутренней поверхности нижней трети голени. Стадия декомпенсации при соответствующем лечении может продолжаться довольно длительно, не переходя в фазу осложнений. Фаза осложнений всегда характеризуется выраженной хронической венозной недостаточностью. Быстро нарастают отеки, усиливается кожный зуд, лишая больных покоя и сна, на коже голени появляются трофические расстройства, выпадают волосы, развивается экзема или возникают язвы. Подкожная клетчатка индури-руется, присоединяются тромбофлебиты, лимфангоиты, возникают кровотечения из лопнувшей вены, реже присое-! диняется слоновость с частыми рецидивами рожистого воспаления.
Диагностика. Начинать исследование больного необходи-| мо с осмотра пораженной конечности. При этом следует обращать особое внимание на состояние кожных покровов, степень их трофических изменений, определять разность в объеме конечностей, измерять кожную температуру. Осо-[бое внимание следует уделять варикозным венам, их расположению, калибру, степени извитости, напряженности. Определение функциональной способности клапанного аппарата поверхностных и перфорантных вен, а также проходимость глубоких вен проводится с использованием клас-шческих функциональных проб. Для выявления клапанной I недостаточности поверхностных вен чаще используется про-|ба Броди—Троянова—Тренделенбурга. Для выявления не-[ состоятельности перфорантных вен наиболее демонстративный являются проба Претта и трехжгутовая проба Бар-[роу—Купера—Шейниса. Среди проб, выявляющих [проходимость и функциональное состояние глубоких вен, [наиболее известна проба Мэйо—Претта или проба Дель-[бе—Пертеса. Особую диагностическую ценность представ-[ляет рентгеноконтрастное исследование вен—флебография. Лечение. Операция показана в тех случаях, когда первич-[ный варикоз сопровождается хронической венозной недостаточностью, и при явлениях расстройства кровообращения |в нижних конечностях с присоединением к варикозу различ-I ных осложнений—экзем, дерматита, язв, тромбофлебита {варикозных узлов. Существующие способы лечения варикоз-
ного расширения вен нижних конечностей можно разделить на 4 группы: 1) консервативные; 2) склерозирующие (инъекционные); 3) хирургические; 4) комбинированные.
Консервативные методы лечения варикозных вен нижних конечностей малоперспективны и по существу сводятся к компрессионной терапии, достигаемой постоянным ношением эластических чулок и бинтов. Естественно, что какого-либо излечения при этом не наступает. Поэтому консервативную терапию следует рекомендовать только тем больным, для которых оперативное лечение противопоказано.
В последние годы в нашей стране и за рубежом стала широко применяться склерозирующая терапия, основанная на том, что некоторые вещества, введенные в просвет вены, вызывают деструкцию интимы и коагуляцию крови с последующим развитием склероза стенки сосуда и облитерацией его просвета. Склеротерапия завоевывает широкое поле применения. Популярность этого метода лечения объясняется, с одной стороны, его простотой, возможностью осуществления в поликлинических условиях, неплохим косметическим эффектом и, с другой стороны—появлением новых надежных специальных склерозирующих веществ типа «Тромбовар» и «Склеровен». Склерозирующая терапия может применяться как самостоятельный метод только по строгим показаниям при начальных формах варикозного расширения вен нижних конечностей.
Наибольшее распространение в настоящее время имеют оперативные способы лечения. К операции предъявляется следующее требование—она должна полностью ликвидировать обратный ток крови в систему большой или малой подкожной вен из подвздошной или бедренной вен, ликвидировать ток крови из глубоких вен в подкожные вены через перфорантные вены с пораженными клапанами и, наконец, обеспечить отток крови из нижних конечностей, в основном по глубоким венам. Подобная операция должна быть радикальной и предусматривает полное иссечение ва-рикозно измененных подкожных вен с их нефункциониру-ющим клапанным аппаратом, вплоть до места их впадения в бедренную или подколенную вену, а также пересечения всех перфорантных вен, имеющих несостоятельные клапаны. Поэтому хирурги при оперативном лечении используют комплекс из нескольких оперативных вмешательств. Наиболее часто применяют операцию Троянова—Тренделенбурга в сочетании с операцией Бебкока или Моделунга и лигатурными методами или операцию Бебкока в сочетании с инъекционным склерозирующим лечением в послеоперационном периоде.
При трофических расстройствах и язвенных осложнениях для ликвидации у больных хронической венозной недостаточности необходимо корригировать кровоток не только в поверхностных венах, но и в глубокой и межуточной системах. Таким больным показана операция Линтона, включающая в себя полное иссечение большой и малой подкожных варикозно-расширенных вен тем или иным способом (чаще всего по методу Бебкока), широкое вскрытие апоневроза на медиальной или задней поверхности голени, перевязку и рассечение перфорантных вен под апоневрозом и в ряде случаев дупликаторное восстановление целостности апоневроза. В 1955 г. чешские хирурги П. Фирт и Л. 1ёйгал начинают применять разработанный ими новый метод эн-доваскулярной электрокоагуляции варикозных вен нижних конечностей. Этот метод в настоящее время нашел ряд
723
сторонников, которые, постоянно усовершенствуя его, получают хорошие непосредственные и отдаленные результаты. После операции больного укладывают в постель с приподнятым ножным концом на 15—20°; головной конец кровати должен находиться в горизонтальном положении. Сразу после операции разрешается двигать ногами, а на следующий день больной может начать ходить. С первых дней после операции необходимо тугое бинтование ног эластическими бинтами, которые больной должен носить не менее 2 мес после операции.
Результаты. В ближайшем послеоперационном периоде у больных, перенесших операцию по поводу варикозного расширения вен нижних конечностей, наиболее серьезными осложнениями следует считать возникновение тромбоза и тромбофлебита глубоких вен.
Рецидивы варикозного расширения вен нижних конечностей после современных радикальных операций возникают относительно редко. Большинство авторов отмечают рецидивы в 8—10% случаев.
7.14.2. ПОСТТРОМБОФЛЕБИТИЧЕСКИЙ СИНДРОМ НИЖНИХ КОНЕЧНОСТЕЙ И ТАЗА
Этиология. В 95% случаев хроническую венозную непроходимость обусловливают острые тромбофлебиты. Они переходят в свою дальнейшую стадию развития или стадию осложнений, вызывая хроническую непроходимость магистральных вен с образованием так называемой хронической недостаточности и развитием ПТФС. Наиболее частой его локализацией является система нижней полой вены, но и в различных отделах этой венозной системы он также имеет «излюбленные» локализации, сочетающиеся с хронической венозной непроходимостью этих венозных стволов. По нашим данным (Л. И. Клионер), больные с поражением системы нижней полой вены и наиболее часто встречающимися локализациями ПТФС делятся на три группы. Наибольшую группу составляют больные с поражением глубоких вен нижних конечностей, на втором месте — больные с хронической непроходимостью илеофе-морального сегмента и на третьем — больные с хронической непроходимостью отдельных сегментов или всего ствола самой нижней полой вены.
Патогенез и гемодинамика. При ПТФС наблюдается ряд особенностей патогенеза и гемодинамики. Хорошо известно, что в нормальных условиях основной отток венозной крови (85—90%) происходит через глубокие вены нижней конечности. Часть крови в глубокую венозную систему поступает из подкожных вен через перфорантные вены. Они имеют клапаны, часто одиночные, расположенные как раз на месте впадения перфорантной вены в глубокую полую вену. Эти клапаны в обычных условиях пропускают кровь только в одну сторону — от поверхностных вен в глубокие. При возникновении острого тромбоза участка глубокой венозной системы отток крови из пораженной конечности грубо извращается. Ввиду того что отток венозной крови уже не может осуществляться через глубокие вены, вся масса крови устремляется через перфорантные вены в обратном направлении в поверхностную венозную сеть. При этом под напором крови происходит расширение просвета перфо-рантных и подкожных вен, их клапанный аппарат, хотя анатомически еще сохраняется, функционально становится недееспособным (рис. 7.96). Стенки подкожных вен гипертрофируются, но сохраняют свою прямолинейность и осуществляют компенсаторную роль по разгрузке конечности от венозной крови. В дальнейшем испытывая постоянное высокое давление, стенки подкожных вен истончаются, мышечные волокна заменяются соединительнотканными, и начинается сегментарное варикозное расширение подкожной венозной сети, одновременно происходит и разрушение кла-
панного аппарата. В свою очередь тромботические массы в глубоких венах начинают также подвергаться изменениям: они могут либо организоваться с прорастанием соединительной тканью, либо редко подвергаются септическому расплавлению, однако чаще всего подвергаются реканализа-ции. И чем выраженнее реканализация, тем больше выражены разрушения клапанного аппарата глубоких и перфорант-ных вен. При выраженной реканализации глубокие вены представляются ригидными склерозированными трубками, лишенными клапанного аппарата. В этот период варикозного расширения подкожных вен, разрушения клапанного аппарата и реканализации тромбов происходит наибольшее извращение кровотока. Кровь по перфорантным венам идет в том и другом направлениях: при сокращении икроножных мышц струя крови выталкивается из нижней конечности, при их расслаблении — возвращается обратно, так как клапанный аппарат как поверхностных, так и глубоких вен значительно изменен. Кровоток как бы баллотирует в поверхностных и глубоких венах конечности (рис. 7.97). В этот период у ряда больных варикозно измененные подкожные вены с разрушенным клапанным аппаратом только усугубляют явления венозного застоя. Они полностью теряют свою компенсаторную роль, создают порочный круг, усугубляющий хроническую венозную недостаточность конечности. И несмотря на то что реканализованные глубокие вены также лишены клапанного аппарата и функционируют как полые ригидные трубки, направление основного кровотока через них, создаваемого даже искусственным, оперативным путем, значительно уменьшает явления венозной недостаточности конечности, в какой-то степени приближает венозный кровоток к «физиологическому» (рис. 7.98).
Клиника. Основной контингент больных с преимущественным поражением глубоких вен нижних конечностей составляют лица молодого и среднего возраста от 20 до 50 лет. Что касается распределения больных по полу, то большинство авторов считают, что у женщин ПТФС развивается чаще, чем у мужчин. Это объясняется более частым возникновением у женщин острых тромбофлебитов, связанных с родами, абортами. Наиболее типичный симптомокомп-лекс складывается из боли, отека, вторичного варикозного расширения подкожных вен на голени и бедре, пигментации и истончения кожных покровов, индурации подкожной клетчатки, дерматита и изъязвлений на голени. По мнению И. М. Тальмана (1961), на долю больных с ПТФС приходится 60% всех язв голени. Хорошие результаты лечения подобных язв зависят не от иссечения рубцовой ткани вокруг язвы, а от перевязки и удаления порочных подкожных и пер-форантных вен, поддерживающих венозную гипертензию.
Больные с подвздошно-бедренной локализацией ПТФС встречаются реже, чем с поражением глубоких вен нижних конечностей. Поражение левой нижней конечности наблюдается значительно чаще, чем правой, двустороннее поражение— очень редко. Причина преобладания левой нижней конечности связана с особенностями топографоанатомиче-ского расположения артерии и вены, и часто правая общая подвздошная артерия сдавливает левую общую подвздошную вену. Клиническая симптоматика при подвздошно-бед-ренном тромбозе остается в основе такой же, как и при поражении глубоких вен нижней конечности, но имеет некоторые особенности. Боли чаще локализуются в паховой области, на передневнутренней поверхности бедра или икроножных мышцах, чаще носят распирающий, тянущий характер. Иногда боли в конечностях сопровождаются болями в пояснично-крестцовой области. Характерной особенностью отека при данной локализации ПТФС является его распространение не только на всю конечность на стороне
724
поражения, но иногда и на половые органы и ягодицу, однако наиболее выражен отек всегда на бедре. При резких степенях отека окружность бедра может увеличиваться на 10 см и более. У некоторых больных с длительно существующим подвздошно-бедренным тромбозом отмечается значительное варикозное расширение подкожных вен передней брюшной стенки на стороне поражения и над лобком. Этот симптом обусловлен развившейся системой анастомозов между наружными срамными венами обоих бедер [Кли-онер Л. И., 1969]. Среди данного контингента больных язвы наблюдаются реже и то при сочетанном ПТФС. поражающем как глубокие вены голени, так и подвздошно-бедрен-ные вены.
Закупорка нижней полой вены—одна из наиболее тяжелых по своему клиническому течению и исходам форм хронической венозной непроходимости. Данная группа больных составляет приблизительно 7% всех больных с поражением системы нижней полой вены. Как правило, развитие непроходимости ствола нижней полой вены сочетается с илеофе-моральным тромбозом, являясь его продолжением или осложнением при восходящих формах процесса. Клиническая картина синдрома нижней полой вены, так же как и синдрома верхней полой вены, складывается из симп-томокомплекса, особенности которого зависят в основном от уровня закупорки ствола нижней полой вены. Наиболее тяжелые формы этого синдрома наблюдаются при высоких окклюзиях ствола, когда закупорка нижней полой вены сочетается с непроходимостью печеночных или почечных вен и с развитием синдрома Хиари или нефротического компонента.
При поражении нижнего, инфраренального сегмента нижней полой вены в сочетании с поражением глубокой венозной сети конечностей клиническая картина складывается из проявления наиболее тяжелых симптомов ПТФС. захватывающего всю конечность. В отличие от двух предыдущих видов локализации первичного тромботического аффекта (в глубоких венах голени или илеофеморальном сегменте) закупорка нижней полой вены всегда обусловливает развитие двустороннего поражения нижних конечностей. Боли носят разлитой характер, распространяясь на нижнюю конечность, паховую область, ягодицы и брюшную полость. Отек выражен: у большинства больных окружность бедра и голени увеличивается на 8—10 см и более. Отек распространяется равномерно на всю нижнюю конечность, вплоть до стопы, нередко захватывает половые органы, ягодицы и переднюю брюшную стенку. Подкожные вены варикозно расширены на голени, меньше—на бедре, особенно сильно—над лобком и по переднебоковым отделам брюшной стенки. Направляясь вверх, они анастомозируют с поверхностными венами грудной стенки. Множественные трофические язвы на обеих ногах характерны для закупорки нижней полой вены.
Классификация ПТФС. Наиболее популярна классификация G. H. Pratt (1964), внедренная в отечественную флебологию М. И. Кузиным и В. Я. Васютковым (1966). Авторы делят ПТФС на отечно-болевую, варикозную и язвенную формы. Наиболее полную классификацию предлагают В. С. Савельев и соавт. (1972). Они делят ПТФС по локализации: нижний (бедренно-подколенный), средний (подвздош-но-бедренный), верхний (нижняя полая вена) сегменты; по типу: локализованный, распространенный; по форме: отеч-
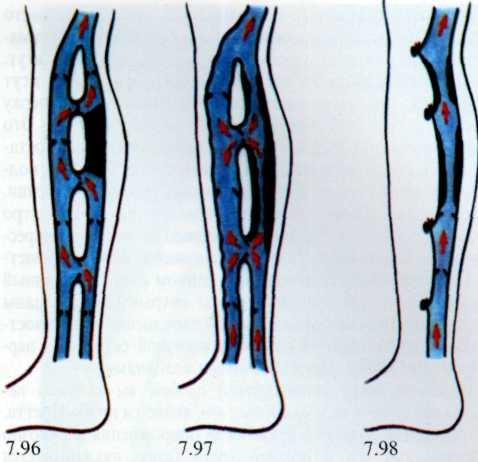
7.96. Схема венозного кровообращения при тромбозе глубо ких вен.
Кровоток извращен — венозная кровь диета.шпее места тромбоза оттекает из глубокой венозной сети но перфо-рантным венам в поверхностные вены.
7.97. Схема венозного кровообращения при реканализации глу боких вен голени.
Кровоток извращен — венозная кровь по перфорашпным и глубоким венам с недееспособными клапанами движется в разных направлениях, застаивается в пораженной конечности.
7.98. Схематическое изображение операции создания оттока венозной крови по глубоким венам при реканализованиом тромбозе (операция Линтона).
Поверхностные вены удалены. Перфорантные вены перевязаны и пересечены. Кровоток осуществляется по рекана.шзо-ванным глубоким венам.
ный, отечно-варикозный; по стадиям: компенсация, декомпенсация (без трофических нарушений, с трофическими нарушениями).
Л. И. Клионер и В. И. Русин (1980) классифицируют ПТФС: А — по локализации: 1) весь ствол НПВ или его сегменты (надпочечный, почечный, подпочечный); 2) подвздошный; 3) подвздошно-бедренный; 4) бедренный сегменты. Б—по состоянию проходимости сосуда: облитерация, частичная и полная реканализация. В—по степени нарушения кровотока, субкомпенсированная, компенсированная.
Диагностика. Для диагностики хронической недостаточности магистральных вен системы нижней полой вены используют функциональные клинические пробы и различные инструментальные методики.
Функциональные пробы позволяют выявить недостаточность клапанов поверхностных и перфорантных вен. проходимость и функциональное состояние глубоких вен.
Среди проб, выявляющих клапанную недостаточность поверхностных вен, распространена проба Броди—Троянова— Тренделенбурга. Для ее выполнения у больных в положении лежа поднимают исследуемую конечность до опорожнения
725
варикозно расширенных поверхностных вен. Далее, место впадения большой подкожной вены в бедренную прижимают пальцем или на верхнюю треть бедра накладывают жгут. Больной становится на ноги. Через некоторое время жгут снимается, при этом спавшиеся варикозные вены сверху быстро и туго заполняются обратным током крови. Это положительный результат пробы, указывающий на недостаточность клапанного аппарата устья и ствола большой подкожной вены при ее быстром ретроградном заполнении. При отрицательном результате поверхностные вены быстро (в течение 5—10 с) заполняются кровью до снятия компрессии в овальной ямке, причем их наполнение не увеличивается при устранении компрессии. В данном случае клапанный аппарат большой подкожной вены сохранен, но клапаны перфорантных вен поражены, ибо заполнение поверхностных вен произошло из глубокой венозной сети через пер-форантные вены с недееспособными клапанами.
Наиболее часто используемой пробой, выявляющей несостоятельность перфорантных вен, является проба Претта. В положении больного лежа после опорожнения варикозно расширенных вен в верхней трети бедра накладывается резиновый жгут, сдавливающий большую подкожную вену. Затем на конечность накладывают эластический бинт от пальцев до жгута, и больной становится на ноги. Эластический бинт начинают снимать сверху, виток за витком. При образовавшемся промежутке между жгутом и бинтом в 10—15 см сверху накладывают второй эластический бинт, которым постепенно сверху вниз обвивают конечность вслед за сжимающимися турами первого бинта. Появление напряженного сегмента варикозной вены между двумя бинтами свидетельствует о несостоятельности клапанного аппарата перфорантной вены, через которую заполняется из глубокой венозной сети данный сегмент подкожной вены. Проба Барроу—Купера—Шейниса или трехжгутовая проба основана на том же принципе, что и проба Претта. На исследуемую конечность накладывают 3 жгута: в верхней трети бедра, над коленным суставом и ниже коленного сустава. Наполнение сегмента поверхностной вены между жгутами при переводе больного в вертикальное положение свидетельствует о несостоятельности перфорантных вен в этом сегменте. При смещении жгутов навстречу друг другу можно более точно определить локализации несостоятельной перфорантной вены.
Наиболее распространена проба Мейо—Претта, выявляющая проходимость и функциональное состояние глубоких вен, при которой больному в горизонтальном положении накладывают резиновый жгут на верхнюю треть бедра. Затем эту конечность туго бинтуют эластическим бинтом от пальцев стопы до верхней трети бедра. Больной ходит 20— 30 мин. Если неприятных и болевых ощущений у него нет, то это свидетельствует о хорошей проходимости глубоких вен и, наоборот, появление распирающих болей в области голени говорит о нарушении проходимости глубоких вен. Ряд авторов отдают предпочтение функциональной пробе Дельбе—Пертеса, при которой в вертикальном положении при максимальном заполнении поверхностных вен на верхнюю треть бедра накладывают жгут. Затем больной ходит 5—10 мин. Быстрое (в течение 1—2 мин) опорожнение поверхностных вен свидетельствует о хорошей проходимости глубоких вен и полноценности клапанного аппарата перфорантных. вен. Если при ходьбе поверхностные вены не
спадаются и, наоборот, их наполнение увеличивается, появляются распирающие боли, это свидетельствует о непроходимости глубокой венозной системы.
Наиболее ценной диагностической методикой при исследовании данной патологии больных является рентгеноконт-растная флебография. В данном случае дистальная флебография может сочетаться с тазовой при исследовании больных с подвздошно-бедренной локализацией ПТФС и тазовая флебография—с ретроградной каваграфией при подвздош-но-кавальной локализации хронической венозной непроходимости. В последние годы часто используют одномоментную ретро- и антеградную флебографию, позволяющую добиться одновременного контрастирования подвздошных вен и вен нижних конечностей. Дистальная флебография выполняется обычно введением контрастного вещества в тыльную вену межпальцевого промежутка стопы путем ее венесекции. Тазовую обтурационную флебографию осуществляют с помощью двух катетеров, вводимых по Сельдингеру через коллатеральную бедренную вену. Один катетер с баллоном устанавливается над бифуркацией нижней полой вены, ди-стальнее устья почечных вен, затем баллон заполняется физиологическим раствором и полностью окклюзирует просвет нижней полой вены. Второй катетер используется для введения контрастного вещества, так что его конец устанавливается в общей подвздошной вене на стороне пораженной конечности. Для определения верхней границы тромбоза при поражении нижней полой вены выполняется ретроградная илеокаваграфия через левую подключичную вену путем ее пункции. Флебографическая семиотика при ПТФС складывается в основном из: а) неровности контуров и неравномерности заполнения контрастным веществом того или иного венозного сегмента («симптом резинки»); б) дефектов наполнения; в) частичного отсутствия заполнения участков в системе глубоких вен; г) полного отсутствия заполнения участков магистральных вен; д) наличия избыточной коллатеральной сети (рис. 7.99).
Радионуклидная флебография является малотравматичным, высокоинформативным методом определения скорости и характера венозного кровотока (рис. 7.100).
Ультразвуковая флоуметрия, основанная на эффекте Доплера, впервые была применена для исследования больных с ПТФС подвздошно-бедренной локализации Л. И. Клионе-ром, В. И. Русиным (1982). Она определяет линейную скорость кровотока по принципу восприятия и усиления сдвига частот, происходящих при прохождении ультразвука через движущуюся кровь. Метод неинвазивный, поэтому очень удобен и безвреден при многократном исследовании больных на разных до- и послеоперационных этапах. Об изменениях скорости кровотока судят по звуковому сигналу, возможна и графическая запись (рис. 7.101).
Флебоманометрия является одним из дополнительных тестов при определении хронической непроходимости магистральных вен. При выраженном варикозном расширении вен нижних конечностей цифры венозного давления увеличиваются до 150—170 мм вод. ст., а при ПТФС могут достигать 200 мм вод. ст. (норма 100—120 мм вод. ст.). В положении стоя венозное давление колеблется в широких пределах—от 750 до 1300 мм вод. ст.
Лечение. Несмотря на то что в вопросах клиники и специальных методов диагностики при ПТФС различной локализации имеются общие подходы, методы хирургического ле-
726
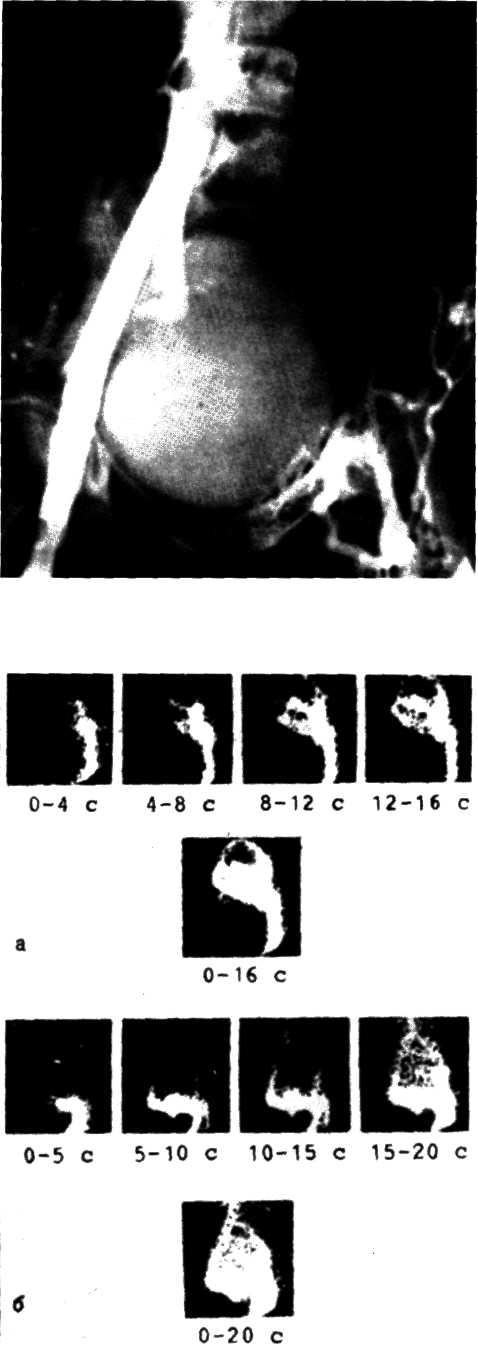
чения данной патологии совершенно различны. Если у наиболее многочисленной группы больных с ПТФС глубоких вен нижней конечности в настоящее время успешно выполняют операции типа Линтона, то при всех других типичных локализациях ПТФС (подвздошно-бедренной, подвздошно-кавальной) производят совершенно иные виды пластических операций.
Всю модифицированную операцию Линтона можно условно разделить на три этапа: 1) иссечение всей системы большой и малой подкожных вен; 2) перевязка и пересечение или иссечение перфорантных вен на голени под апоневрозом; 3) пластика апоневроза. Первый этап операции по существу ничем не отличается от операций по удалению варикозно расширенных вен. В зависимости от навыков хирурга в данном случае можно воспользоваться любым из применяемых способов удаления варикозных вен. Нужно учесть, что следует удалять только варикозно расширенные вены. Если, например, на голени имеется варикоз, а на бедре стенки подкожных вен без видимых изменений, то на бедре подкожные вены удалять не следует, так как они играют определенную компенсаторную роль по оттоку венозной крови от пораженной конечности у больного с ПТФС. Второй этап операции начинается широким кожным разрезом по внутренней поверхности голени, начиная чуть ниже коленного сустава и почти до внутренней лодыжки (рис. 7.102). Образуется обширная рана длиной 20 см и более, дном которой является, как правило, довольно мощный слой индуцированной, склерозированной очень плотной клетчатки. В пределах раны необходимо иссечь эту патологически измененную клетчатку, после чего обнажается апоневроз, охватывающий мышцы голени. Далее по длине раны широко вскрывается апоневроз, под ним обнажаются перфорант-ные вены, которые располагаются главным образом по внутренней задней поверхности голени, обычно в количестве 5—8, в различной степени расширенные и измененные, диаметр их может достигать в отдельных случаях 8—10 мм, приближаясь к диаметру большой подкожной вены на голени. По мере тупой препаровки и обнажения перфорантные вены перевязываются двумя лигатурами, между которыми рассекаются. После второго этапа в типичной операции Линтона рана послойно зашивается наглухо и операция заканчивается. В ряде случаев мы предпочитаем производить еще третий этап операции, направленный на пластику апоневроза. При некотором сужении апоневроза и «усилении» его стенки мышцы голени получают лучшую точку опоры, что приводит к их более полному и мощному сокращению. Поэтому края апоневроза не просто сшиваются, а создается дупликатура его точно так же, как это делается при пластике пахового канала по С. И. Спасокукоцкому.
7.100. Различные варианты радионуклидной флебографии при тромбозе подвздошных вен после введения препарата в глубокую (а) и поверхностную (б) венозные системы нижней конечности.
а—кровоток по бедренной вене (препарат введен после наложения жгута); б—кровоток по поверхностной вене (препарат введен без наложения жгута).
727
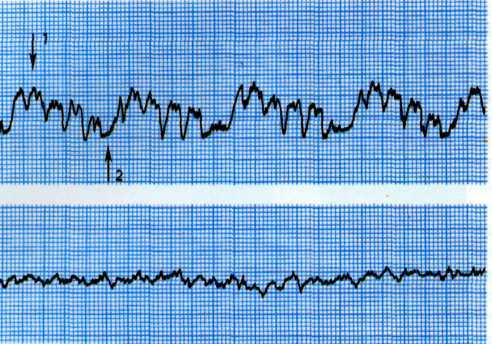
7.101.
Вид кривой линейной скорости кровотока
у больногос
тромбозом левой общей подвздошной
вены, записанной при помощи
ультразвукового флоуметра.
Верхняя кривая — с правой непораженной бедренной вены: ясно видны волны венозного кровотока и циклические респираторные колебания: I — пик выдоха; 2 — пик вдоха. Нижняя кривая — на стороне поражения с левой бедренной вены: кровоток имеет постоянную линейную скорость, пульсовые волны венозного кровотока отсутствуют.
Проекция кожного разреза на голени при операции Линтона.
Схема разрезов для пересечения и перевязки перфо- рантных вен (указаны крестами) при операции Линтона в модификации Де Пальма.
При определении показаний к операции Линтона следует учитывать наличие трофических язв. При неподдающихся консервативному лечению язвах следует оперировать после тщательной и длительной (не менее 1 нед) предварительной санации язв различными антисептическими растворами. Вовремя операции нужно стремиться к тому, чтобы кожный разрез прошел как можно дальше от язвенной поверхности,ибо зона язвы является зоной наибольших трофических изменений тканей, которые плохо срастаются в послеоперационном периоде. В данном случае лучше использовать доступ по Фельдеру, проходящий строго по задней поверхности голени от ахиллова сухожилия до подколенной ямки. В других случаях для доступа к перфорантным венам при выраженных трофических нарушениях может быть использована операцияR.DePalma(1974), который вместопродольного разреза Линтона производит несколько косых поперечных небольших разрезов по линиям, параллельнымкожным складкам (рис. 7.103).
Хирургическое лечение больных с различной локализацией ПТФС в венах крупного калибра. У больных с непроходимостью магистральных вен крупного калибра лучшей операцией является аутовенозное шунтирование, несмотря на все свои недостатки, главными из которых являются трудности подыскания шунта нужного диаметра и длины. Единственным «свободным» трансплантатом может быть большая подкожная вена бедра на всем ее протяжении.
При подвздошно-бедренном тромбозе выполняются различные шунтирующие операции. В одних случаях накладывается сафенобедренный шунт (операция Де Пальма), в других—подвздошно-бедренный или бедренно-бедренный шунт. При изолированных подвздошно-бедренных тромбозах оптимальным является сафенобедренный шунт с использованием в качестве шунта большой подкожной вены «на ножке» (рис. 7.104). При небольших по протяженности тромбозах, возникших вследствие сдавления вены рубцамипосле ножевого ранения или травмы вены во время операции, хорошее впечатление оставляют короткие свободныеаутовенозные шунты, которые анастомозируются своими концами с пораженной веной выше и ниже места закупорки(бедренно-бедренные, подвздошно-бедренные, подвздошно-иодвздошные шунты).
За последние годы предложены новые варианты пластических операций. Так, А. Н. Введенский (1979) рекомендует накладывать анастомозы между бедренной веной после ее частичной резекции и глубокой веной бедра, так как клапанный аппарат глубокой вены бедра меньше страдает при ПТФС.
Последнюю группу больных составляют лица с непроходимостью ствола нижней полой вены. Изолированный тромбоз ствола нижней полой вены так же, как и его отдельных сегментов (надпочечного, почечного и подпочечного), встречается довольно редко. Хирургическое лечение таких больных возможно только в тех случаях, когда, во-первых, распространение тромбоза к периферии заканчивается где-то на уровне бедренных вен, и чем выше, тем лучше. Во-вторых, проксимально тромб не должен доходить до почечных вен. ибо необходим участок под почечными венами дляналожения проксимального анастомоза при выполнении операции аутовенозного шунтирования. В данном случае можно наложить аутовенозный бедренно-кавальный или подвздошно-кавальный одно- и двусторонние шунты. Одна-
728
ко, к сожалению, подобная «идеальная» локализация тромбоза встречается довольно редко.
При пластических венозных операциях в последние годы стали пользоваться временным, сроком на 3—4 нед, наложением артериовенозных свищей, повышающих в 5—7 раз скорость венозного кровотока и тем самым препятствующих раннему тромбозу шунтов [Клионер Л. И., Русин В. И.. 1983]. Искусственные артериовенозные свищи создаются различными способами: с помощью анастомоза бок в бок. с использованием коллатеральной ветви и наложением анастомоза конец в бок, с использованием аутовенозной надставки. Для этой же цели используют и шунтирование по методу Скрибнера. применяемое при гемодиализе, когда часть силиконовой трубки находится на поверхности кожи. Чаще при ПТФС подвздошно-бедренной локализации при перекрестном сафенобедренном шунтировании накладывают артериовенозный свищ при помощи большой подкожной вены пораженной стороны. Анастомоз между трансплантатом (большая подкожная вена) и бедренной веной накладывается бок в бок, а избыточная культя трансплантата вшивается конец в бок в поверхностную бедренную артерию (рис. 7.105) по типу «рукоятки корзинки».
Результаты. Непосредственные хорошие результаты после выполнения операции Линтона получены у 86% больных. Отдаленные результаты через 6 лет были хорошими и удовлетворительными у 84% оперированных больных [Клионер Л. И„ 1969]. При восстановительных операциях аутовеноз-ного шунтирования в непосредственном послеоперационном периоде основная масса больных имела гладкое течение (81,5%), у 10,4% отмечен тромбоз шунта. В отдаленные сроки наблюдения от 1 года до 5 лет тромбоз шунта наступал еще у 19% больных. Следовательно, общее количество тромбозов шунтов в ближайшем и отдаленном послеоперационном периоде равнялось 29,4% по отношению ко всем операциям аутовенозного шунтирования.
7.104. Варианты сафенобедренного шунтирования при под-вздошно-бедренном тромбозе с использованием трансплантата на ножке (операция по методу Де Пальма).
7.15. ОККЛЮЗИИ СИСТЕМЫ ВЕРХНЕЙ ПОЛОЙ ВЕНЫ
Острая и хроническая недостаточность в системе верхней полой вены развивается гораздо реже, чем в системе нижней полой вены, и соответствует соотношению 1:5 [Клионер Л. И. и др., 1984]. Причины развития острой и хронической венозной непроходимости в системе полых вен также различны. Так, если в системе нижней полой вены как острая, так и хроническая венозная непроходимость является, как правило, следствием венозного тромбоза, то в системе верхней полой вены развитие непроходимости часто связано с различными внесосудистыми факторами. Ствол верхней полой вены как в изолированном виде, так и в сочетании с безымянными венами крайне редко поражается первичным острым тромботическим процессом. Непроходимость этих венозных сегментов развивается постепенно вследствие сдавления их извне чаще всего злокачественными опухолями легких или средостения. Острый венозный тромбоз чаще развивается в подключично-подмышечном венозном сегменте и носит название синдрома Педжета—Шреттера. Однако истинный острый тромбоз подключичной вены, связанный с физической нагрузкой, отмечается лишь у части больных с синдромом Педжета—Шреттера. Другие больные
7.105. Схема операции перекрестного сафенобедренного шунтирования с созданием артериовенозного свища (ABC) при помои/и избыточной культи большой подкожной вены по типу «рукоятки корзины». НПВ—НИЖНЯЯ полая вена; Ао — аорта.
729
7.106. Больной с правосторонним синдромом Педжета —
Шреттера.
Правая верхняя конечность отечна, увеличена в объеме.
этой группы, как правило, острого начала болезни не отмечают, с каким-либо определенным фактором его не связывают и соответственно поступают в клинику уже в хронической стадии бблезни, которую более правильно называть ПТФС верхних конечностей. Таким образом, с этиопатогенетической и методологической точек зрения в данной главе совместно описываются все стадии синдрома Педжета—Шреттера и так называемого синдрома верхней полой вены, поэтому данная глава и называется не «острая» или «хроническая венозная недостаточность», а «окклюзии системы верхней полой вены».
7.15.1. СИНДРОМ ПЕДЖЕТА —ШРЕТТЕРА И ПТФС ВЕРХНИХ КОНЕЧНОСТЕЙ
Впервые в 1875 г. J. Paget описал два случая заболевания с явлениями нарушения венозного оттока в верхних конечностях, связанного с тромбозом магистральных вен. L. Schroetter (1884) впервые высказал предположение о том, что причиной заболевания является травматическое повреждение глубокой вены верхней конечности с последующим тромбозом. Таким образом, приоритет первого описания заболевания остается за L. Schroetter, отметившим связь его с физическим усилием, хотя в литературе данную патологию чаще называют синдромом Педжета — Шреттера, признавая заслуги обоих авторов. Большой литературный материал собрал Е. S. R. Hughes (1949). Он обобщил 320 наблюдений исследователей различных стран мира.
Впервые в отечественной литературе синдром Педжета — Шреттера описал А. Я. Пытель (1934) и назвал его тромбозом от усилия.
Частота. Всего в мировой литературе описано более 900 наблюдений синдрома Педжета—Шреттера. Статистические данные свидетельствуют о том, что мужчины болеют чаще, чем женщины (4:1). Обычно этим заболеванием страдают люди физического труда и спортсмены в возрасте 20—40 лет с хорошо развитой мускулатурой. Заболевание в основном одностороннее.
Этиология и патогенез. Из гипотез, объясняющих причины и механизм развития синдрома Педжета — Шреттера, заслуживают внимания травматическая, инфекционная и ней-рогенная. Согласно травматической гипотезе, непрямая травма подключичной и подмышечной вен во время физического усилия ведет к повреждению внутренней оболочки вены и образованию в этой зоне тромба [Schroetter L., 1884]. Нет единого мнения о характере и первичной локализации повреждения вен при физическом усилии. Так, W. Rosental (1962) считал основной причиной тромбоза подмышечной вены отрыв мелких венозных веточек при физическом, усилии. Другие авторы [Cadenat P. M., 1970] предполагают, что тромбообразование в вене происходит на фоне разрыва ее стенки при резком подъеме венозного давления, связанного с внезапным мышечным сокращением. J. Sampson (1963) объясняет причину заболевания сужением щели между ключицей и I ребром, где, по его мнению, происходит сдавление подключичной вены. Многие авторы большое значение в развитии заболевания придают различным аномалиям развития плечевого пояса, не исключая деформацию ключицы и I ребра. Выявление во время операции сужения подключичной вены при наличии шейных симпатических узлов послужило основанием для выдвижения нейрогенной гипотезы, сущность которой заключается в наличии патологического очага раздражения в пе-ривенозных тканях, что приводит к нарушению вазомоторного равновесия [Cottalorda J., 1932]. Сторонники инфекционной гипотезы [Lampe С, Lester J., 1967] большое значение в развитии процесса придают неспецифической инфекции. Теория основана на повышении температуры во время болезни, лейкоцитозе и увеличенной СОЭ. Как видно из сказанного, основное значение в этиологии и патогенезе болезни придается анатомо-топографическим особенностям подключичной и подмышечной вен и их взаимодействию с окружающими костными образованиями. В этой связи заслуживает интерес теория развития синдрома Педжета — Шреттера, выдвинутая в 1982 г. В. С. Савельевым и Е. Г. Яблоковым. Авторы считают, что при данной патологии происходит травматизация проксимального отдела подключичной вены в реберно-подключичном промежутке, в результате чего образуются внутрисосудистые изменения в виде гипертрофии стенки подключичной вены, а также гипертрофии и ригидности терминального клапана внутренней оболочки. В дальнейшем все это приводит к тромбозу подключичной вены.
Клиника. Клиническая картина заболевания развивается очень быстро вследствие острой закупорки магистральной вены и проявляется различными симптомами. Основные из них: прогрессирующий отек конечности, сильные боли и цианоз, нарушение кровообращения в конечности, видимое развитие коллатералей, прощупывание по ходу вены плотного тромба, повышение температуры (рис. 7.106). По степени и распространенности отека P. Cadenat (1970) выделил две формы болезни: частичную, когда отек имеется только на конечности, и распространенную, когда он переходит на грудную клетку и подключичную область. Кроме того, по тяжести заболевания автор различает легкую и тяжелую формы. Последняя, прогрессируя, приводит больных к инвалидности.
По характеру развития заболевания Е. Loelsen (1969) различает тромботическую и нетромботическую формы. А. Я. Пытель (1934), Б. Ф. Соколовский (1961) придержива-
730
ются клинической классификации, выделяя острую и хроническую стадии заболевания. В. Л. Прикупец (1971) выделяет острую и хроническую стадии заболевания, а в острой стадии—три формы: легкую, средней тяжести и тяжелую.
Течение болезни Л. И. Клионер и соавт. (1984) также разделяют на две стадии: острую (болезнь Педжета—Шрет-тера) и хроническую (ПТФС верхних конечностей). В острой стадии болезни Педжета—Шреттера при развившемся ок-клюзирующем тромбозе подключичной вены симптомы заболевания становятся постоянными, а интенсивность их быстро нарастает до максимума в течение 24—36 ч. У 11% больных они развиваются сразу после физической нагрузки, у 37%—в течение первого часа, у 37%—в течение последующих часов первых суток и лишь у 15%—по истечении 24 ч. Продолжительность острой стадии болезни Педжета— Шреттера не превышает 2—3 нед. В этот период полностью стихают острые явления, развивается коллатеральная сеть в области плеча и передней грудной стенки соответствующей стороны. В дальнейшем течение заболевания носит стабильный характер с периодическими ухудшениями состояния, т. е. переходит в ПТФС верхних конечностей.
Прогноз жизни при болезни Педжета—Шреттера и ПТФС верхних конечностей абсолютно благоприятен. Однако полного выздоровления не наступает. Такие осложнения заболевания, как эмболия легочной артерии и венозная гангрена, исключительно редки.
Диагностика. Рентгенологическое исследование при болезни Педжета—Шреттера и ПТФС верхних конечностей позволяет исключить внутригрудинные процессы, ведущие к венозной закупорке. Кроме того, диагностическая ценность его состоит в возможности выявления шейного ребра, наличие которого некоторые исследователи связывают с возникновением непроходимости подключичной артерии.
Флеботонометрия имеет диагностическое значение. При синдроме Педжета—Шреттера венозное давление на пораженной конечности в зависимости от степени тяжести болезни может подниматься до 200—400 мм вод. ст. (в норме— не выше 150 мм вод. ст.).
Исключительно ценно для установления локализации тромбоза, протяженности его и степени развития коллатеральных путей оттока крови флебографическое исследование. Оно выявляет ампутацию магистральной вены и отсутствие ее контрастирования, что характерно для всех случаев тромбоза подключичной, подмышечной и плечевой вен (рис. 7.107). Дефекты наполнения магистральной вены при болезни Педжета—Шреттера и ПТФС верхних конечностей являются частыми симптомами тромботической окклюзии вены и объясняются пристеночным тромбозом. Нередко вена перед местом окклюзии оказывается конически суженной циркулярным пристеночным тромбом (рис. 7.108). Множественные дефекты наполнения вены и неравномерность ее контрастирования весьма характерны для тромбоза большой давности с явлениями реканализации и острого пристеночного (неокклюзирующего) тромбоза подключичной вены. Характерным признаком венозной окклюзии наряду с одним или несколькими перечисленными симптомами являются множественные коллатерали, которые в виде сети сопровождают ствол магистральной вены, распространяясь в под- и надключичные области, на боковую поверхность шеи и подмышечную впадину.
Хирургическое лечение. Если функция конечности удовле-
7.107. Флебограмма больного с правосторонним синдромом
Педжета — Шреттера.
Определяется «ампутация» правой подключичной вены.
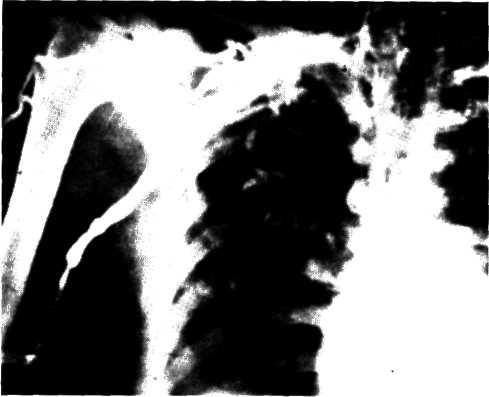
7.108. Флебограмма больного с правосторонним синдромом Педжета — Шреттера.
Определяются дефекты наполнения подключичной вены, неравномерность ее контрастирования и широкая коллатеральная сеть венозных сосудов.
творительная или отсутствуют неприятные субъективные ощущения (боль, отек, парестезии и тяжесть в руке), хирургическое лечение не показано. Хирургическое лечение болезни Педжета—Шреттера и ПТФС верхних конечностей, применяющееся в клинической практике, складывается из тромб-эктомии при болезни Педжета—Шреттера и венозной пластики в виде аутовенозного шунтирования при ПТФС. Кроме того, в обеих стадиях могут быть предприняты паллиативные операции: венолизис и иссечение различных экстра-вазальных образований, окружающих и сдавливающих подключичную и подмышечную вены. При необходимости ревизии подключичной вены в тех случаях, когда патологический процесс локализуется в пространстве между I ребром
737
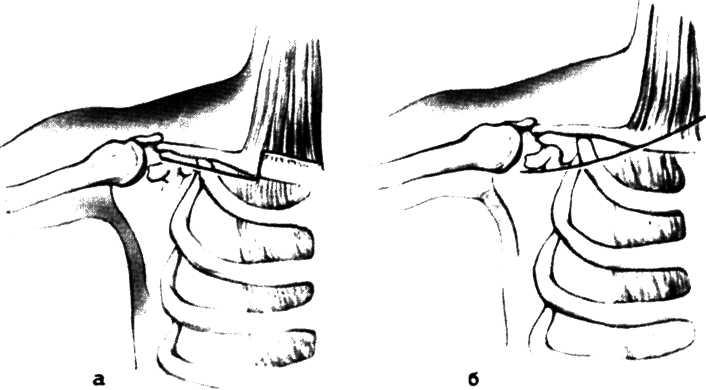
а — комбинированный под- и надключичный доступ для ревизии подключичной вены; б— дугообразный доступ для ревизии подключичной вены.
и ключицей и распространяется в сторону венозного угла, L. M. Me Cleery и соавт. (1961) рекомендуют комбинированный под- и надключичный доступ (рис. 7.109). Этот подход обеспечивает хороший обзор подключичной вены на всем протяжении. Однако существенным недостатком этого доступа является ломаная линия кожного разреза. Лучше использовать дугообразный разрез, начинающийся у медиального края грудиноключично-сосцевидной мышцы на 2—3 см выше ключицы, пересекающий последнюю на границе внутренней и средней трети и заканчивающейся на 2—3 см ниже ключицы по передней подмышечной линии (см. рис. 7.109).
Тромбэктомия, к сожалению, еще не нашла широкого применения из-за преувеличения опасности последующих эмболии и повторных тромбозов. Длительное время сообщения о подобных операциях носили казуистический характер. Лишь в последние годы эта операция привлекает все большее число сторонников. Исследования ряда авторов [Бакулев А. Н. и др., 1967; Шалимов А. А., Сухарев И. И., 1984] показали, что при острых тромбозах подмышечной и подключичной вен тромбэктомия должна быть операцией выбора. Оптимальными сроками операции являются первые дни от момента развития клинической картины заболевания. Хирургическое вмешательство при остром тромбозе подключичной и подмышечной вен должно быть направлено на восстановление проходимости подключичной и подмышечной вен (тромбэктомия) и устранение факторов, определяющих первичную локализацию тромбозов подключичной вены в области реберно-ключичного промежутка (декомпрессия вены—рассечение реберно-клювовидной связки, иссечение подключичной мышцы, иссечение деформированных клапанов). Только выполнение полного объема операции гарантирует радикальность предпринятого хирургического вмешательства.
Венозная пластика. При хронических венозных окклюзиях тромбэктомия невыполнима. Восстановление нарушенной гемодинамики у больных возможно при помощи пластических и реконструктивных операций, которые в последние годы применяют ряд хирургов [Клионер Л. И., 1969, 1984; Клемент А. А и др., 1969; Введенский А. Н., 1979; Шалимов А. А. и др., 1984]. Клиническое применение нашли операции следующих видов: 1) шунт между подключичной или подмышечной венами (дистальнее места окклюзии) и яремной
веной (внутренней) с использованием сегмента большой подкожной вены [Клионер Л. И., 1969] (рис. 7.110); 2) прямой анастомоз между наружной яремной веной и подключичной веной или подмышечной венами [Клемент А. А. и др., 1969]. Для лучшего и более длительного функционирования шунта Л. И. Клионер, А. А. Апсатаров (1971) стали применять при пластических операциях в хронической стадии синдрома Педжета—Шреттера дополнительное наложение дистальных временных артериовенозных свищей на верхнюю конечность обычно при помощи V-образной канюли из набора Скрибнера. Свищ, как правило, накладывался между лучевой артерией и проходящей вблизи подкожной веной.
Консервативное лечение в острой стадии заболевания должно быть направлено на ликвидацию спазма сосудов, уменьшение отека конечности, предупреждение образования и распространения тромбоза.
Результаты. После пластических операций в хронической стадии синдрома Педжета—Шреттера в отдаленные сроки наблюдения до 12 лет А. Н. Введенский отмечает у ряда больных проходимость шунта и хорошие результаты операции. Данные Л. И. Клионера и соавт. (1984) свидетельствуют о том, что на отдаленных сроках наблюдения хорошие результаты после аутовенозного шунтирования наблюдаются у 33,3% больных.
7.15.2. ОККЛЮЗИИ ВЕРХНЕЙ ПОЛОЙ И БЕЗЫМЯННЫХ ВЕН
Группа симптомов, возникающих при нарушении кровотока по стволу верхней полой вены и объясняющихся наличием регионарной венозной гипертензии верхней половины туловища, получила название «синдрома верхней полой вены». Вопрос о приоритете в описании этого синдрома окончательно не решен. F. Mclntire и Е. Sykes (1949) пишут, что в 1740 г. Т. Бартолинус описал случай смерти от удушья, когда на вскрытии было найдено инородное тело («маленький кусочек мяса») в устье полой вены. Они же отмечают, что в 1757 г. Hunter сообщил о смерти больной в связи со сдавлением верхней полой вены аневризмой аорты. Среди первых отечественных ученых, собравших значительные сведения о клинике синдрома верхней полой вены, следует упомянуть Э. К. Вагнера (1914), А. Д. Минца (1919), Г. Г. Глухонького (1924) и др. Среди наших совре-
732

7.110. Схематическое изображение подкмочично-яремного
шунтирования с использованием сегмента большой подкожной вены бедра в качестве трансплантата (а) и прямого подк.почично-наружнояремного шунтирования (б). В качестве шунта использована наружная яремная вена.
менников диагностикой и радикальным лечением «синдрома верхней полой вены» занялись В. А. Жмур (1960), Б. В. Петровский (1962), А. Н. Бакулев, В. С. Савельев, Э. П. Думпе (1967). Л. И. Клионер (1969), А. А. Шалимов, Н. Н. Сухарев (1984) и др.
Вопрос о частоте данного заболевания остается открытым. Так, Н. С. Hinshaw и соавт. (1942) сообщают, что из 85000 больных, госпитализированных последовательно в клинку, только у четырех наблюдался «синдром верхней полой вены». В свою очередь W. Bruckner (1958) считает, что больной с синдромом верхней полой вены встречается в среднем один раз в год в больнице на 200—300 функционирующих коек.
Другие авторы сообщают о гораздо большей частоте данного заболевания. Так, W. Richter (1959) за 8 лет наблюдал 97 больных с синдромом верхней полой вены. А. Н. Бакулев, В. С. Савельев, Э. П. Думпе (1967) за 4 года наблюдали 34 подобных больных. За 10 лет Л. И. Клионер (1969) наблюдал 23 больных с синдромом верхней полой вены, причем в отделении заведомо не госпитализировали больных с этим синдромом. Большинство авторов считают, что болезнь чаше встречается в возрасте 30—50 лет.
Мужчины, по данным литературы, болеют в 3—4 раза чаще, чем женщины.
Этиология и патогенез. Первичный тромбоз верхней полой вены встречается довольно редко. Так, по данным А. Н. Бакулева, В. С. Савельева и Э. П. Думпе (1967). только у одного больного из 34 они наблюдали первичный тромбоз верхней полой вены. Н. Junge (1956). по данным литературы, изучил синдром верхней полой вены у 600 больных и только у 5% отметил местные тромбофлебиты. Среди множества внесосудистых факторов, которые могут обусловить непроходимость верхней полой и безымянных вен. на первое место следует поставить злокачественные опухоли средостения и бронхолегочный рак. Внутригрудинные доброкачественные опухоли являются причиной непроходимости верхней полой вены гораздо реже, в 7% случаев. Кроме того, причинами синдрома верхней полой вены могут быть
сифилитические аневризмы аорты и артерий и. наконец, довольно часто медиастиниты различной этиологии [Шалимов А. А., Сухарев И. И.. 1984]. Патогенетически все эти внесосудистые образования могут либо сдавливать верхнюю полую вену, либо прорастать ее. обтурировать и вызывать вторичный тромбоз.
Патологическая физиология. Очевидно, что тяжесть данного заболевания зависит от места закупорки верхней полой вены, обычно выделяют три этапа: 1) закупорка проксима-льнее непарной вены, 2) закупорка дистальнее устья непарной вены; 3) закупорка на уровне непарной вены. Принципиальное значение данной классификации состоит в том, что она отражает компетенцию оттока из верхней половины туловища при закупорке верхней полой вены, так как основными путями коллатерального кровотока являются непарная и полунепарная вены, позвоночная вена, внутренние грудные и подкожные вены. При окклюзии верхней полой вены и устья непарной вены наблюдается ретроградный кровоток по непарной и полунепарной венам через поясничные вены в нижнюю полую вену. Из позвоночных вен кровь через позвоночные сплетения направляется к поясничным и седалищным венам, а затем через непарные вены и восходящие поясничные вены—в нижнюю полую вену. Из внутренних грудных вен кровь оттекает в нижние надчревные и наружные подвздошные вены. Степень эффективности коллатерального кровообращения связана с его развитием, которое зависит в свою очередь от быстроты развития синдрома верхней полой вены.
Клиника. Жалобы больных с синдромом верхней полой вены весьма характерны и зависят от двух патогенетических моментов. Одни жалобы (отечность лица, шеи, верхних конечностей, цианоз, расширение подкожных вен) связаны с венозным застоем в поверхностных глубоких венах лица, туловища и верхних конечностей. Другие (головная боль, шум в голове, приступы удушья, быстрая утомляемость, шум в ушах, снижение слуха, быстрая усталость глаз, слезоточивость) обусловлены венозным застоем в головном мозге. Основная клиническая симптоматика также зависит от этих двух факторов. Если классическая триада ведущих признаков синдрома верхней полой вены—цианоз головы, шеи и верхней половины туловища, расширение венозной подкожной сети этих же областей—связана с застоем в глубоких и поверхностных венах той же локализации, то целый
733
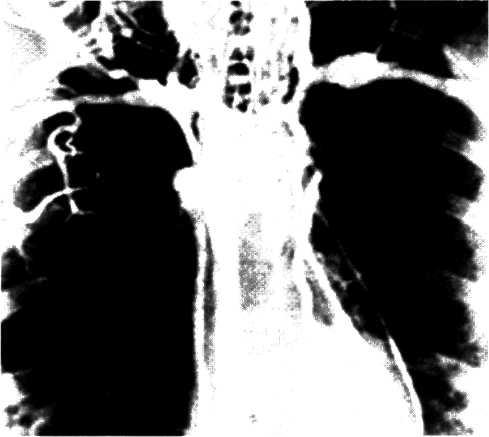
7.111. Флебограмма больного с окклюзией верхней полой вены. Виден коллатеральный отток с участием непарной, полунепарной и внутренних грудных вен.
ряд других симптомов—общемозговых, корковых, глазных—обусловлен нарушением мозгового кровообращения.
Для контингента больных с хронической непроходимостью верхней полой или безымянной вен подходит деление по тяжести клинического течения и расстройств венозной гемодинамики на три стадии: легкую, среднюю и тяжелую [Клионер Л. И., 1969].
Диагностика. Флебография является основным диагностическим методом, определяющим локализацию окклюзии, ее особенности, степень функционирования коллатеральной венозной сети при синдроме верхней полой вены. Показаниями к флебографическому исследованию являются случаи, имеющие клиническую симптоматику, подозрительную на синдром верхней полой вены. Методика флебографии при исследовании больных с поражением верхней полой и безымянной вен в отличие от синдрома Педжета—Шрет-тера требует только серийного производства флебограмм в прямой и боковой проекциях. Наиболее ярко флебо-графическая картина проявляется и зависит от уровня окклюзии верхней полой вены, описанного выше в разделе патофизиологии. Действительно, на флебограммах отчетливо видны уровень закупорки верхней полой вены и степень участия в оттоке коллатеральной сети (рис. 7.111), в первую очередь непарной, затем полунепарной и, наконец, внутренних грудных вен.
Манометрия. Картина величины венозного давления также непосредственно связана с уровнем и обширностью окклюзии верхней полой и безымянных вен и степенью развития коллатеральной сети. Обычно давление у больных с синдромом верхней полой вены колеблется от 200 до 500 мм вод. ст.
Хирургическое лечение окклюзионных процессов в системе верхней полой вены—одна из труднейших и не до конца разрешенных проблем современной флебологии. Пластические операции на верхней полой вене выполняются лишь немногими хирургами и количество их у каждого
исчисляется единицами, в лучшем случае десятками [Жмур В. А., 1961; Петровский Б. В., 1962; Бакулев А. Н. и др., 1967; Покровский А. В., Клионер Л. И., 1977; Шалимов А. А., Сухарев И. И., 1984]. Хирургическим доступом к верхней полой и безымянным венам является продольная стернотомия, если же процесс ограничивается лишь стволом верхней полой вены, можно использовать правостороннюю торакотомию в четвертое межреберье справа. У очень тяжелых больных со злокачественными опухолями, для того чтобы как-то разгрузить резко выраженный венозный застой верхней половины туловища, при синдроме верхней полой вены выполняется обходное шунтирование длинными ауто-венозными шунтами, которые проводятся подкожно и соединяют крупные венозные магистрали верхней и нижней полых вен [Клионер Л. И., 1969]. Таким образом накладываются бедренно-подключичные и бедренно-яремные ауто-венозные шунты, используя выделенную для этого большую подкожную вену на всем протяжении и проведя ее подкожно на животе и грудной клетке к подключичной или яремной вене. Подобные шунты, как правило, делают двусторонними, однако функционально они недолговечны.
Внутригрудная пластика верхней полой вены наиболее перспективна, особенно с применением полубиологических и других тромборезистентных протезов. Как правило, через продольную стернотомию выделяется верхняя полая вена. Дистальный анастомоз протеза накладывается по принципу конец в конец после рассечения верхней полой вены, в непосредственной близости от места слияния безымянных вен, проксимальный анастомоз также по принципу конец в конец накладывается с ушком правого предсердия после его внут-риперикардиального выделения и иссечения его верхушки. Кроме того, у ряда больных для улучшения венозной гемодинамики создаются временные артериовенозные свищи на предплечье в различных модификациях [Покровский А. В., Клионер Л. И., 1977]. Обычно при подобной фистуле скорость объемного кровотока в вене увеличивается в 5—7 раз, что в значительной мере предохраняет шунт или протез от тромбоза. Предложен и успешно выполняется целый ряд и других пластических внутригрудных операций. Так, В. С. Савельев и соавт. (1972) наиболее обоснованной операцией при синдроме верхней полой вены, особенно в случаях расположения окклюзии верхней полой вены ниже устья непарной вены, считают операцию обходного анастомоза между непарной веной и ушком правого предсердия. А. А. Шалимов и И. И. Сухарев (1984) выполняли подобные операции, используя аутовенозные трансплантаты, смоделированные из большой подкожной вены.
Результаты лечения. При изучении непосредственных результатов А. В. Покровский, Л. И. Клионер (1977) отметили, что при использовании длинных аутовенозных шунтов у 70% больных получено гладкое послеоперационное течение, в отдаленном периоде все эти шунты тромбировались. В свою очередь у больных с внутригрудными операциями, которым была выполнена пластика верхней полой вены полубиологическими протезами, непосредственные результаты были хорошими, в отдаленные же сроки наблюдения до 2 лет протезы функционировали у 60% больных.
А. А. Шалимов, И. И. Сухарев (1984) у всех оперированных ими 11 больных отметили хороший непосредственный результат. У 3 из 7 больных, оперированных радикально, тромбоз шунта наступил через 3—4 мес.
734

7.16. ОСНОВЫ АНГИОМИКРОХИРУРГИИ
Выдающимся достижением реконструктивной хирургии мелких сосудов и нервов следует считать микрохирургию. | Это новое направление активно развивается в последние : 20 лет как за рубежом, так и у нас в стране, и сфера его приложения постоянно расширяется. Дополнительно к существующим операциям по реплантации, свободной пересадке на микрососудистой ножке кожи, сальника, пальцев с каждым годом прибавляются все новые операции. В нашей стране ряд клиник и отдельных авторов располагают уже ! десятками и даже сотнями подобных микрохирургических 'операций [Петровский Б. В., Крылов В. С, 1976, 1985; Шалимов А. А., Дрюк Н. Ф., 1979, 1984].
Микрохирургия — это обычная хирургическая техника, выполняемая специальными микрохирургическими инструментами под микроскопом. Искусство хирургии постепенно возрастает. Применение микрохирургического инструментария и шовного материала позволяет максимально щадить ; анатомические структуры и восстанавливать их с почти абсолютной точностью. Если атравматическая хирургия заменила сантиметры на миллиметры, то микрохирургия ознаменовала собой новую эру — хирургию микрона [O'Brier В., 1981]. В хирургии сосудов микрохирургический метод впервые применили J. Jacobson и Е. Suarez в 1960 г.
Операционный микроскоп должен соответствовать определенным требованиям. Во-первых, давать увеличение от 6 до 40 раз и иметь источник холодного освещения, причем регулировка увеличения и фокусного расстояния должна производиться рукой или ногой хирурга. Во-вторых, микроскоп должен передвигаться в любом направлении до 3 см в горизонтальной плоскости и наклоняться во всех плоскостях. В-третьих, бинокулярная система для ассистента должна давать обзор того же операционного поля, что и у хирур-
га, с расположением ассистента в любой точке напротив хирурга. В-четвертых, микроскоп должен быть снабжен фото-, кино- или телекамерой. Наконец, штатив микроскопа должен быть либо напольным, либо иметь удобное потолочное крепление. В настоящее время в клинической практике применяются различные операционные микроскопы фирмы «Карл Цейс». Наилучшим считается триплоскоп 7Р/Н. Zeiss—он дает освещение большого операционного поля под несколькими углами (рис. 7.112). Увеличительные лупы могут также применяться при выполнении микрохирургических операций. Наибольшее применение находит лупа Keeler с 4-кратным увеличением и откидывающимися телескопическими линзами.
Микрохирургические инструменты и шовный материал. Если от операционного микроскопа требуется создание увеличения операционного поля, то от микрохирургических инструментов, наоборот,—их миниатюрность и удобства. Для обеспечения большей разносторонности J. Parel и соавт. (1970) создали группу электрических автоматизированных инструментов со сменными головками (рис. 7.113). Такой набор включает ножницы, иглодержатели, электронож, микродрель и т. п. В нашей стране создан специальный набор микрохирургических инструментов (рис. 7.114). Наиболее ценным шовным материалом для микрососудистой хирургии является нейлон, так как он не разволокняется при протягивании через ткань. Соотношение между диаметром нити и иглы должно быть практически равным. Для сосудов диаметром от 0,5 до 1 мм диаметр иглы должен быть 60—80 мкм, а нейлоновой нити—20 мкм. Весь шовный материал маркируется по диаметру иглы и нити (мкм), длине иглы (мкм) и кривизне иглы ('/8 окружности).
Морфологические особенности микрососудистых анастомозов. Одним из первых условий для адекватного состояния
735
7.114. Набор микрохирургических инструментов [Петровский Б. В., Крылов В. С, 1976].
микрососудистого анастомоза является точное сопоставление краев пересеченного сосуда, так как последующее заживление происходит посредством организации пристеночного тромба и сгустка, расположенного между краями сосуда. Параллельно с этим поверхность тромба эндотелизируется путем пролиферации клеток [Murray M. et al., 1966]. Процесс заживления зависит главным образом от активности средней оболочки, ее минимальное повреждение является важнейшим условием для успешного восстановления сосуда. В свою очередь даже при самой филигранной хирургической технике ткани стенки сосуда всегда подвергаются заметному повреждению. В артериях эндотелий начинает покрывать пристеночный тромб со стороны просвета сосуда в сроки от 8 до 12 дней, в венозных анастомозах этот процесс удлиняется до 4 нед [Nomura J., 1970]. Новые эндотелиальные клетки, покрывающие пристеночный тромб, образуются либо за счет разрастания неповрежденных клеток эндотелия, расположенных по краям повреждения, либо непрерывность эндотелиального клеточного слоя просвета сосуда восстанавливается за счет циркулирующих мононуклеарных клеток [GhaniA., 1963].
7.16.1. МИКРОХИРУРГИЧЕСКИЕ ОПЕРАЦИИ НА АРТЕРИЯХ ГОЛЕНИ
Показания для реконструктивных операций на сосудах голени—тяжелые степени ишемии конечности, прегангрена и даже гангрена дистальных отделов стопы при наличии окклюзии бедренной, подколенной артерий и артерий голени, выявляющихся на ангиограмме. В данном случае благодаря успехам микрохирургии стала перспективной операция аутотрансплантации большой подкожной вены в виде свободного трансплантата-шунта значительной протяженности, например аутовенозное шутнирование между общей
бедренной и задней большеберцовой артериями на уровне мыщелка или аутовенозное шунтирование между поверхностной бедренной артерией в средней трети бедра и задней большеберцовой артерией на уровне голеностопного сустава. Операции на сосудах голени осуществляют также при неудачно выполненных ранее реконструктивных операциях на бедренно-подколенном сегменте. По данным Б. В. Петровского, В. С. Крылова (1976), основной причиной окклюзии сосудов голени является не атеросклероз, а артериит (болезнь Бюргера). Авторы считают, что при выработке показаний к хирургическому лечению нет необходимости в проходимости всех трех сосудов голени, достаточно проходимости хотя бы одного из них. Таким образом, наиболее часто выполняемой операцией при поражении сосудов голени является аутовенозное бедренно-тибиальное шунтирование. В качестве трансплантата-шунта, как правило, используется большая подкожная вена. Далее накладывается проксимальный анастомоз, от которого в основном зависит хороший кровоток по шунту. Проксимальный анастомоз между трансплантатом и поверхностной или общей бедренной артерией накладывается по принципу конец в бок. Адекватную функцию данного анастомоза желательно проверить флоуметром. Средняя величина объемного кровотока не должна быть меньше 120—150 мл/мин. Чрезвычайно важным фактором является адекватная укладка трансплантата в подкожном туннеле. Следует избегать перегибов и пере-крутов трансплантата по оси и его чрезмерного натяжения по длине. Дистальный анастомоз может быть наложен с любой из артерий голени, но предпочтительной является задняя большеберцовая артерия, которая обнажается из медиального продольного разреза, идущего на 2—3 см кнутри и кзади от внутреннего края большеберцовой кости. Длина разреза зависит от уровня закупорки артерии. Сюда же через подколенную ямку, лучше в подкожной клетчатке,
736
протягивается трансплантат. Дистальный анастомоз между аутовеной и артерией, имеющей диаметр 3 мм и менее, накладывается также по принципу конец в бок с помощью микрохирургической техники, обеспечивающей точность наложения сосудистого шва и минимальную травматизацию стенки артерии и вены. Некоторые авторы дистальный анастомоз накладывают первым. Обычно для оптического увеличения используют микроскоп или чаще лупу-очки, при наложении анастомоза—микрохирургический инструмент и соответствующий шовный материал. Обычно об-вивной сосудистый шов накладывают иглой с проленовой нитью 8/0.
К малоберцовой артерии существуют медиальный и латеральный доступы. Чаще используют медиальный, при котором кожный разрез проводится, отступя 5 см от нижнего края медиального мыщелка болыпеберцовой кости, вдоль ее внутреннего края длиной 15 см. Аутовенозный трансплантат при данном доступе укладывается после пересечения части волокна медиальной головки икроножной мышцы, прикрепляющейся к медиальному надмыщелку. Эта манипуляция уменьшит угол, создаваемый при проведении трансплантата. Из-за глубокой раны операционный микроскоп у таких больных использовать не всегда возможно, поэтому пользуются очками-лупой. В качестве шовного материала при наложении анастомоза по принципу конец в бок используют атравматичный шовный материал— проленовые нити 7/0—8/0.
Переднюю большеберцовую артерию обнажают разрезом, проходящим на 2—3 см кнаружи от латерального края болыпеберцовой кости, с верхним краем разреза конечности на 2—3 см ниже головки малоберцовой кости. Проведение шунта к передней болыпеберцовой артерии осуществляется из подколенной ямки кнаружи к головке малоберцовой кости и далее под головкой по ходу расположения малоберцового нерва вниз в переднем ложе голени к передней боль-шеберцовой артерии. Проведение шунта в данном случае— дело очень ответственное и сложное. Наложение анастомоза-шунта с передней большеберцовой артерией производится с помощью микроскопа или лупы-очков по принципу конец в бок атравматичными иглами с проленовыми нитями 7/0-8/0.
Результаты операций шунтирования артерий голеней с использованием микрохирургической техники у 72% больных благоприятные, сохранить конечность от ампутации удается у 65%. Послеоперационная летальность составляет 3—7% [Imprato A., 1974]. По данным Б. В. Петровского и В. С. Крылова (1976), в отдаленные сроки наблюдения тромбоз шунта наблюдается у 50% больных, оперированных с использованием микрохирургической техники на артериях голени. Летальных исходов не было.
7.16.2. РЕПЛАНТАЦИЯ КОНЕЧНОСТИ
Реплантационная хирургия существует немногим более 20 лет, в основном это реплантация конечностей и пальцев. Н. Е. Kleinert и соавт. (1963) сообщают о реплантации не полностью оторванной верхней конечности. С. W. Ch'en (1972) сообщает, что с 1963 по 1971 г. было произведено 94 реплантации (10% у детей) верхних и нижних конечностей с приживлением конечностей у 84% больных. Ишемия ам-
путированной конечности длилась от 6 до 10 ч и более. У 41 больного была достигнута такая функция конечности, которая позволила им вернуться к прежней профессии. При реплантации оторванной конечности большое значение имеют условия сохранения оторванного органа до трансплантации. При правильном хранении трансплантат сохраняется до 10 ч и более. Наилучшим средством сохранения оторванной конечности является ее охлаждение—поверхностное или с помощью холодных растворов, перфузирующих через сосуды этой конечности. Без подобного охлаждения сроки возможной реплантации сокращаются до 6 ч. В качестве охлаждающих растворов для перфузии отторгнутой конечности используют декстран, гепарин и антибиотики. Охлаждение продолжают до тех пор, пока не наложат артериальные анастомозы. Этапы операции реплантации сводятся к следующему: 1) фиксация костных отломков внутрикост-ными штифтами или пластинками до их полной неподвижности; 2) восстановление проходимости артерий; 3) восстановление проходимости вен. Венозные анастомозы выполняются после снятия зажимов с артерий и заполнения кровью всей кровеносной системы конечности. Обычно на одну сшитую артерию восстанавливается проходимость двух вен. Восстановление нервов и сухожилий может быть отсрочено на несколько недель. При восстановлении непрерывности нервов сохраняется сосудистый принцип—поврежденные и размозженные участки нервов иссекаются. Обезболивание при реплантации конечности чаще общее.
Для данной операции необходимы травматологические и микрохирургические наборы инструментов. Сосуды на кисти и на уровне лучезапястного сустава сшиваются атрав-матическими иглами с проленовыми нитями 10/0, а на предплечье—нитями 8/0—9/0. Первичная хирургическая обработка в начале операции выполняется под увеличительной лупой-очками. Затем используют два микроскопа для тщательного изучения культи и ампутированной конечности, где отыскивают и подготавливают для соединения поврежденные сосуды, нервы и другие ткани. Необходимое укорочение костей позволяет правильно сопоставить сосуды и нервы. Для фиксации костей используют самые различные способы остеосинтеза: пластинки, спицы, внутрикостные гвозди. Обычно укорочение костей составляет 3—10 см, при этом их рост в реплантированной конечности не нарушается [Ch'en С. W., 1972]. При ампутации на уровне лучезапястного сустава удаляется проксимальный ряд костей запястья, а при ампутации на уровне запястья иссекается дистальный ряд костей с сохранением лучезапястного сустава. Крупные мышцы на предплечье лучше восстанавливать в начале операции во избежание повреждения крупных сосудистых анастомозов. В тех же случаях, когда в ампутированной части конечности имеется много мышц, артериальные анастомозы следует накладывать сразу же после остеосинтеза, так как сами мышцы очень чувствительны к длительной ишемии. Сосудистые анастомозы накладывают с соблюдением всех принципов микрососудистой хирургии: 1) сшивать можно только нормальные сосуды с хорошим кровотоком. Оценка состояния сосуда должна определяться только под микроскопом. Если сосуд поврежден, его необходимо резецировать до здоровых участков; 2) сшивают только сосуды одинакового диаметра, для этой цели можно накладывать косые ана.стомозы; 3) как правило, анастомозы накладывают конец в конец и лишь при невозможности осуществить
737
такую операцию—конец в бок. Если имеется сосудистый дефект, то его замещают, как правило, венозным трансплантатом, который чаще всего берут с внутренней поверхности противоположного предплечья, тыла стопы или паховой области. Все сосудистые анастомозы накладывают отдельными узловатыми швами в отличие от операций аутовеноз-ного бедренно-тибиального шунтирования, где возможен обвивной шов. Если срок небольшой, то вначале анастомо-зируют крупные вены. Количество восстановленных вен должно превышать в 2 раза количество анастомозирован-ных артерий. Если же срок ишемии продолжительный, то первыми восстанавливают артерии.
Первичное восстановление нервов определяется индивидуально. Оно может быть отсрочено на довольно длительный срок. Но всегда следует помнить, что основной задачей реплантационной хирургии является первичное соединение пересечения тканей во всех случаях, где это возможно, так как вторичные операции приходится делать в плотных руб-цовых тканях, что представляет большие трудности. Хотя чаще нервы сшивают эпиневрально, ряд авторов [O'Brien В., 1981] предпочитают полиневральный шов, т.е. сшивание отдельных нервных пучков. В послеоперационном периоде необходимо почасовое наблюдение за окраской и температурой конечности. В течение 10 дней назначают антибиотики. Антикоагулянты при больших реплантациях назначают не всегда. Запрещается курение. Благоприятное влияние оказывает гипербарическая оксигенация. Иммобилизацию конечности сохраняют в течение 6—8 нед, а затем разрешают движения в пальцах, лучезапястном и локтевом суставах.
Результаты реплантации конечности пока разноречивы из-за немногочисленных наблюдений. Так, В. O'Brien (1981) сообщает, что у 13 из 17 оперированных получены хорошие результаты; у 7 из них осуществлена успешная реплантация кисти, причем у 5 достигнуто хорошее сгибание и разгибание пальцев и лучезапястного сустава.
