
7 вопрос
Теплоемкость
тела —
это физическая величина, определяемая
отношением количества теплоты, поглощенной
телом при нагревании, к изменению его
температуры:
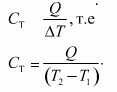
Физический смысл теплоемкости тела: теплоемкость тела равна количеству теплоты, поглощенному телом при нагревании или выделенному при его охлаждении на 1К.
Так
как теплоемкости переменные величины,
то различают среднюю и истинную
теплоемкости.
Под
средней теплоемкостью понимают отношение
количества теплоты q,
подведенной к единице количества
вещества (газа), к изменению его температуры
от t1 до t2при
условии, что разность температур t2 –
t1 является
величиной конечной.
Средние
массовая, объемная и мольная теплоемкости
соответственно обозначаются через cm,
cm’ и ![]() m.
Из
определения средней теплоемкости
следует, что если температура газа
повышается от t1 до t2 то
его средняя теплоемкость [кДж/(кг*К)]
m.
Из
определения средней теплоемкости
следует, что если температура газа
повышается от t1 до t2 то
его средняя теплоемкость [кДж/(кг*К)]
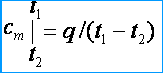
Под истинной теплоемкостью понимают теплоемкость газа, соответствующую бесконечно малому изменению температуры газа, соответствующую бесконечно малому изменению температуры dt, т. е.
c = dq/dt,
откуда dq = cdt.
Удельная
теплоемкость
— это способность разных
веществ к поглощению теплоты при их
нагревании.
Удельная
теплоемкость вещества определяется
отношением количества теплоты, полученной
им при нагревании, к массе вещества и
изменению его температуры, если ![]() :
:
![]()
8 Вопрос
соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера) : Cp = CV + R. ИЛИ БОЛЕЕРАЗВЕРНУТО Теплоёмкость идеального газа Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c. c = Q / (mΔT). Во многих случаях удобно использовать молярную теплоемкость C: C = M · c, где M – молярная масса вещества. Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры. Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const). В процессе при постоянном объеме газ работы не совершает: A = 0. Из первого закона термодинамики для 1 моля газа следует QV = CVΔT = ΔU. Изменение ΔU внутренней энергии газа прямо пропорционально изменению ΔT его температуры. Для процесса при постоянном давлении первый закон термодинамики дает: Qp = ΔU + p(V2 – V1) = CVΔT + pΔV, где ΔV – изменение объема 1 моля идеального газа при изменении его температуры на ΔT. Отсюда следует: Отношение ΔV / ΔT может быть найдено из уравнения состояния идеального газа, записанного для 1 моля: pV = RT, где R – универсальная газовая постоянная. При p = const Таким образом, соотношение, выражающее связь между молярными теплоемкостями Cp и CV, имеет вид (формула Майера) : Cp = CV + R.
Газовая постоянная численно равна работе расширения 1 моля идеального газа под постоянным давлением при нагревании на 1 K. R = pV/T = 1.01•105•22.4•10-3/273[Па•м3/моль]/K =8.31(44) Dж/(моль•K)
Универсальная газовая постоянная — универсальная, фундаментальная физическая константа R, равная произведению постоянной Больцмана k на постоянную Авогадро
![]()
Физический смысл: Газовая постоянная численно равна работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К
В
системе СГС Газовая постоянная равна
:![]()
Удельная
Газовая постоянная равна :![]()
Показатель
адиабаты (иногда
называемый коэффициентом Пуассона) —
отношение теплоёмкости при
постоянном давлении (![]() )
к теплоёмкости при постоянном объёме
(
)
к теплоёмкости при постоянном объёме
(![]() ).
Иногда его ещё
называют фактором изоэнтропийного расширения.
Обозначается греческой буквой
).
Иногда его ещё
называют фактором изоэнтропийного расширения.
Обозначается греческой буквой ![]() (гамма)
или
(гамма)
или ![]() (каппа).
Буквенный символ в основном используется
в химических инженерных дисциплинах.
В теплотехнике используется латинскаябуква
(каппа).
Буквенный символ в основном используется
в химических инженерных дисциплинах.
В теплотехнике используется латинскаябуква ![]() [1].
[1].
