
- •Физические основы
- •Введение
- •1. Термодинамическая система. Основные параметры состояния системы
- •2. Уравнение состояния идеального газа. Идеальная газовая смесь
- •3. Термодинамические процессы
- •4. Внутренняя энергия термодинамической системы
- •5. Энтальпия
- •6. Эквивалентность теплоты и работы. Историческая справка
- •7. Особенности процессов передачи энергии в форме теплоты и работы
- •8. Первый закон термодинамики для замкнутой термодинамической системы
- •9. Первый закон термодинамики в дифференциальном виде. Формула для расчёта механической работы при изменении объёма системы
- •10. Понятие теплоемкости
- •10.1. Общие сведения
- •10.2. Теплоёмкость газов
- •10.3. Теплоёмкость твёрдых и жидких тел
- •Значения температуры Дебая для некоторых веществ
- •11. Открытие энтропии
- •12. Второй закон термодинамики
- •13. Третий закон термодинамики
- •14. Основные соотношения для расчёта процессов в идеальном газе
- •15. Расчёт процессов в идеальном газе
- •15.1. Изохорный процесс
- •15.2. Изобарный процесс
- •15.3. Изотермический процесс
- •15.4. Адиабатный процесс
- •15.5 Политропный процесс
- •Значение показателя политропы n для основных термодинамических процессов в идеальном газе
- •Библиографический список
- •2.1. Уравнение Клапейрона
- •2.2. Понятие моль вещества
- •2.3. Закон Авогадро
- •2.4. Уравнение Клапейрона – Менделеева
- •3.1. Смеси идеальных газов
- •3.2. Парциальные давления в газовой смеси. Закон Дальтона
- •3.3. Приведённый объём компонента газовой смеси. Закон Амага
- •3.4. Химический состав газовой смеси
- •3.5. Газовая постоянная идеальной газовой смеси
- •3.6. Кажущаяся молярная масса идеальной газовой смеси
- •3.7. Удельный объём или плотность газовой смеси
- •3.6. Соотношение между массовыми и объёмными долями идеальной газовой смеси
- •4.1. Обратимые и равновесные процессы
- •5.1. Удельные объёмные и мольные теплоёмкости
- •5.2. Соотношения между удельными теплоёмкостями для газов и газовых смесей
- •5.3. Расчёт значений средних теплоёмкостей
- •5.4. Теплоёмкость смеси идеальных газов
- •6.1. Существование энтропии у реальных (не идеальных) газов
- •6.2. Существование энтропии у систем, находящихся в жидком или твёрдом состояниях
- •Оглавление
- •194021, Санкт-Петербург, Институтский пер., 5.
5. Энтальпия
Для удобства проведения расчётов в термодинамике помимо внутренней энергии вводится ещё одна функция состояния э н т а л ь п и я I (от греческого нагреваю):
I = U + p V, (5.1)
где U – внутренняя энергия системы, Дж; p – абсолютное давление в системе, Па; V – объём, который занимает система, м3.
Разделив обе части (5.1) на массу системы М, кг, получим формулу для удельной энтальпии i:
![]() , (5.2)
, (5.2)
где υ – удельный объем системы (параметр состояния), м3/кг.
Выражение (5.2) можно считать определением удельной энтальпии термодинамической системы.
Из (5.2) очевидно, что i является непрерывной функцией параметров состояния или функцией состояния, так как в правой части оба слагаемые являются непрерывными функциями параметров состояния р и υ. Другими словами, если нам известны значения двух любых параметров состояния, например, р и υ, то этого достаточно, чтобы определить значение i.
Также из (5.2) очевидно, что энтальпия по физическому смыслу является как бы вторичной функцией от внутренней энергии. Значения удельных энтальпий различных веществ определены экспериментально и приводятся в справочных таблицах.
6. Эквивалентность теплоты и работы. Историческая справка
В механике работа всегда измерялась как произведение силы на расстояние. В системе СИ работа измеряется в джоулях:
1 Дж = 1 Н · 1 м.
Энергия материального объекта, по определению, является мерой механической работы, которую этот объект может совершить при определённых условиях. Поэтому размерность энергии и механической работы совпадают. То есть по определению энергия в системе СИ измеряется в джоулях.
Изначально теплота в физике не считалась энергией и никак с ней не сопоставлялась. Считалось, что теплота проявляется при изменении температуры тел. Количественное измерение теплоты стало возможно после изобретении первого термометра (около 1590 года), позволявшего измерять температуру тел в градусах. Изменение температуры тел объясняли «впитыванием» этими телами флюидов теплорода – невесомой жидкости, подобно тому, как вода впитывается губкой.
Исторически теплота измерялась в калориях (от латинского calor – тепло). Одна калория определялась как количество теплорода, которое необходимо передать воде для повышения температуры одного грамма воды на один градус.
Физики всегда отмечали, что между джоулями и калориями существует какая-то связь. Например, когда молот бьёт по наковальне, то кинетическая энергия молота, измеряемая в джоулях, исчезает, но зато увеличивается температура и молота, и наковальни. Такое повышение температуры в те времена объяснялось поступлением к этим объектам т е п л о р о - д а из окружающей среды. Аналогичным образом дело обстояло при совершении механической работы против сил трения.
Постепенно в физике был поставлен вопрос об экспериментальном определении количественных соотношений между калориями и джоулями в различных процессах.
Первые исследователи этого вопроса были несколько удивлены, когда выяснилось, что в отличающихся процессах при «превращении» джоулей в калории пропорция между ними примерно сохраняется.
В 1844 – 1854 гг. английский физик Д.Джоуль провёл опыты, которым было суждено сыграть большую роль в науке. Цель опытов состояла в том, чтобы установить соотношение между работой, затрачиваемой при выделении теплоты, и количеством выделившейся теплоты. Схема опыта Джоуля приведена на рис. 6.1.
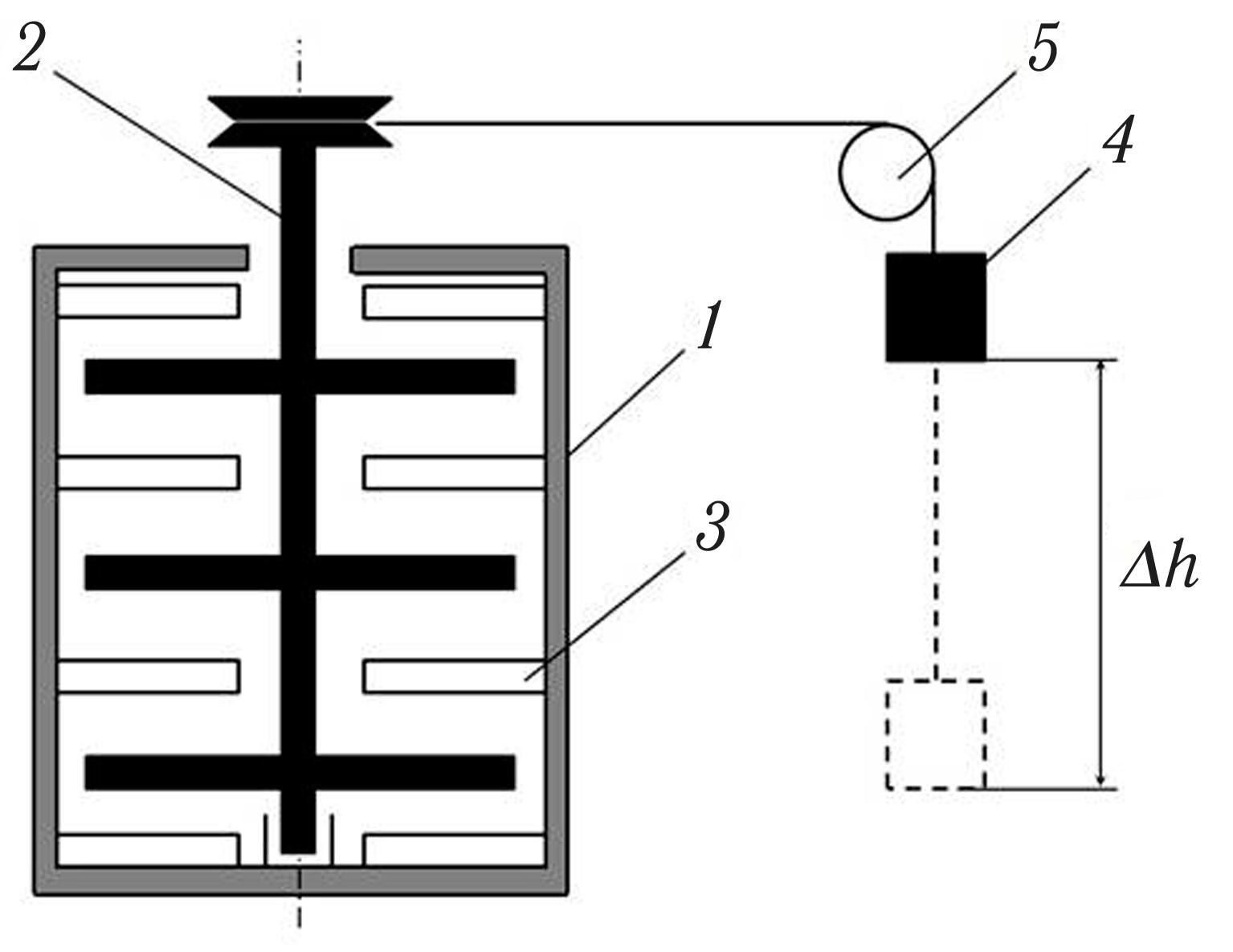
Рис. 6.1.Схема опыта Джоуля:
1 – сосуд; 2 – мешалка; 3 – лопатки; 4 – груз; 5 – блок
В теплоизолированный медный сосуд 1, заполненный водой, погружена мешалка 2, снабжённая лопатками. К стенкам сосуда также прикреплены лопатки 3, затрудняющие движение воды при вращении мешалки. Мешалка приводится во вращение посредством опускания груза 4 массой М, кг, связанного с ней тросом через блок 5. Благодаря механической передаче скорость вращения лопаток мешалки составляет порядка 700 мин –1 [2]. При опускании на высоту Δh работа L, Дж, производимая грузом и, следовательно, мешалкой, равняется убыли потенциальной энергии груза:
L = M · g · Δh, Дж,
где g – ускорение свободного падения, м/с2.
Теплота Q, выделившаяся в сосуде с водой вычисляется в калориях по повышению температуры воды, измеряемой термометром. Масса воды была заранее измерена. Учитывалось поглощение теплоты стенками сосуда, лопатками и мешалкой. Усредняя данные своих экспериментов, Джоуль приходит у выводу: «Для получения количества тепла, которое в состоянии нагреть один фунт воды на один градус Фарингейта, необходимо употребить механическую силу, которая может быть представлена падением 772 фунтов с высоты в один фут». Из этих данных следует, что найденный Джоулем механический эквивалент калории Jдж равен [3]:
![]() ,
Дж/кал. (6.1)
,
Дж/кал. (6.1)
Впоследствии производились многочисленные эксперименты определения этой «универсальной постоянной», как её называл Гельмгольц. Например, опыты Г.Грина, который, исследуя в 1860 – 1861 гг. соударения двух свинцовых тел, нашел значение эквивалента равным 4,166 Дж/кал. А также опыты Роуланда (1880 г.) который методом Джоуля получил значение эквивалента 4,186 Дж/кал, что считается достаточно точным и по настоящее время.
Впоследствии значение эквивалента, полученного Джоулем, было несколько уточнено. В соответствии с результатами наиболее точных современных измерений [4] механический эквивалент теплоты J равен:
![]() Дж/кал. (6.2)
Дж/кал. (6.2)
Другими словами:
1 кал = 4,1868 Дж. (6.3)
Определяемая (6.3) калория называется Международной. Её значение установлено в 1948 году на IX Генеральной конференции по мерам и весам как точное равенство [2].
Теплоёмкость воды несколько зависит от температуры. Международная калория определяется как количество теплоты, расходуемой на нагревание 1 грамма воды при нормальном атмосферном давлении от 14,5 до 15,5 С. Иногда её называют 15-градусная калория.
Если нагрев на один градус производится при исходной температуре воды, соответствующей нормальным условиям (нормальному давлению ро = 760 мм рт. ст. = 101325 Па и нормальной температуре to = 0 С), то такая калория называется термохимической:
1 кал (термохимическая) = 4,14 Дж.
Установленная таким образом однозначная для всех процессов связь между джоулями и калориями впервые позволила аналитически сформулировать закон сохранения энергии, который был назван «Первое начало термодинамики».
