
- •Полоний
- •Ливерморий
- •Свойства атомов элементов VI группы
- •Энергии одинарных и двойных связей
- •Физические свойства гидридов эн2 элементов VI группы
- •Физические свойства
- •Свойства диоксидов эо2
- •Сернистая, селенистая, теллуристая кислоты. Строение, свойства и их солей
- •Серная, селеновая, теллуровая кислоты. Строение, свойства и их солей
- •Влияние на окружающую среду и здоровье человека
- •Влияние на состояние атмосферы
Сернистая, селенистая, теллуристая кислоты. Строение, свойства и их солей
Сила кислот (в свободном состоянии выделена лишь Н2SeO3, свойства Н2SO3 и Н2TeO3, оцениваются по свойствам соответствующих полей) уменьшается в ряду Н2SO3 - Н2SeO3 - Н2TeO3. В отличие от селенитов и теллуритов сернистая кислота и ее соли обладают выраженными восстановительными свойствами. Сульфиты в водных растворах медленно окисляются кислородом воздуха: 2SO32- + О2 SO42- (аналогичная реакция, катализируемая оксидом азота NO, в атмосфере служит источником кислотных дождей).
Сернистая кислота действует как мягкий восстановитель в многочисленных реакциях с солями металлов:
Fe2(SO4)3 + SO2 + 2H2O 2FeSO4 + 2H2SO4
![]()
У селенистой и теллуристой кислот восстановительные свойства выражены слабее, то есть окислить их до производных Se(VI) и Te(VI) значительно труднее.
окислительные свойства H2TeO3 выражены сильнее, чем у сернистой кислоты. Соединения Se(IV) проявляют более сильные окислительные свойства, чем соединения S(IV) и Te(IV). Например, водный раствор SO2 восстанавливает селенистую кислоту: H2SeO3 + 2 SO2 + H2O Se + 2H2SO4 . Аналогично протекает реакция с H2TeO3.
Серная, селеновая, теллуровая кислоты. Строение, свойства и их солей
H2SO4 – бесцветная маслянистая жидкость, летучая, смешивается с водой в любфх отношених.
Оксокислоты халькогенов (VI) H2SO4, H2SeO4 и H6TeO6 синтезируют окислением их диоксидов (или соответствующих им кислот):
![]()
H2SeO3
+ Н2О2
![]() H2SeO4 + Н2О
H2SeO4 + Н2О
5TeO2 + 2KMnO4 + 6HNO3 + 12 Н2О 5H6TeO6 + 2KNO3 + 2Mn(NO3)2 ,
а также окислением простых веществ сильными окислителями:
5Te + 6HClO3 + 12H2O 5H6TeO6 + 3Cl2 ,
или обменными реакциями:
BaTeO4 + H2SO4 + 2H2O H6TeO6 + BaSO4.
В молекуле H2SO4 сера тетраэдрически окружена двумя гидроксильными (ОН) группами и двумя атомами кислорода. Бесцветные, похожие на лед кристаллы H2SO4 имеют слоистую структуру, в которой каждая молекула H2SO4 соединена с четырьмя соседними молекулами прочными водородными связями, образуя единый пространственный каркас. При температуре 10.48оС H2SO4 плавится с образованием тяжелой маслянистой жидкости, кипящей при 280оС. У жидкой H2SO4 структура почти такая же, как у твердой, только целостность пространственного каркаса нарушена, и его можно представить как совокупность микрокристалликов, постоянно меняющих свою форму. H2SO4 смешивается с водой в любых соотношениях, что сопровождается образованием гидратов H2SO4. n H2O. Теплота гидратации настолько велика, что смесь может даже закипеть.
Жидкая H2SO4 удивительно похожа на воду со всеми структурными особенностями и аномалиями. Здесь та же система сильных водородных связей, что и в воде, почти такой же прочный пространственный каркас, такие же аномально высокие вязкость, поверхностное натяжение, температуры плавления и кипения.
Серная и селеновая кислоты являются сильными двухосновными кислотами и близки по структуре и свойствам между собой.
Строение ортотеллуровой кислоты H6TeO6 отличается от строения серной и селеновой кислот. Кристаллическая структура твердой H6TeO6 построена из молекул правильной октаэдрической формы, которые сохраняют свою форму и в растворах. Селеновая кислота более сильный окислитель, чем Н2SO4 и Н6ТеО6. Она растворяет без нагревания Cu и даже Au:
2Au + 6H2SеO4 Au2(SeO4)3 + 3 H2SeO3 + 2H2O,
окисляет ионы галогенидов, кроме фторида, до свободных галогенов, под ее действием воспламеняется клетчатка. Ортотеллуровая кислота также более сильный окислитель, чем серная кислота. Наиболее частым продуктом восстановления H2SeO4 и H6TeO6 являются простые вещества.
Серная кислота обладает сильными окислительными свойствами только в концентрированном виде и при нагревании:
Cu
+ 2 H2SO4
![]() CuSO4 + SO2 + 2H2O .
CuSO4 + SO2 + 2H2O .
Продуктами
ее восстановления в зависимости от
условий проведения реакций могут быть
SO2 (при избытке H2SO4), H2S, S,
![]() , политионаты (при недостатке H2SO4).
, политионаты (при недостатке H2SO4).
H2SеO4, например, выделяет хлор из концентрированной HCl:
H2SеO4 + 2HCl = =Cl2 + H2SeO3 + H2O.
Химические свойства разбавленной серной кислоты. Разбавленная серная кислота — сильный электролит, она проявляет общие свойства кислот: меняет цвет индикаторов и образует соли в реакциях с металлами, основными и амфотерными оксидами, гидроксидами металлов, другими солями. Рассмотрим конкретные примеры.
1. Индикаторы лакмус и метилоранж окрашивают раствор серной кислоты в красный цвет. В разбавленных растворах серная кислота диссоциирует согласно схеме:
![]()
2. Образование солей:
а) металлы, расположенные в ряду активности до водорода, вытесняют его из разбавленных растворов серной кислоты:
Zn + Н2SO4 = ZnSO4 + H2↑; Fe + Н2SO4 = FeSO4 + H2↑;
б) реакции серной кислоты с основными и амфотерными оксидами, как правило, требуют небольшого нагревания для увеличения скорости:
СuO + Н2SO4 = CuSO4 + H2O; Al2O3 + 3Н2SO4 = Al2(SO4)3 + 3H2O;
в) в реакциях со щелочами и нерастворимыми основаниями образуются соли и вода (нейтрализация):
2NaOH + Н2SO4 = Na2SO4 + 2H2O или NaOH + Н2SO4 = NaНSO4 + H2O; Сa(OH)2 + Н2SO4 = СаSO4↓ + 2H2O.
Отметим, что при мольном соотношении щёлочи NaOH и кислоты Н2SO4 2 : 1 или избытке NaOH образуется средняя соль (сульфат), а при их соотношении 1 : 1 — кислая соль (гидросульфат). Следовательно, избыток многоосновной (двухосновной) кислоты Н2SO4 приводит к образованию кислых солей;
г) реакции растворов серной кислоты с солями протекают в полном соответствии с условиями реакций ионного обмена:
H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑; H2SO4 + Na2SiO3 = Na2SO4 + H2SiO3↓.
Концентрированная серная кислота — более сильный окислитель, чем разбавленная. Её окислительные свойства проявляются прежде всего в реакциях с металлами. Отметим несколько важных моментов.
Во-первых, происходит восстановление не водорода, а атомов серы. Продуктами восстановления являются SO2, S и Н2S. Состав преимущественно образующихся продуктов зависит как от концентрации кислоты, так и от активности металла как восстановителя. Чем меньше концентрация кислоты и выше активность металла, тем сильнее восстанавливаются атомы серы.
Так, в реакции с металлами, находящимися в ряду активности после водорода (кроме золота и платины), образуется оксид серы(IV) SO2, например:
![]()
В реакциях с металлами, расположенными в ряду активности до водорода, могут образовываться и SO2, и S, и Н2S. Например, cхемы реакций, протекающих при взаимодействии цинка с серной кислотой по мере увеличения её концентрации, выглядят так:
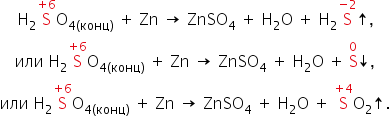
Во-вторых, некоторые сравнительно активные металлы (например, железо, алюминий, хром) концентрированной серной кислотой при комнатной температуре пассивируются: на поверхности металла образуется плотная оксидная плёнка. Благодаря пассивации железа возможна перевозка кислоты в стальных цистернах.
Среди других особенностей концентрированной серной кислоты можно отметить следующие. Она способна вытеснять менее сильные или более летучие кислоты (НСl, HNO3, H3PO4, CH3COOH) из их солей:
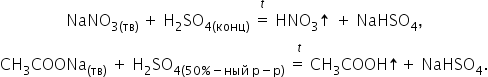
Концентрированная кислота окисляет сложные органические вещества: обугливает бумагу, древесину, кожу, поэтому необходимо крайне осторожное обращение.
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида) с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют «контактной» (концентрация 92-94 %).
2SO2 + O2 = 2SO3
H2O + SO3 = H2SO4
О́леум – это масляный раствор серного ангидрида SO3 в 100%-й серной кислоте H2SO4.
Олеум представляет собой вязкую маслянистую бесцветную жидкость или легкоплавкие кристаллы, которые, однако, могут приобретать самые различные оттенки вследствие наличия примесей. Входит в состав серной кислоты, сера – основной компонент кислоты. Олеум – крайне едкое вещество: оставляет сильные ожоги на коже, быстро разъедает многие материалы, за исключением наименее реакционноспособных. Тем не менее, вследствие эффекта пассивации может храниться в стальных ёмкостях. Олеум нельзя разбавлять водой или выливать его в воду из-за сильно экзотермической реакции. Разбавление олеума производится прибавлением его к серной кислоте. При приливании в воду жидкость закипает, образуя туман из серной кислоты. Применяется в промышленности при производстве серной кислоты, капролактама и многих других веществ. В органической химии применяется как сульфирующий, водоотнимающий или окисляющий реагент.
Сульфаты – кристаллические вещества, бесцветные (если катион бесцветен), в большинстве случаев хорошо растворимые в воде. Малорастворимые сульфаты встречаются в виде минералов: гипса CaSO4×2H2O, целестина SrSO4, англезита PbSO4 и др. (см. Сульфаты природные). Практически нерастворимы барит BaSO4 и RaSO4. Кислые сульфаты выделены в твёрдом состоянии лишь для наиболее активных металлов – Na, К и др. Они хорошо растворимы в воде, легко плавятся. Нормальные сульфаты можно получить растворением металлов в H2SO4, действием H2SO4 на окиси, гидроокиси, карбонаты металлов и др. Гидросульфаты получают нагреванием нормальных сульфатов с концентрированной H2SO4:
K2SO4 + H2SO4 = 2KHSO4.
Кристаллогидраты сульфатов некоторых тяжёлых металлов называются купоросами.
Широкое применение во многих отраслях промышленности находят сульфаты природные.
Гидросульфаты, бисульфаты, кислые соли серной кислоты H2SO4, например NaHSO4. Известны только гидросульфаты щелочных металлов. Их получают умеренным нагреванием сульфатов с серной кислотой: K2SO4+H2SO4=2KHSO4. Гидросульфаты калия и натрия при плавлении теряют воду, превращаясь в пиросульфаты, например: 2KHSO4=K2S2O7+H2O; последние при дальнейшем нагревании разлагаются: K2S2O7=K2SO4+SO3. Этим пользуются для перевода в растворимые нерастворимых в кислотах сильно прокалённых окисей алюминия, хрома и железа, которые при сплавлении с гидросульфатами (или пиросульфатами) превращаются в сульфаты, например: Al2O3+3K2S2O7=Al2(SO4)3+3K2SO4.
Квасцы́ – двойные соли, кристаллогидраты сульфатов трёх- и одновалентных металлов
Квасцы могут быть получены смешением горячих эквимолярных водных растворов сульфатов соответствующих металлов. При охлаждении таких растворов из них кристаллизуются квасцы.
Квасцы хорошо растворимы в горячей воде. Растворимость снижается с увеличением атомного номера одновалентного катиона (то есть от натрия до цезия). Обладают вяжущим вкусом.
Купоро́с, реже – витрио́л – общее название кристаллогидратов сульфатов некоторых двухвалентных металлов.
В промышленности, сельском хозяйстве, медицине широко применяются следующие купоросы:
• ванадиевый купорос (VSO4·7H2O);
• железный купорос (FeSO4·7H2O);
• кобальтовый купорос (CoSO4·7H2O);
• медный купорос (CuSO4·5H2O);
• никелевый купорос (NiSO4·7H2O);
• свинцовый купорос (PbSO4);
• хромовый купорос (CrSO4·7H2O);
• цинковый купорос (ZnSO4·7H2O);
• марганцевый купорос (MnSO4·5H2O)
Полисерные кислоты, полисульфаты.
При растворении SOg В безводной серной кислоте образуется олеум, представляющий собой жидкую, маслообразную смесь полисерных кислот, аналогичных по строению полифосфорным кислотам. Соли полисерных кислот — полисульфаты. Молекулы полисерных кислот и анионы их солей представляют собой цепи, построенные из тетраэдров SO4, каждый из которых имеет по одному общему атому кислорода с соседним тетраэдром. Простейшая из полисерных кислот — пиросерная кислота HgSgOy — образуется в результате реакции.
Химические свойства. Полисерные кислоты и пероксокислоты легко взаимодействуют с водой с образованием серной кислоты.
Перексосерные кислоты - неорганическое соединение, двухосновная кислота с формулой H2S2O8, белое, очень гигроскопичное вещество, устойчиво в концентрированном водном растворе, разлагается в разбавленном.
Кислородные кислоты серы, характеризующиеся наличием пероксогруппы —О—О—. Известны три П. к.: пероксо-моносерная H2SO5, пероксодисерная H2S2O8 и пероксотрисерная H2S3O11. Наиболее изучены H2SO5 (называется также кислота Каро) и H2S2O8 (называется также надсерная кислота) и их соли — пероксосульфаты. В свободном виде H2SO5 и H2S2O8 — бесцветные кристаллы, плавящиеся соответственно при 45 °С и 65 °С. Их водные растворы получают электролизом растворов серной кислоты. H2SO5 — сильный окислитель, применяемый в органическом синтезе. H2S2O8 и её соли — также окислители; служат исходными продуктами при получении H2O2.
Физические свойства
Пероксодисерная кислота — белое, очень гигроскопичное вещество, устойчиво в концентрированном водном растворе, разлагается в разбавленном.
Растворимо в этаноле, диэтиловом эфире, серной кислоте
Политио́новые кисло́ты — соединения серы с общей формулой H2SnO6, где n >2 или n=2. Их соли называются политионатами H2S3O6 — тритионовая кислота
H2S4O6 — тетратионовая кислота
H2S5O6 — пентатионовая кислота
Политионовые кислоты очень неустойчивы, известны только в растворах и обладают сильными восстановительными свойствами. Соли их довольно устойчивы.
Политионовые кислоты не выделены в свободном состоянии, но представляют собой довольно сильные кислоты. Значительно более стабильны политионаты, особенно щелочных металлов.
Политионовые кислоты мало устойчивы, существуют только в растворах в сильно диссоциированном виде, но образуют хорошо кристаллизующиеся
соли, легко растворимые в воде.
Политионовые кислоты не выделены в свободном состоянии, но представляют собой довольно сильные кислоты. Значительно более стабильны политионаты, особенно щелочных металлов.
Политионовыми кислотами называют кислоты, образованные остатками серной кислоты ( сульфогруппами SO3H), связанными непосредственно или при помощи цепочки из атомов серы.
Известны политионовые кислоты Н25 Об, или НОзЗ - - ( 5 - 2) - SO3H, содержащие цепочку из четырех - шести атомов серы. Эти кислоты малоустойчивы и являются сильными восстановителями, их соли - политионаты, например K2S4Og - тетратионат калия, довольно устойчивы.
Смесь политионовых кислот, получаемая при пропускании сероводорода в водный раствор сернистой кислоты, называется жидкостью Вакенродера.
В политионовых кислотах и политионатах х может быть до 10, известны политионаты с 20 - 40 атомами серы.
В политионовых кислотах и политионатах х может принимать значения 3, 4, 5, 6, а возможно, еще более высокие.
В политионовых кислотах и политионатах х может принимать значения 3, 4, 5, 6, а возможно, еще более высокие.
Многочисленные соли политионовых кислот выделяются из водных растворов в виде бесцветных кристаллов, содержащих различное число молекул воды.
Существует группа политионовых кислот, отвечающих общей форму. Политионовые кислоты неустойчивы и известны лишь в водных растворах. Соли их - полнтионаты - более устойчивы, некоторые из них получены в виде кристаллов.
В водных растворах политионовые кислоты сильно диссоциированы, но сами по себе они малоустойчивы и гидролитически разлагаются с образованием H2SO4, H2SO3 и S. Несколько отличается от всех политионовых кислот дитионовая кислота.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
