
- •Содержание курса лекций «Теоретические и экспериментальные методы исследования в химии. (Электрохимические
- •План лекции.
- •В соответствии с рекомендациями ИЮПАК все электрохимические методы анализа подразделяются на две большие
- •В электрохимических методах анализа -
- •ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
- •Уравнением полярографической волны:
- •КОЛИЧЕСТВЕННЫЙ ПОЛЯРОГРАФИЧЕСКИЙ АНАЛИЗ
- •МЕТОДЫ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ
- •2. В методе стандартных растворов в строго одинаковых условиях снимают полярограммы стандартного и
- •4. Дифференциальная полярография
- •АНАЛИЗ СМЕСИ ВЕЩЕСТВ
- •Условия проведения полярографического анализа:
- •Рис. Максимум I рода на фоне 0,05 М раствора KCI (1), исчезает после
- •АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- •1.Титрование с фиксацией диффузионного тока для определяемого вещества
- •2. Титрование с фиксацией диффузионного тока для титранта
- •3. Титрование с фиксацией диффузионного тока для определяемого вещества и титранта .
- •4. Титрование с фиксацией диффузионного тока, обусловленного продуктом реакции титрования.
- •В методах амперометрического титрования используют различные реакции:
- •Общая характеристика метода:
- •МЕТОД ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ
- •Рис. Схема электрохимической ячейки для инверсионной вольтамперометрии.
- •ПРОЦЕССЫ:
- •Таблица. Значения потенциалов анодных пиков некоторых ионов металлов на фоне 0,1 М НСl
- •ОСНОВА КОЛИЧЕСТВЕННОГО АНАЛИЗА
- •ВОЛЬТАМПЕРОМЕТРИЯ С ЛИНЕЙНОЙ РАЗВЕРТКОЙ ПОТЕНЦИАЛА НА СТАЦИОНАРНЫХ ЭЛЕКТРОДАХ (ЦИКЛИЧЕСКАЯ ВОЛЬТАМПЕРОМЕТРИЯ)
- •Рис. Вольтамперограмма при линейной развертки потенциала на электроде с постоянной площадью поверхности.
- •МЕТОД ЦИКЛИЧЕСКОЙ ВОЛЬТАМПЕРОМЕТРИИ (ЦВАМ) Метод циклической вольтамперометрии отличается тем, что в нем осуществляется
- •Форма I-E –кривых зависит от:
- •МЕТОД ВРАЩАЮЩЕГОСЯ ДИСКОВОГО ЭЛЕКТРОДА
- •Вращающийся дисковый электрод равнодоступен в диффузионном отношении (т. е. скорость диффузии одинакова в
- •Достоинства метода ВДЭ
- •Академик А.Н.ФРУМКИН и проф. Л.Н. НЕКРАСОВ предложили новый вариант вращающегося электрода – Вращающийся
- •Отличие метода ВДЭсК. Продукты реакции, образующиеся на диске, вместе с потоком жидкости проходят
- •ПОТЕНЦИОМЕТРИЯ
- •Для идеального индикаторного электрода:
- •Электродвижущую силу - Е электрохимической цепи, приведенной выше, определяют по уравнению:
- •Электроды для потенциометрического анализа
- •ВИДЫ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА
- •1. Метод градуировочного графика. .
- •3. Метод концентрационного элемента.
- •Добавляя концентрированный раствор в стандартный, либо разводя его, получаем зависимость:
- •4. Метод потенциометрического титрования
- •Достоинства метода:
- •ЭЛЕКТРОЛИЗ И КУЛОНОМЕТРИЧЕСКИЙ АНАЛИЗ
- •1.Прямая кулонометрия - анализируемое вещество непосредственно подвергается электрохимическим превращениям.
- •Общая характеристика метода:
- •КОНДУКТОМЕТРИЯ
- •Электропроводность растворов зависит:
- •æ - Удельная электрическая проводимость равна электрической проводимости раствора, находящегося между параллельными электродами
- •Рис. Зависимость электропроводности от концентрации.
- •λ - Эквивалентная электрическая проводимость – проводимость
- •• Для сильных электролитов, в области разбавленных растворов, наблюдается линейная зависимость эквивалентной электрической
- •ЗАКОН АДДИТИВНОСТИ - закон независимости движения ионов ( Ф. Кольрауш)
- •МЕТОД КОНДУКТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ.
- •Практически могут быть использованы такие химические реакции, в ходе которых достаточно заметно изменяется
- •Метод высокочастотного титрования.
- •.Практическое применение кондуктометрии
- •Общая характеристика метода.
Общая характеристика метода:
1.Применим для анализа всех элементов периодической системы, если они окисляются или восстанавливаются.
2.Погрешность 2-5 %,
3.Предел обнаружения 10-8 – 10-9М
4.Быстрота анализа.
Недостатки: Hg, калибровка.
МЕТОД ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ
Сущность метода инверсионной вольтамперометрии заключается в выделении электролизом определяемого элемента из очень разбавленного раствора на стационарном индикаторном электроде (чаще всего на ртутной капле или тонкой пленке ртути) с последующим анодным растворением полученной амальгамы и регистрацией вольтамперной кривой. Процесс электролиза ( накопления ) проводят при постоянном потенциале (Еэ), соответствующем предельному току, в перемешиваемом растворе фонового электролита. Анодное окисление полученной амальгамы (переход анализируемых металлов в раствор) осуществляют при линейно - меняющемся потенциале.
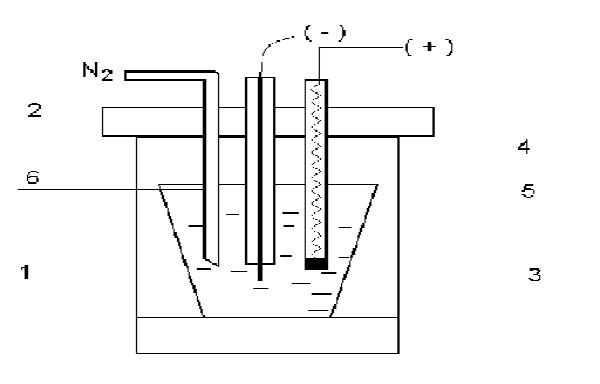
Рис. Схема электрохимической ячейки для инверсионной вольтамперометрии.
1 - корпус ячейки; 2 - съемная крышка с отверстиями; 3 - вставной кварцевый стаканчик с фоновым электролитом, содержащим пробу с определяемыми элементами; 4 - индикаторный электрод; 5 - электрод сравнения; 6 - трубка для ввода в фоновый электролит инертного газа.
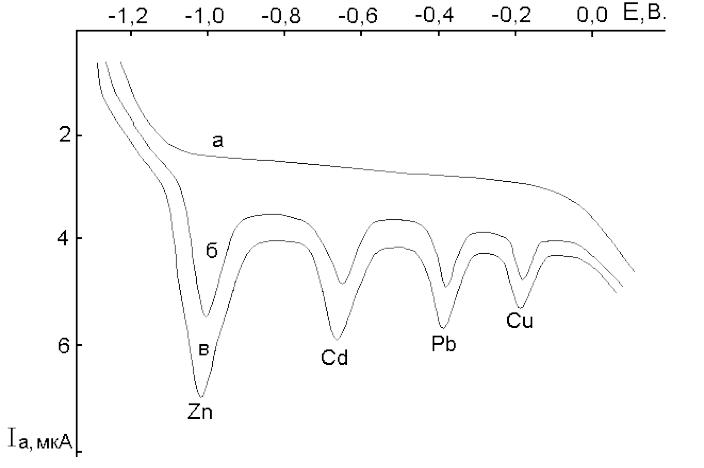
Рис. Вольтамперограммы раствора, содержащего Zn2+; Cd2+; Pb2+; Cu2+ на фоне 0,1 М КСl. Еэ = -1,2 В ( отн. нас. калом. электрода ); время
электролиза : 3 мин; а.) Вольтамперограмма фонового раствора 0,1 М КСl; б.) Вольтамперограмма раствора, содержащего элементы неизвестной концентрации; в.) Вольтамперограмма раствора (б) после добавки стандартных растворов Cu2+, Pb2+, Cd2+, Zn2+ известной концентрации.
ПРОЦЕССЫ:
При электролизе происходит выделение ионов металла на ртути с образованием амальгамы металла по реакции:
Меn+ + n e + Hg = Me (Hg).
При использовании твердых электродов в стадии концентрирования происходит выделение определяемого элемента в виде металла:
Men+ + n e = Me0
или образование концентрата ( осадков оксидов, гидроксидов металла, химических и интерметаллических соединений с компонентами раствора или материала электрода ). Например:
2 VO3- + 3 H2O + 4 e = V2O3 ( тв. ) + 6 ОН-.
3Сu2+ + 2 As3+ + 12 e = Cu3As2.
Ванодном процессе происходит окисление амальгамы металла, выделенного
металла или полученного концентрата:
Me ( Hg ) - n e =Men+ + Hg;
Meo - n e = Men+.

Таблица. Значения потенциалов анодных пиков некоторых ионов металлов на фоне 0,1 М НСl (качественный анализ)

ОСНОВА КОЛИЧЕСТВЕННОГО АНАЛИЗА
I |
|
K |
|
S |
|
|
O |
|
|
e |
B |
|||
|
|
|
|
V |
C |
|
1 |
|
|
|||||
|
|
|
|
|
KЭ |
|
|
|
|
|
|
|
|
|
|
|
B |
|
|
|
S V |
|
|
|
|
|
|||
|
|
nF |
|
|
|
|
|
|
||||||
где I - величина анодного тока, А;
Со - концентрация ионов определяемого элемента, М;
S - поверхность ртутного электрода, см2;
, V, - объемы раствора и ртутной капли, соответственно, см3; КЭ, Kа - коэффициенты электролиза и анодного пика;
- время электролиза, с;
n - число электронов, принимающих участие в электродном процессе;
F - число Фарадея : F = 96500 Кл / моль-экв.
ВОЛЬТАМПЕРОМЕТРИЯ С ЛИНЕЙНОЙ РАЗВЕРТКОЙ ПОТЕНЦИАЛА НА СТАЦИОНАРНЫХ ЭЛЕКТРОДАХ (ЦИКЛИЧЕСКАЯ ВОЛЬТАМПЕРОМЕТРИЯ)
Возрастающая популярность этого метода объясняется тем, что окисление многих органических соединений нельзя изучать на ртутном электроде из-за ограниченного диапазона анодных потенциалов. Поэтому, в данном случае применяются твердые микроэлектроды из благородных металлов (платина, золото), а также угольные (графитивые) электроды. Первые используются для неводных сред, последние – для водных растворов. На индикаторный электрод с постоянной площадью поверхности подают линейную развертку потенциала :
Еt = Еi Vt,
где Еt - начальный потенциал, V –скорость развертки потенциала (от 0,001 до 0,1 В/с, t – время электролиза.
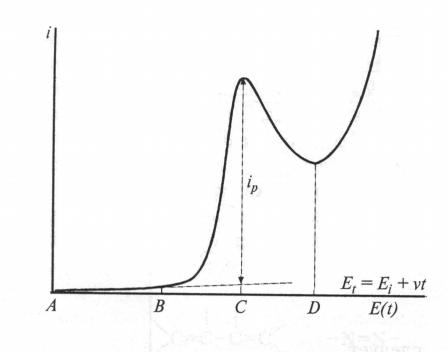
Рис. Вольтамперограмма при линейной развертки потенциала на электроде с постоянной площадью поверхности.
Три участка: 1-при потенциалах до начала восстановления определяемого вещества - протекает только остаточный ток (участок А-В), 2- область восстановления анализируемого вещества (фарадеевский
ток) – участок В-С. Реакция переноса заряда протекает быстро и ток экспоненциально растет с повышением потенциала электрода.
3- область снижения тока с ростом потенциала за счет увеличения толщины обедненного слоя (участок С-Д).
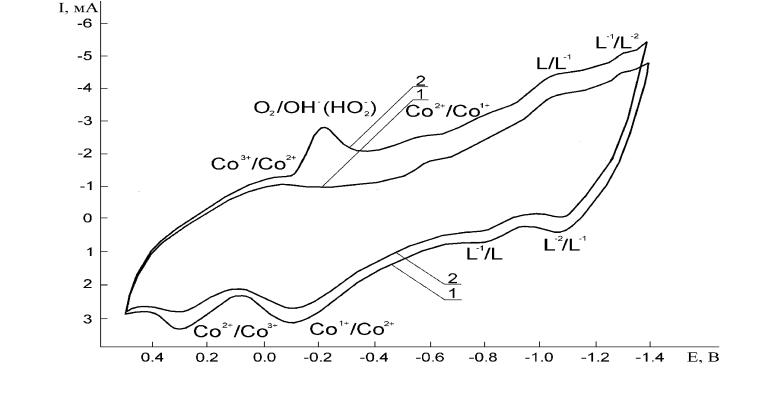
МЕТОД ЦИКЛИЧЕСКОЙ ВОЛЬТАМПЕРОМЕТРИИ (ЦВАМ) Метод циклической вольтамперометрии отличается тем, что в нем осуществляется фиксация катодных и анодных токов при линейно- изменяющемся потенциале со сменой его полярности при достижении определенного значения потенциала.
I-E-кривые для электрода с ТФП Со. V=20 мВ/с. Диапазон от 0.5 до -1.4 В.
1-полное насыщение электролита аргоном
2- полное насыщение электролита дикислородом
