
- •14.Суточные и сезонные изменения фотосинтеза. Фотосинтез, рост и продуктивность растений
- •15.Экология фотосинтеза: влияние основных факторов среды на интенсивность и направленность фотосинтеза
- •1. Дыхание и его роль в жизнедеятельности растений. История развития учения о дыхании: начальный этап, работы Баха, Палладина, Виллана, Варбурга, Кейлина.
- •2. Взаимосвязь брожения и дыхания. Работы с.П. Костычева.
- •3. Количественные показатели дыхания: интенсивность дыхания, дыхательный коэффициент и его зависимость от природы окисляемого субстрата.
- •4. Основные этапы дыхания и их субклеточная локализация.
- •5. Анаэробная фаза дыхания (гликолиз): этапы и энергетический выход.
- •6. Аэробная фаза дыхания. Цикл Кребса, энергетический выход.
- •7. Этц дыхания растений, ее особенности. Окислительноефосфорилирование: механизмы и энергетическая эффективность.
- •8. Пфп дыхания, его значение.
- •9. Экология дыхания (влияние внешних и внутренних факторов); изменение интенсивности дыхания в онтогенезе растений. Влияние внешних и внутренних факторов на интенсивность фотосинтеза
ВВЕДЕНИЕ
Предмет, цели и задачи физиологии растений. Краткая история развития физиологии растений в мире, России, Казанском университете.
Физиология растений — наука, которая изучает процессы жизнедеятельности и функции растительного организма. Перед научными работниками, физиологами растений поставлены такие задачи: изучить обмен веществ и энергии в растительном организме, фотосинтез, хемосинтез, биологическую фиксацию азота из атмосферы и корневое питание растений; разработать методы повышения использования растениями солнечной энергии и питательных веществ почвы, обогащения почвы азотом; создать новые, более эффективные формы удобрений и разработать методы их применения; исследовать действие биологически активных веществ с целью использования их в растениеводстве; разработать методы более продуктивного использования воды растением.
Круг вопросов, составляющих предмет Ф. р., во многом определяется специфическими особенностямиеё объекта зелёного растения. Зелёные растения отличаются от всех др. форм живых существспособностью использовать в качестве источника энергии солнечный свет и преобразовывать его энергию вхимическую (свободную) энергию органических соединений. Изучение координации их функционирования во времени и пространстве составляет важную цель этой науки.
Первые попыткиэкспериментально решить вопрос о том, за счёт чего строят свои ткани растения, сделал голландскийестествоиспытатель Ян ван Гельмонт (1629). Выращивая в течение 5 лет ивовую ветвь в горшке совзвешенной почвой, он установил, что за время опыта вес ветви увеличился в 30 раз, тогда как вес почвыпочти не изменился. Гельмонт пришёл к заключению, что основной источник питания растения не почва, авода. Несмотря на ошибочность такого вывода.Работы голл.естествоиспытателя Я. Ингенхауза (1779) и особенно швейц. учёных Ж. Сенебье и Н. Т. Соссюра (конца 18 начала 19 вв.), а позднее нем. учёного Ю. Р. Майера, французского агрохимика Ж. Б. Буссенго (1868) и др.позволили расшифровать отдельные стороны фотосинтеза как процесса усвоения углекислого газа и воды,происходящего с выделением кислорода при обязательном участии света. Нем. учёный А. Тэерсформулировал гумусовую теорию, в которой решающую роль в питании растений отводилорганическому веществу почвы. В 40х гг. 19 в. на смену гумусовой теории питания растений пришламинеральная теория нем. химика Ю. Либиха, в которой подчёркивалась роль минеральных элементов почвыв корневом питании растений. Работы Либиха содействовали развитию физиологических исследований ивнедрению минеральных удобрений в с.-х. практику. Тимирязев обосновал и развил представления о космической роли зелёных растений, которые, осуществляя уникальную функцию фотосинтеза, связывают жизнь на Земле с энергией Солнца. Впервые термин «обмен веществ» применительно к растениям ввёлрус. ботаник А. С. Фаминцын (1883). Русский биохимик А. Н. Бах в 1896–97 создалперекисную теорию биологического окисления, являющуюся фундаментом современной теории радикалов.Перекисная теория послужила толчком к интенсивному изучению химизма и энзимологии дыхания. Детальным изучением процессов обмена азотистых веществ в растении, результаты которого привели ккоренным изменениям в практике применения азотсодержащих удобрений, наука обязана сов. агрохимику Д.Н. Прянишникову. Большое значение имели работы Прянишникова и его школы в области фосфорного икалийного питания растений, известкования почв и во многих др. областях физиологии минерального питания.
Зарождение физиологии растений в Императорском Казанском университете относится к 70-м годам 19 столетия и связано с именем профессора Н.Ф. Леваковского. Н.Ф. Леваковский, исследуя взаимоотношения растений в природе, влияние внешних условий (влажности почвы, света, температуры) на морфологию, рост и развитие растений, положил начало экспериментальной морфологии и экологической физиологии растений. Вместе с Н.Ф. Леваковским работали Е.Ф.Вотчал, который изучал механизмы передвижения воды по сосудистой системе растений, и В.А. Ротерт, впервые доказавший наличие у растений чувствительности и способности к ростовым движениям (фото- и геотропизм).Открытие кафедры фр и микробиологии состоялось в 1932 Алексеем Михайловичем Алексеевым., который является основателем широко известной Казанской школы водного режима растений (школа А.М. Алексеева). В 2011 году кафедра переименована в кафедру физиологии и
биохимии растений.
Методы и методология фр: аналитический и синтетический подход, причинный анализ. Общая и частная фр.
Основной метод познания процессов, явлений в физиологии — эксперимент, опыт. Следовательно, физиология растений — наука экспериментальная.
Для изучений физико-химической сути функций, процессов в физиологии растений широко применяют методы: лабораторно-аналитический, вегетационный, полевой, меченых атомов, электронной микроскопии, электрофореза, хроматографического анализа, ультрафиолетовой и люминесцентной микроскопии, спектрофотометрии и др. Кроме того, используют фитотроны и лаборатории искусственного климата, в которых выращивают растения и проводят опыты в условиях определенного состава воздуха, нужной температуры и освещения. Применяя эти методы, физиологи исследуют растения на молекулярном, субклеточном, клеточном и организменном (интактное растение) уровнях.
Сейчас в биологических исследованиях широко применяют электронные микроскопы просвечивающего типа с разрешающей способностью 0,15—0,5 нм, в которых объект рассматривают в электронных лучах, проходящих через него. Значительное увеличение разрешающей способности электронных микроскопов по сравнению со световыми обусловливается меньшей длиной волны электронов (на пять порядков меньшей, чем длина волны ультрафиолетовых лучей).
Кроме того, для биологических исследований применяют так называемые растровые электронные микроскопы, в которых изображение создается по принципу телевизионных. Разрешающая способность растровых микроскопов равна 20—40 нм, с их помощью изучают строение поверхности пыльцы, эпидермального слоя клеток, формы клеток и др. Применение электронной микроскопии в биологии имеет большое значение для развития биологической науки и физиологии растений в частности.
Исследование ультраструктуры органоидов растительной клетки (хлоропластов, митохондрий, рибосом, мембранных структур) дало возможность раскрыть суть процессов фотосинтеза и дыхания, которые определяют возможность самой жизни на нашей планете. Изучение строения клеточных оболочек, открытие цитоплазматических мембранных структур способствовали выяснению процессов обмена веществ и энергии в клетке, изучению структуры и функции органоидов растительной клетки. Большое принципиальное значение имеет электронно-микроскопическое исследование строения РНК и ДНК, локализации их на структурных компонентах клетки. Результаты этих исследований легли в основу раскрытия генетической роли ядра и проблемы наследственности.
Общая фр изучает физиологические функции (фотосинтез, дыхание растений, транспирацию, рост, развитие и др), устанавливая закономерности общие для всех видов растении.
Частная фр изучает конкретные физиологические особенности отдельных видов сортов растений.
Практическое значение физиологии растений как теоретической основы растениеводства. Связь фр с агрономическими науками и селекцией.
Физиология растений является теоретической основой интенсификации растениеводства, диагностики и лечения болезней растений, получения трансгенных растений с хозяйственно-ценными признаками, микроклонального размножения растений, биотехнологии получения важных продуктов на основе изолированных растительных клеток и тканей, а также решения ряда задач по охране окружающей среды, подверженной вредным воздействиям антропогенных загрязнений. Фр является основой для рационального земледелия. Фр настолько тесно связана с агрохимией, что между ними нельзя провести реальную границу. Учение о почвенном питании растений неразрывно связано с учением б удобрениях, а поэтому агрохимика часто переходит к решению проблем физиологии питания растений, а физиологи принимают участие в разработке применения удобрений. Большое значение физиология имеет для полеводства, так как большая часть агротехнических приемов представляет собой создание для растений благоприятных условий существования, при которых они дали бы наибольший урожай.
Тесная связь существует между фр и селекцией. Отбор и создание новых сортов ставят своей задачей повышение урожая и качества продуктов, а для целенаправленного отбора необходимо знать физиологические признаки сортов: их скороспелость, зимоустойчивость, засухоустойчивость и т.д. Эти сведения можно получить только при постоянном физиологическом изучении сортов.
Природные и синтетические регуляторы роста растений, применение в с/х
Природные регуляторы роста образуются в самих растениях в небольших количествах. К этойгруппе веществ относятся гиббереллины, ауксины, цитокинины, брассинолиды, стимулирующие рост и деление клеток, а также абсцизовая кислота и этилен – ингибиторы этих процессов. Ауксины активируют рост стеблей, листьев и корней, обеспечивая реакции типа тропизмов, а также стимулируют образование корней у черенков растений. Благодаря обнаружению в растениях ауксинов удалось установить внутренние причины ряда остовых процессов. Однако механизмы регуляции многих форм роста, в частности роста стебля, цветения розеточных растений, нарушения покоя и зеленения листьев выявлены только после открытия гиббереллинов и цитокининов. Гиббереллины индуцируют или активируют рост стеблей растений, вызывают прорастание некоторых семян и образование артенокарпических плодов, а также нарушают период покоя ряда растений. Цитокинины стимулируют клеточное деление (цитокенез), заложение и рост стеблевых почек.Природные ингибиторы роста кумарин и его производные, абсцизовая кислота и др. тормозят рост растений при переходе их в состояние покоя.
Синтетические регуляторы роста стали появляться после синтеза голландским физиологом растений Ф.Кеглем (1931-35) ауксина. Синтетические ингибиторы, в отличии от природных, способны более резко подавлять ростовые процессы; они длительный период не поддаются инактивации растительными тканями; характер их действия часто связан не только с ростом, но и с нарушением морфогенетических процессов. Наиболее перспективными оказались регуляторы роста типа индолилмасляной, нафтилуксусной и 2,4-дихлорфенилуксусной комитеты (2,4-Д). В 1955 был синтезирован кинетин (цитокинин). К группам синтетических регуляторов относятся также ингибиторы: ретарданты — препараты, уменьшающие длину и увеличивающие толщину стеблей, и морфактины — соединения, вызывающие аномалии в точке роста и появление уродливых органов у растений. К ним примыкают вещества, специфически задерживающие передвижение ИУК и её производных по растению.
Применение регуляторов роста растений в практике позволяет получить сдвиги в обмене веществ, идентичные тем, которые возникают под влиянием определённых внешних условий (длины дня, температуры и др.), например ускорить образование генеративных органов, усилить или затормозить рост и т. п. Для усиления роста и органогенеза культурных растений применяются стимуляторы типа ауксинов и гиббереллинов, а для торможения — синтетические ингибиторы роста, в том числе дефолианты, вызывающие опадение листьев, и десиканты — подсушивание органов или целых растений.
Синтетические стимуляторы типа ауксинов b-индолилуксусная кислота, или гетероауксин, b-индолилмасляная комитета, a-нафтил-уксусная комитета, или АНУ) используются для усиления корнеобразования у черенков древесных и травянистых растений, улучшения срастания тканей при их пересадке и прививках, для предотвращения опадения завязей у плодовых деревьев и ягодников и др. Гиббереллины используют для усиления роста ягод бессемянных сортов винограда, выведения из состояния покоя клубней картофеля, усиления роста стеблей конопли, льна и ускорения плодоношения томата. Синтетические ингибиторы роста используют для задержания прорастания клубней картофеля при хранении, торможения роста стеблей злаков для повышения устойчивости к полеганию (ретарданты), уничтожения сорняков (гербициды)
Положение фр в системе биологических наук. Связь с современными биологическими дисциплинами. Фр-интегрирующая наука.
Физиология растений относится к биологическим, теоретическим наукам, является отраслью экспериментальной ботаники, которая в XIX в. выделилась в самостоятельную науку. В разное время на базе физиологии растений сформировались вирусология (1902 г.), агрохимия (1910 г.), химия гербицидов и стимуляторов роста (1925 г.), микробиология (1930 г.), биохимия (1930 г.). Физиология растений тесно связана с биохимией, биофизикой, микробиологией, цитологией, генетикой, молекулярной биологией, химией, физикой, использует современные методы химии, физики, математики, кибернетики. Успешное развитие биохимии способствует изучению обмена веществ и энергии растений на субклеточном и молекулярном уровнях. Трудно установить границы между отдельными биологическими науками, науками о жизни. Однако прежде всего физиология растений обеспечивает необходимую интеграцию всех биологических значений на уровне целого растения и ценоза, в этом ее особая роль в системе биологических наук.
Физиология растений как фундаментальная основа агрономических наук. К. А. Тимирязев неоднократно указывал, что физиология растений является теоретической основой рационального земледелия. Изучая основные закономерности жизнедеятельности растений, раскрывая зависимость функций растений от условий внешней среды, физиология растений является фундаментальной основой всех агрономических наук (земледелие, растениеводство, овощеводство и др.), создает теоретическую основу агротехнических систем, направленных на повышение урожайности и качества продукции сельскохозяйственных культур. Она тесно связана с химией, физикой, биохимией, биофизикой, микробиологией, молекулярной биологией. Физиология растений тесно связана с другими биологическими дисциплинами - молекулярной биологией, биохимией, биофизикой, генетикой, микробиологией, органической химией и другими
В 1902 г. от физиологии растений отделилась вирусология, в 1910 г. оформилась в самостоятельную науку агрохимия, в 1930 г. — микробиология и биохимия.
Перспективы практического приложения результатов физиологических исследований в растениеводстве, биотехнологии, охраны и защиты растительного мира, биоэнергетике, фармацевтике и освоении космоса
Изучение растений в условиях окружающей среды, помогает селекционерам изменять природу растений в необходимую для практики сторону с помощью управления их жизнедеятельности. Физиология является источником новых приемов и воздействия на растения, при помощи которых можно повысить устойчивость к неблагоприятным факторам среды, ускорить развитие.
Очень большое значение имеет фр для успешного решения экологических проблем. Способность зеленых растений улучшать воздух была отмечена еще первыми физиологами растений.
Люди, которые находятся в космосе вдыхают кислород и выдыхают углекислый газ. Зеленые растения в процессах фотосинтеза обеспечивают обратный процесс, а также могут служить пищей для человека.
Применение исследовании фр в фармацевтике связано с лекарственными растениями. Благодаря изучению лекарственных свойств многих растений было открыто множество препаратов.
Системы регуляции растений (внутриклеточные и организменные): генетическая, мембранная, трофическая, гормональная, электрофизиологическая
К внутриклеточным относятся метаболическая, генетическая и мембранная системы регуляции. Генетическая регуляция осуществляется в ходе синтеза новых белков, в том числе и ферментов, на уровне транскрипции, трансляции и процессинга. Молекулярные механизмы регуляции рН, ионы, модификация молекул, белки-регуляторы. Роль генов состоит в хранении и передаче генетической информации. Информация записывается в хромосомной ДНК с помощью триплетного нуклеотидного кода. Информация в клетках передается благодаря синтезу РНК на матрице ДНК (транскрипция) и синтезу специализированных белков на матрице мРНК с участием рибосом, содержащих рРНК и рибосомальные белки, и тРНК (трансляция). В ходе и после транскрипции или трансляции происходит модификация (процессинг) биополимеров, транспортирующихся в места назначения. Важную роль в поддержании пространственной организации белковой молекулы и в ее транспорте к местам постоянной дислокации играют белки-шапероны [4]. Специализированные белковые молекулы в соответствии со своей "структурной" информацией путем самосборки образуют специфические комплексы, выполняющие различные функции: каталитические (ферменты), двигательные (сократительные белки), транспортные (насосы и переносчики), рецепторные (хемо-, фото- и механорецепторы), регуляторные (белковые активаторы, репрессоры, ингибиторы), защитные (лектины) и др.
Мембранная регуляция осуществляется благодаря изменениям в мембранном транспорте, связыванию или освобождению ферментов и регуляторных белков и путем изменения активности мембранных ферментов. Все функции мембран - барьерная, транспортная, осмотическая, энергетическая, рецепторно-регуляторная и др. - одновременно являются и различными сторонами механизма регуляции внутриклеточного обмена веществ. Причем особое значение во всех этих механизмах имеет система мембранных хемо-, фото- и механорецепторов, позволяющих клетке оценивать качественные и количественные изменения во внешней и внутренней среде и в соответствии с этим изменять функциональную активность клетки.
Трофическая регуляция - взаимодействие с помощью питательных веществ - наиболее простой способ связи между клетками, тканями и органами. У растений корни и другие гетеротрофные органы зависят от поступления ассимилятов - продуктов, образующихся в листьях в процессе фотосинтеза. В свою очередь, надземные части нуждаются в минеральных веществах и воде, поглощаемых корнями из почвы. Корни используют ассимиляты, поступающие из побега, на собственные нужды, а часть трансформированных органических веществ движется в обратном направлении. Изолированные корни в стерильных условиях для нормального развития помимо минеральных веществ и сахара нуждаются еще и в некоторых витаминах, таких, как В1 , В6 и никотиновая кислота. Очевидно, витамины поступают в корни из побегов. Однако трофическая регуляция носит скорее количественный, чем качественный, характер. При ограниченном питании у растений, как правило, развитие продолжается в соответствии с внутренними закономерностями, но у них формируются органы уменьшенного размера и сокращается количество листьев, плодов и семян. Интересно, что при этом конечная величина сформировавшихся семян (даже если это одно семя) мало отличается от нормы. Все это указывает, что наряду с трофическими взаимодействиями в растительном мире функционируют более совершенные системы регуляции, обеспечивающие взаимодействие всех его частей.
Гормональная система - важнейший фактор регуляции и управления у растений [7-10]. Фитогормоны - ауксин (индолил-3-уксусная кислота), цитокинины (зеатин, изопентениладенин), гиббереллины, абсцизовая кислота, этилен - сравнительно низкомолекулярные органические вещества с высокой физиологической активностью, присутствующие в тканях в очень низких концентрациях (пикограммы и нанограммы на 1 г сырой массы), с помощью которых клетки, ткани и органы взаимодействуют между собой. Как правило, фитогормоны вырабатываются в одних тканях, а действуют в других, однако в некоторых случаях они функционируют в тех же клетках, где образуются. Характерной особенностью фитогормонов, отличающей их от других физиологически активных веществ (витаминов, микроэлементов), является то, что они включают физиологические и морфогенетические программы, например такие, как корнеобразование, созревание плодов и т.д. Каждый из перечисленных фитогормонов является основой системы, включающей в себя ферменты синтеза, связывания (конъюгирования) и освобождения гормона из связанного состояния, способы мембранного и дальнего транспорта, механизмы действия, которые определяются наличием рецепторов и их локализацией, и, наконец, ферменты, кофакторы и ингибиторы разрушения фитогормона
Электрофизиологическая система регуляции у растений включает в себя возникновение градиентов биоэлектропотенциалов (БЭП) между разными частями растения и генерацию распространяющихся потенциалов (потенциала действия и вариабельного потенциала) . Градиенты БЭП возникают благодаря различию величин мембранного потенциала (МП) в клетках разных тканей, зон и органов растительного организма. Эти градиенты не остаются постоянными, а совершают медленные периодические колебания, обусловленные изменениями условий внутренней и внешней среды. Разность потенциалов между любыми частями растения не может превышать 100-200 мВ, так как эти величины соответствуют максимальной величине МП растительных клеток. Потенциалы действия (ПД) представляют собой электрические импульсы деполяризации МП продолжительностью 1-60 с и распространяющиеся по плазматической мембране через плазмодесмы из клетки в клетку со скоростью 0,1-1,0 см/с. ПД индуцируется лишь при достижении критического уровня деполяризации МП плазмалеммы и перемещаются по живым клеткам проводящих пучков. Вариабельные потенциалы возникают при градуальном изменении МП плазмалеммы и распространяются по плазматическим мембранам и плазмодесмам в виде медленных волн с периодом 1-10 мин. Распространяющиеся потенциалы индуцируются, как правило, при резких и сильных воздействиях на клетки факторов внешней и внутренней среды. Как распространяющиеся потенциалы, так и градиенты БЭП у растений, очевидно, выполняют, как и у животных, информационные функции.
Раздражимость растений и ее значение для сохранения целостности растительного организма
Это способность клетки реагировать на действие внешних и внутренних факторов – раздражителей и передавать возбуждение в другие клетки. Восприятие раздражения обозначают термином перцепция или рецепция. У растений нет органов чувств, но есть рецепторные белки и клетки, воспринимающие разные воздействия. Различают фото-, хемо - и механорецепторы.
У растений раздражителями могут быть различные агенты, но особенно чувствительны они к таким жизненно важным факторам, как свет, температура, сила тяжести, влажность, аэрация, концентрация и состав солей, кислотность и щёлочность почвенного раствора. Реакции растения на раздражители определяют расположение его органов в воздушном и почвенном пространстве (см. Движения у растений, Тропизмы) . Свойством Р. обладают все живые клетки растений, но наиболее чувствительны к указанным раздражителям верхушки побегов и кончики корней, с которых возбуждение передаётся в зоны роста этих органов и вызывает соответствующее изменение в направлении их роста. Стеблям, черешкам листьев и усикам вьющихся и лазящих растений, а также тычинкам и пестикам некоторых растений присуща очень высокая контактная чувствительность (см. Гаптотропизм) . Цветки и листья многих растений чутко реагируют на изменения освещённости или температуры (см. Настии, «Сон» растений) . Быстрыми реакциями на раздражения обладают особо чувствительные, в том числе и насекомоядные, растения (например, мимоза, мухоловка, росянка) и гифы хищных грибов. Под влиянием раздражителей могут меняться движения цитоплазмы, ядра, хромосом, хлоропластов, митохондрий и др. структур растительной клетки, а также движения не прикрепленных к субстрату низших растений, зооспор и спермиев.
ФИЗИОЛОГИЯ РАСТИТЕЛЬНОЙ КЛЕТКИ
Особенности строения растительной клетки, ее структурные элементы: клеточная оболочка, ядро, митохондрии, рибосомы, пероксисомы, глиоксисомы, ЭПС, аппарат Гольджи
Клетка — основная структурная и функциональная единица растительного организма, в которой протекают все процессы жизнедеятельности. Особенности строения: наличие ядра, пластид, клеточной стенки(основным компонентом которой является целлюлоза); хорошо развитая система вакуолей; отсутствие центриолей при делении; рост путем растяжения.
Оболочка клетки: придает тканям растений механическую прочность. Служит противоинфекционным барьером. Состав: целлюлоза, гемицеллюлоза, пектиновые вещества, липиды и небольшое количество белков. Тонкие волокна целлюлозы переплетаются и составляют сетчатую структуру клеточной оболочки, которая погружена в аморфную желеобразную массу — матрикс. Матрикс состоит из гемицеллюлоз, пектиновых веществ, незначительного количества белка. Сетчатая структура клеточной оболочки придает ей эластичность и прочность, а матрикс обеспечивает пластические свойства — способность к растяжению. Толщина клеточной стенки колеблется от десятых долей до 10 мкм. При формировании вторичной оболочки утрачивается пластичность и клетка становится неспособной к росту. Клеточная оболочка находится в набухшем состоянии. Она обладает низким сопротивлением, поэтому легко пропускает воду и растворенные в ней вещества. В клеточных оболочках имеются поры, через которые проходят тяжи цитоплазмы — плазмодесмы. Плазмодесмы одной клетки связаны с плазмодесмами другой. В стареющих клетках оболочка пропитывается лигнином и суберином, теряя эластичность и проницаемость.
Ядро — это основная органелла клетки, в которой сосредоточена большая часть наследственной информации. В молодой клетке ядро расположено ближе к центру, в выросшей оно смещается к оболочке вместе с цитоплазмой. Диаметр от 5 до 20 мкм. Ядерная оболочка состоит из двух мембран — наружной и внутренней, которые разделены между собой пространством, заполненным полужидкой стромой. На внешней мембране расположено большое число рибосом. Ядерная оболочка имеет поры, с помощью которых происходит обмен между ядром и цитоплазмой. Нуклеоплазма (внутреннее содержимое ядра) включает белки, нуклеиновые кислоты, липиды, углеводы, минеральные соли и другие вещества. В ядре находятся хромосомы (сост. ДНК, белка, неб. кол-ва РНК и липидов). В ядре имеются одно или несколько ядрышек, в которых содержатся белки, РНК и неб. кол-во ДНК. В ядрышко входят рибосомы, в которых синтезируются ядерные белки. При его разрушении ядро перестает делиться. Функции: передача наследственной информации (репликация), хранение информации (интерфаза).
Митохондрии обычно имеют удлиненную форму длиной 1 — 5 мкм. Число митохондрий в клетке может быть от нескольких десятков до двух тысяч. Они окружены двойной мембраной. Внутренняя образует выросты, называемые кристами. Пространство, ограниченное внутренней митохондриальной мембраной, наз-ся матриксом. Сухое вещество митохондрий состоит в основном из белков и липидов. В их состав входят РНК, ДНК и рибосомы, а также вся система синтеза белка. Митохондрии — центры окислительных процессов, в них осуществляется большая часть реакций дыхания. Окисление субстрата в процессе дыхания происходит на наружной мембране, которая характеризуется высокой проницаемостью для низкомолекулярных соединений. Процесс фосфорилирования, т. е. накопления освобождающейся при дыхании энергии с образованием АТФ, связан с кристами и матриксом. Освобождающаяся при дыхании энергия аккумулируется в молекулах АТФ и служит основным источником для физиологической деятельности клетки.
Рибосомы — это субмикроскопические частицы, различимые в электронный микроскоп, представляющие собой компактные рибонуклеопротеидные частицы, лишенные мембран. Они состоят из двух субъединиц — большой (15 нм), и малой (9 нм). Составные части рибосом образуются в ядрышке, а их самосборка осуществляется в цитоплазме. Хим. состав — 50 % рРНК и 50 % белка. Располагаются: свободно в цитоплазме, на мембранах ЭПС, на оболочке ядра, в ядре, митохондриях и в пластидах. Рибосомы могут образовывать цепочки — составлять комплекс полисом, состоящий из нескольких частиц. Основная функция рибосом — синтез белка.
Пероксисомы многочислены в клетках листьев, где они тесно связаны с хлоропластами. В них окисляется гликолевая кислота и образуется аминокислота глицин. В листьях высших растений пероксисомы участвуют в фотодыхании.
Глиоксисомы появляются при прорастании семян, в которых запасаются жиры и содержат ферменты необходимые для превращения жирных кислот в сахара: системы бета-окисления жирных кислот и глиоксилатный цикл.
ЭПС: вся цитоплазма клетки пронизана каналами ЭПС, которые имеют расширения — цистерны. Эти каналы и цистерны образованы мембранами и могут увеличиваться до более крупных полостей. Мембраны ЭПС связаны с мембраной ядра, пронизывают всю клетку и выходят через плазмодесмы в соседние клетки. К мембранам ЭПС прикрепляются рибосомы, поэтому у ЭПС бывают шероховатые участки. Каналы и цистерны заполнены жидкостью, в которой содержатся различные растворимые соединения. Мембраны разделяют клетку на отдельные отсеки, поэтому не происходит случайного взаимодействия веществ. По каналам ЭПС осуществляется перемещение веществ и связываются отдельные клетки. В развитой раст. клетке в результате слияния полостей ЭПС образуется вакуоль.
Аппарат Гольджи представляет собой группы трубочек (цистерн, имеющих мембраны) и сферических пузырьков, которые формируются на одном из концов трубочек и отделяются на другом. Его элементы принимают участие в формировании плазмалеммы и клеточной оболочки. В то же время цистерны служат для удаления (секреции) некоторых выработанных клеткой веществ.
Вакуоль заполнена клеточным соком и окружена мембраной — тоноплас т о м. В клеточном соке растворены органич. кислоты, сахара, мин. в-ва и другие соед-ия, к-ые являются запасными пит. в-ми. Размеры — от 1 до 1000 мкм. Мелкие вакуоли трудно отличимы от пузырьков и везикул, крупные (в мякоти плода лимона, арбуза) видны невооруженным глазом. Вакуоль может образовываться из мембран ап-та Гольджи, ЭПС, везикул цитоплазмы. Функции вакуоли заключаются в отделении воды от цитоплазмы, создании осмотического потенциала клетки, поддержании состояния тургора. Кроме того, она служит резервуаром запасных пит. в-в и ненужных продуктов обмена.
Мембранный принцип организации поверхности протоплазмы и органоидов клетки. Строение и функции биологических мембран.
В основе структурной организации клетки лежит мембранный принцип строения. Это означает, что клетка в основном построена из мембран сходного строения. Они образованы двумя рядами липидов, в которые на разную глубину с наружной и внутренней стороны погружены многочисленные и разнообразные молекулы белков.
Наиболее изученной является наружняя мембрана клетки или плазмалемма. Она состоит из липидов, белков, углеводов. Липиды лежат в два слоя. Белки располагаются либо на поверхности, лбо часть погружена в мембрану(интегральные), либо полностью ее перекрывают.
Функции мембран: ограничивающая, барьерная, транспортная, рецепторная, каталитическая, энергетическая. Происходит активный и пассивный транспорт. Осмотическая роль. Структурная функция мембран заключается в упорядоченности расположения полиферментных комплексов. Аккумуляция и трансформация энергии.
Пластиды растительной клетки: типы, локализация в тканях и органах растений, функции, взаимопревращения
Пластиды-полуавтономные органеллы высших растений, водорослей и некоторых фотосинтезирующих простейших. Особенности: двойная мембрана, собственная ДНК, белоксинтезирующий аппарат, внутреннее содержимое- строма.

Бесцветные: пропластиды-в меристематических клетках, меньше рибосом, содержат белок фитоферритин который хранит железо; этиопласты- развиваются из пропластид в темноте, при освещении превращаются в хлоропласты, имеют проламеллярные тела; лейкопласты- характерны для запасающих органов и тканей(аммилопласты-крахмал, протеинопласты-белки, олеопласты-жиры)
Цветные: хромопласты- содержатся в цветных частях растений, внутри стромы находятся структуры каротиноидов(глобулярные, кристаллические, набор мембран, трубчатые); хлоропласты- зеленые, функция фотосинтез
Могут быть трех типов — лейкопласты, хромопласты и хлоропласты. Размеры пластид от 3 до 20 мкм. Пластиды зрелых клеток, сохранившие структуру пропластид, называются лейкопластами. Они окружены двойной мембраной, наружная — гладкая, внутренняя имеет небольшие впячивания. Внутри лейкопластов нах. матрикс. В них накапливаются запасные вещества. Хлоропласты имеют овальную форму, окружены двойной мембраной. Внутри хлоропласта содержится жидкое вещество — строма, в которой находятся длинные вытянутые мембранные пластинки — ламеллы — или мембранные шаровидные образования — граны. Граны окрашены, так как в них содержатся пигменты — хлорофиллы и каротиноиды. Основная функция — фотосинтез. Хромопласты, имеют желтую, красную или коричневую окраску. Хромопласты встречаются в клетках в надземных и подземных органов, они придают окраску плодам и стареющим листьям.
Пластиды различных типов обладают способностью взаимно переходить друг в друга. Так, лейкопласты на свету превращаются в хлоропласты. Хромопласты могут образовываться из хлоропластов при разрушении в них хлорофилла

Структурно-функциональная организация фотосинтетического аппарата высших растений
Лист как орган фотосинтеза. Верхняя и нижняя эпидерма листовой пластинки, если не считать замыкающих клеток устьиц, состоит из клеток с большими вакуолями, в которых отсутствуют хлоропласты. Такие клетки хорошо пропускают свет в мезофилл и, таким образом, непосредственного участия в фотосинтезе не принимают. Эпидермальные клетки, покрытые кутикулой и воском, уменьшая транспирацию, помогают поддерживать водный гомеостаз листа. Мезофилл у большинства растений состоит из палисадной и губчатой паренхимы. В клетках мезофилла имеются хлоропласты, здесь и проходит вся фотосинтетическая деятельность зеленого растения. Палисадная паренхима, которая размещается под верхней эпидермой, поглощает больше света, чем губчатая. Палисадная является главной тканью, где идет фотосинтез. Для губчатой паренхимы характерно наличие межклетников. Они помогают газообмену листа. Объем их составляет 15–20 % общего объема листовой пластинки. Благодаря верхней и нижней эпидерме, а также межклетникам, в листе образуется внутреннее газовое окружение, которое хотя и связано с наружной средой с помощью устьиц, но как правило, всегда отличается от наружной среды по своему составу. Кроме того, межклетники значительно увеличивают внутреннюю поверхность листа, которая в 7–10 раз больше, чем наружная. Это весьма важно в связи с небольшим содержанием в воздухе СО2 (0,045 %). Однако увеличивается опасность обезвоживание тканей листа.
Так как фотосинтез идет главным образом в палисадной паренхиме, ее называют ассимиляционной.
Мезофилл пронизан сеткой проводящих пучков, в состав которых входят сосуды, которые доставляют хлоропластам воду и минеральные соли, и ситовидные трубки, отводящие от хлоропластов продукты фотосинтеза.

Хлоропласт-органелла фотосинтеза. В хлоропластах находятся все пигменты фотосинтеза (5–10 % сухого веса хлоропластов). Кроме того, хлоропласт содержит 35–55 % белков, 30–50 % липидов, 2–3 % РНК, 0,5 % ДНК, 5 % золы. Основными компонентами золы являются калий, фосфор, железо, медь, магний, цинк. Пигменты, которые принимают участие в фотосинтезе при поглощении света, а также ферменты, необходимые для световой стадии, встроены в мембраны тилакоидов; ферменты, катализирующие восстановление СО2 (темновая стадия), находятся в строме.
ВОДНЫЙ ОБМЕН РАСТЕНИЙ
Роль воды в жизни растений. Молекулярная структура и физические свойства воды
Для нормальной физиологической деят-ти клетка растения должна быть полностью насыщена водой (или близка к насыщению). В жизни клетки вода имеет значение для поддержания структуры цитоплазмы путем гидратации ее коллоидов и тургорного состояния. Кроме этого, вода необходима как среда для протекания обмена веществ, так как биохимические реакции возможны только между веществами, находящимися в растворенном состоянии. Вода является средой для переноса веществ, т.к. он происходит также только в растворенном состоянии. Вода служит регулятором t° тела раст., т. е. защищает его от быстрого охлаждения или перегревания. Растения относятся к пойкилотермным организмам, не имеющим постоянной t° тела, которая значительно зависит от t° среды, но в некоторой степени она может регулироваться водой. Этому способствуют такие, свойства воды, как теплоемкость и теплота парообразования. Теплоемкость воды, в сравнении со многими веществами, особенно металлами, очень высока. При нагревании она поглощает много тепла, а при охлаждении выделяет большое его количество. Это приводит к смягчению колебания t° тела растения при изменении t° среды. Также очень высока у воды теплота парообразования. Это приводит к тому, что при ее испарении затрачивается много тепла, которое выделяется органами растения, что вызывает значительное понижение их t°.
Физ. Свойства. Плотность воды определяется отношением ее массы к объему при определенной температуре. За единицу плотности воды принята плотность дистиллированной воды при температуре 4°С. Плотность воды зависит от температуры, количества растворенных в ней солей, газов и взвешенных частиц и изменяется от 1 до 1,4 г/см3. Благодаря сильному притяжению между молекулами у воды высокие температуры плавления (0° С) и кипения (100° С). Плотность воды в твердом состоянии меньше, чем в жидком. Следовательно, лед образуется на поверхности водоемов и не опускается на дно. Очень малая теплопроводность. При понижении температуры и давления понижается и теплопроводность. С понижением температуры и понижением плотности уменьшается теплопроводность. Поэтому происходит медленный нагрев и охлаждение водной массы. Проявляется это свойство в том, что снег предохраняет почву от промерзания, а лед - водоемы от промерзания.
Формула воды - Н2О (предложена в 1805 г Гумбольдтом и Гей-Люсаком), т.е. состоит из 1 атома кислорода и 2-х атомов водорода.
1). Молекула воды асимметрична, образует равнобедренный треугольник.
2). Молекула воды обладает полярностью, поэтому является электрическим диполем.
3). Молекулярная структура воды: вода находится в трех состояниях и осуществляет фазовые переходы.
Поступление воды в растительную клетку. Осмотическое давление и его значение в поглощении воды клеткой. Методы определения осмотического давления
Поглощение воды из внешней среды обязательное условие существования любого организма. Вода может поступать в клетку растений благодаря набуханию биоколлоидов, увеличивая степень их гидратации. Такое поступление воды характерно для сухих семян помещенных в воду. Однако главный способ поступления воды в живые клетки является ее осмотическое поглощение.
Осмосом называется прохождение растворителя в раствор, отделенный от него полунепроницаемой мембраной(т.е. пропускающей растворитель, но не молекулы растворенных веществ).
Природу осмоса стали изучать в 1826 году, когда фран. Физиолог Г.Дютроше сконструировал первый осмометр: пузырь из полупроницаемой пленки(пергамент, животный пузырь) с помещенной в него стеклянной трубочки заполнялся раствором сахара или другого орг. В-ва. После погружения пузыря в чистую водй наблюдался подъем уровня жидкости в трубке. Однако применявшееся пленка не были абсолютно полупроницаемыми и медленно проникавший сахар мешал количественному измерению осмотического давления.
В. Пфеффер изготовил «искусственную камеру». Основой ее служил пористый фарфоровый сосуд. Во внутреннюю полость наливался раствор желтой кровяной соли и сосуд помещался в раствор CuSO4. При взаимодействие этих веществ в порах фарфора образовывалось гелеобразная масса железистосинеродистой меди
Поступление воды в такого рода осмотическую ячейку приводит к увеличению объема жидкости и поднятию ее уровня в манометрической трубке до тех пор пока гидростатическое давление столба жидкости не повысится настолько, чтобы препятствовать дальнейшему увеличению объема раствора. В достигнутом состоянии равновесия полупроницаемая мембрана в 1 времени пропускает одинаковое количество воды в обоих направлениях. Гидростатическое давление в этом случае соответствует потенциальному осмотическому давлению П*
Вант-Гофф: для разбавленных растворов осмотическое давление при постоянной температуре определяется концентрацией частиц (молекул, ионов) растворенного вещества (числом их в 1 объема раствора). Потенциальное осмотическое давление выражается в Паскалях и отражает максимально возможное давление, которое имеет раствор данной концентрации, или максимальную способность раствора в ячейке поглощать воду.
П*= i*c*RT, где c-концентрация раствора в молях, T-абсолютная t, R-газовая постоянная, i-изотонический коэффициент, равный 1+α(n-1), где α-степень электролитической диссоциации, n-число ионов, на которые распадается молекула электролита
Значение осмотического давления в поглощении воды: от осмот давления зависит сосущая сила клетки, достигая у семян при 6%-ной окружающей влажности величины 4,0510Па(400Атм), что обеспечивает необходимое для прорастания поглощеия воды даже из сравнительно сухой почвы.
Осмотическое давление можно определить благодаря фотометрическому методу.
Термодинамические показатели водного режима: активность воды, химический и водный потенциалы. Методы определения водного потенциала.
Энергетический уровень молекул данного вещества, который выражается в скорости их диффузии наз-ют химическим потенциалом этого вещества(ψ). Хим потенциал чистой воды называют водным потенциалом. (ψh2o) Он характеризует способность воды диффундировать, испаряться или поглощаться и выражается в Паскалях. Наивысшая величина водного потенциала – у хим. Чистой воды, эта величина принята за нуль. Поэтому водный потенциал любого раствора и биологической жидкости имеет отрицательное значение. Водный потенциал складывается из осмотического потенциала ψs, потенциала давления ψp, гравитационного потенциала ψg, потенциала набухания биоколлоидов.
Для оценки степени участия воды в различных химических, биохимических и микробиологических реакциях широко применяют показатель активность воды aw, определяемый как отношение парциального давления паров воды над продуктом к парциальному давлению пара над чистой водой. Показатель «активность воды» был предложен У. Скоттом в 1953 г. и в настоящее время широко применяется на практике.
Методы определения водного потенциала: Метод Шардакова основан на подборе раствора, удельный вес, а соответственно и концентрация которого не изменяется после пребывания в нем растительных тканей в течении 20 минут. В этом случае величина осмотического потенциала раствора равна по модулю потенциалу растения.
Сосущая сила клетки и водный потенциал. Методы определения сосущей силы
Так как мембрана избирательно проницаема и вода проходит через нее значительно легче, чем вещества, растворенные в клеточном соке и цитоплазме, при помещении клетки в воду, то по законам осмоса она будет поступать внутрь клетки.
Силу с которой вода входит в клетку, называют сосущей силой S. Она тождественна водному потенциалу клетки(ψh2o). Величина сосущей силы определяется осмотическим давлением П* клеточного сока и тургорным (гидростатическим) давлением в клетке(Р), которое равно противодавлению клеточной стенки, возникающему при ее эластическом растяжении. S=П*-Р
При замене этих обозначений соответствующими термодинамическими величинами уравнение приобретает следующий вид: -ψh2o=-ψп-ψр
В условиях разной оводненности соотношения между всеми компонентами этого уравнения меняются. Когда клетка полностью насыщена водой(полностью тургесцентна), ее сосущая сила равна нулю, а тургорное давление равно потенциальному осмотическому: S=0, П*=Р. Состояние полного тургора наблюдается в клетке при достаточной влажности почвы и воздуха. Если подача воды к клетке уменьшается (при усилении ветра, при недостатке влаги в почве и т.д.), то вначале возникает водный дефицит в клеточной стенке, водный потенциал которых становится ниже, чем в вакуолях, и вода начинает перемещаться в клеточные стенки. Отток воды из вакуолей снижает тургорное давление в клетке и следовательно увеличивает их сосущую силу. При длительном недостатке влаги большинство клеток теряет тургор и растение повядает. В этих условиях Р=0, S=П*. Метод определения сосущей силы: Определение методом полосок (по Лилиенштерн) Принцип метода основан на подборе такой концентрации наружного раствора, при которой погруженные в раствор полоски растительной ткани не меняют своей длины, так как в поступлении воды наступает динамическое равновесие и объем клеток остается неизменным. При более высокой концентрации раствора длина полосок уменьшается. Если осмотическое давление меньше величины сосущей силы клетки, то клетка всасывает воду из раствора, увеличивается в объеме и длина полосок становится больше.
Состояние воды в растворах. Взаимодействие воды и биополимеров (белков), гидратация. Формы воды в клетке- свободная и связанная вода, их физиологическая роль
В электрическом поле катиона все ближайшие молекулы воды ориентируются отрицательными полюсами внутрь, а вокруг аниона внутрь направлены положительные полюсы молекулы воды. Этот внутренний, прочно связанный с ионами слой молекул воды называют первичной или ближней гидратацией. В процессе электрофореза он движется вместе с ионом как одно целое. Однако, ион связывая определенное число молекул воды из своего непосредственного окружения, в результате ион-дипольного взаимодействия ориентирует также более далеко расположенные диполи воды. Эту гидратацию называют вторичной(дальней).
В растворах содержащих ионы структура воды существенно меняется. В разбавленных растворах (<0,1моль/л) это происходит благодаря заряженным ионам. Маленькие ионы с большей плотностью заряда сильнее действуют на структуру чистой воды по сравнению с большими ионами, имеющими малую плотность заряда, и те и другие разрушают структуру воды: первые притягивают молекулы воды, вторые при внедрении в воду из-за большого размера разрушают льдоподобный каркас. При этом может меняться вязкость водного раствора: структура, создаваемая слабогидратированными большими ионами(с малым зарядом) делает вязкость раствора ниже вязкости чистой воды(Li, Na, Mg,F), а более плотная структура, образуемая гидратированными ионами, обусловливает более высокую вязкость, чем в чистой воде(K, Rb, Cl, OH, NO3)
В белках гидратация обусловлена взаимодействиями молекул воды с гидрофильными (ионными и электронейтральными) и гидрофобными (неполярными) группами и ее иммобилизацией в замкнутых пространствах внутри макромолекул при их конформационных перестройках. При ионной гидратации(взаимодействие с -NH3, -СОО группами) и электронейтральной(с -СООН, -ОН, -СО, -NH) молекулы воды электростатически связываются и образуется мономолекулярный слой первичной гидратации. Число ионнизированных групп в белке зависит от рН среды. Наименее гидратирован белок в его изоэлектрической точке, при которой отмечается также самая низкая растворимость белков.
Иммобилизованная вода, оказавшаяся замкнутой внутри макромолекул, может участвовать в образовании слоя первичной гидратации, а остальная ее часть сохраняет свойства обычной воды, но с ограниченной подвижностью
Свободная вода легко передвигается по растению и испаряется. Она находится в основном в межклетниках, т. е. в свободном пространстве. Связанная вода испаряется и передвигается с трудом. Она находится преимущественно внутри клетки — в цитоплазме и вакуоли. Разделяется на осмотически и коллоидно связанную. Первая соединена с растворенными в ней веществами и находится в вакуоли. Эта связь не очень прочная, и осмотически связанная вода может выходить из клетки, например, при плазмолизе. Свойства коллоидно связанной воды обусловлены наличием белков — коллоидов цитоплазмы, где она и находится. Такая связь большей частью очень прочная, и коллоидно связанная вода выходит из клетки только при очень сильном обезвоживании (продол. засухе).
Корневая система как орган поглощения воды. Состояние воды в почве. Поступление и передвижение воды в корне: пути и механизмы
Вышедшие на сушу растения приспособились к наземному образу жизни благодаря приобретению способности создавать внутри своего тела непрерывный восходящий ток воды.

Роль этого органа прежде всего заключается в том, что благодаря огромной поверхности обеспечивается поступление воды в растение из почвы. Сформировавшаяся корневая система представляет собой сложный орган с хорошо дифференцированной внешней и внутренней структурой. Корневой чехлик служит защитой для точки роста. Клетки корневого чехлика слущиваются, что уменьшает трение и способствует проникновению корня в глубь почвы. Под корневым чехликом расположена меристематическая зона. Меристема состоит из многочисленных мелких, усиленно делящихся, плотно упакованных клеток, почти целиком заполненных цитоплазмой. Следующая зона — зона растяжения. Здесь клетки увеличиваются в объеме (растягиваются). Затем следует зона корневых волосков. При дальнейшем увеличении возраста клеток, а также расстояния от кончика корня, корневые волоски исчезают, начинается кутинизация и опробковение клеточных оболочек. Поглощение воды происходит главным образом клетками зоны растяжения и зоны корневых волосков. Некоторое количество воды может поступать и через опробковевшую зону корня. Это главным образом наблюдается у деревьев. В этом случае вода проникает через чечевички. Строение корня в зоне корневых волосков. Поверхность корня в этой зоне покрыта ризодермой. Это однослойная ткань с двумя видами клеток, формирующими и не формирующими корневые волоски. В настоящее время показано, что клетки, формирующие корневые волоски, отличаются особым типом обмена веществ. Кора состоит из нескольких слоев паренхимных клеток. Важной особенностью коры является развитие системы крупных межклетников. На границе коры и центрального цилиндра развивается один слой плотно прилегающих друг к другу клеток — эндодерма, для которой характерно наличие поясков Каспари. Цитоплазма в клетках эндодермы плотно прилегает к клеточным оболочкам. По мере старения вся внутренняя поверхность клеток эндодермы, за исключением пропускных клеток, пропитывается суберином, что не позволяет передвигаться воде и растворенным в ней веществам.
Поступление воды и растворенных веществ в корни через биологические мембраны осуществляется благодаря таким процессам как осмос, диффузия и активный транспорт.
Осмос – диффузия воды через мембрану. Диффузия – проникновение веществ через мембрану по градиенту концентрации (из области где их концентрация выше, в область, где их концентрация ниже). Диффузный транспорт веществ воды и ионов осуществляется при участии белков мембраны, в которой имеются молекулярные поры, либо при участии жирорастворимых веществ.
Активный транспорт – перенос веществ против их градиента концентрации, связанный с затратами энергии. Он осуществляется специальными белками-переносчиками, которые образуют ионные насосы.
Из клеток с корневыми волосками водный раствор просачивается в клеточные поры корня и далее из клетки в клетку попадает в сосуды. По сосудам корня вода с растворенными веществами поднимается в стебель, а по сосудам стебля – почкам, листьям, цветкам.
В почве вода находится в разных физических состояниях: жидком, газообразном (водяной пар), твердом (лед), химически и физико-химически связанном с другими веществами и твердыми минеральными, органическими и органо-минеральными частицами. Зависимости от физического состояния и характера связей воды в почвенном среде различают категории, формы и виды грунтовой воды. В почве выделяют следующие категории воды:
• химически связанная вода, входящая в состав других веществ (например, гипса) и недоступна для использования растениями;
• жесткая вода (лед) - находится в этом состоянии по низкой (отрицательной) температуры и недоступна для растений, однако становится доступной после таяния;
• водяной пар, содержащийся в почвенном воздухе и после конденсации становится доступной для растений;
• прочно связанная вода, которая содержится адсорбционными силами на поверхности частиц почвы в виде пленки толщиной в два-три диаметра молекул воды, находится в газообразном состоянии (водяной пар) и недоступна для растений;
• непрочно связанная вода, которая представляет собой пленки влаги вокруг частичек грунта толщиной до 10 диаметров молекул воды, перемещается между грунтовыми частицами под воздействием сорбционных сил и является труднодоступной для растений;
• свободная вода, которая не связана молекулярными силами с частицами почвы, поэтому свободно или под влиянием менисковых сил движется в грунтовых порах и доступна для растений.
Корневое давление «плач» и гуттация растений
Корневое давление-давление возникающее в проводящих сосудах корней растений. К. д. и Транспирация вызываютподнятие пасоки (воды и растворённых в ней питательных веществ) вверх по стеблю. В основе К. д. лежитявление Осмоса; клетки корня активно выделяют в сосуды минеральные и органические вещества, что исоздаёт более высокое, чем в почвенном растворе, Осмотическое давление. К. д. обычно равно 1-3 ат (внекоторых случаях до 10 ат; 1 ат = 105 н/м2) и зависит от условий жизнедеятельности корня. При низкойтемпературе или недостатке кислорода К. д. снижается, при гибели корня равно нулю. Максимум К. д.отмечается днём, минимум — ночью.
Плач растений. — Под этим названием известно выделение водянистого сока из древесины растений при поранении их, напр., при просверливании отверстий в стволе или при отрезании ветвей или целого стебля. «Плач» находится в связи с током почвенной воды, поднимающимся по древесине. Особенно энергично П. происходит весною, до распускания почек; (так наз. весенний П.). В это время с пробуждением жизни в растении начинается поднятие воды, а между тем, при отсутствии листьев испарение ее еще очень слабо. Растение наливается поэтому водою, и если в это время просверлить в стволе, напр., березы или клена, отверстие, то из него в изобилии будет выделяться водянистый сок — пасока. Выделение ее происходит со значительною силою, различною, смотря по растению и условиям. По химическому составу пасока представляет водный раствор различных органических (плодовый или тростниковый сахар, белки, органические кислоты) и минеральных веществ. Присутствие этих веществ объясняется тем, что на зиму древесные породы наполняются питательными запасами, которые весною подвергаются растворению и вместе с почвенною водою, всасываемою корнями, передвигаются по древесине в развивающиеся почки. Если же удалить всю облиственную (испаряющую) часть растения, срезав его под корень, то пенек сначала всасывает воду, но через некоторое время, если почва достаточно влажна, начинает выделять ее. Это так назыв. летний П. Летняя пасока не содержит уже органических веществ и представляет чистый раствор почвенных минеральных солей.
Гуттациявыделение листьями растений капельножидкой воды. Происходит, когда корнями поглощается водыбольше, чем испаряется листьями. Г. наблюдается большей частью ночью, рано утром или при помещениирастений во влажную атмосферу; часто отмечается у молодых проростков, например злаков, развитиекорневой системы у которых обгоняет развитие испаряющей поверхности листьев. Капельки водывыделяются через Водяные устьица под воздействием корневого давления, с силойнагнетающего воду в стебли и листья. Г. -физиологический процесс, связанный с жизнедеятельностьюрастения: если проростки пшеницы поместить под колпак, внутри которого находятся пары хлороформа, тоГ. прекращается. Выделения при Г. всегда содержат ряд минеральных веществ. Очевидно, Г. освобождаетрастение от избытка солей, главным образом кальция. Выделение жидкости идет через специальные водные устьица – гидаторы.
Транспирация, ее значение; лист как орган транспирации. Виды транспирации, ее показатели. Суточный ход транспирации, влияние внешних условии
Значения: Транспирация спасает растение от перегрева, который ему грозит на прямом солнечном свете; Транспирация создает непрерывный ток воды из корневой системы к листьям, который связывает все органы растения в единое целое; С транспирационным током передвигаются растворимые минеральные и частично органические питательные вещества, при этом чем интенсивнее транспирация, тем быстрее идет этот процесс. Основным транспирирующим органом является лист. Средняя толщина листа составляет 100—200 мкм. Паренхимные клетки листа расположены рыхло, между ними имеется система межклетников. Эпидермис — покровная ткань листа, состоит из компактно расположенных клеток, наружные стенки которых утолщены. Кроме того, листья большинства растений покрыты кутикулой. Удаление кутикулы во много раз повышает интенсивность испарения. Для соприкосновения листа с атмосферой имеются поры — устьица. Устьице — это отверстие (щель), ограниченная двумя замыкающими клетками. Каждая замыкающая клетка устьица в отличие от клеток эпидермиса имеет хлоропласта. В них происходит фотосинтез, хотя с меньшей интенсивностью, чем в клетках мезофилла. Устьица — одно из оригинальных приспособлений, обладающих способностью открываться и закрываться в зависимости от насыщенности замыкающих клеток водой. Обычно устьичные отверстия ограничены двумя замыкающими клетками, стенки которых неравномерно утолщены. У двудольных растений замыкающие клетки бобовидной, или полулунной, формы, при этом их внутренние прилегающие друг к другу клеточные стенки более толстые, а внешние — более тонкие.

Кутикулярная транспирация Снаружи листья имеют однослойный эпидермис, внешние стенки клеток которого покрыты кутикулой и воском, образующие эффективный барьер на пути движения воды. На поверхности листьев часто развиты волоски, которые также влияют на водный режим листа, так как снижают скорость движения воздуха над его поверхностью и рассеивают свет и тем самым уменьшают потери воды за счет транспирации.Интенсивность кутикулярной транспирации варьирует у разных видов растений. У молодых листьев с тонкой кутикулой она может составлять около половины всей транспирации. У зрелых листьев с более мощной кутикулой кутикулярная транспирация равна 1/10 общей транспирации. В стареющих листьях из-за повреждения кутикулы она может возрастать. Таким образом, кутикулярная транспирация регулируется главным образом толщиной и целостностью кутикулы и других защитных покровных слоев на поверхности листьев. Кутикулярная транспирация обычно составляет около 10% от общей потери воды листом.
Устьичная транспирация Основная часть воды испаряется через устьица. Устьица играют важную роль в газообмене между листом и атмосферой, так как являются основным путем для водяного пара, углекислого газа и кислорода. Устьица находятся на обеих сторонах листа. Есть виды растений, у которых устьица располагаются только на нижней стороне листа. В среднем число устьиц колеблется от 50 до 500 на 1 мм². Транспирация через устьица идет почти с такой же скоростью, как и с поверхности чистой воды. Это объясняется законом И. Стефана: через малые отверстия скорость диффузии газов пропорциональна не площади отверстия, а диаметру или длине окружности. Поэтому, хотя площадь устьичных отверстий мала по отношению к площади всего листа (0,5-2 %), испарение воды через устьица идет очень интенсивно
Количественные показатели транспирации: Интенсивность транспирации – это количество, г, воды, испаряемой растением в единицу времени (ч) с единицы поверхности (дм 2 ). При определении продукционных характеристик рассчитывают ко- личество воды, израсходованной растением за весь вегетационный период, и относят его к сухой массе всего растения. Транспирационный коэффициент – это количество воды (г), расходуе- мой растением на образование 1 г сухого вещества.
Сутчный ход транспирации. У всех растений наблюдается периодичность суточного хода транспирации. У деревьев, теневых растений злаков (гидростабильные виды) испарение воды достигает максимума до наступления максимума дневной температуры. В полуденные часы транспирация падает. Вечером, при снижении дневных температур транспирация снова увеличивается. Такой ход транспирации приводит к незначительным изменениям осмотического давления и содержания воды в клетках в течение дня.
У видов, способных переносить резкие изменения содержания воды в клетках в течение дня, транспирация повышается в полдень и падает ночью (гидролабильные виды) Закрывание устьиц в полдень может быть вызвано увеличением уровня углекислого газа в листьях при повышении температуры воздуха (усиление дыхания и фотодыхания), а также возможным водным дефицитом, возникающим в тканях при высоких температурах и низкой влажности воздуха. Это приводит к повышению концентрации АБК и закрыванию устьиц.
На поступление воды в растение оказывают влияние внешние условия.
1. Температура. Поступление воды в растение зависит от температуры. С понижением температуры скорость поступления воды сокращается. Это может происходить в результате следующих причин:
а) повышается вязкость воды и снижается ее подвижность;
б) Тормозится рост корней;
в) Уменьшается скорость метаболических процессов;
2. Снижение аэрации почвы (повышение углекислого газа) Повышение концентрации углекислого газа приводит к повышению вязкости воды и снижает проницаемость цитоплазмы.
3. Содержание воды в почве, концентрация почвенного раствора. Вода поступает в корень, если водный потенциал корня ниже, чем водный потенциал почвы. На засоленных почвах или на почвах, где концентрация почвенного раствора очень высокая, водный потенциал почвы ниже. Поэтому вода начнет выделяться из корня. У растений, произрастающих на этих почвах - галофитах, в процессе эволюции выработался такой приспособительный признак как высокая
концентрация клеточного сока. Это обуславливает более низкий водный потенциал клеточного сока, вследствие чего вода из почвенного раствора поступает в корни.
Устьичная транспирация. Регуляция устьичных движений при действие внешних и внутренних факторов.
Устьичная транспирация Основная часть воды испаряется через устьица. Устьица играют важную роль в газообмене между листом и атмосферой, так как являются основным путем для водяного пара, углекислого газа и кислорода. Устьица находятся на обеих сторонах листа. Есть виды растений, у которых устьица располагаются только на нижней стороне листа. В среднем число устьиц колеблется от 50 до 500 на 1 мм². Транспирация через устьица идет почти с такой же скоростью, как и с поверхности чистой воды. Это объясняется законом И. Стефана: через малые отверстия скорость диффузии газов пропорциональна не площади отверстия, а диаметру или длине окружности. Поэтому, хотя площадь устьичных отверстий мала по отношению к площади всего листа (0,5-2 %), испарение воды через устьица идет очень интенсивно
Регуляция устьичной активности.
Открывание и закрывание устьиц регулируется несколькими механизмами.
1.Изменение тургора замыкающих клеток.
Замыкающие клетки устьиц имеют неоднородные клеточные стенки. Клеточная стенка, которая ближе к устьичнойщели толще, чем противоположная стенка. Целлюлозные волокна располагаются в ней так, что эта стенка менее эластична. По мере того, как клетка поглощает воду, тонкая и эластичная часть клеточной стенки, удаленной от устьичной щели растягивается. Менее эластичный участок клеточной стенки, окаймляющий устьичную щель, растягивается слабее. Поэтому замыкающие клетки устьиц принимают круглую форму и между замыкающими клетками образуется отверстие – устьица раскрываются.
Когда вода выходит из замыкающих клеток, то устьица закрываются.
2 Степень обеспеченности клеток водой.
Гидропассивная устьичная реакция происходит тогда, когда клетки эпидермиса и хлоренхимы, окружающие устьица, после обильного полива переполняются водой и механически сжимают замыкающие клетки. Если окружающие клетки теряют воду, то устьица открываются.
Гидроактивная устьичная реакция. Гидроактивное закрывание устьиц происходит в результате того, что транспирация превышает поглощение воды корнем. При этом тургорное давление замыкающих клетках достигает критического уровня. По мере развития водного дефицита в клетках листа увеличивается содержание фитогормонаабсцизовой кислоты (АБК), которое приводит к снижению тургора клеток, и устьица закрываются.
3.Фотоактивное открывание устьиц. При хорошем освещении, чем выше уровень освещенности, тем шире открываются устьица. Установлено, что днем на свету в замыкающих клетках увеличивается содержание сахаров и, соответственно, повышается осмотическое давление. В замыкающих клетках увеличивается сосущая сила и в них поступает вода. Это приводит к открыванию устьиц. Кроме того, днем на свету взамыкающих клетках накапливаются и ионы калия, что также приводит к повышению осмотического давления и открыванию устьиц.
Пути и механизмы передвижения воды по растению
Поглощение воды корневой системой идет благодаря работе двух концевых двигателей водного тока: верхнего концевого двигателя(транспирации), и нижнего концевого двигателя, или корневого двигателя. Основной силой, вызывающей поступление и передвижение воды в растении, является присасывающая сила транспирации, в результате которого возникает градиент водного потенциала. Водный потенциал – это мера энергии, используемой водой для передвижения. Водный потенциал и сосущая сила одинаковы по абсолютному значению, но противоположны по знаку. Чем меньше насыщенность водой данной системы, тем меньше (более отрицателен) ее водный потенциал. При потере воды растением в процессе транспирации создается ненасыщенность клеток листа водой, как следствие, возникает сосущая сила (водный потенциал падает). поступление воды идет в сторону большей сосущей силы, или меньшего водного потенциала.
Таким образом, верхний концевой двигатель водного тока в растении – это присасывающая сила транспирации листьев, и его работа мало связана с жизнедеятельностью корневой системы.
Кроме верхнего концевого двигателя водного тока, в растениях существует нижний концевой двигатель. Это хорошо доказывается на примере таких явлениях, как гуттация. Листья растений, клетки которых насыщены водой, в условиях высокой влажности воздуха, препятствующей испарению, выделяют капельно-жидкую воду с небольшим количеством растворенных веществ – гуттация. Выделение жидкости идет через специальные водные устьица – гидаторы. Выделяющаяся жидкость – гутта. Таким образом, процесс гуттации является результатом одностороннего тока воды, происходящего в отсутствие транспирации, и, следовательно, вызывается какой-то иной причиной. К такому же выводу можно прийти и при рассмотрении явления плач растений Если срезать побеги растения и к срезанному концу присоединить стеклянную трубку, то по ней будет подниматься жидкость. Анализ показывает, что это вода с растворенными веществами – пасока. Все сказанное приводит к выводу, что плач, как и гуттация, связана с наличием одностороннего тока воды через корневые системы, не зависящего от транспирации. Силу, вызывающую односторонний ток воды по сосудам с растворенными веществами, не зависящую от процесса транспирации, называют корневым давлением. Наличие корневого давления позволяет говорить о нижнем концевом двигателе водного тока. Передвижение воды по растению Вода, поглощенная клетками корня, под влиянием разности водных потенциалов, которые возникают благодаря транспирации, а также силе корневого давления, передвигается до проводящих путей ксилем. В 1932 г. немецкий физиолог Мюнх развил представление о существовании в корневой системе двух относительно не зависимых друг от друга объемов, по которым передвигается вода, - апопласта и симпласта. Апопласт – это свободное пространство корня, в которое входят межклетные промежутки, оболочки клеток, а также сосуды ксилемы. Симпласт – это совокупность протопластов всех клеток, отграниченных полупроницаемой мембраной. Благодаря многочисленным плазмодесмам, соединяющим между собой протопласт отдельных клеток, симпласт представляет единую систему. Апопласт, по-видимому, не непрерывен, а разделен на два объема. Первая часть апопласта расположена в коре корня до клеток эндодермы, вторая – по другую сторону клеток эндодермы, и включает в себя сосуды ксилемы. Клетки эндодермы благодаря пояскам Каспари представляют как бы барьер для передвижения воды по свободному пространству. Для того чтоб попасть в сосуды ксилемы, вода должна пройти через полупроницаемую мембрану и главным образом по апопласту и лишь частично по симпласту. Однако в клетках эндодермы передвижение воды идет, по-видимому, по симпласту. Далее вода поступает в сосуды ксилемы. Затем передвижение воды идет по сосудистой системе корня, стебля и листа. Из сосудов стебля вода движется через черешок или листовое влагалище в лист. В листовой пластинке водопроводящие сосуды расположены в жилках. Жилки, постепенно разветвляясь, становятся более мелкими. Чем гуще сеть жилок, тем меньшее сопротивление встречает вода при передвижении к клеткам мезофилла листа. Вся вода в клетке находится в равновесном состоянии. Вода передвигается от клетки к клетке благодаря градиенту сосущей силы.
Особенности водного обмена у растений различных экологических групп. Физиологические основы орошаемого земледелия
Растения, обитающие в воде - гидратофиты или гидрофиты, погружены в воду полностью или частично. Они регулируют постоянство состава внутренней среды с помощью механизмов защиты от избыточного поступления воды. Первичными гидрофитами являются водоросли. Водные цветковые растения - это вторичные гидрофиты, происходящие от наземных форм.
По способности приспосабливать водный обмен к колебаниям водоснабжения различают две группы наземных растений: пойкилогидрические и гомойгидрические.
Пойкилогидрические организмы (бактерии, синезеленые водоросли, низшие зеленые водоросли, грибы, лишайники и другие) приспособились переносить значительный недостаток воды без потери жизнеспособности. При этом у них снижается интенсивность обмена веществ, клетки равномерно сжимаются. Протопласт их клеток при сильном обезвоживании переходит в состояние геля. Увеличение количества воды в среде приводит к возобновлению активного метаболизма в клетках. По характеру изменения таких показателей водного режима, как интенсивность транспирации, осмотическое давление, содержание воды в течение суток они относятся к гидролабильным растениям, так как у них значительно изменяются содержание воды и испарение.
Гомойгидрические растения (наземные папоротникообразные, голосеменные, цветковые) составляют большинство обитателей суши. Они обладают механизмами регуляции устьичной транспирации, а также корневой системой, обеспечивающей доставку воды. Поэтому даже при значительных изменениях влажности среды у этих растений не наблюдается резких колебаний содержания воды в клетках, в которых, как правило, развита вакуолярная система. Их клетки не способны к обратимому высыханию. У этих растений гидростабильный тип водного режима. Стабилизации водного режима у многих видов растений способствуют запасы воды в корнях, стеблях и запасающих органах. Гомойгидрические растения делятся на три экологические группы:
1. Гигрофиты (тонколистные папоротники, некоторые фиалки и другие), произрастающие в условиях повышенной влажности и недостаточной освещенности. Теневыносливые гигрофиты, с почти всегда открытыми устьицами, имеют гидатоды, через которые выделяют избыток воды в капельножидком состоянии. Гигрофиты плохо переносят почвенную и воздушную засуху.
2. Мезофиты (лиственные деревья, лесные и луговые травы, большинство культурных растений) обитают в среде со средним уровнем обеспеченности водой и не имеют ясно выраженных приспособлений к избытку или недостатку воды.
3. Ксерофиты живут в местах с жарким и сухим климатом и приспособлены к перенесению атмосферной и почвенной засухи.
Если годовые осадки превышают годовое испарение, то говорят о гумидной зоне, в обратном случае об аридной. Многие с/х районы расположены в аридной зоне, где земледелие возможно только благодаря искусственному орошению. Орошение — это искусственное увлажнение почвы для получения высоких и устойчивых урожаев сельскохозяйственных культур. Для подачи воды на поля строят оросительные системы.
Увлажнительное орошение создает в почве нужный водный и воздушный режимы. Оно нужно везде, где растения не обеспечены требуемым количеством воды в течение всего вегетационного периода или его части. Этот вид орошения является основным в России и других странах. Удобрительное орошение применяют для внесения удобрения в почву с помощью воды, которая, являясь растворителем удобрений, транспортирует их в увлажняемый слой почвы
Разработаны методы определения сроков полива исходя из состояния растения: уровня оводненности листьев, их осмотического давления, степени отверстности устьиц и способности выделять пасоку. Наибольшее распространение получил метод определения сосущей силы листьев, коррелирующийся с тем состоянием водного режима растений, которое еще не вызывает нарушений обмена веществ, и проведенный вовремя полив обычно приводит к повышению урожая.
ФОТОСИНТЕЗ
История развития учения о фотосинтезе до работ К. А. Тимирязева
Анг ботаник и химик С.Гейлс в своей книге Статика растений 1727 г высказал предположение что растения большую часть пищи получают из воздуха. Также он вслед за Ньютоном полагал, что свет облагораживает эту пищу. Сходные мысли были и у Ломоносова(Слово о явлениях воздушных 1753). Так возникла теория о воздушном питании растений. Первые опыты по фотосинтезу были проведены Джозефом Пристли в 1770—1780-х годах, когда он обратил внимание на «порчу» воздуха в герметичном сосуде горящей свечой (воздух переставал быть способен поддерживать горение, помещённые в него животные задыхались) и «исправление» его растениями. Пристли сделал вывод, что растения выделяют кислород, который необходим для дыхания и горения, однако не заметил, что для этого растениям нужен свет. Это показал вскоре Ян Ингенхауз. Позже было установлено, что помимо выделения кислорода растения поглощают углекислый газ и при участии воды синтезируют на свету органическое вещество. В 1842 г. Роберт Майер на основании закона сохранения энергии постулировал, что растения преобразуют энергию солнечного света в энергию химических связей. Хлорофиллы были впервые выделены в 1818 г. П. Ж. Пельтье и Ж. Кавенту. Разделить пигменты и изучить их по отдельности удалось М. С. Цвету с помощью созданного им метода хроматографии. Сенебье в 1782 гду установил, что растения поглощают углекислый газ. Швейцарский ученый Т .Соссюр в 1804 применив метод количественного анализа показал, что на свету растения поглощают углекислый газ и выделяют кислород, но необходима еще и вода. В 1865 немецкий физиолог растений Сакс установил, что на свету образуется крахмал, который находится в хлоропластах (Проба Сакса: лист, картон, йод, спирт)
Работы К. А. Тимирязева
К. А. Тимирязев исследовал зависимость фотосинтеза от интенсивности света и его спектрального состава и при этом установил, что из углекислого газа, находящегося в воздухе, растения ассимилируют углерод за счет энергии солнечного света. Им было экспериментально подтверждено, что в красных и синих лучах, которые наиболее полно поглощаются хлорофиллом, процессы проходят эффективнее. Именно Тимирязеву принадлежит идея, что хлорофилл как физически, так и химически принимает участие в процессе фотосинтеза. Далее он развил свою теорию и опубликовал работу «Зависимость усвоения углерода от интенсивности света» в 1889 году. По сути, ученый на практике доказал, что процесс фотосинтеза подчиняется закону сохранения энергии и первому закону фотохимии. В 1903 году в Лондонском королевском обществе Тимирязев прочитал лекцию под названием «Космическая роль растения», где обобщил собственные исследования в течение многих лет в области фотосинтеза. В ней он привел доказательства того, что фотосинтез, осуществляемый зелеными растениями, является первоисточником органического вещества и энергии, без которых жизнедеятельность растений невозможна. Это открытие стало крупнейшим вкладом в мировое учение о неразрывной связи и единстве живой и неживой материи, которая участвует у непрерывном круговороте как веществ, так и энергии на нашей планете. В 1867 году Тимирязев заведовал опытным полем, которое было организованно на средства Вольного экономического общества и располагалось в селе Реньевке Симбирской губернии. Там проводились испытания по применению минеральных удобрений и фиксировались их воздействия на урожай.
Масштабы и значения фотосинтеза для биосферы
Накопление органической массы: В процессе фотосинтеза растения образуют 100-172 млрд т, а растения морей и океанов 60-70 млрд т биомассы в год. Общая масса растений на Земле в настоящее время составляет 2402,7 млрд т. За время существования жизни на Земле органические остатки растений и животных накапливались и модифицировались. На суше эти органические вещества представлены в виде гумуса, торфа, подстилки.
Обеспечение постоянства содержания углекислого газа в атмосфере: связывание СО2 в ходе фотосинтеза и образование карбонатов компенсируется выделением СО2 за счет других процессов. Фотосинтез с одной стороны, дыхание организмов и карбонатная система океана с другой поддерживают относительно постоянный уровень СО2 в атмосфере.
Парниковый эффект: диоксид углерода в атмосфере, а также вода поглощают инфракрасное излучение и таким образом сохраняют значительное содержание теплоты на Земле. Микроорганизмы и растения в процессе дыхания и брожения поставляют около 85% общего количества СО2 поступающего ежегодно в атмосферу, и вследствие этого оказывают влиние на тепловой режим нашей планеты
Выделение молекулярного кислорода: фотосинтезирующие организмы, а через их посредство и вся живая природа, получили доступ практически к неиссякаемому возобновленному источнику электронов, участвующих во всех биоэнергетических процессах
Озоновый слой: В результате фотосинтеза в атмосфере стало появляться все больше и больше кислорода и вокруг планеты образовался озоновый экран, ставший надежно защитой организмов от губительной УФ радиации солнца
Таким образом фотосинтез стал мощным поставщиком энергии в биосферу, революционным образом обогатил биоэнергетику благодаря включению кислорода в метаболизм живых организмов, защитил живую материю от гибельного действия космической радиации. Все это индуцировало мощное развитие биологической материи на Земле, приведшее в конечном счете к появлению человека.
Экологический этап в развитие учения о фотосинтезе. Водное происхождение кислорода фотосинтеза. Доказательства существования световой и темновой фаз фотосинтеза
Водное происхождение кислорода:Еще перед войной исследованием изотопного состава кисло рода разного происхождения занялись два советских ученых – А.П. Виноградов (впоследствии академик) и Р.В. Тейс. Они выяснили, что кислород морской воды легче кислорода воздуха, а тот в свою очередь легче кислорода углекислоты. В этой же работе впервые была установлена тождественность водного и фотосинтетического кислорода (по изотопному составу). Но на вопрос о трех лишних процентах ответа не было.К исследованиям, прерванным Великой Отечественной войной, Виноградов и Тейс вернулись лишь в 1946...1947 гг. и, казалось, сумели вскоре объяснить эффект Дола. Их расчеты и опыты показали, что легкий изотоп кислорода 16О вступает в реакции немного легче, чем тяжелый, и потому атмосфера постепенно обогащается изотопом 18О. Трехпроцентный избыток соответствует точке равновесия. Главные создатели эффекта Дола – водоросли и микрофлора мирового океана, которые, кстати, регенерируют большую часть атмосферного кислорода.
Доказательства сущ-я двух фаз фотосинтеза: Уравнение ван Ниля включает две группы реакций, причем одна связана с фотодиссоциацией воды, а другая, не зависящая от света, — с восстановлением С02 до углевода:
Группа американских ученых, возглавляемая С. Рубеном и М. Каменом, одновременно проводила опыты с водорослями. В одной камере, куда помещались водоросли, вода содержала тяжелый изотоп кислорода (H2lsO), а кислород С02 не метился. Во второй камере, наоборот, использовался меченый С02 (С1802), а в состав воды входил обычный кислород. При освещении водорослей в этих камерах 1802 выделялся в значительно большем количестве, если метка была у кислорода воды.
Доказательства существования световой и темновой фаз фотосинтеза. Уравнение ван Ниля включает две группы реакций, причем одна связана с фотодиссоциацией воды, а другая, не зависящая от света, — с восстановлением С02 до углевода: Первую реакцию можно назвать световой, вторую — темновой.
Экспериментальные доказательства реального существования этих двух фаз фотосинтеза были получены в опытах с мигающим светом, которые ставились следующим образом. Между источником света и растением помещали непрозрачный вращающийся диск с вырезанным сектором. Изменяя скорость вращения диска и величину вырезанного сектора, создавали различную длительность и соотношение светового и темнового периодов. Были использованы и другие способы импульсного освещения. Определялась интенсивность фотосинтеза листьев или суспензии клеток хлореллы. Опыты с мигающим светом, проведенные в России (А. А. Рихтер, 1914) и в США (Р. Эмерсон и У. Арнольд, 1932, 1941), показали, что максимальная интенсивность фотосинтеза наблюдается не при непрерывном, а при импульсном освещении (пересчет сделан на время освещения) и особенно в тех случаях, когда продолжительность темновых промежутков составляла 0,04 — 0,06 с (при 25 °С). Оптимальное время световой вспышки оказалось порядка 105 с. Большая эффективность импульсного света доказывает наличие темновых реакций в фотосинтезе, так как темновые (энзиматические) процессы осуществляются более медленно, чем фотохимические.
Другим доказательством существования темновой фазы фотосинтеза является величина его температурного коэффициента Q ю, показывающего, во сколько раз увеличивается скорость реакции при повышении температуры на 10 °С. Для химических, в том числе энзиматических процессов, Q10 составляет от 2 до 4, для фотохимических, не зависящих от температуры,— он близок к единице.
Хлорофиллы синтеза при 15 и 25 °С величина Ql0 равна 2,0-2,5. Следовательно, интенсивность фотосинтеза определяется скоростью его химических (темновых) реакций.
Окончательно вопрос о двухэтапности процесса фотосинтеза был решен американским физиологом и биохимиком растений Д. И. Арноном. В 1954 г. в его лаборатории было показано, что выделенные из листьев шпината хлоропласты под действием света способны восстанавливать NADP+ и фосфорили-ровать ADP: хлоропласты причем эти процессы осуществляются в тилакоидах хлоропластов.
Пигментные системы фотосинтезирующих организмов. Хлорофиллы: строение, спектральные свойства, функции, биосинтез. Электронно-возбужденное состояние пигментов
Пигменты — важнейший компонент аппарата фотосинтеза. Изучение растительных пигментов резко ускорилось благодаря работам русского физиолога растений М. С. Цвета. Пытаясь найти способ разделения пигментов на индивидуальные вещества, Цвет в 1901 — 1903 гг. открыл принципиально новый метод, который он назвал адсорбционной хроматографией. Через колонку с сорбентом пропускается растворитель с растворенными веществами. Так как вещества различаются по степени адсорбции, они перемещаются по колонке с разной скоростью. В результате происходит разделение веществ.
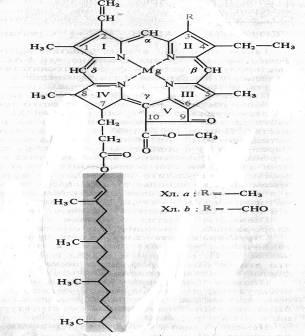
Польские биохимики М. Ненцкий и Л. Мархлевский (1897) обнаружили, что основу молекулы хлорофилла, как и гема гемоглобина, составляет порфириновое кольцо. Таким образом было показано принципиальное структурное сходство этих пигментов у растений и животных.
Немецкий химик Р. Вильштеттер в 1906—1914 гг. установил элементарный состав хлорофилла а — C55H72O5N4Mg и хлорофилла b — C55H70O6N4Mg. Хлорофилл — сложный эфир дикарбоновой кислоты хлорофиллина, у которой одна карбоксильная группа этерифицирована остатком метилового спирта, а другая остатком одноатомного непредельного спирта фитола.
Четыре пиррольных кольца (I — IV) соединены между собой метановыми мостиками, образуя порфириновое ядро. Наружные атомы углерода в тетрапиррольном цикле обозначены цифрами 1 — 10. Атомы азота пиррольных колец четырьмя координационными связями взаимодействуют с атомом магния. В структуре порфиринового ядра есть также циклопентановое кольцо (V), образованное остатком кетопропионовой кислоты и содержащее химически активную карбонильную группу у С9 и метилированную карбоксильную группу у С10. Структура, состоящая из тетрапиррольного и циклопентанового колец, получила название форбина. Боковая цепь IV пиррольного кольца включает в себя пропионовую кислоту, связанную сложноэфирной связью с полиизопреновым непредельным спиртом фитолом (С20Н39ОН). У 1, 3, 5 и 8-го углеродов пиррольных колец имеются метальные группы, у 2-го — винильная, у 4-го — этильная группа. Порфириновое кольцо представляет собой систему из девяти пар конъюгированных (сопряженных) чередующихся двойных и одинарных связей с 18 делокализованными p-электронами. Хлорофилл b отличается от хлорофилла а тем, что у 3-го углерода вместо метильной находится формильная (—СНО) группа. Структура хлорофилла, лишенная фитола, называется хлорофиллидом. При замещении атома магния протонами в молекуле хлорофиллов образуются соответствующие феофетины. Все фотосинтезирующие растения, включая все группы водорослей, а также цианобактерии, содержат хлорофиллы группы а. Хлорофилл b представлен у высших растений, у зеленых водорослей и эвгленовых. У бурых и диатомовых водорослей вместо хлорофилла b присутствует хлорофилл c, а у многих красных водорослей — хлорофилл d.
Биосинтез хлорофиллов. Первый этап биосинтеза хлорофиллов у растений — образование 5-аминолевулиновой кислоты (А Л К) из С5-дикарбоновых кислот. Показано, что глутаминовая кислота через 2-гидроксиглутаровую превращается в 4,5-диоксовалериановую, которая затем аминируется за счет аланина или других аминокислот (рис. 5.2). Реакция переаминирования катализируется АЛК-трансаминазой с участием пиридоксальфосфата в качестве кофермента. Для синтеза АЛК может использоваться и оскетоглутаровая (2-оксоглутаровая) кислота. Циклизация двух молекул АЛК приводит к образованию пиррольного соединения — порфобилиногена. Из четырех пиррольных колец формируется уропорфириноген, который превращается в протопорфирин IX. Дальнейший путь превращений протопорфирина может быть различным. С участием железа формируется гем, входящий в состав цитохромов, каталазы, пероксидазы и гемоглобина. Если молекулу протопорфирина включается магний, затем карбоксильная группа у С10 этерифицируется метильной группой 6-аденозил-b-метионина и замыкается циклопентановое кольцо (К), то образуется протохлорофиллид. Под действием света в течение нескольких секунд протохлорофиллид превращается в хлорофиллид а в результате гидрирования двойной связи у С7 — С8 в IV пиррольном ядре. У низших растений и некоторых голосеменных (у хвойных) хлорофиллид может образовываться в темноте. Хлорофиллид обладает теми же спектральными свойствами, что и хлорофилл. Последний этап в формировании молекулы хлорофилла а — этерификация фитолом, который, как и все полиизопреновые соединения, синтезируется из ацетил-KоА через мевалоновую кислоту. По данным А. А. Шлыка (1965), хлорофилл b может образовываться из вновь синтезированных молекул хлорофилла а.
Растворы хлорофиллов в полярных растворителях обладают яркой флуоресценцией (люминесценцией). В этиловом эфире у хлорофилла а наблюдается рубиново-красная флуоресценция с максимумом 668 нм, у хлорофилла b — 648 нм
Наиболее устойчивы те состояния атомов и молекул, в которых валентные электроны занимают самые низкие энергетические уровни и распределены по ним согласно принципу Паули (не более двух электронов с антипараллельными спинами на каждой орбитали). Такое состояние молекулы называют основным синглетным (S0) энергетическим состоянием. Суммарный спин (вектор магнитных моментов) всех электронов молекулы в этом случае равен нулю. Когда молекула поглощает квант света, то за счет этой энергии электрон переходит на более высокие вакантные орбитали. Если у возбужденного электрона сохраняется то же направление спина, то молекула находится в синглетном возбужденном состоянии (S*). Если при переходе на более высокую орбиталь спин электрона обращается, то такое возбуждение называется триплетным (T*). Прямой переход из основного состояния в триплетное — маловероятное событие, так как для этого необходимо обращение ориентации спина. Переходу молекулы из основного состояния в возбужденное, происходящему при поглощении кванта света, соответствует полоса в спектре поглощения.
Поглощение молекулой хлорофилла кванта красного света приводит к синглетному электронвозбужденному состоянию — S*1.
При поглощении кванта синего света с более высоким уровнем энергии электрон переходит на более высокую орбиту (S*2). Возбужденная молекула хлорофилла возвращается в основное состояние различными путями. Отдав часть энергии в виде теплоты (особенно с уровня S*1), молекула может излучить квант света с большей длиной волны (правило Стокса), что проявляется в виде флуоресценции. Хлорофилл а поглощает свет в красной и синей областях спектра, но флуоресцирует лишь в красной. Время жизни синглетного возбужденного состояния 10-13 10-9с.
Другой путь потери энергии состоит в переходе молекулы из синглетного возбужденного состояния в метастабильное триплетное (с обращением спина). Этот переход безизлучательный, т. е. энергия теряется в виде теплоты. Триплетное возбужденное состояние имеет гораздо большее время жизни (>10-4 с). Из триплетного состояния молекула может вернуться в основное, излучив еще более длинноволновый (чём в случае флуоресценции) квант света. Это обычно более слабое свечение и есть фосфоресценция.
Энергия возбужденного состояния может быть использована на фотохимические реакции. В этом случае флуоресценции и фосфоресценции хлорофилла не наблюдается.
Молекула хлорофилла способна выполнять три важнейшие функции: 1) избирательно поглощать энергию света, 2) запасать ее в виде энергии электронного возбуждения, 3) фотохимически преобразовывать энергию возбужденного состояния в химическую энергию первичных фотовосстановленных и фотоокисленных соединений.
Каротиноиды и фикобиллины: распространение, строение, спектральные свойства, функции. Явление хроматической адаптации
Каротиноиды — жирорастворимые пигменты желтого, оранжевого, красного цвета — присутствуют в хлоропластах всех растений. Они входят также в состав хромопластов в незеленых частях растений, например в корнеплодах моркови. В зеленых листьях каротиноиды обычно незаметны из-за присутствия хлорофилла, но осенью, когда хлорофилл разрушается, именно каротиноиды придают листьям характерную желтую и оранжевую окраску. К каротиноидам относятся три группы соединений: 1) оранжевые или красные пигменты каротины (С40Н56); 2) желтые ксантофиллы (С40H56O2 и С40H51O4);
3) каротиноидные кислоты — продукты окисления каротиноидов с укороченной цепочкой и карбоксильными группами (например, C20H24O2— кроцетин, имеющий две карбоксильные группы).
Все каротиноиды — полиеновые соединения. Каротиноиды первых двух групп состоят из восьми остатков изопрена, которые образуют цепь конъюгированных двойных связей. Каротиноиды могут быть ациклическими (алифатическими), моно- и бициклическими. Циклы на концах молекул каротиноидов являются производными ионона.

Примером ациклического каротиноида может служить ликопин (С40Н56) — основной каротин некоторых плодов (в частности, томатов) и пурпурных бактерий. Каротин имеет два β-иононовых кольца (двойная связь между С5 и С6). При гидролизе β-каротина по центральной двойной связи образуются две молекулы витамина А (ретинола). α-каротин отличается от β-каротина тем, что у него одно кольцо β-иононовое, а второе — £-иононовое (двойная связь между С4 и С5).
Основные каротиноиды пластид высших растений и водорослей — Β-каротин, лютеин, виолаксантин и неоксантин. Каротиноиды, как и хлорофиллы, нековалентно связаны с белками и липидами фотосинтетических мембран.
Каротиноиды — обязательные компоненты пигментных систем всех фотосинтезирующих организмов. Они выполняют ряд функций, главные из которых: 1) участие в поглощении света в качестве дополнительных пигментов, 2) защита молекул хлорофиллов от необратимого фотоокисления. Возможно, каротиноиды принимают участие в кислородном обмене при фотосинтезе. Важное значение каротиноидов как дополнительных пигментов, поглощающих свет в синефиолетовой и синей частях спектра.
Максимум радиации приходится на сине-голубую и зеленую части спектра (480 — 530 нм). В естественных условиях доходящая до поверхности Земли суммарная радиация слагается из потока прямой солнечной радиации на горизонтальную поверхность и рассеянной радиации неба.
Каротиноиды обусловливают цвет лепестков и плодов у некоторых растений Производные каротиноидов — витамин А, ксантоксин, действующий подобно АБК, и другие биологически активные соединения. Хромопротеин родопсин, обнаруженный у некоторых галофильных бактерий, поглощая свет, функционирует в качестве Н+-помпы. Хромофорной группой бактериородопсина является ретиналь — альдегидная форма витамина А. Бактериородопсин аналогичен родопсину зрительных анализаторов животных.
Фикобилины. Их структура, функции и физиологическая роль
Синезеленые водоросли (цианобактерии), красные морские водоросли и некоторые морские криптомонады помимо хлорофилла а и каротиноидов содержат пигменты фикобилины. Наиболее известные представители фикобилинов — фикоэритробилины и фикоцианобилины. Первые преобладают у красных водорослей и определяют их цвет, вторые — у синезеленых.
По структуре фикобилины относятся к группе желчных пигментов — билинов (у животных представитель этой группы — билирубин). Это тетрапирролы с открытой цепью, имеющие систему конъюгированных двойных и одинарных связей. В своем составе они не содержат атомов магния или других металлов, а также фитола.
У фикоцианобилина пиррольные кольца соединены между собой метиновыми мостиками. I и IV пирролы имеют по одной карбонильной группе. Пиррольные кольца содержат следующие боковые радикалы: четыре метильных (у C1,3,6,7), винильную (у С2), этильную (у С8) и два остатка пропионовой кислоты (у С4 и С5).

Фикобилины являются хромофорными группами фикобилипротеинов — глобулиновых белков, с которыми в отличие от хлорофиллов они связаны прочными ковалентными связями. Фикобилипротеины делятся на три основные группы; 1) фикоэритрины — белки красного цвета с максимумом поглощения от 498 до 568 нм, 2) фикоцианины — сине-голубые белки с максимумами поглощения от 585 до 630 нм, 3) аллофикоцианины — синие белки с максимумами поглощения от 585 до 650 нм. Все эти хромопротеины обладают флуоресценцией с максимумами 575 — 578, 635 — 647 и 660 нм соответственно.
Фикобилипротеины водорастворимы, в клетках водорослей они локализованы в фикообилисомах — гранулах, расположенных на наружной поверхности фотосинтетических ламелл.
Значение фикобилинов. Максимумы поглощения света у фикобилинов находятся между двумя максимумами поглощения у хлорофилла: в оранжевой, желтой и зеленой частях спектра. Вода, поглощает длинноволновые лучи. На глубине 34 м в морях и океанах полностью исчезают красные лучи, на глубине 177 м — желтые, на глубине 322 м — зеленые и, наконец, на глубину свыше 500 м не проникают даже синие и фиолетовые лучи. В связи с таким изменением качественного состава света в верхних слоях морей и океанов обитают преимущественно зеленые водоросли, глубже — сине-зеленые и еще глубже — водоросли с красной окраской. В. Т. Энгельман назвал это явление хроматической комплементарной адаптацией водорослей. По его наблюдениям (1881 — 1884), наиболее интенсивная ассимиляция С02 у водорослей с различной окраской соответствует максимумам поглощения света пигментными системами этих водорослей. В настоящее время известно, что изменения цвета клеток связаны с изменениями в синтезе фикобилинов, принимающих участие в процессе фотосинтеза. Таким образом, у водорослей фикобилины — дополнительные пигменты, выполняющие вместо хлорофилла b функции светособирающего комплекса. Около 90% энергии света, поглощенного фикобилинами, передается на хлорофиллы а.
Две пигментные системы (ФС1, ФС2): состав, функции, локализация. Фотосинтетическая единица. Реакционный центр.
На световой фазе фотосинтеза происходит поглощение света молекулами хлорофилла а с участием дополнительных пигментов (хлорофилла b, каротиноидов, фикобилинов) и трансформация энергии света в химическую энергию АТФ и восстановленного НАДФ. Все эти процессы осуществляются в фотохимически активных мембранах хлоропластов и представляют собой сложную систему фотофизических, фотохимических и химических реакций. В состав ламелл хлоропластов входят пять многокомпонентных белковых комплексов: светособирающий комплекс, фотосистемы I и II, цитохромный комплекс, включающий цитохромы b6 и f5 и АТФазный комплекс, участвующий в синтезе АТФ. Все они функционируют, взаимодействуя друг с другом.
В состав ФС I в качестве реакционного центра входит димер пигмента П700 (хлорофилл а с максимумом поглощения 700 нм), а также хлорофиллы а675-695, играющие роль антенного компонента фотосистемы I. Первичным акцептором электронов в этой системе является мономерная форма хлорофилла а695 (Ах), вторичными акцепторами — А2 и Ав (железосерные белки — FeS). Комплекс ФС I под действием света восстанавливает водорастворимый FeS-белок ферредоксин (Фд) и окисляет медьсодержащий водорастворимый белок пластоцианин (Пц).
Белковый комплекс ФС II включает в себя реакционный центр содержащий хлорофилл а П680, а также антенные пигменты — хлорофиллы a670-673. Первичным акцептором электронов в этой фотосистеме выступает феофетин а (Фф), передающий электроны на первичный пластохинон, ассоциированный с FeS (QA) и дальше на вторичный пластохинон (Qb). В состав ФС II входят также белковый комплекс S-системы, окисляющий воду, и переносчик электронов Z, связанный с системой S и служащий донором е для П680. Этот комплекс функционирует с участием марганца, хлора и кальция. В ФС II локализован цитохром b559. ФС II восстанавливает пластохинон (PQ) и окисляет воду с выделением 02 и протонов.
Связующим звеном между ФС II и ФС I служат пул (фонд) пластохинонов, белковый цитохромный комплекс b6 — f5 и пластоцианин.
В ходе эволюции ФС I возникла раньше. Она функционирует у ныне существующих фотосинтезирующих бактерий, фотосинтез которых осуществляется без разложения воды и выделения 02 (фоторедукция). В этом случае функцию доноров электронов для световой фазы фотосинтеза выполняют легко окисляемые соединения, такие, как H2S, Н2, СН4 и др.
Антенный белковый комплекс ФС II содержит 40 молекул хлорофиллов а с максимумами поглощения 670 — 683 нм на один П680 и β-каротин.
Антенный белковый комплекс ФС I состоит из хромопротеинов, содержащих 110 молекул хлорофиллов а с максимумами поглощения 680 — 695 нм на один П700, из них 60 молекул — компоненты антенного комплекса самой фотосистемы, а 50 входят в состав комплекса, который можно рассматривать как ССК ФС I. Антенный комплекс ФС I также содержит β-каротин.
В антенных комплексах перенос энергии осуществляется в ряду: каротин (400-550 нм)--► хлорофилл b (650 нм)--►хлорофиллы a (660-675 нм)---► П680 (ФС II). Скорость резонансного переноса энергии от молекулы к молекуле 10-10 — 10-9 с, причем эффективность переноса между молекулами хлорофилла достигает 100, а между молекулами каротина и хлорофилла — лишь 40%.
Реакционные центры. Белки, содержащие длинноволновые формы хлорофиллов (П680 в ФС II и П700 в ФС I) в количестве одна молекула на 200 — 400 молекул других хлорофиллов и способные к первичному фотохимическому разделению зарядов, называют реакционными центрами.
ЭТЦ фотосинтеза: циклический и нециклический транспорт электронов (световая стадия фотосинтеза)
Для восстановления одной молекулы NADP+ в процессе фотосинтеза необходимы два электрона и два протона, причем донором электронов является вода. Фотоиндуцированное окисление воды осуществляет ФС II, восстановление NADP+ — фотосистема I. Следовательно, эти две фотосистемы должны функционировать во взаимодействии.
В ФС II димер П680, поглотив энергию, эквивалентную 2 квантам коротковолнового красного света, и перейдя в синглетное возбужденное состояние, отдает 2 электрона феофетину (Фф). От Фф электроны, теряя энергию, последовательно передаются на пластохиноны ФС 11 - QA и QB, на пул липидорастворимых молекул пластохинона (PQ), переносящих через липидную фазу мембраны электроны и протоны, на железосерный белок FeSK и цитохром цитохромного комплекса b6 — f, восстанавливая Cu-содержащий белок пластоцианин (Пц).
Вакантные места («дырки») в Пб80 заполняются двумя электронами из содержащего Мп переносчика электронов Z, который в свою очередь восстанавливается с участием системы S. Окисленный белковый комплекс S связывает воду и восстанавливается за счет электронов воды. Для осуществления этой реакции в белковом комплексе S необходимы Мп и С1-, а также Са2 + .
Однако описанная цепь реакций резко замедляется, если не возбуждена ФС I, так как в этом случае весь Пц переходит в восстановленное состояние. При возбуждении П700 в реакционном центре ФС I энергией, эквивалентной 2 квантам длинноволнового красного света, 2 электрона захватываются мономерной формой хлорофилла a (A1) и затем последовательно передаются переносчикам электронов А2 и Ав (железосерные белки FeS), ферредоксину (водорастворимый FeS-белок) и ферредоксин: NADP-оксидоредуктазе с FAD в качестве кофактора. Наконец, редуктаза восстанавливает NADP + .
На вакантные места в П700+ переходят электроны с Пц, и нециклическая цепь переноса электронов таким образом замыкается. Z-схема убедительно объясняет «эффект усиления Эмерсона», так как только при совместном использовании коротковолновых (ФС II) и длинноволновых (ФС I) лучей красного света интенсивность фотосинтеза будет оптимальной.
Энергия, освобождающаяся при движении электронов от П680 до П700, используется для синтеза АТФ из AДФ и неорганического фосфата (фотофосфорилирование).
Наряду с нециклическим в мембранах хлоропластов функционирует циклический транспорт электронов, включающий в себя только ФС I и комплекс цитохромов Ь6 — f. В этом случае возбужденные молекулы П700 последовательно отдают электроны на А1, А2, АB, Фд, PQ, цитохром b6, FeSR, цитохром f, Пц и, наконец, П700. При этом НAДФ+ не восстанавливается. Освобождающаяся энергия используется для фосфорилирования AДP.
Фотофосфорилирование: циклическое и нециклическое. Хемиосмотическая теория энергетического сопряжения Митчелла
Сущность хемиосмотической теории:
Энергия окислительно-восстановительных процессов первично запасается в системе в форме электрохимического градиента протонов (ΔμН)
Необходимо функционирование сопрягающей мембраны, непроницаемой для протонов. В мембране определенным образом ориентированы переносчики электронов и протонов благодаря чему достигается векторный трансмембранный перенос электронов и протонов
Преобразование энергии электрохимического градиента протонов в энергию АТФ осуществляет фермент АТФ-синтаза
На внутренней стороне мембраны тилакоида под действием света возбуждаются П680 и П700. Электроны от П680 захватываются акцепторами е- на наружной стороне и передаются на окисленную форму пластохинона (PQ) — липидорастворимого переносчика протонов и электронов, выполняющего функцию челнока. Принимая два электрона, 2PQ диффундируют к цитохромному комплексу и захватывают из стромы 2Н + . Электроны с 2PQH2 поступают в цепь: F.eSR -> цит. f -> Пц,-> П700, а ионы Н + попадают в полость тилакоида. Вторая пара ионов Н+ освобождается там же при фотоокислении воды. В ФС I электроны П700 захватываются акцептором А, передаются ферредоксину и затем НAДФ+ на наружной стороне мембраны, причем 1Н+ используется на восстановление НAДФ.
Таким образом, из среды, окружающей тилакоид, при поглощении пигментами квантов света исчезают, а во внутренней полости тилакоида появляются протоны. В результате на мембране возникает электрохимический потенциал ионов Н + , который затем используется для фосфорилирования AДФ. Этот процесс называется нециклическим фотофосфорилированием.
При циклическом фотофосфорилировании, когда функционирует только ФС I, электроны от Фд поступают на цитохромный комплекс с использованием пула PQ, который действует как переносчик электронов и протонов. Затем электроны через цитохром f и Пц возвращаются на основной энергетический уровень в П700, а протоны поступают в полость тилакоида
Темновая фаза фотосинтеза: химизм реакций цикла Кальвина-Бенсона
В результате фотохимических реакций в хлоропластах создается необходимый уровень АТР и NADPH. Эти конечные продукты световой фазы фотосинтеза стоят на входе в темновую фазу, где С02 восстанавливается до углевода.
Химизм реакции цикла Кальвина
Этот способ ассимиляции С02, присущий всем растениям. Фотосинтезирующие водоросли помещали в среду, содержащую 14С02, на разные промежутки времени, затем клетки быстро фиксировали, экстрагировали из них спирторастворимые вещества и определяли содержание 14С в различных соединениях после их разделения с помощью хроматографии.
Оказалось, что после экспозиции в течение 1 мин 14С включался в С3 —С7-сахара и фосфосахара, в органические кислоты (яблочную, щавелевоуксусную, ФЕП), в аминокислоты (аланин, аспарагиновую кислоту). Если же время экспозиции было сокращено до 0,1—2 с, то большая часть метки обнаруживалась в фосфоглицериновой кислоте, в ее карбоксильной группе.
Следовательно, 3-фосфоглицериновая кислота (ФГК) является первичным продуктом фотосинтеза.
Природа первичного акцептора С02. Сначала предположили, что таким акцептором является какое-либо двухуглеродное соединение. Однако введение в инкубационную среду винилфосфата, фосфогликольальдегида и других веществ с С2 не приводило к увеличению содержания радиоактивной метки из С02 в ФГК. Тогда схему опыта видоизменили следующим образом. Водоросли экспонировали на свету при высокой (1 %-ной) концентрации С02, затем резко снижали его концентрацию до 0,003%. Расчет был на то, что в условиях дефицита С02 быстро накопится именно то соединение, которое служит акцептором С02. С помощью двумерной хроматографии удалось установить, что при отсутствии возможности карбоксилирования в клетках кратковременно возрастает концентрация рибулозо-1,5-дифосфата (рибулозо-1,5-бисфосфата). Отсюда возникло предположение, что первичная фиксация С02 происходит следующим образом : С5 + С02-> С6-► 2С3. Для проверки этой гипотезы в бесклеточный экстракт из листьев шпината или клеток хлореллы вносили меченный по 32Р рибулозо-1,5-дифосфат. На свету в экстракте появлялась радиоактивная ФГК.
На основании полученных данных процесс первичной фиксации С02 можно записать следующим образом:

Эта реакция катализируется рибулозодифосфаткарбоксилазой (рибулозобисфосфаткарбоксилазой; другие названия — белок фракции I, карбоксидисмутаза). Максимум активности фермент имеет при рН 7,8 — 8,0 и нуждается в присутствии ионов Mg2 + .
Дальнейшая работа в лаборатории Кальвина и в других лабораториях привела к расшифровке всех последующих реакций С3-пути фотосинтеза, который получил название цикла Кальвина. Этот цикл, весьма напоминающий обращенный пентозофосфатный путь дыхания, состоит из трех этапов: карбоксилирования, восстановления и регенерации.
1. Карбоксилирование. Молекулы рибулозо-5-фосфата фосфорилируются с участием АТР и фосфорибулозокиназы, в результате чего образуются молекулы рибулозо-1,5-дифосфата, к которым в свою очередь присоединяется С02 с помощью рибулозодифосфаткарбоксилазы. Полученный продукт расщепляется на две триозы: 2 молекулы 3-фосфо-глицериновой кислоты (3-ФГК).
2. Фаза восстановления. 3-ФГК восстанавливается до 3-фосфоглицеринового альдегида (3-ФГА) в два этапа. Сначала происходит фосфорилирование 3-ФГК при участии АТФ и фосфоглицераткиназы до 1,3-дифосфоглицериновой кислоты, а затем восстановление 1,3-ФГК с помощью НАДФH и дегидрогеназы фосфоглицеринового альдегида.
3. Фаза регенерации первичного акцептора диоксида углерода и синтеза конечного продукта фотосинтеза. В результате описанных выше реакций при фиксации трех молекул С02 и образовании шести молекул восстановленных 3-фосфотриоз пять из них используются затем для регенерации рибулозо-5-фосфата, а один — для синтеза глюкозы. 3-ФГА под действием триозофосфатизомеразы изомеризуется в фосфодиоксиацетон. При участии альдолазы 3-ФГА и фосфодиоксиацетон конденсируются с образованием фруктозо-1,6-дифосфата, у которого отщепляется один фосфат с помощью фруктозо-1,6-дифосфатазы. В дальнейших реакциях, связанных с регенерацией первичного акцептора С02, последовательно принимают участие транскетолаза и альдолаза. Транскетолаза катализирует перенос содержащего два углерода гликолевого альдегида от кетозы на адьдозу:

Альдолаза затем осуществляет перенос трехуглеродного остатка фосфодиоксиацетона на альдозу, в данном случае эритрозо-4-фосфат, в результате чего синтезируется седо-гептулозо-1,7-дифосфат. Последний дефосфорилируется и под действием транскетолазы из него и 3-ФГА образуются ксилулозо-5-фосфат и рибозо-5-фосфат. Две молекулы ксилулозо-5-фосфата при участии рибулозофосфатэпимеразы и одна молекула рибозо-5-фосфата с участием рибозофосфатизомеразы превращаются в три молекулы рибулозо-5-фосфата, с которого начинается новый цикл фиксации С02.
Из оставшейся неиспользованной 6-ой молекулы 3-ФГА под действием альдолазы синтезируется (при повторении цикла) молекула фруктозо-1,6-дифосфата, из которой могут образовываться глюкоза, сахароза или крахмал:
Таким образом, для синтеза одной молекулы глюкозы в цикле Кальвина необходимы 12 NADPH и 18 АТР, которые поставляются в результате фотохимических реакций фотосинтеза.
Химизм реакций ассимиляции С₄ растений. Цикл Хетча-Слека-Карпилова. САМ-метаболизм органических кислот
В работах Л. А. Незговоровой (1956—1957 гг.), было установлено, что при коротких экспозициях листьев кукурузы на свету 14С из 14С02 обнаруживается в аспарагиновой кислоте. В дальнейших исследованиях как советских, так и зарубежных специалистов эти представления были развиты, что привело к открытию C4-nymu углерода в фотосинтезе. Так, в 1960 г. Ю. С. Карпилов, а в 1963 г. И. А. Тарчевский и Ю. С. Карпилов представили данные о раннем образовании яблочной кислоты в листьях кукурузы. Г. П. Корчак и др. впервые показали, что дикарбоновые кислоты (яблочная и аспарагиновая) являются первичными продуктами фиксации С02 у сахарного тростника. Затем эти соединения через 3-ФГК и гексозофосфаты превращаются в сахара. Как новый тип фиксации С02, принципиально отличающийся от цикла Кальвина, этот цикл впервые описали австралийские ученые М. Д. Хетч и, К. Р. Слэк (1966). К группе растений с С4-путем фотосинтеза относятся сахарный тростник, кукуруза, сорго и др. Листья этих растений содержат два разных типа хлоропластов: хлоропласты обычного вида — в клетках мезофилла и большое количество крупных хлоропластов, часто не имеющих гран, — в клетках, окружающих проводящие пучки (обкладка). С02, диффундирующий в лист через устьица, попадает в цитоплазму клеток мезофилла, где при участии ФЕП-карбоксилазы вступает в реакцию с ФЕП, образуя щавелевоуксусную кислоту (оксалоацетат). Затем уже в хлоропластах оксалоацетат восстанавливается до яблочной кислоты (малата) за счет NADPH, образующего в ходе световой фазы фотосинтеза.
Щавелевоуксусная кислота в присутствии NH4+ может превращаться также в аспартат. Затем малат (или аспартат) переносится в хлоропласты клетки обкладки сосудистого пучка, где он декарбоксилируется малик-энзимом (малатдегидрогеназой декарбоксилирующей) до пирувата и С02.
В хлоропластах обкладки отсутствуют граны, а следовательно, слабо представлена ФС II, необходимая для нециклического транспорта электронов, однако в них в изобилии накапливается крахмал. Объясняется это тем, что в хлоропластах обкладки используется поставляемый малик-энзимом НAДФH, а также тот С02, который образовался при окислительном декарбоксилировании малата (или аспартата). В этих хлоропластах в процессе циклического фотофосфорилирования синтезируется большое количество АТР и фиксация С02 осуществляется по типу цикла Кальвина. У некоторых растений с С4-путем фотосинтеза (амарант, лебеда) яблочная кислота декарбоксилируется в митохондриях клеток обкладки с восстановлением NAD.
Возникающий при расщеплении малата в хлоропластах клеток обкладки пируват перемещается назад в хлоропласты клеток мезофилла, где может снова превращаться в первичный акцептор С02 — ФЕП. Такая компартментация процессов позволяет растениям с С4-путем осуществлять фотосинтез даже при закрытых устьицах, так как хлоропласты клеток обкладки используют малат (аспартат), образовавшийся ранее, как донор С02. С4-растения могут также использовать С02, возникающий при фотодыхании. Закрывание устьичных отверстий в наиболее жаркое время дня сокращает потери воды за счет испарения (транспирации). Не удивительно поэтому, что к С4-растениям относятся многие виды засушливой тропической зоны. Растения с С4-путем фотосинтеза, как правило, устойчивы к засолению. Эффективность использования воды, т. е. отношение массы ассимилированного С02 к массе воды, израсходованной при транспирации, у С4-растений зачастую вдвое выше, чем у С3-растений. Таким образом, С4-растения имеют преимущества перед С3-растениями в засушливых местах обитания благодаря высокой интенсивности фотосинтеза даже при закрытых устьицах. Фиксация С02 с участием ФЕП и образование малата (аспартата) служит как бы насосом для поставки С02 в хлоропласты обкладки, функционирующие по С3-пути.
САМ-тип метаболизма. Потоки метаболитов в хлоропласт и из него
Суккуленты (роды Crassula, Bryophyllum и др.) также приспособились осуществлять фотосинтез в условиях резко засушливого климата. Для них характерен суточный цикл метаболизма С4-кислот с образованием яблочной кислоты ночью. В соответствии с английским выражением Crassulacean Acid Metabolism (САМ) этот тип фотосинтеза часто сокращенно называют САМ-метаболизм. Устьица этих растений днем обычно закрыты, что предотвращает потерю воды, и открываются ночью. С02 поступает в листья, где при участии содержащейся в цитоплазме ФЕП-карбоксилазы взаимодействует с фосфоенолпируватом, образуя оксалоацетат. Источник ФЕП-карбоксилазы взаимодействует с фосфоенолпируватом, образуя оксалоацетат. Источником ФЕП служит крахмал. То же самое происходит и с С02, который освобождается в клетках в процессе дыхания. Образовавшийся оксалоацетат восстанавливается под действием NADH-зависимой малатдегидрогеназы до яблочной кислоты, которая накапливается в вакуолях клеток листа.
Это приводит к закислению клеточного сока в ночное время. Как и у С4-растений, оксалоацетат может быть источником аспартата, однако этот путь здесь менее выражен.
Днем в условиях высокой температуры, когда устьица закрыты, малат транспортируется из вакуолей в цитоплазму и там декарбоксилируется при участии малатдегидрогеназы декарбоксилирующей (малик-энзима) с образованием С02 и пирувата. С02 поступает в хлоропласты и включается в них в цикл Кальвина, участвуя в синтезе сахаров.
Таким образом, у растений с фотосинтезом по типу толстянковых много общего с С4-путем фотосинтеза. Однако при САМ-метаболизме фиксация С02 с образованием малата (ночью) и декарбоксилирование малата с высвобождением С02 и пирувата (днем) разделены во времени. У С4-растений эти же реакции разграничены в пространстве: первая протекает в хлоропластах мезофилла, вторая — в клетках обкладки. При достаточном количестве воды ряд растений с метаболизмом по типу толстянковых могут вести себя как С3-растения. В свою очередь некоторые растения с С3-путем фотосинтеза при недостатке воды проявляют черты САМ-метаболизма.
Физиологические особенности С₄- растений
Исследования показали, что в растениях, в которых процесс фотосинтеза протекает по С4-пути, имеются два типа клеток и хлоропластов:
1) мелкие гранальные пластиды в клетках мезофилла листа;
2) крупные пластиды, часто лишенные гран, в клетках обкладки, окружающих сосудистые пучки.
Клетки обкладки имеют утолщенные клеточные стенки, содержат большое количество хлоропластов и митохондрий, расположены вокруг сосудистых пучков в 1 или 2 слоя.
У таких растений специфичное анатомическое строение листа. У них два типа фотосинтезирующих клеток: клетки обкладки, радиально покрывающие проводящие пучки в листе, и клетки мезофилла столбчатой и губчатой ткани. Это может служить диагностическим признаком на определение С4-растений. В структуре этих клеток также есть различия: в клетках обкладках в хлоропластах отсутствуют граны, они агранальные, а в клетках мезофилла все хлоропласты гранальные
К группе с С4-путем фотосинтеза относятся сахарный тростник, кукуруза, сорго и др. Эти растения устойчивы к засолению. Эффективность использования воды , т.е. отношение массы ассимилированного СО2 к массе воды, израсходованной при транспирации, у С4 растений зачастую вдвое выше, чем у С3-растений. Таким образом, С4-растения имеют преимущества перед С3-растениями в засушливых местах обитания, благодаря высокой интенсивности фотосинтеза даже при закрытых устьицах. Фиксация СО2 с участием ФЕП и образование малата(аспартата) служит как бы насосом для поставки СО2 в хлоропласты обкладки, функционирующие по С3 пути.
Фотодыхание (химизм, структурная организация процесса) и функциональная роль
Путь восстановления СО2 при фотосинтезе М. Кальвин изучал при относительно высоких концентрациях углекислого газа. При более низких концентрациях СО2, приближающихся к атмосферным, в хлоропласте образуется значительное количество фосфогликолевой кислоты. Это связано с тем, что в условиях низкого парциального давления СО2 и высокого парциального давления О2 РДФ-карбоксилаза может присоединять к рибулозо-1,5-дифосфату кислород; это значит, что она может выполнять не только карбоксилирующую, но и оксигенерирующую функции. Присоединение кислорода к молекуле рибулозодифосфата приводит к тому, что вместо двух молекул ФГК образуется одна молекула ФГК и одна молекула фосфогликолата. Последняя во время транспорта через мембрану хлоропласта дефосфорилируется при участии фосфогликолатфосфатазы и превращается в гликолат, который поступает в специальную органеллу-периксисому.
В последней содержится каталаза – фермент, разлагающий перекиси. В периксисоме гликолат вступает в реакцию с кислородом воздуха, в результате образуется глиоксилат и перекись водорода. Реакцию катализирует гликолатоксидаза.
Перекись сразу разрушается каталазой на воду и кислород, а глиоксилат в результате реакции трансаминирования, которая проходит при участии глиоксилатглицинаминотрансферазы, превращается в глицин, который перемещается в митохондрию. Тут из двух молекул глицина при участии серинглиоксилатаминотрансфераза синтезируется одна молекула серина, образуется СО2, аммиак и восстанавливается НАД+. СО2 или выделяется в атмосферу, это значит теряется для растения, или вновь может связаться в С3-цикле.
Предполагают, что образующийся НАДН может быть связан с электрон-транспортной цепью дыхания, что приводит к синтезу АТФ при его окислении.
Серин из митохондрий транспортируется вновь в периксисому, где после дезаминирования превращается в оксипируват, потом в глицерат, и наконец, в ФГК. ФГК – конечный продукт этого цикла может поступать в С3-цикл. Цикл превращения гликолата в триозофосфат(ФГК) называется гликолатным. Образовавшийся аммиак не выделяется в окружающую среду, а связывается в виде глутамина.
Так как образуются кислоты, содержащие 2 атома углерода, то этот цикл получил название С2-цикла. С другой стороны, так как во время этих превращений происходит поглощение кислорода и выделение СО2, то этот процесс получил название фотодыхания.
Фотодыхание (или световое дыхание) – это индуцированное светом поглощение О2 и выделение СО2, которое наблюдается в зеленых клетках. Интенсивность фотодыхания увеличивается при повышении освещенности.
Хотя органеллой фотодыхания считается периксисома, в этом цикле непосредственное участие принимают хлоропласты и митохондрии. Интенсивное фотодыхание может снизить продуктивность С3-растений на 30 %, так как при фотодыхании происходит не поглощение СО2, а его потери. Из каждых 10 молекул риболозо-1,5-дифосфата, образовавшегося в С3-цикле и включившихся в фотодыхание, одна разрушается:

Низкую интенсивность фотодыхания в С4-растениях объясняют тем, что в них высокая концентрация СО2 в клетках-обкладки. В этих растениях РДФ-карбоксилаза находится только в клетках-обкладки, где и происходит процесс.
Фотодыхание рассматривают как одну из необходимых функций зеленого растения. Во-первых, фотодыхание, как и С3-цикл, САМ-цикл и другие процессы, является источником метаболитов для разных синтезов. Во-вторых, что при образовании серина и глицина восстанавливается митохондриальная НАД+. В-третьих, выявлена связь фотодыхания с ассимиляцией азота. И, наконец, появилась теория, в соответствии с которой излишки продуктов цикла Кальвина служат сигналом, который увеличивает фотосинтез. Таким образом, соотношение фотосинтеза и фотодыхания выполняют регуляторную роль в растениях.
14.Суточные и сезонные изменения фотосинтеза. Фотосинтез, рост и продуктивность растений
Ранним утром фотосинтез идет слабо вследствие небольшой интенсивности света и низкой температуры. При повышении интенсивности света, нагревании воздуха устьица открываются, фотосинтез начинает быстро увеличиваться и может достичь максимума до полудня. Часто вслед за максимумом наступает полуденное понижение. Полуденная депрессия нередко сменяется новым повышением фотосинтеза в более поздние послеполуденные часы, а затем окончательно снижается.. Вследствие изменений условий внешней среды в разные дни и в пределах одного дня дневной ход фотосинтеза часто значительно отклоняется от описанного выше.
Причины дневных изменений фотосинтеза. Регуляция дневного хода фотосинтеза под влиянием разнообразных внешних и внутренних факторов очень сложна. Главными из внешних факторов являются, по-видимому, свет, температура, наличие воды, содержание СО2 в воздухе и различные взаимодействия между ними. Внутреннюю регуляцию поглощения СО2 относили за счет разных причин: водного стресса, закрывания устьиц, чрезмерного дыхания, накопления конечных продуктов фотосинтеза и фотоокисления ферментов.
Сезонные изменения
Сезонные изменения фотосинтетической способности у голосеменных происходят более постепенно, чем у листопадных покрытосеменных. Когда температура весной повышается и ночные заморозки становятся менее частыми, фотосинтетическая способность голосеменных постепенно увеличивается. Осенью интенсивность фотосинтеза также постепенно понижается. У листопадных покрытосеменных фотосинтез быстро ускоряется весной, когда деревья вновь покрываются листвой, остается высоким в течение лета, быстро уменьшается в конце лета, когда листья стареют, и окончательно падает до нуля, когда они опадают. Сезонные изменения фотосинтетической способности различаются у видов с разным характером развития листьев. Следовательно, сезонные изменения фотосинтетической способности происходят при изменении площади листьев.
Фотосинтез, рост и продуктивность растений
Взаимоотношения роста растений и интенсивности фотосинтеза отражают непрерывную перестройку фотосинтетического аппарата в ходе онтогенеза и динамику формирования и активности растущих (аттрагирующих) органов, потребляющих ассимиляты. Начальный этап развития листа осуществляется за счет деления и роста клеток, а затем — лишь путем растяжения. За это время делятся и развиваются хлоропласты, число которых увеличивается, пока растет объем клетки. Новообразование хлоропластов завершается довольно рано, но рост клеток опережает увеличение числа хлоропластов. Однако содержание хлорофилла в хлоропласте продолжает увеличиваться и после достижения хлоропластом наибольшей величины. Максимальная интенсивность фотосинтеза наблюдается во время роста клеток листа растяжением и начинает несколько снижаться. Затем процесс фотосинтеза может уменьшаться с возрастом листа.
На ранних этапах роста лист сам потребляет ассимиляты из более зрелых листьев или из запасающих тканей. По мере роста листа усиливается транспорт ассимилятов из него в другие листья и органы и постепенно лист становится донором ассимилятов. Взрослые листья отдают свои ассимиляты в аттрагирующие зоны растения, оставляя на собственные нужды 10—40% ассимйлятов и почти не обмениваясь между собой продуктами фотосинтеза. Последнее явление, названное «суровым законом», способствует лучшему распределению ассимилятов в целом растении. Стареющие листья со слабой фотосинтетической активностью отдают другим органам не только ассимиляты, но и продукты распада структур цитоплазмы.
