
- •Глава 18. Кристаллизация и растворение
- •18.1. Общие сведения
- •18.2. Равновесие в системе кристалл-раствор
- •18.3. Кинетика процессов кристаллизации
- •18.4. Методы кристаллизации, материальный и тепловой балансы
- •18.5. Конструкции кристаллизаторов
- •18.6. Растворение
- •Контрольные вопросы к главе 18
- •Вопросы для обсуждения
18.4. Методы кристаллизации, материальный и тепловой балансы
Для проведения процесса кристаллизации необходимо создать в растворе пересыщение. Пересыщение в растворе создается различными методами. Наибольшее распространение получили: охлаждение или, для некоторых веществ с отрицательной растворимостью, нагревание раствора; частичное удаление растворителя при выпаривании.
Метод, при котором меняют температуру раствора, называется изогидрической кристаллизацией. При этом количество растворителя остается постоянным. Рассмотрим этот процесс с охлаждением раствора на диаграмме растворимости (рис. 18.5). Точка А на диаграмме соответствует раствору в начальный момент времени. В этой точке ненасыщенный раствор имеет температуру T1 и концентрацию С1. Линия А-С характеризует охлаждение раствора до температуры T2 и пересекает кривую растворимости в точке В.
Если кристаллизация начинается только при температуре T2 и при этой температуре заканчивается, то процесс кристаллизации изобразится линией С-D. Точка D на кривой растворимости, соответствующая равновесной концентрации С2, соответствует конечному состоянию раствора. Если раствор не может быть пересыщенным, т.е. процесс кристаллизации начинается при равновесной концентрации, то процесс охлаждения и кристаллизации изобразится линией А-В-D. В реальности процесс охлаждения и кристаллизации может протекать в соответствии с линиями А-В'-D'-D или А-В"-D.
Метод, при котором
раствор переводят в пересыщенное
состояние за счет удаления растворителя
при выпаривании, называется изотермической
кристаллизацией.
На диаграмме растворимости (рис. 18.5)
изменение концентрации раствора от
начала процесса (точка А)
изобразится линией A-E-G.
Линия А-Е,
характеризующая процесс выпаривания
до концентрации насыщения, показывает,
что с повышением концентрации повышается
температура кипения раствора. В
большинстве случаев кристаллизация
при выпаривании протекает при постоянной
концентрации раствора, близкой к
состоянию насыщения для данной температуры
![]() .
.
Р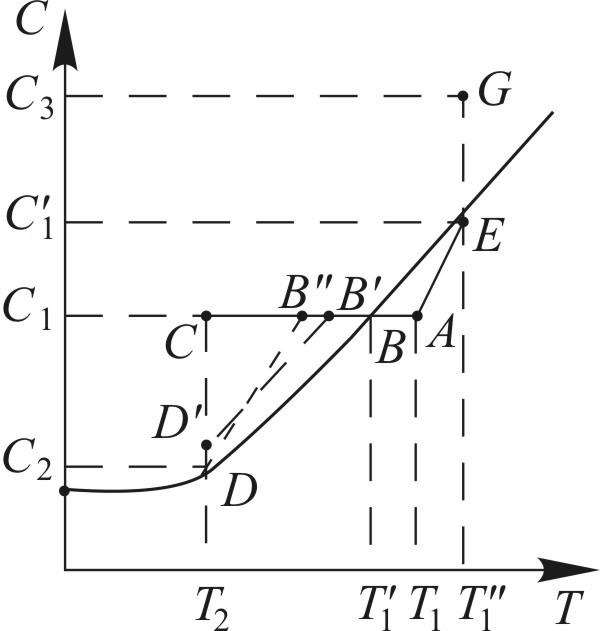 ис.
18.5. Изображение процесса кристаллизации
на диаграмме растворимости
ис.
18.5. Изображение процесса кристаллизации
на диаграмме растворимости
Существуют и другие методы кристаллизации: высаливанием, вымораживанием, в результате химической реакции. При высаливании к раствору добавляют вещество, понижающее растворимость выделяемой соли. При вымораживании охлаждают раствор до температуры образования кристаллов растворителя (льда). Достичь пересыщения возможно и в результате химических реакций, проходящих в растворе.
Выбор того или иного метода кристаллизации зависит от свойств растворителя и выделяемого вещества. Для веществ, растворимость которых резко уменьшается с понижением температуры (KNO3, K2Cr2O3, NH4CL и др), кристаллизацию целесообразно проводить изогидрическим методом. В противном случае (NaCL) применяется изотермическая кристаллизация.
Из сказанного выше следует, что процесс кристаллизации происходит только тогда, когда исходная фаза находится в состоянии пересыщения. Поскольку пересыщенные растворы неустойчивы, то из них выделяется избыточное количество растворенного вещества, т.е. происходит процесс кристаллизации. После прекращения выделения кристаллов раствор становится насыщенным. Такой раствор называется маточным, его отделяют от кристаллов путем отстаивания, фильтрования, центрифугирования и др.
Запишем материальный и тепловой балансы кристаллизации в общем виде, применяя обозначения, использованные при рассмотрении выпаривания (разд. 11.5)
![]() ,
(18.4)
,
(18.4)
![]() ,
(18.5)
,
(18.5)
![]() ,
(18.6)
,
(18.6)
где Gкр
![]() расход кристаллической фазы,K
расход кристаллической фазы,K
![]() отношение молекулярных масс собственно
кристаллического вещества и
кристаллосольвата,
отношение молекулярных масс собственно
кристаллического вещества и
кристаллосольвата,![]()
![]() подвод тепла за единицу времени, что
свойственно для изотермического метода
(положительная величина) или отвод
подвод тепла за единицу времени, что
свойственно для изотермического метода
(положительная величина) или отвод![]() свойственно для изогидрического метода
(отрицательная величина, кроме того в
этом случае расход испаряемого
растворителяW,
как правило, равен нулю). Слагаемое
свойственно для изогидрического метода
(отрицательная величина, кроме того в
этом случае расход испаряемого
растворителяW,
как правило, равен нулю). Слагаемое
![]() учитывает как теплоту концентрирования
раствора (при изотермическом методе),
так и теплоту кристаллизации.
учитывает как теплоту концентрирования
раствора (при изотермическом методе),
так и теплоту кристаллизации.
