
9956
.pdf120
жидком состоянии и образование α-полугидрата обусловлено растворением метастабильного дигидрата в воде, возникновением и ростом центров кристаллизации полугидрата.
Обезвоживание дигидрата при давлении не выше атмосферного и температуре 120°С и более приводит к выделению воды в парообразном состоянии и образованию β- модификации полугидрата.
Различия между α- и β- формами проявляются в термодинамических свойствах, плотности, водопотребности, форме кривых ДТА, причем β-
полугидрат характеризуется более высокой водопотребностью, растворимостью в воде, скоростью растворения и гидратации по сравнению с α -формой.
Различают α- и β- модификации полуводного гипса методом рентгеновского фазового анализа по профилю дифракционного максимума под углом 2Ө=(49-50)°.
Результаты исследований методами ДТА, ИКС, рентгеновского фазового анализа свидетельствуют о том, что различия α- и β- форм полугидрата обусловлены изменением степени совершенства кристаллической решетки,
размеров и морфологии зерен полуводного гипса.
Зерна β- полугидрата - это псевдоморфозы по гипсу, поли-
кристаллические агрегаты, состоящие из кристаллов размером менее I мкм.
Псевдоморфозы могут иметь пористость, приблизительно равную 29%, что связано с выделением химически связанной воды. При обезвоживании дигидрата образуются открытые микропоры размером от 10 до 100 А.
По сравнению с α- модификацией кристаллы β- формы характеризуются меньшей степенью совершенства кристаллической решетки, более высокой концентрацией дефектов (защемленная газовая фаза, дислокации и др.). α-
полугидрат существует в виде сравнительно крупных совершенных кристаллов.
Поэтому в наших опытах при сравнительно небольшом различии зерновых составов удельная поверхность β-полугидрата, определенная методом
121
низкотемпературной адсорбции азота, в два и более раз превышала удельную поверхность α- полугидрата.
Можно считать достаточно обоснованным, что α- и β- модификации
CaSO4·0,5H2O являются одним и тем же веществом, различающимся дефектностью и степенью несовершенства структуры кристаллов, размерами кристаллов и морфологией зерен, причем β- модификация имеет меньшую степень порядка, большее количество дефектов и микропор.
Изменяя режим термообработки двуводного гипса - толщину слоя материала, режим перемешивания, скорость нагревания, парциальное давление паров воды и др. - можно получить полугидраты, физико-химические свойства которых занимают промежуточное положение между α- и β- -формами.
Следовательно, α- β- модификации определяют пределы изменения технических свойств серии полугидратов, полученных в разных условиях. С
этой точки зрения утверждение, что промышленное вяжущее содержит,
например, одинаковое количество α- и β- полугидратов определяет только степень дефектности структуры кристаллов полугидрата и технические свойства полученного продукта, но не его фазовый состав.
Об этом же свидетельствует изменение физико-химических свойств
α- полугидрата (переход в β -полугидрат) при тонком измельчении.
Растворимый ангидрит образует кристаллы, относящиеся к гексагональной сингонии, нерастворимый ангидрит - к ромбической.
Характерными структурными фрагментами кристаллических решеток растворимого и нерастворимого ангидритов являются цепи -Ca-SO4-Ca-,
параллельные оси С кристалла, и тетраэдры SO4.
Тетраэдры располагаются так, что образуют каналы, параллельные цепям
-Ca-SO4-Ca-. Диаметр каналов в решетке растворимого ангидрита равен 3А, а в решетке нерастворимого ангидрита - приблизительно 2А. Изменение скорости гидратации при переходе растворимого ангидрита в нерастворимый иногда
122
связывают с уменьшением диаметра каналов, вследствие чего в них не могут проникать молекулы воды.
α- и β- растворимые ангидриты, также как и полугидраты, не рассматриваются как индивидуальные фазы в системе CaSO4-H2O; они различаются степенью совершенства кристаллической решетки, размерами и морфологией зерен.
Результаты структурных исследований кристаллических решеток сульфатов кальция свидетельствуют о том, что реакции дегидратации двуводного сульфата кальция относятся к числу топотаксических. Несмотря на некоторое изменение параметров кристаллических решеток, при фазовых превращениях в системе CaSO4-H2O образуются слоистые структуры со сходным базисом, наследуются основные структурные фрагменты - цепи -Ca- SO4-Ca- SO4-, параллельные оси С кристалла.
В современной литературе рассматриваются как достоверные и воспроизводимые приведенные ниже фазы в системе CaSO4-H2O: гипс
(двуводный гипс, дигидрат) CaSO4·2Н20; полуводный гипс (полугидрат)
CaSO4·0,5Н20; растворимый ангидрит (γ-ангидрит, ангидрит III, АШ), CaSO4·
εН20 нерастворимый ангидрит (β-ангидрит, ангидрит II, АII), CaSO4;
высокотемпературный ангидрит (α-ангидрит , ангидрит I, А I).
Исследование равновесия в системе CaSO4-H2O, кинетический анализ осложняются влиянием таких факторов, как содержание примесей, структура образующихся кристаллических фаз, парциальное давление водяного пара и др.
Не всегда удается определить число реакций, одновременно протекающих в системе.
Например, скорость фазовых переходов и равновесие в системе зависят от парциального давления водяного пара.
При 20°С упругость водяного пара над CaSO4·0,5Н20 соответствует относительной влажности воздуха, равной 6%. Для стабильного существования
123
дигидрата при 20°С необходимо, чтобы относительная влажность воздуха была не менее 20%.
Следовательно, на воздухе обезвоживание гипса возможно в широком интервале температур, от 10 до 130°С, в зависимости от парциального давления водяного пара. Но при низких температурах диссоциация идет медленно,
скорость реакции дегидратации растет с повышением температуры.
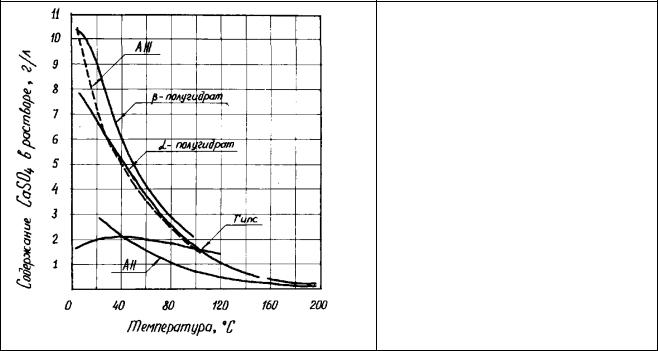
Растворимость сульфатов кальция в воде в зависимости от температуры приведена на рисунке 2.1. Ниже 42°С стабильной фазой в системе CaSO4-Н20
является двуводный гипс, а при более высокой температуре - нерастворимый ангидрит. Полугидрат метастабилен. Однако из-за сравнительно низкой энергии образования центров кристаллизации при температуре выше 97°С (по данным разных исследователей от 97 до 101,50С) дигидрат переходит в полугидрат. До температуры 97°С существует метастабильный гипс.
При 185-200°С полугвдрат переходит в растворимый ангидрит АIII CaSO4· εН20, где ε обычно близко к 0,1. При низких парциальных давлениях водяного пара из дигидрата непосредственно образуется АIII путем прямого превращения "дигидрат - АIII". Растворимый ангидрит метастабилен и в атмосфере влажного воздуха сравнительно быстро переходит в полугидрат.
Нерастворимый ангидрит АII образуется в интервале 290-5500С.
Превращение "АШ-АП" идет с разной скоростью в зависимости от морфологии кристаллов АIII, температуры и парциального давления водяного пара. АII,
полученный обжигом дигидрата при 300-600°С, по физико-химическим свойствам аналогичен природному ангидриту.
При температуре, приблизительно равной 1200°С, АII переходит в высокотемпературный ангидрит АI, который вследствие диссоциации CaSO4
всегда содержит некоторое количество СаО.
Получить АI при низких температурах путем быстрого охлаждения не удается.
124
Исследование системы CaSO4-Н20 связано с разработкой и совершенствованием методики количественного анализа. Для количественных определений широко применяются микроскопический, фазовый химический,
дифференциальный термический, рентгеновский фазовый и инфракрасный спектроскопический методы. Проблема совершенствования методики количественного анализа становится особенно актуальной в связи с развитием химической промышленности и, в частности, разработкой и промышленным освоением технологических процессов, связанных с производством попутных продуктов, содержащих сульфаты кальция. Комплексная переработка минерального сырья, изучение и совершенствование этих процессов требуют разработки разработки сравнительно простой методики количественного анализа в системе CaSO4-Н20.
Рисунок 2.1 – Растворимость сульфатов кальция в воде по М. Мюра
Модификационные превращения гипса
Гипс представляет собой водную соль сернокислого кальция и отвечает формуле - CaSO4·2H2O. В природе он представлен несколькими минералогическими разновидностями, отличающимися кристаллической структурой . Как отмечено выше, наиболее распространенные из них: алебастр
125
- мелкозернистый и крупнозернистый с характерным сахаровидным изломом;
селенит - волокнистая порода, сложенная из нитевидных кристаллов; гипсовый шпат - пластинчатый гипс в виде тонких плоских прозрачных кристаллов слоистой структуры.
Наиболее чистые разновидности гипса бесцветны или прозрачны, иногда бывают окрашены в различные цвета: желтый, красный, зеленый, серый до черного. В виде примесей в породах встречаются карбонаты, доломиты, кварц,
илистые вещества.
Гипсовое сырье идет на получение вяжущих веществ.
Мелкокристаллические разновидности, обладающие повышенной прочностью,
более предпочтительны для производства высокопрочного гипса.
Двуводный гипс обладает способностью при нагревании частично или полностью выделять кристаллизационную воду. Его обезвоживание сопровождается изменениями фазового состава, структуры и физико-
механических свойств.
Закономерность фазовых преобразований позволила сделать заключение о существовании нескольких различных сульфатов кальция, образующихся в процессе обезвоживания гипса.
На основании данных, опубликованных в литературе, а также в результате собственных исследований автора предлагается выделять следующие модификации сульфатов кальция и температуры их образования:
- сульфат кальция, CaSO4·2H2O, природный или полученный искусственным путем;
- α-полуводный сульфат кальция, α-CaSO4 .0,5H2O /α-полугидрат/,
получаемый обезвоживанием двуводного гипса в замкнутом пространстве при повышенном давлении или в растворах солей при нагревании его до
1800С;
- β-полуводный сульфат кальция, β-CaSO4. 0,5H2O /β-полугидрат/,
получаемый обезвоживанием двуводного гипса при нагревании его до 160оС
126
вусловиях свободного выхода паров воды;
-α-обезвоженный гипс, α-Ca SO4, получаемый нагреванием α-
полугидрата при температуре 200-210оС;
-β-обезвоженный гипс, β-CaSO4, получаемый нагреванием β-
полугидрата при температуре 170-180оС;
-α-растворимый ангидрит, образующийся при нагревании α-
полугидрата до 400оС;
-β-растворимый ангидрит, образующийся при нагревании β-полугидрата до 360оС;
-нерастворимый ангидрит, CaSO4, получаемый при обжиге всех вышеименованных модификаций при температуре свыше 450оС, а также его природные разновидности.
Из термически обработанных веществ наибольшее практическое значение имеют α- и β-CaSO4.0,5H2O и обезвоженные/ ангидритовые/
разновидности сульфата кальция.
С точки зрения дальнейших исследований определенный интерес представляют фазовый переходы гипса по схеме:
CaSO4.2H2O ↔ CaSO4.0,5H2O + 1,5H2O
Впроцессе нагревания двугидрата со свободным выходом паров в атмосферу образуется β-полуводный гипс и его разновидности. При этом, как отмечают авторы работ, происходит механическое диспергирование зерен гипса.
Вслучае протекания процесса дегидратации в при повышенном давлении или в растворах некоторых солей двугидрат переходит в α-полуводный гипс.
Вода в этом случае удаляется в капельно-жидком состоянии. Зерна не разрушаются, а перестраиваются в новую кристаллическую форму.
Характер связи воды в гипсе и кинетика ее удаления остаются придметом исследования.
Основное направление в исследовании процессов дегидратации гипса
127
подчинено изучению характера выделения воды и ее связи в решетке полугидрата. Вопросы формирования структуры полугидратного камня при различных режимах тепловой обработки имеют важное технологическое значение.
Исследование и уточнение процесса формирования структуры полугидратного гипсового камня при дегидратации, выполненное автором,
является олной из немногих работ в этом направлении.
Механизм гидратации полуводного гипса издавна привлекал внимание исследователей. Известно, что двугидрат образуется в процессе растворения полуводного гипса. При затворении водой создается пересыщение двугидратной фазы по отношению к исходному продукту. Вследствие пересыщения из раствора выпадают новые кристаллические образования.
Сцепление кристаллов, их взаимная адгезия, обеспечивают прочность затвердевшего теста.
Согласно другой схеме процесс образования вторичного двугидрата состоит из трех этапов. На первой стадии, после затворения водой, идет образование раствора и его насыщение по отношению к исходным продуктам.
На втором этапе раствор переходит в гелеобразное состояние, минуя полное растворение. Заключительный этап характеризуется перекристаллизацией частиц с образованием кристаллов новообразований и их срастанием.
После образования насыщенного раствора последующая гидратация осуществляется прямым присоединением воды к твердой фазе с образованием гидратных соединений высокой дисперсности. Зависимость растворимости исходного продукта от дисперсности способствует пересыщению образующегося раствора по отношению к более крупным частицам.
Перекристаллизация протекает за счет растворения мельчайших коллоидных частиц и роста более крупных, являющихся основой кристаллического каркаса.
Как установлено ход гидратации и кинетика роста прочности изделий из гипса совпадают. Применение метода меченых атомов говорит о том, что
128
между кристаллами и раствором происходит быстрый обмен атомами.
Рентгеновские методы исследования гидратации гипса на различных этапах показали, что переход от полугидрата к двугидрату является непрерывным процессом. При этом не на одной стадии не наблюдается сходства между гидратацией полуводного и коллоидного гипсов.
Работы авторов подтверждают кристаллическую теорию образования вторичного двугидрата. Как показано, концентрация сульфата кальция в растворе остается постоянной и сохраняется в начальной стадии, снижаясь до равновесной концентрации к концу гидратации. Большая скорость растворения полугидрата, равная 1,3 м2/см2.сек, способна обеспечить переход гипса в раствор в течение всего периода кристаллизации. Замедление кинетики перекристаллизации с ростом температуры свыше 40оС, при полном соответствии со знаком температурного коэффициента растворимости двугидрата также подтверждает этот вывод.
Всестороннему исследованию механизма образования вторичного двугидратного камня и параметров, от которых зависят механические свойства материала, посвящены работы, выполненные под руководством П.А.
Ребиндера. Серия экспериментов по изучению степени пересыщения раствора,
кинетики структурообразования камня, изменение дисперсности в процессе гидратации и другие результаты позволили выделить ряд закономерностей.
Картина гидратации сводится к растворению и образованию раствора пересыщенного относительно выкристаллизовывающегося двугидрата. Во всех суспензиях α-полуводного гипса наблюдается одинаковое наибольшее пересыщение, соответствующее концентрации CaSO4 и равное 8 г/л. Это пересыщение сохраняется тем дольше, чем меньше концентрация суспензии.
В следующий момент образуется пластическая коагуляционная структура. Это так называемый индукционный период структурообразования,
продолжительность которого тем больше, чем ниже растворимость исходного вещества и меньше пересыщение, возникающее в жидкой фазе. Так для β-
129
полуводного гипса постоянный уровень пересыщения возникает через 30 сек., а
для α-полуводного гипса - через 10-12 минут.
Структурообразование начинается на первых этапах гидратации при наличии в жидкой фазе суспензии достаточно высоких пересыщений. Когда убыль вещества из раствора перестает компенсироваться поступлением его за счет растворения, пересыщение падает, и вместе с ним уменьшается образование зародышей двугидрата. Дальнейший рост прочности структуры происходит за счет обрастания первоначального каркаса.
Контакты между кристаллами, представляющие между собой места непосредственного срастания кристаллитов новообразований, обладают искаженной, деформированной решеткой. Эти кристаллизационные контакты определяют прочность вторичного двуводного камня. Являясь термодинамическими неустойчивыми, они обладают повышенной растворимостью и во влажных условиях самопроизвольно разрушаются в результате процесса перекристаллизации с образованием свободных кристаллов двугидрата. При этом происходит падение прочности. Оно идет тем интенсивнее, чем выше пористость получаемого камня.
Основные физико-механические процессы фазовых превращений гипса исследованы достаточно полно и подчинены задачам получения вторичного двугидрата из двух составляющих - твердой /полугидратного гипса вяжущего/
и жидкой /воды/. Формирование структуры камня в этом случае осуществляется с применением различных методов уплотнения затворенной массы. Как следует из данных М.М. Сычева, чем выше степень "стесненности"
условий гидратации, тем выше плотность, прочность и некоторые другие эксплутационные свойства изделий. Образование кристаллического каркаса двугидритного камня происходит за счет выкристаллизовывания из раствора новообразований и их срастания по границам контактов, количество которых зависит от степени уплотнения.
Теоретически для завершения реакции гидратации достаточно 18,6%
