
- •-Лекция 9 галогенопроизводные углеводородов
- •1.1 Галогенопроизводные со связью с(sp3)-Наl
- •1.2. Способы получения
- •1.4. Химические свойства
- •1.4.1. Нуклеофильное замещение
- •1.4.2. Механизм sn1. Мономолекулярное замещение
- •1.4.3 Механизм sn2. Бимолекулярное замещение
- •1.4.4. Элиминирование
- •1.5. Восстановление
- •2. Галогенопроизводные со связью с(sp2)-Наl
- •2.4. Химические свойства
- •2.4.2. Нуклеофильное замещение по типу «присоединение-отщепление»
- •2.4.3. Нуклеофильное замещение по типу «отщепление-присоединение»
- •3. Металлоорганические соединения
1.4.3 Механизм sn2. Бимолекулярное замещение
Реакции нуклеофильного замещения протекают по бимолекулярному механизму придействии на субстраты сильных нуклеофильных реагентов. Например щелочной гидролиз метилбромида:

В этой реакции гидроксид-ион (вступающая группа, нуклеофил) замещает анион брома (уходящая группа или нуклеофуг) в молекуле метилбромида (субстрат).
Скорость реакции бимолекулярного замещения пропорциональна концентрациям субстрата и нуклеофила. Следовательно, в скоростьлимитирующей стадии гидролиза метилбромида участвуют две частицы: метилбромид и гидроксид-ион:

Гидроксид-ион атакует атом углерода, имеющий частичный положительный заряд, со стороны, противоположной атому брома, т.е. «с тыла». Образование связи С-О и разрыв связи С-Br происходят одновременно. Это означает, что реакция протекает как синхронный процесс. Синхронному процессу соответствует следующая энергетическая диаграмма:

Особенности бимолекулярного нуклеофильного замещения
1. Стереохимия реакции
В реакциях с участием оптически активных субстратов происходит 100% обращение конфигурации (инверсия), которая является следствием атаки «с тыла». Так называемое Вальденовское обращение:

2. Влияние природы растворителя на реакции SN2.
Влияние растворителя на скорость реакции SN2зависит от природы нуклеофильного реагента (ион или нейтральная молекула), что связано со степенью разделения зарядов в переходном состоянии.
3. Влияние природы нуклеофильного реагента.
Нуклеофильный реагент – нейтральная молекула.
Переходное состояние в этой реакции более полярно, чем исходные соединения. Поэтому увеличение полярности растворителя приведет к лучшей сольватации ПС. Эти реакции ускоряются полярными растворителями как протонными: уксусная кислота, спирты, так и апротонными – ацетон, ДМСО.
Нуклеофильный агент –анион.
ПС в этой реакции менее полярно, чем исходный нуклеофил. Применение протонных растворителей приводит к сольватации нуклеофила и снижению его реакционной способности. Поэтому более эффективны полярные апротонные растворители.
4. Влияние строения субстрата на реакции SN2.
Атаке с тыла будут препятствовать заместители у реакционного центра. Поэтому при переходе от метилгалогенидов к третичным алкилгалогенидам скорость реакции понижается.
Аллилгалогениды и бензилгалогениды в реакции SN2. более активны, чем первичные галогениды.
5. Влияние природы уходящей группы.
Скорость реакции SN2.тем выше, чем выше поляризуемость уходящей группы. Мерой поляризуемости является рефракция.
6. Влияние нуклеофила.
Активность нуклеофила определяется двумя факторами: - нуклеофильностью – способностью отдавать электроны и основностью – способностью присоединять протон. Как правило сильные нуклеофилы являются слабыми основаниями, а слабые нуклеофилы являются сильными основаниями. Благоприятствует протеканию реакции оптимальное сочетание основности и нуклеофильности, что в частности связано с природой растворителя.
1.4.4. Элиминирование
Третичные галогеналканы не способны к реакциям бимолекулярного нуклеофильного замещения. Однако если нуклеофильный реагент является сильным основанием, то под его воздействием протекает реакция отщепления (реакция элиминирования Е). Например при обработке трет-бутилбромида спиртовым раствором щелочи наблюдается реакция дегидробромирования:

Реакции отщепления, в которых уходящие группы – анион галогена и протон – отщепляются от соседних атомов углерода с образованием π-связи между ними, называются β-элиминированием:
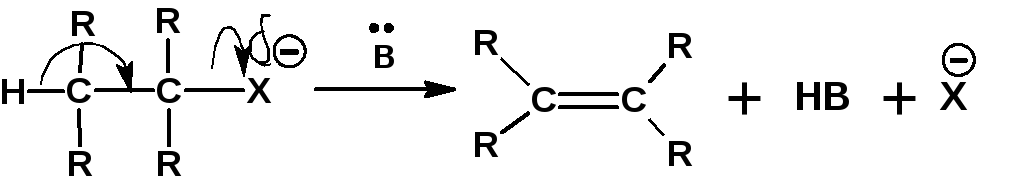
Реакции β-элиминирования, приводящие к алкенам, являются наиболее важными реакциями отщепления. Аналогично реакциям нуклеофильного замещения реакции β-элиминирования протекают по двум механизмам; Е1 и Е2.
Механизм реакции Е1 включает две стадии.
На первой стадии, как и в реакциях SN1происходит ионизация галогенопроизводного с образованием карбкатиона и бромид-иона. Эта стадия является скоростьлимитирующей и характеризуется наиболее высокой энергией активации:

На второй стадии происходит быстрое отщепление протона под действием основного реагента и образование π-связи:

Этой схеме механизма соответствует следующая энергетическая диаграмма:

Особенности мономолекулярного элиминирования
1. Правило Зайцева.
Реакции Е1 соединений, имеющих несколько доступных элиминированию β-атомов водорода, обычно протекают по правилу Зайцева, т.е. с преимущественным образованием более устойчивого алкена.
2 Стереохимия реакции
Термодинамически более устойчивый транс- изомер образуется легче, чем цис-изомер.
3. Протонные растворители, обладающие высокой ионизирующей способностью ускоряют реакции Е1
4. Влияние температуры.
С повышением температуры доля продукта Е1 возрастает.
Бимолекулярное элиминирование также как и мономолекулярное конкурирует с замещением. Кинетика описывается уравнением второго порядка. Это значит, что в скоростьлимитирующей стадии участвуют молекула субстрата и основания. Реакция представляет собой одностадийный согласованный процесс β-элиминирования, протекающий через переходное состояние, в котором разрыв связей Сα-Х и Сβ-Р и образование π-связи происходят одновременно:
 Особенности
бимолекулярногоэлиминирования
Особенности
бимолекулярногоэлиминирования
1. Региоселективность реакции Е2
Реакции β-элиминирования галогеналканов, имеющих в молекуле две неэквивалентные С-Н связи, способные к разрыву, приводят к образованию смеси двух алкенов в соответствии с правилом Зайцева.
2. реакционная способность галогеналканов в реакциях Е2.
В реакциях Е2 скорость и выхода продуктов возрастают в ряду галогеналканов первичный вторичный третичный.
3. Влияние природы галогена
Реакционная способность возрастает в ряду от фтора к йоду.
4. Свойства нуклеофила.
Рост основности способствует протеканию по механизму Е2. Также протеканию реакции элиминирования способствует рост объема основания.
5. Влияние среды
В переходном состоянии Е2 заряд распределен между пятью атомами. В реакции замещения только по трем атомам. Следовательно, в реакции элиминирования большая степень локализации и соответственно меньшие величины зарядов на атомах. Поэтому при элиминировании целесообразно использовать растворители менее полярные, чем при замещении. Практически элиминировпние проводят в спиртовой среде, а замещение в водной.
6. Влияние температуры.
Рост температуры ведет к увеличению выхода продукта элиминирования.
