
- •Лекция 12 карбоновые кислоты
- •1. Классификация, номенклатура, изомерия.
- •2. Способы получения
- •2.1. Промышленные способы
- •2.1. Гидролиз нитрилов
- •2.1.1. Гидролиз нитрилов полученных из галогенопроизводных
- •2.1.2. Гидролиз нитрилов полученных из карбонильных соединений
- •2.3. Гидролиз сложных эфиров.
- •2.4. Карбоксилирование металлорганических соединений
- •3. Физические свойства
- •4.1. Кислотные свойства карбоновых кислот
- •4.2. Реакции, сопровождающиеся разрывом связи о-н
- •4.3. Реакции, сопровождающиеся разрывом связи с-о.
- •4.4. Реакции нуклеофильного присоединения по карбонильной группе.
- •4.6.3. Реакция переэтерификации
- •4.7. Особые свойства непредельных одноосновных кислот и их производных
- •4.8. Особые свойства двухосновных предельных кислот
- •4.9. Двухосновные непредельные кислоты
- •4.10. Свойства ароматических карбоновых кислот
2. Способы получения
На самостоятельную проработку:
гидролиз геминальных тригалогенопроизводных
озонолиз алкенов;
окисление циклоалканов;
окисление алкенов и алкинов в жестких условиях;
окисление спиртов;
окисление альдегидов и кетонов;
окисление бензола, нафталина, гомологов бензола;
2.1. Промышленные способы
В промышленности насыщенные одноосновные карбоновые кислоты получают прямым окислением углеводородов кислородом воздуха:
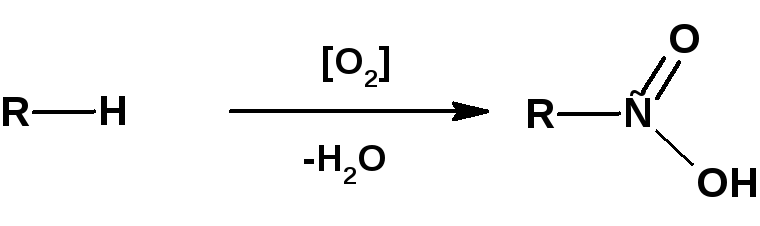
Низшие углеводороды, с числом углеродных атомов меньше 8-ми, окисляются в газовой фазе. Высшие углеводороды с числом атомов от 10 до 30 для получения так называемых СЖК (синтетические жирные кислоты) окисляются в жидкой фазе.
Окислением олефинов получают непредельные карбоновые кислоты. В частности окислением пропилена получают акриловую кислоту:
![]()
Окислением изобутилена получают метакриловую кислоту:
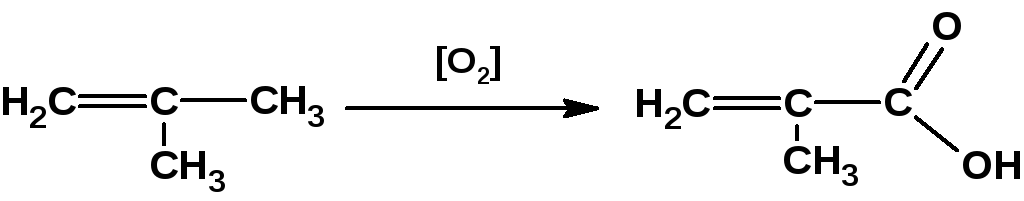
Взаимодействием олефинов с оксидом углерода (II) и водяным паром в присутствии катализатора (тетракарбонил никеля) получают смесь кислот нормального и изомерного строения:
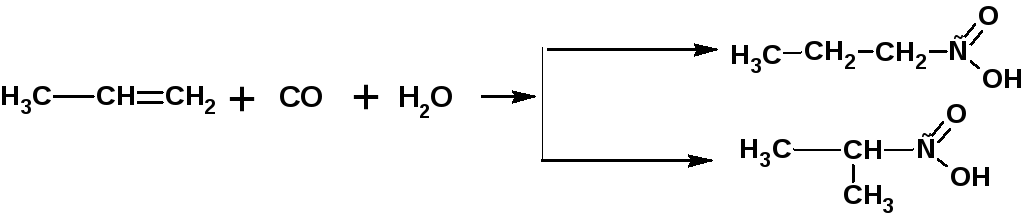
2.1. Гидролиз нитрилов
2.1.1. Гидролиз нитрилов полученных из галогенопроизводных
Исходными веществами являются галогеналкилы, из которых получают нитрилы действием цианида калия. В дальнейшем нитрилы подвергаются кислотному или щелочному гидролизу:
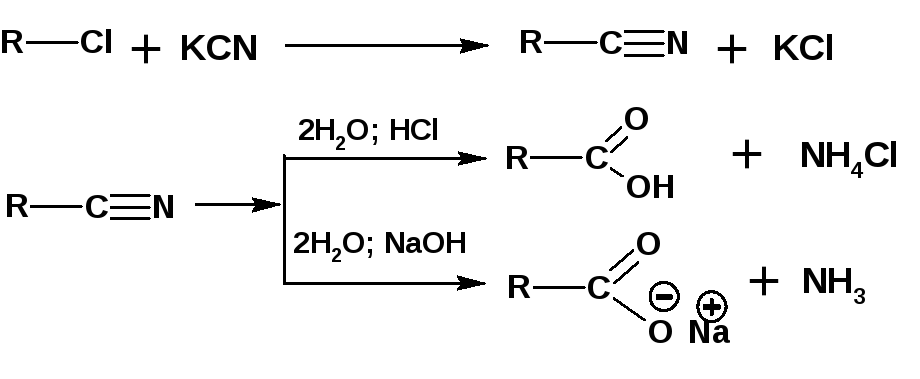
Например, винилуксусную кислоту получают по схеме:
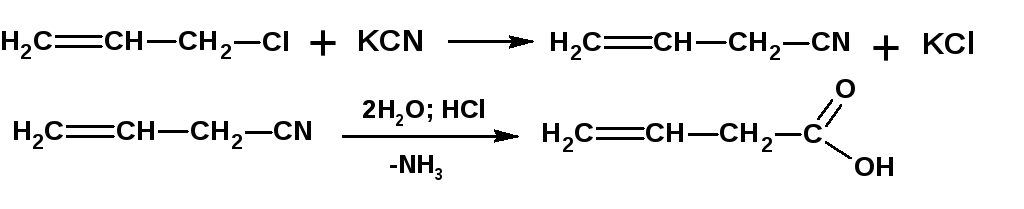
Фенилуксусную кислоту получают по схеме:
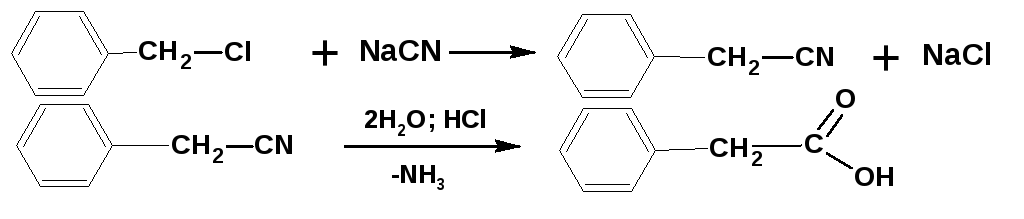
Янтарную кислоту можно получить по схеме:
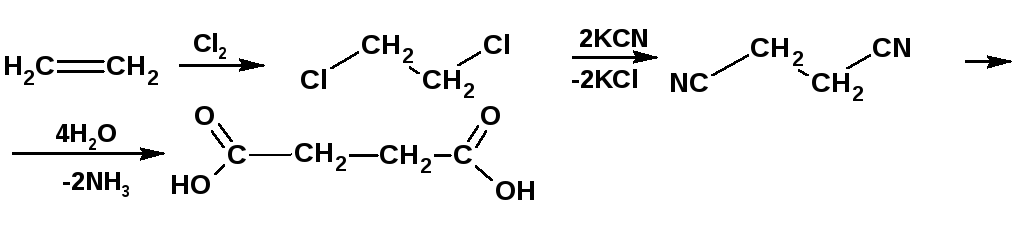
2.1.2. Гидролиз нитрилов полученных из карбонильных соединений
Гидролизом α-гидроксинитрилов получают метакриловую кислоту и ее метиловый эфир:
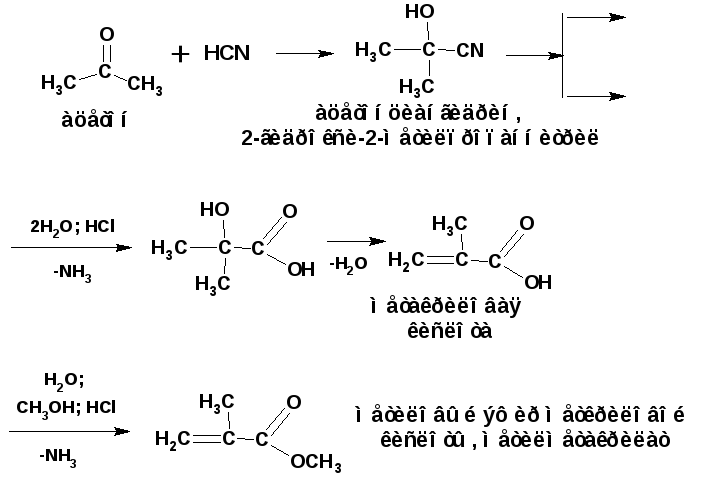
2.3. Гидролиз сложных эфиров.
При нагревании сложного эфира в присутствии разбавленного водного раствора щелочи протекает реакция:
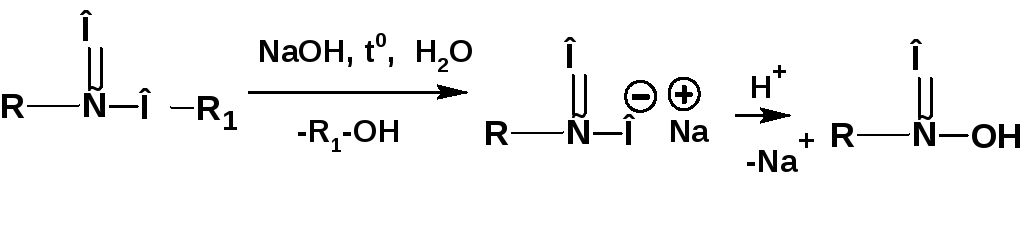
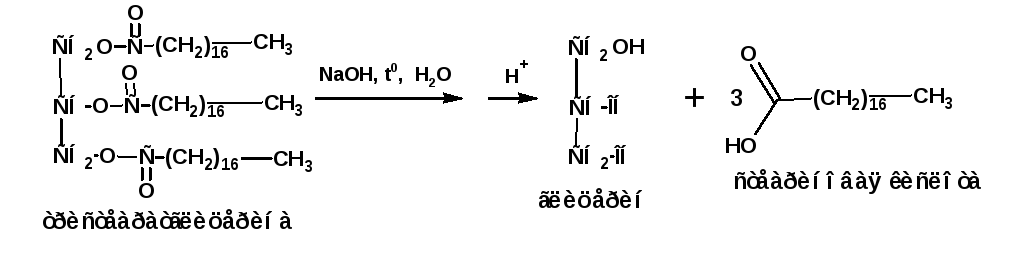
В природе широко распространены сложные эфиры глицерина и высших насыщенных и ненасыщенных карбонов кислот, которые известны как жиры. Эфиры насыщенных кислот при нормальных условиях являются твердыми веществами. Сюда относятся жиры животного происхождения. Эфиры ненасыщенных кислот при нормальных условиях являются жидкостями. Это растительные масла. Из насыщенных кислот основную массу составляют пальмитиновая и стеариновая кислоты:
Из высших ненасыщенных кислот основное значение имеет олеиновая кислота:
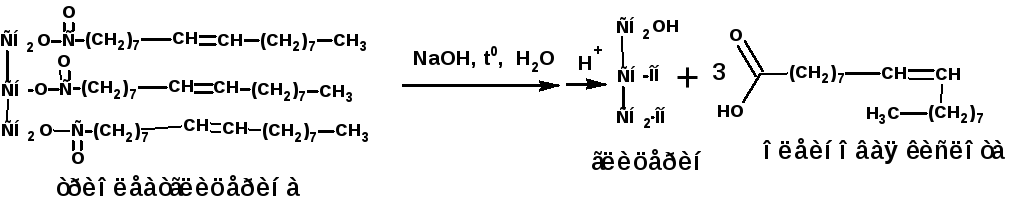
Процесс гидролиза жиров называется омылением. Непосредственно после гидролиза образуются соли карбоновых кислот, которые называются мылами. Получаемая при омылении животных жиров смесь твердых жирных кислот называется стеарином. Из стеарина с добавкой парафина изготавливают свечи.
2.4. Карбоксилирование металлорганических соединений
Карбоксилирование металлоорганических реагентов является универсальным способом получения карбоновых кислот:
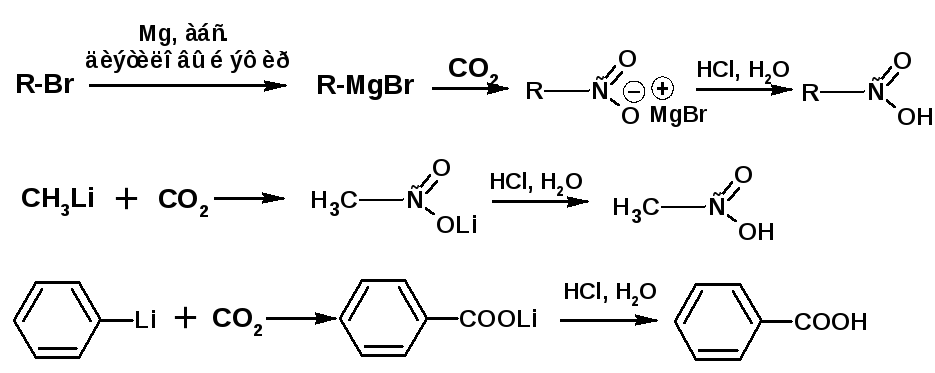
Получение щавелевой кислоты при нагревании формиата натрия.
3. Физические свойства
Муравьиная и уксусные кислоты обладают раздражающим запахом. Масляная, валериановая, и капроновая кислоты маслянистые малоподвижные жидкости с неприятным запахом. Высшие жирные и ароматические кислоты не имеют запаха, поскольку обладают малой летучестью. Температуры кипения кислот выше, чем у соответствующих спиртов. Данное различие обусловлено большей полярностью молекул карбоновых кислот и более прочными водородными связями, которые они образуют в соответствующих димерах. Димеры карбоновых кислот устойчивы даже в газообразном состоянии. Молекулы каробоновых кислот образуют с молекулами воды прочные водородные связи. Однако лишь первые четыре члена гомологического ряда алифатических карбоновых кислот смешиваются с водой в любых соотношениях.
Группы С=О и О-Н, образующие карбоксильную систему, влияют друг на друга. Соответственно их свойства отличаются от гидроксильной группы спиртов и карбонильной группы альдегидов и кетонов. Для карбоксильной группы можно привести резонансные структуры:
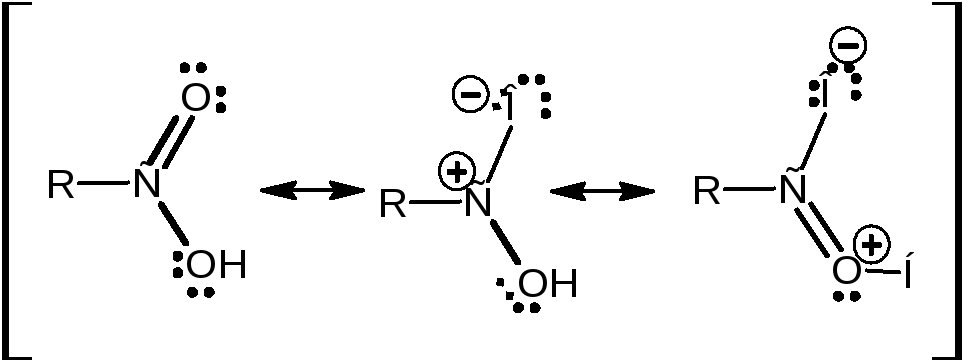
НЭП атома кислорода гидроксильной группы способна участвовать в р-π-сопряжении с π-электронной системой двойной связи карбоксильной группы. Делокализация делает атом углерода карбонильной группы менее электрофильнфым , чем атом углерода в карбонильной группе альдегидов или кетонов. Карбоновая кислота имеет три реакционных центра:
реакции, сопровождающиеся разрывом связи О-Н
реакции, сопровождающиеся разрывом связи С-О
реакции нуклеофильного присоединения по связи С=О карбонильной группы
реакции замещения атома водорода у α-углродного атома.
