
3. Способы получения.
Все способы получения делятся на промышленные и лабораторные.
Природные источники и промышленные способы получения алканов.
1. Предельные углеводороды снебольшим числом углеродных атомов (до 11) выделяют из природного газа или бензиновой фракции нефти. Основным способом переработки нефтяных фракций являются различные виды крекинга. Крекинг – это термическое разложение углеводородов и других составных частей нефти.
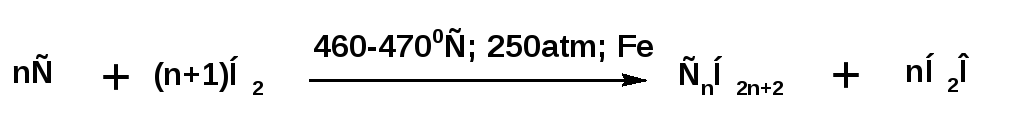
2. По методу Фишера-Тропшаалканы можно получать каталитичеким гидрированием окиси и двуокиси углерода:

3. Каталитическая гидрогенизация угля. Получила название «ожижение» угля. Твердый каменный уголь в ходе этого процесса превращают в смесь алканов. Эта реакция лежит в основе производства синтетического бензина:
Лабораторные способы получения алканов.
1. Предельные углеводороды, начиная с пентана, наиболее часто получают в лабораторных условиях каталитическим гидрированием непредельных углеводородовс тем же числом углеродных атомов и таким же строением цепи:

В качестве катализатора используют мелкодисперстные Рt,Pd,Ni. Процесс проводят при обычных температуре и давлении.
2. Предельные углеводороды в лабораторных условиях получают восстановлением галогенпроизводных действием цинка в водном растворе минеральной кислотыили уксусной кислоты:
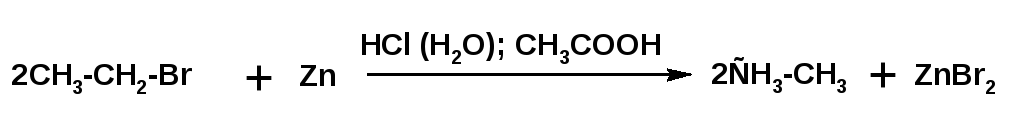
При использовании в качестве субстрата йодистых алкилов можно получить алкан восстановлением йодистоводородной кислоты:
![]() 3.
Синтез предельных углеводородов из
соединений с меньшим числом углеродных
атомов осуществляется действием натрия
на галогенпроизводные – реакция
Вюрца:
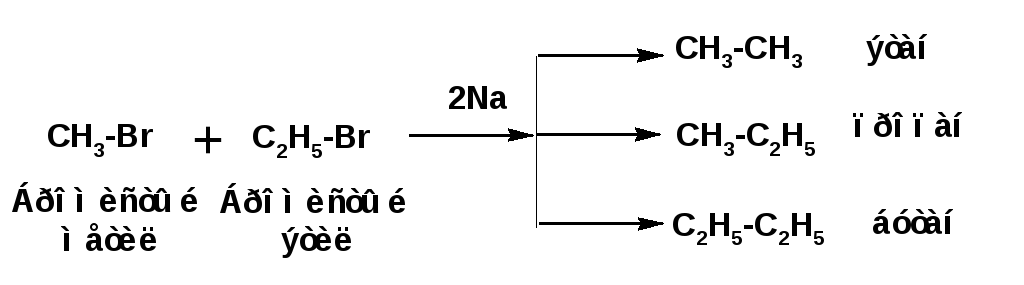
3.
Синтез предельных углеводородов из
соединений с меньшим числом углеродных
атомов осуществляется действием натрия
на галогенпроизводные – реакция
Вюрца:
![]()
Особенностью синтеза Вюрца является то, что в случае использования в качестве исходных веществ различных галогеналкилов в результате реакции получается смесь трех углеводородов:
4. Общим способом получения углеводородов является декарбоксилирование карбоновых кислот:
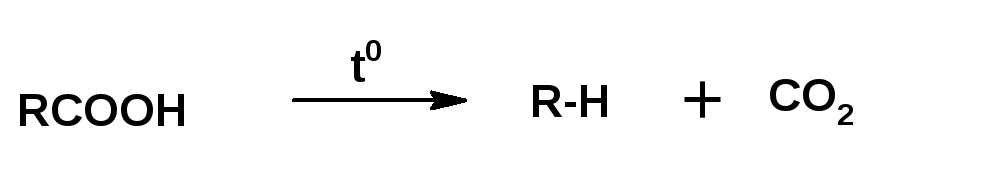
Насыщенные углеводороды в ряде случаев удобнее получать нагреванием натриевой соли карбоновой кислоты с избытком едкого натра:
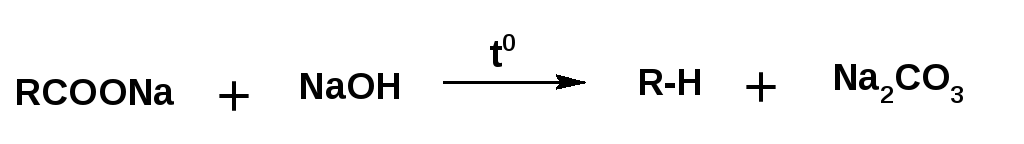
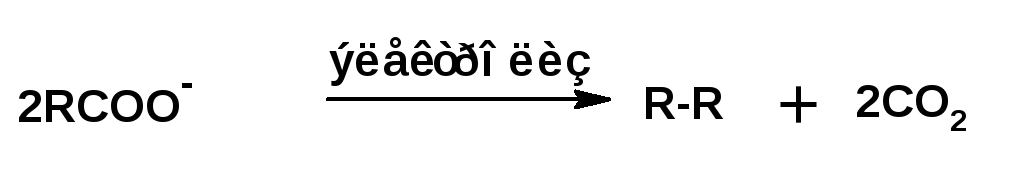
При нагревании натриевой соли карбоновой кислоты с едким натром получается углеводород с числом атомов углерода равным числу атомов углерода в радикале кислоты. Углеводород с удвоенным количеством атомов углерода получается при электролизе натриевой соли карбоновой кислоты:
4. Физические свойства и строение.
4.1. Физические свойства
Физические свойства алканов, как и всех других органических соединений определяются их составом и строением. Низшие алканы С1-С4при нормальных находятся в газообразном состоянии. Линейные алканы С5-С15являются жидкостями. Температуры кипения в гомологическом ряду возрастают, причем разность температур кипения ближайших гомологов все время уменьшается. (Относительное уменьшение изменения кинетической энергии). Изомеры с нормальной цепью углеродных атомов кипят при более высокой температуре, чем углеводороды с разветвленной цепью. Причина в меньшем взаимодействии между молекулами с разветвленной цепью. Ответвления от главной цепи создают пространственные препятствия для сближения молекул. Температуры плавления в гомологическом ряду предельных углеводородов медленно возрастают. При этом предельные углеводороды образуют два ряда. Один для гомологов с четным числом углеродных атомов в цепи. Другой – для гомологов с нечетным числом углеродных атомов. Температуры плавления у четных гомологов обычно выше, чем у нечетных. Объяснение данному факту дано из рассмотрения пространственного расположения. Молекулы с четным числом атомов углерода построены симметрично и плотнее упакованы в кристаллической решетке. Поэтому на разрушение более плотной упаковки необходимо затратить больше энергии, что выражается в больших температурах плавления.
Плотность предельных углеводородов вначале быстро, а затем все медленнее возрастает до 0.78.
Предельные углеводороды – вещества неполярные (аполярные) и трудно поляризуемые. Растворимость в воде очень малая.
