
- •Лекция № 1 Предмет и содержание курса «охт»
- •Анализ эффективности проведения хтп
- •Лекция № 2 Химико-технологическая система, ее состав и структура
- •Основные принципы системного подхода
- •Состав хтс
- •Структура хтс
- •Лекция № 3 Основные этапы создания хтс
- •Формы представления хтс (классификация моделей)
- •Классификация технологических схем
- •Лекция № 4 Сырье в химической промышленности
- •Классификация сырья
- •Сырье для промышленности органического синтеза
- •Углеводородные газы
- •Сырье для промышленности неорганического синтеза
- •Выбор и обоснование сырьевой базы
- •Лекция № 5 Закономерности управления химико-технологическими процессами
- •Технологическая классификация химических процессов (модели реакций)
- •Закономерности управления простым необратимым гомогенным процессом
- •Лекция № 6 Закономерности управления простым необратимым гетерогенным процессом
- •Методы интенсификации гетерогенного процесса, протекающего в диффузионной области
- •Процессы массопередачи в гомогенных средах
- •Лекция № 7 Закономерности управления простым обратимым гомогенным процессом
- •Лекция № 8 Закономерности управления сложными процессами
- •Лекция № 9 Закономерности управления каталитическими процессами
- •Основные стадии и кинетические особенности гетерогенно-каталитических процессов
- •Требования к гетерогенным катализаторам:
- •Химические свойства катализатора
- •Физические свойства катализатора
- •Лекция № 11 Теория химического реактора
- •Классификация химических реакторов
- •Материальный баланс реактора
- •Лекция № 12 Гидродинамические модели реакторов. Вывод характеристических уравнений.
- •Реактор идеального вытеснения непрерывного действия
- •Сравнение рис и рив
- •Каскад реакторов идеального смешения непрерывного действия
- •Гидродинамические режимы в реальных реакторах
- •Распределение времени пребывания в проточных реакторах
- •Лекция № 14 Теплоперенос в химических реакторах
- •Уравнение теплового баланса реактора
- •1.Политропический режим
- •2. Адиабатический режим
- •3.Изотермический режим
Лекция № 8 Закономерности управления сложными процессами
Сложными называются процессы, в которых наряду с реакцией, приводящей к образованию целевого продукта (целевой реакцией), протекают побочные реакции.
Характеристика модели:
Выход целевого продукта не равен конверсии реагента β ≠ α;
Выход целевого продукта, даже теоретически не может достигнуть значения 100% β < 100%.
Объекты управления:
Наряду со скоростью процесса, положением равновесия (если реакция обратима) объектом управления в сложных процессах становится селективность.
r = f (С, р, t, kat) или r = f (W, ω, f) в зависимости от лимитирующей стадии
α* = f (C, p, t)
S = f (C, p, t, kat)
Инструменты управления: кинетические параметры.
Рассмотрим, как влияют основные технологические параметры на скорость и селективность сложного необратимого гомогенного процесса.
Пусть
протекают две параллельные реакции, в
которых расходуется реагент А.
![]()
Кинетические кривые для сложно-параллельного процесса имеют вид, представленный на рисунке. Концентрация исходного реагента А уменьшается во времени, а концентрация продуктов C и D увеличивается, причем скорость увеличения зависит от порядка реакции. При n1 > n2 быстрее увеличивается концентрация целевого продукта.

Для анализа воспользуемся понятием дифференциальной селективности, под которой понимают отношение скорости целевой реакции (скорости образования целевого продукта) к общей скорости процесса (скорости расходования реагента).
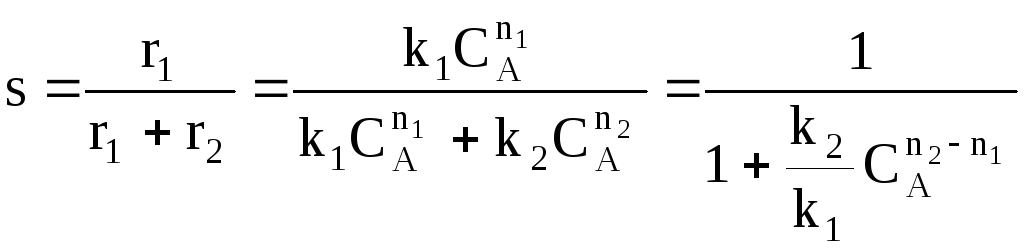
При
условии, что
![]()

Используя полученную формулу, проведем анализ влияния начальной концентрация реагента, степени его превращения, давления и температуры на селективность процесса.
Характер влияния концентрации, давления и конверсии зависит от соотношения порядков целевой и побочной реакции.
Если порядки равны, начальная концентрация, давление и конверсия не влияют на селективность процесса. Если порядок целевой реакции выше, селективность увеличивается при повышении концентрации реагента и давления и уменьшается при достижении высоких конверсий. Если порядок целевой реакции ниже, чем порядок побочной реакции, при увеличении концентрации реагента и давления селективность должна понижаться, а увеличение времени реакции (конверсии реагента) приводит к повышению селективности.
При СА0 ↑ rхим. р. ↑ если n1 = n2 s = const
если n1 > n2 s↑
если n1 < n2 s↓
При αА↑ rхим. р.↓ если n1 = n2 s = const
если n1 > n2 s↓
если n1 < n2 s↑
Для газофазных реакций

При р↑ rхим. р. ↑ если n1 = n2 s = const
если n1 > n2 s↑
если n1 < n2 s↓
Влияние температуры зависит от соотношения энергий активации целевой и побочной реакции.
При t ↑ rхим. р. ↑ если Еа1 = Еа2 s = const
если Еа1 > Еа2 s↑
если Еа1 < Еа2 s↓
Рассмотрим другой тип сложных процессов – сложно-последовательный необратимый гомогенный процесс (консекутивный).
![]()
С течением времени концентрация реагента А снижается. Концентрация промежуточного продукта С вначале увеличивается, достигает своего максимального значения, затем убывает. Концентрация продукта D увеличивается по мере протекания реакции. Величина максимальной концентрации продукта С зависит от соотношения скоростей каждой из последовательных стадий.

Если целевым продуктом является продукт С, то селективность процесса равна

При увеличении начальной концентрации реагента
СА0 ↑ rхим. р. ↑ если n1 = n2 s = const
если n1 > n2 s↑
если n1 < n2 s↓
При увеличении степени превращения реагента
αА↑ rхим. р , s↓
При увеличении температуры
t ↑ rхим. р. ↑ если Еа1 = Еа2 s = const
если Еа1 > Еа2 s↑
если Еа1 < Еа2 s↓
На селективность газофазных процессов будет оказывать влияние давление.

При р↑ rхим. р. ↑ если n1 = n2 s = const
если n1 > n2 s↑
если n1 < n2 s↓
Анализ показал, что в некоторых случаях изменение технологического параметра может привести к увеличению скорости процесса, а селективность при этом уменьшится или к увеличению селективности при снижении скорости процесса. Выбор оптимального значения этого технологического параметра производится путем технологических и экономических расчетов. Очень часто предпочитают получить высокую селективность, особенно если сырье имеет высокую стоимость, высока стоимость отделения и очистки целевого продукта от побочных продуктов, а скорость процесса невелика.
Обобщая вышесказанное, можно сделать следующие выводы:
При разработке технологии сложных процессов основное внимание следует уделить селективности процесса. Другими словами, нужно найти условия, обеспечивающие преимущественное протекание целевой реакции.
Условия проведения процесса определяются на основании экспериментального изучения кинетики процесса (определения порядка всех реакций, энергии активации и др.). Найденные условия можно менять в узком диапазоне.
Самое лучшее решение в задаче повышения селективности процесса – это нахождение селективного катализатора.
