
книги / Физика металлов
..pdfЭта температура значительно превышает температуру плавления, т.е. свойства электронного газа в твердом состоянии практически не зависят от температуры и определяются значениями соответствующих величин при абсолютном нуле.
3. Зонная теория почти свободных электронов. В реаль-
ных кристаллах электроны не являются полностью свободными частицами. На их движение оказывает влияние электростатическое поле положительно заряженных ионов в узлах кристаллической решетки – ионный остов кристаллической решетки.
Основной принцип зонной теории почти свободных электронов заключается в том, что ионы в кристаллической решетке расположены с определенной периодичностью и создают периодическое электростатическое поле, в котором и происходит движение коллективизированных электронов.
Электрон обладает свойствами и частицы и волны, поэтому возможно его отражение от различных плоскостей в кристаллической решетке. Условие отражения определяется уравнением Вульфа – Бреггов:
|
|
2d sin θ = |
nλ , |
где d |
– |
межплоскостное расстояние; |
|
θ |
– |
угол падения электронов |
на кристаллографическую |
плоскость;
n– порядок отражения (1, 2, 3, …);
λ– длина волны излучения.
Для свободного движения электрона энергия является непрерывной функцией волнового вектора. В действительности существуют запрещенные интервалы значений энергии, для которых не существует стационарных состояний электронов (рис. 22). Движение электрона определяется силовым полем ионов, а энергетический спектр распадается на зоны дозволенных энергий – зоны Бриллюэна, разделенные конечными значениями энергий, запрещенными для электронов. Одна зона отделена от другой энергетической щелью, ширина которой определяется симметрией кристалла и направлением импульса.
41
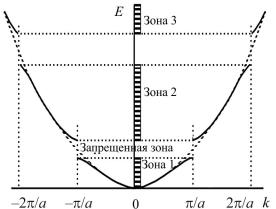
Рис. 22. Зависимость энергии электрона от волнового вектора [21]: а – параметр кристаллической решетки
Зоны Бриллюэна. Под зонами Бриллюэна понимают зоны разрешенных значений энергии при движении по кристаллической решетке, когда электроны не испытывают отражения по закону Вульфа – Бреггов.
Зоны Бриллюэна принято строить в k-пространстве, т.е. в воображаемом пространстве, в котором по осям откладывается значения волнового вектора (см. рис. 22). Зоны Бриллюэна (1, 2 и 3) разделены между собой зонами запрещенных энергий (запрещенные зоны), для которых нет стационарных состояний электронов. В зависимости от ширины запрещенной зоны материалы разделяются на проводники, у которых возможно перекрытие зон Бриллюэна, и полупроводники, у которых ширина запрещенной зоны несколько меньше, чем у диэлектриков.
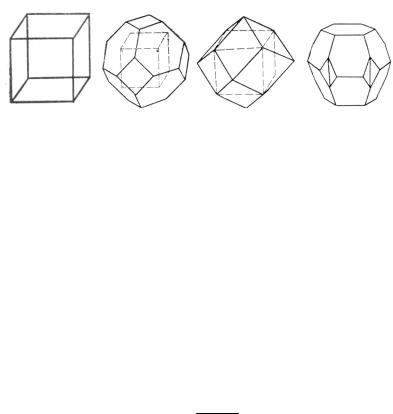
Форма и размер зоны Бриллюэна зависят от индекса отражающей плоскости и типа кристаллической решетки (рис. 23). Для примитивной кубической решетки первая зона Бриллюэна ограничена плоскостью {100}, вторая – {110} и т.д. Первая зона Бриллюэна для ГЦК-решетки ограничена плоскостями {111}
и {100}, для ОЦК – {110}, для ГК – {10.0}, {00.2} и {10.1}.
42
а |
б |
в |
г |
Рис. 23. Зоны Бриллюэна для различных типов кристаллических решеток: а – примитивная кубическая; б – ГЦК; в – ОЦК; г – ГК [20]
Эффективная масса электрона – масса, которая характеризует взаимодействие электрона с кристаллической решеткой и около критических значений энергии стремится кбесконечности.
Таким образом, зонная теория почти свободных электронов предлагает следующую формулу для кинетической энергии электрона:
Е |
= |
h2 |
k 2 , |
|
2m* |
||||
к e |
|
|
где m* – эффективная масса электрона. Проводимость в этой теории
σ = ne2l .
2m*ν ср
Вопросы по главе 3
1.В чем заключаются преимущества и недостатки теоретическогоописанияпланетарноймоделиатома, даннойНильсомБором?
2.Какие принципы квантовой механики вы знаете?
3.На каком представлении основана классическая теория электронов?
4.Что описывает функция распределения Ферми – Дирака?
5.Что такое зоны Бриллюэна?
43

4.ТЕОРИЯ ТВЕРДЫХ РАСТВОРОВ
ИМЕТАЛЛИЧЕСКИЕ СОЕДИНЕНИЯ
Почти все твердые кристаллические тела являются твердыми растворами, металлическими соединениями или состоят из твердых растворов и металлических соединений.
Твердыми растворами называются твердые фазы, которые состоят из двух и более компонентов и сохраняют кристаллическую решетку одного из компонентов, имеют переменный химический состав. Металлические соединения, в отличие от твердых растворов, имеют свою собственную кристаллическую решетку, отличную от решеток составляющих их компонентов.
Среди твердых растворов выделяют три вида:
1. В твердых растворах внедрения, как правило, в качест-
ве растворителя выступает металл, а в качестве растворенного вещества– неметалл (углерод, азот, водород, кислород) (рис. 24, а). Атомы растворенного вещества D располагаются в порах кристаллической решетки металла-растворителя А, так как их размеры близки к размерам пор.
а |
б |
в |
Рис. 24. Виды твердых растворов:
а – внедрения; б – замещения; в – вычитания
44
Твердые растворы внедрения обладают ограниченной растворимостью, а количество атомов на элементарную ячейку раствора в них превышает количество атомов на элементарную ячейку в чистом металле-растворителе.
Углерод, азот, водород, кислород растворяются во многих ОЦК- и ГЦК-металлах по принципу внедрения и располагаются преимущественно в октапорах, так как радиус этих атомов ближе к размерам более объемных октапор, чем тетрапор. Водород же находится в тетрапорах, так как радиус тетрапор больше, чем радиус атомов водорода, и он там легко помещается.
2.В твердых растворах замещения атомы растворенно-
го вещества В замещают атомы растворителя А в узлах его кристаллической решетки и располагаются там хаотически и статистически равномерно (рис. 24, б). При этом сохраняется кристаллическая решетка растворителя и существует возможность образования непрерывного ряда твердых растворов. Количество атомов на элементарную ячейку раствора замещения равно количеству атомов на ячейку в чистом металле-растворителе.
3.Твердые растворы вычитания образуются на основе металлических соединений, где некоторые позиции атомов или
ионов второго компонента оказываются вакантными – |
В |
(рис. 24, в). Такие дефектные решетки имеют растворы |
Sb |
в NbSb, S в CoS, Te в CoTe и Zr в ZrN1+х. Количество атомов на элементарную ячейку раствора вычитания меньше количества атомов на ячейку в исходном веществе.
Правила неограниченной растворимости элементов в твердом растворе
Если всякое взаимодействие между атомами при образовании кристаллической решетки является следствием взаимодействия электронных оболочек этих атомов, то процессы образования твердых растворов должны подчиняться законам квантовой механики. Как правило, формирование твердых растворов
45
рассматривают с полуэмпирических позиций, разработанных главным образом Юм-Розери и его сотрудниками. Установленные закономерности определяют условия возникновения неограниченной растворимости компонентов твердого раствора [22]:
1.Для неограниченной растворимости компонентов твердых растворов замещения их собственные кристаллические решетки должны быть изоморфны, т.е. одинаковы.
2.Разница в величинах атомных радиусов и периодах собственныхкристаллических решетокне должна превышать14–15 %.
3.Элементы должны обладать близкой электроотрицательностью, т.е. схожестью электрохимических свойств. В противном случае возможно образование промежуточных соединений между элементами, что сужает концентрационную область существования твердых растворов, и тем более, чем больше разница в электрохимических свойствах.
4.Близость строения электронных оболочек. Предел растворимости определяется емкостью зоны Бриллюэна, и если достигнута предельная электронная концентрация, т.е. количество валентных электронов, приходящихся на один атом, то кристаллическая решетка растворителя теряет устойчивость и возможно формирование новой кристаллической решетки с большой емкостью первой зоны Бриллюэна, т.е. образование промежуточного соединения.
Если не соблюдается хотя бы одно из приведенных условий, то твердый раствор обладает ограниченной растворимостью.
Исследование нанокристаллических материалов показало увеличение растворимости элементов друг в друге при диспергировании структурных элементов твердого раствора – уменьшение размеров кристаллов, зерен или субзерен. Этот эффект становится заметным при уменьшении размеров частиц менее 100 нм. Эффект увеличения растворимости в наносистемах показан на таких металлических системах, как Fe – Mo, Cu – Al,
Fe – W, Fe – Cu, Al – Fe и др. [23].
46
Периоды в твердых растворах
Атомы растворителя и растворенного элемента, как правило, имеют различные размеры, и поэтому кристаллическая решетка твердого раствора замещения искажена. Наиболее существенные искажения наблюдаются в случае наличия атомов внедрения и образовании вакантных мест в растворах вычитания. Это подтверждается рядом экспериментальных фактов [20]:
1.Изменяется период кристаллической решетки элементарастворителя.
2.Увеличивается удельное электрическое сопротивление.
3.Увеличивается твердость и снижается пластичность. Исследования показали, что при образовании твердых
растворов замещения, как правило, при растворении элемента с меньшим атомным радиусом, чем атомный радиус растворителя, уменьшается период кристаллической решетки, а при растворении элементов с большим атомным радиусом период решетки возрастает. При образовании твердых растворов внедрения объем и период элементарной ячейки возрастают, а в случае твердых растворов вычитания период кристаллической решетки уменьшается.
Самые ранние исследования параметра решетки в твердых растворах показали, что изменение параметра при растворении второго компонента подчиняется линейному закону, который получил название «закон Вегарда» [24]:
а = а1 + (а2 − а1 )с,
где а1 и а2 – периоды кристаллической решетки растворителя
ирастворенного вещества;
с– концентрация твердого раствора.
Более поздние работы показали, что закон Вегарда является лишь грубым приближением. В действительности же зависимость параметра решетки от концентрации твердого раствора
47
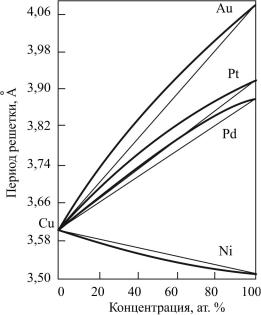
описывается кривыми линиями (рис. 25). Так, для сплавов Ti – Nb, Ti – Ta, Ag – Au зависимость а = f(с) выражается в виде кривой с минимумом, в сплавах Ni-γ-Fe – с максимумом. Известны и противоположные зависимости: при растворении Ni с атомным радиусом 1,244 Å в W с атомным радиусом 1,406 Å период кристаллической решетки не уменьшается, а растет. У сплавов α-Fe с Cr и Cr с Ti период решетки меняется по сложной кривой, имеющей одну и три точки перегиба соответственно [20].
Рис. 25. Зависимости периода кристаллической решетки двухкомпонентных твердых растворов замещения в сплавах меди [20]
Существует несколько объяснений отклонения от закона Вегарда. Во-первых, обнаружили зависимость параметра от упругого взаимодействия компонентов, что определяется их коэф-
48

фициентами сжимаемости (χ1 и χ2) и значением модуля сдвига элемента-растворителя G. Величина поправки в этом случае составляет [20]:
∆ a= c c a − a 4 / 3G1 (χ 1 − χ 2 ) ,
1 2 2 1 1 + 4 / 3G1 (χ 1c2− χ 2c1 )
гдеc1 иc2 – концентрации растворителяи растворенного вещества; а1 и а2 – параметры решетки растворителя и растворенного
вещества.
Во-вторых, отклонения от закона Вегарда объясняют изменением электронного состояния твердого раствора, что обусловлено различием валентности составляющих его компонентов. При этом средний атомный объем раствора, т.е. объем, приходящийся на один атом раствора, зависит от валентности ( f1 и f2 ),
объема ( v1 и v2 ) и концентрации компонентов (c1 и c2) [20]:
v |
тв.р-ра |
= |
c1v1 f1 + c2v2 f2 |
. |
|
|
|
c1 f1 |
+ c2 f2 |
||
|
|
|
|||
Устойчивость твердых растворов
Образование твердых растворов может сопровождаться выделением или поглощением тепла. Если тепло выделяется, то внутренняя энергия раствора понижается, а если поглощается – внутренняя энергия раствора возрастает. Растворы с повышенной внутренней энергией менее устойчивы.
Устойчивость твердых растворов характеризует энергия смешения, которая является разницей между энергией взаимодействия разноименных атомов в растворе и энергией взаимодействия одноименных атомов:
∆ u= uAB− (uAA+ uBB ) / 2,
49
где uAB – взаимнаяпотенциальная энергияразноименных атомов; (uAA + uBB ) / 2 – средняя взаимная потенциальная энергия
одноименных атомов.
Знак величины энергии смешения определяет устойчивость раствора: если энергия смешения отрицательна ( ∆ u < 0), компоненты А и В образуют непрерывный ряд твердых растворов; если энергия смешения положительна ( ∆ u > 0) – при определенной температуре происходит распад на два более устойчивых твердых раствора [20]. При абсолютном нуле растворимость компонентов
АиВпотеореме Нернста(Т→0, S→0) равнанулю.
Внеустойчивых твердых растворах при охлаждении происходит расслоение твердого раствора на две составляющие. Температура максимальной стабильности к расслоению зависит
от энергии смешения ∆ u и от упругих искажений ε , вызванных разницей в атомных размерах компонентов. Эта температура определяется формулой [20]:
Тmax = z(∆ u+ ε ) / 2k.
Здесь возможны два случая: Тmax выше температуры плавления Тпл (рис. 26). Если температура максимальной устойчивости сплава к расслоению выше температуры плавления, то в системе образуется эвтектика. Для обратного случая происходит расслоение твердого раствора на два с большей устойчивостью.
При охлаждении растворов с отрицательной энергией смешения происходят процессы упорядочения, или образование сверхструктур. Исторически это явление обнаружено Н.С. Курнаковым с сотрудниками в 1914 году при исследовании золотомедистых сплавов. Ими показано, что в сплавах 50%Au+50%Cu и 25%Au+75%Cu системы Au – Cu происходит резкое снижение электросопротивления (рис. 27, а). При этих концентрациях образуются так называемые сверхструктуры (рис. 27, б). При упорядочении происходит переход от хаотического расположения атомов в растворе к строго упорядоченному взаимному
50
