
книги / Физико-химические свойства взрывчатых веществ, порохов и твердых ракетных топлив
..pdf
ности реакций не зависит от пути превращения исходных веществ в конечные продукты, а зависит от начального и конечного состояний системы. Он равен алгебраической сумме тепловых эффектов промежуточных реакций. Таким образом, если из одних и тех же исходных веществ получить различными путями одни и те же конечные вещества, то суммы количеств тепла, выделенных на этих путях, будут одинаковы.
Таблица 22
Теплота образования ряда индивидуальных ВВ, компонентов ВВ и продуктов взрыва
Вещество
Тротил
Динитронафталин
Гексоген
Тэн
Октоген
Нитроглицерин
Нитрогликоль
Нитродигликоль Азотнокислый аммоний Азотнокислыйнатрий Азотнокислый калий Азотнокислый кальций Перхлорат аммония
Перхлорат калия Коллодионный хлопок (12,2 % N)
Целлюлоза
Парафин
|
Теплота образования |
|||
Химическая |
при посто- |
|
при постоянном |
|
|
||||
формула |
янном |
|
объеме |
|
|
давлении, |
|
кДж/моль |
кДж/кг |
|
кДж/моль |
|
||
С7Н5N3O6 |
59,4 (74,8) |
|
42,3 |
186,7 |
С10Н6N2O4 |
15,2 |
|
−29,8 |
−138 |
С3Н6N6O6 |
−71,6 (–62) |
|
−93,3 |
−420,3 |
С5Н8N4O12 |
531,6(525,6) |
|
402,3 |
1588,6 |
С4Н8N8O8 |
−46 (−48,3) |
|
− |
− |
С3Н5N3O9 |
365 (374) |
|
344,5 |
1516,6 |
С2Н4N2O6 |
244,0 |
|
229,4 |
1508,6 |
С4Н8N2O7 |
428,2 |
|
407,7 |
2078,3 |
NH4NO3 |
365,7 |
|
354,8 |
4433.0 |
|
|
|
|
|
NaNO3 |
467,6 |
|
462,8 |
5444,7 |
|
||||
KNO3 |
494,4 |
|
489,5 |
4841,5 |
Ca(NO3 )2 |
937,8 |
|
928,0 |
5655,3 |
|
|
|
|
|
NH4ClO4 |
293,8 |
|
281,7 |
2397,7 |
|
||||
KClO4 |
437,4 |
|
431,1 |
3119,1 |
С6Н7N3O12 |
2762,8 |
|
2700,0 |
10310,1 |
|
|
|
|
|
− |
964,0 |
|
946,0 |
5835,3 |
|
||||
C19H40- |
− |
|
− |
2197,6 |
C33H72 |
|
|||
|
|
|
|
|
161
|
|
|
Окончание табл. 22 |
||||
|
|
Теплота образования |
|
||||
|
|
|
|||||
Вещество |
Химическая |
при посто- |
|
|
при постоянном |
|
|
|
|
||||||
формула |
янном |
|
|
объеме |
|
||
|
|
|
|
||||
|
|
давлении, |
|
|
кДж/моль |
кДж/кг |
|
|
|
кДж/моль |
|
|
|
||
Хлористый аммоний |
NH4Cl |
313,7 |
|
|
306,4 |
5726,4 |
|
Минеральные масла |
− |
− |
|
|
− |
~ 2100 |
|
Стеариновая кислота |
C17H5COOH |
933,5 |
|
|
888,2 |
3131,1 |
|
Окись углерода |
CO |
112,5 |
|
|
113,7 |
4060,4 |
|
Двуокись углерода |
CO2 |
395,6 |
|
|
395,6 |
8987,3 |
|
Вода (пар) |
H2Oп |
241,9 |
|
|
240,6 |
13354,6 |
|
Вода (жидкость) |
H2Oж |
286,2 |
|
|
282,5 |
15717,6 |
|
Окись азота |
NO |
−90,4 |
|
|
−90,4 |
−3014,0 |
|
Окись алюминия |
Al2O3 |
1670,2 |
|
|
1666,4 |
16346,3 |
|
Углекислый натрий |
NaCO3 |
1129,7 |
|
|
1126,1 |
10624,1 |
|
Хлористый натрий |
NaCl |
411,6 |
|
|
410,4 |
7019,9 |
|
Хлористый калий |
KCl |
436,8 |
|
|
435,6 |
5843,6 |
|
Двуокись азота |
NO2 |
−33,0 |
|
|
−33,0 |
−717,4 |
|
Применив закон Гесса к реакции взрывчатого превращения, можно считать, что само ВВ является некоторым промежуточным состоянием, аконечнымсостояниемявляютсяпродуктывзрыва.
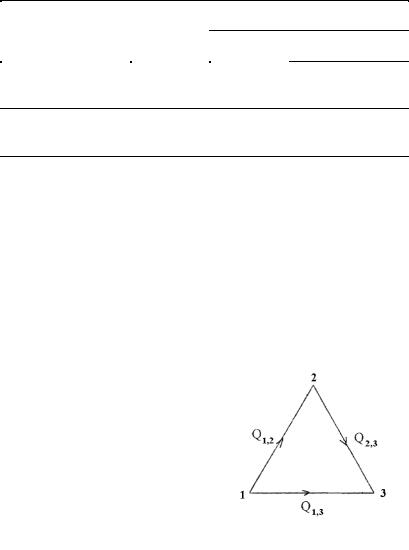
Вычисление теплоты взрыва |
|
по теплотам образования на осно- |
|
вании закона Гесса можно иллю- |
|
стрировать следующей схемой, |
|
которую называют треугольником |
|
Гесса (рис. 10). На этой схеме |
|
вершины углов треугольника со- |
|
ответствуют различным состояни- |
|
ям системы: состоянию 1 (началь- |
Рис. 10. Схематическое |
ное состояние) соответствуют сво- |
изображение закона Гесса |
бодные элементы, из которых состоит взрывчатое вещество; состоянию 2 – ВВ и состоянию 3 – продукты взрыва (конечное состояние). Для перехода системы из первого состояния в третье
162
мыслимы два пути. По одному из них вначале из свободных элементов получается взрывчатое вещество и при этом выделяется или поглощается количество тепла Q1-2 (теплота образования ВВ), затем взрывчатое вещество взрывается и выделяется количество тепла Q2-3 (теплота взрыва). По другому пути – непосредственно из элементов образуются продукты взрыва, и выделяется теплота образования продуктов взрыва Q1-3 .
Алгебраическая сумма теплот реакций при переходе системы по первому пути, согласно закону Гесса, равняется теплоте, выделенной системой при переходе ее пo второму пути, т.е.
Q1-2 + Q2-3 = Q1-3,
откуда теплота взрыва Q2-3 выразится уравнением
Q2-3 = Q1-3 – Q1-2
Следовательно, теплота взрыва равняется теплоте образования продуктов взрыва минус теплота образования взрывчатого вещества.
Здесь следует отметить, что для вычисления теплоты взрыва необходимо знание уравнения взрывчатого превращения вещества.
Вследствие того, что реакции взрывчатого превращения протекают с очень большими скоростями и газообразные продукты взрыва за время реакции не успевают заметно расшириться, считают, что эти реакции протекают при постоянном объеме и за теплоту взрыва принимают QV.
Теплоты образования продуктов взрыва, а также теплоты образования BВ при вычислении обычно берутся из соответствующих термохимических таблиц. Следует указать, что в этих таблицах обычно приведены теплоты для реакций, протекающих при постоянном давлении (Qp), а так как за теплоту взрыва чаще принимается теплота, выделившаяся при постоянном объеме QV, то следует внести поправку на работу, совершаемую продуктами взрыва при их расширении.
163
Qv = Qp + P(V2 – V1),
где V1 и V2 – начальный и конечный объемы продуктов взрыва. При расширении продуктов взрыва до атмосферного дав-
ления и температуры +18 °С, пренебрегая величиной V1 ввиду ее малости по сравнению с V2, получим численное значение для второго члена правой части уравнения:
P(V2 – V1) ≈ 2,42n,
где п – число молей газообразных продуктов взрыва.
Тогда уравнение Qv = Qp + P(V2 – V1) приобретает следующий вид:
Qv = Qp + 2,42n
При расчетах (и при экспериментальных определениях) необходимо также указывать, в каком агрегатном состоянии находится вода в продуктах взрыва – в парообразном или жидком, подставляя соответствующие значения теплоты образования в уравнение. Qвзр для парообразной воды меньше Qвзр для воды жидкой на величину теплоты конденсации водяных паров.
Приотсутствиисправочныхданныхотеплотеобразованиятех илииныхсоединенийихможнополучитьрасчетнымспособом.
Теплота образования является достаточно точной константой веществ. Однако состав продуктов взрыва может быть различным в зависимости от конечных параметров состояния газов, что связано с константами равновесия между обратимыми реакциями в продуктах, являющимися функцией температуры. Тогда и теплота взрыва данного ВВ перестает быть постоянной величиной, если только не будут заданы какие-либо конечные условия, общие для ВВ любого химического состава и позволяющие однозначно устанавливать состав продуктов взрыва.
Наиболее соответствующим этому положению следует признать условие, отвечающее максимальному изменению энтропии системы в процессе взрыва с образованием термодинамически наиболее устойчивых соединений. Выбранное условие
164
отвечает максимальному тепловыделению Qmax при взрыве, причем Qmax является константой ВВ, так как не зависит от параметров конечного состояния продуктов взрыва.
Другое возможное условие – максимальный объем продуктов взрыва – основано на принципе Ле-Шателье, согласно которому при свободном и неограниченном расширении продуктов взрыва система будет стремиться к равновесию, отвечающему наибольшему их объему. Это условие менее определенное, чем первое, так как само по себе требует дополнительных оговорок, чтобы избежать невероятныx ситуаций. Так, например, трудно себе представить устойчивое сосуществование в продуктах взрыва свободного водорода или оксида углерода и свободного кислорода, хотя левые части уравнений имеют больший объем газов, чем правые:
2Н2 + О2 = 2Н2О и 2СО + О2=2СО2.
Поэтому условливаются, что данный принцип (наибольший объем газа) прежде всего требует отсутствия в продуктах взрыва твердого углерода. Если кислорода не хватает для полного окисления углерода и водорода, то последовательность реакций, согласно данному принципу, будет такой, как в схеме ЛеШателье, т.е. сначала весь углерод окисляется до СО, затем оставшийся кислород поровну распределяется на окисление СО до СО2 и Н2 до Н2О, но с учетом равновесия реакции водяного газа. При наличии алюминия в составе ВВ предполагается, что сначала окисляется С (до СО), а затем – алюминий. При достатке кислорода образуются продукты полного окисления, т.е. СО2 и Н2О. И тогда данное условие совпадает с предыдущим. С учетом этой оговорки QV mах можно рассматривать так же, как некоторую константу ВВ, причем QV mах ≤ Qmах (равенство имеет место при нулевом или положительном кислородном балансе).
Экспериментально измеренные теплоты взрыва не совпадают с обеими указанными идеализированными величинами, они всегда меньше, чем QV mах. Это объясняется тем, что в реальных условиях эксперимента всегда фиксируется некоторое
165

равновесное состояние газов. Наибольшее совпадение с QV mах получается для ВВ с нулевым и небольшим положительным кислородным балансом, что объясняется малой скоростью реакций диссоциации CO2 и Н2О. Для ВВ с большим положительным кислородным балансом совпадение менее полное из-за образования при взрыве окислов азота. Наименее полное совпадение для ВВ с отрицательным кислородным балансом, где тепловой эффект взрыва сильно зависит от плотности ВВ и ряда других факторов. Для этих ВВ теплота взрыва экспериментальная занимает промежуточное положение между QV mах и Qmах.
Чтобы приблизить расчетное значение теплоты взрыва к экспериментальным, пользуются рядом условных приемов. Так, Б.Я. Светлов для ВВ с отрицательным кислородным балансом рекомендует пользоваться среднеарифметической величиной между QV mах и Qmах. Другие авторы конечные продукты отбирают на основе каких-либо схематизированных уравнений реакций взрывчатого превращения.
Г.А. Авакян предложил упрощенный способ расчета теплоты взрыва, не требующий знания конечного равновесного состава продуктов взрыва. Им принято, что сам состав продуктов взрыва, аследовательно, и теплота их образования– функции кислородного коэффициента ВВ, под которым понимается отношение имеющегося в ВВ кислорода к количеству, необходимому для получения полных продуктов окисления. Если ВВ имеет химическую формулу CaHbOcNd, токислородныйкоэффициент
KK = |
с |
|
100 %. |
|
2а + b |
2 |
|||
|
|
|||
|
|
|
Теплота образования фактических продуктов взрыва принимается пропорциональной теплоте образования продуктов, отвечающих Qmax, т.е.
Qпродуктов взрыва = k ·Qпродуктов взрыва max,
где коэффициент k < l и, согласно экспериментальным данным, является степенной функцией от кислородного коэффициента k = 0,32 КК0,24.
166
Получив значение Qпродуктов взрыва, на основании закона Гесса можно высчитать Qвзр для исследуемого ВВ.
Эмпирическая формула k = 0,32 КК0,24 получена для ВВ с плотностью 1,6 г/см3, поэтому предложенный метод расчета применим к высокоплотным ВВ.
Итак, константой ВВ может быть только некоторая идеализированная теплота взрыва, основанная на каком-либо правиле отбора состава продуктов взрыва независимо от конкретных условий их расширения и физического состояния ВВ.
Пользоваться такой величиной для инженерных расчетов, связанных, например, с оценкой эффективности взрыва, нужно аккуратно, сопоставляя принятые условия определения с реальными условиями взрывания.
Наиболее достоверными и в наименьшей мере колеблющимися следует считать расчетные данные по Qвзр для ВВ с кислородным балансом, близким к нулевому. Истинная теплота взрыва, т.е. то количество тепла, которое реально выделяется в заданных условиях взрывания и взаимодействия с окружающей средой, может быть определена только путем точных термодинамических расчетов с учетом констант равновесия обратимых газовых реакций, отвечающих заданным условиям, либо экспериментально в условиях, достаточно близко моделирующих практические.
При экспериментальном определении Qвзр для ВВ с отрицательным кислородным балансом обнаружено сильное влияние плотности ВВ, заполнения пустот между частицами ВВ жидкостями, толщины металлической оболочки заряда и некоторых других факторов. Это влияние тем сильнее, чем более отрицательным является кислородный баланс ВВ.
Прирост теплоты взрыва с увеличением плотности объясняют сдвигом равновесия реакции генераторного газа
2СО ↔ CО2 + C + Q
в правую сторону в результате увеличения давления взрыва.
167
Подтверждением тому может служить состав продуктов взрыва при разных плотностях.
Заполнение пустот инертной жидкостью по действию аналогично уплотнению ВВ. Средняя плотность заряда в этом случае повышается, соответственно повышается давление в детонационной волне (в зоне реакции) и увеличивается тепловыделение в результате сдвига равновесия реакции генераторного газа. Экспериментально подтверждено, что с увеличением плотности наполнителя теплота взрыва возрастает.
Для крупных зерен (гранул) индивидуальных ВВ детонация может распространяться по зернам. В этом случае роль наполнителя сводится к созданию вокруг каждого зерна малосжимаемой оболочки, и реакция взрывчатого превращения происходит при «местной» плотности ВВ, т.е. плотности гранулы или сростка кристаллов.
Наличие массивной оболочки препятствует быстрому расширению продуктов взрыва и благоприятствует завершению реакций с максимальным тепловыделением, происходящим при высоких давлениях. Справедливость такого объяснения подтверждается отличиями в составе продуктов взрыва в зависимости от условий взрывания.
Вода жидкая, в остальных случаях вода – пар.
Казалось бы, что в процессе расширения газов и спада давления должны происходить обратные эндотермические реакции, однако равновесные состояния могут не поспевать за охлаждением продуктов взрыва, наступает закалка ложного равновесия и эндотермической реакции не происходит; тепловой эффект взрыва сохраняется на высоком уровне.
Влияние плотности на величины экспериментальной теплоты взрыва некоторых ВВ показано в табл. 23.
Обработка опытных данных позволяет аппроксимировать зависимость теплоты взрыва от плотности для ВВ с отрицательным кислородным балансом как линейную с различными коэффициентами для следующих ВВ:
168

|
|
|
|
|
Таблица 23 |
|
|
Зависимость теплоты взрыва от плотности ВВ |
|||||
|
ВВ |
|
Плотность, г/см3 |
|
Теплота взрыва, |
|
|
|
|
|
|||
|
|
|
|
|
кДж/кг |
|
|
|
|
0,5 |
|
5 352* |
|
|
|
|
1,0 |
|
5 770* |
|
|
Гексоген |
|
1,8 |
|
6 313* |
|
|
|
0,95 |
|
5 310 |
|
|
|
|
|
|
|
||
|
|
|
1,1 |
|
5 352 |
|
|
|
|
1,5 |
|
5 394 |
|
|
|
|
0,85 |
|
3 387...3 554 |
|
|
Тротил |
|
1,0 |
|
3 596…3 679 |
|
|
|
1,5 |
|
4 223 |
|
|
|
|
|
|
|
||
|
|
|
1,62 |
|
4 850 |
|
для гексогена
QV = 5759 + 700 (ρ0 – 1), кДж/кг;
для тротила
QV = 4202 + 1034 (ρ0 – l), кДж/кг;
для тетрила
QV =4369 + 1440 (ρ0 – l), кДж/кг.
Если пустоты в заряде будут заполнены более тяжелой жидкостью, чем вода, например, водными растворами солей, то плотность заряда еще более повышается и соответственно повышается теплота взрыва. Особый практический интерес представляет заполнение пустот между зернами ВВ с отрицательным кислородным балансом растворами окислителей. В этом случае достигается комбинированный эффект вследствие высокой плотности заряда и участия в реакции взрыва растворенного окислителя. Например, смесь, содержащая 67 тротила и 33 % раствора аммиачной селитры (60 %-ного), имеет плотность около 1,35 г/см3 и теплоту взрыва 4431 кДж/кг против 1,24 г/см3 и 2717 кДж/кг для смеси тротила с чистой водой в том же соотношении.
169

3.2.2. Задачи для самостоятельного решения
1. Подсчитать теплоту взрыва тротила, если он разлагается по следующему уравнению:
С6Н2(NО2)3 · СН3 = 2СО +1,2СО2 + 3,8С + 0,6 Н2 +1,6 Н2O +
+1,4N2 + + 0,2NH3 + QV
2. Вычислить теплоту взрыва одного килограмма нитроглицерина Qv, если он разлагается по следующему уравнению:
2С3Н5(NО2)3 = 6CO2 + 5H2O + 3N2 + 0,5O2 +QV.
3. Уравнение разложения 1, 3, 5-тринитробензола по опытным данным имеет следующий вид:
C6H3(NО2)3 = 0,25CО2 + 5CO + 0.75C + 0.5H2О + H2 + 1.5N2+ QV.
Вычислить тепловой эффект взрыва одного килограмма тринитробензола Qv.
4. Вычислить теплоту взрыва одного килограмма азида свинца Qv, если последний разлагается по следующему уравнению:
PbN6 = Pb+3N2 + QV. |
|
Молекулярная теплота образования |
азида свинца Qp = |
= –448 Дж/моль. |
|
5. Амматол 80/20 [80 % NH4NO3 и 20 % С6Н2(NО2)3 · СН3] |
|
при взрыве образует продукты полного |
окисления углерода |
и водорода. Вычислить теплоту взрыва одного килограмма амматола (Qv).
6. Подсчитать теплоту взрыва тетрила Qvk, если последний
разлагается по уравнению |
|
С6Н2(NO2)3N |
CH3 |
→ |
|
|
NO2 |
→3,1CO+1,6CО2+0,6H2+1,7H2O+2,3N2+0,1CH4+0,2С2N2 + +1,8С.
170
