
книги / Изобретенческая реальность принципы достижения технических преимуществ в объектах техники с помощью физических явлений, свойств и эффектов
..pdf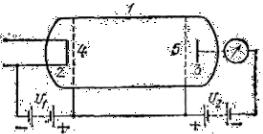
Диаметры ядер разных атомов несколько различны (диаметр ядра тем больше,чем больше масса атома) и составляютоколо 10–12 см.Раз- мер ядра оказался примерно в 10 тысяч раз меньше размера атома. Если визуально представить строение атома, то ядро атома заключе- но в оболочку из быстро вращающихся вокруг него электронов, кото- рые заполняют весь объём атома, а внутри оболочки тяжёлое атомное ядро. Внутри плотной среды (жидкости или твердого тела) «визуаль- но» имеется перемешивающийся «туман» или газ из легких электро- нов, которые заполняют весь объем вещества. В этом «бушующем тумане» довольно редко расположены крошечные, но тяжелые атом- ные ядра, отстоящие друг от друга на расстояниях, в десять тысяч раз превышающих размеры самих ядер. Покоя, как в макромире предме- тов, там нет, есть непрерывное хаотичное с огромными скоростями движение, которое создаёт прочный объём у атомов, а уже атомы — и форму и объём у тел.
Заряд ядра равен некоторому числу элементарных зарядов.Так как атомвцеломнейтрален,точислоэлектроновватомеравноэтомучислу. Следовательно,порядковый номер элемента втаблице Д. И. Менделее- ва имеет глубокий физический смысл: порядковый номер элемента
является зарядом атомного ядра в элементарных единицах заря- да и одновременно числом электронов в атоме.
О свойствах атомов поведало изучение таких атомных процессов, которые сопровождаются изменением внутренней энергии атома. К ним относят столкновения электронов с атомами, испускание и по- глощение света атомами.
Устройство для измерения потери энергии электроном при движении в парах ртути
содержит: трубку 1 с большим
разрежением, накалённый
катод 2, анод 3 и управляющие сетки 4 и 5, гальванометр в цепи.
В трубку 1 введено небольшое количество одноатомных паров какого-нибудь вещества, например ртути.
Электроны, испускаемые накалённым катодом 2, ускоряются раз- ностью потенциалов U1 действующей между катодом 2 и металличе- ской сеткой 4. Благодаря очень малой концентрации атомов в трубке 1 электроны пролетают короткий путь между катодом и первой сет- кой без столкновений и приобретают энергию равную (e . U1).
Путь между сетками 4 и 5 выбирается такой длины, чтобы каждый электрон испытал хотя бы одно соударение с атомами ртути. Между
280
сеткой 5 и анодом 3 действует разность потенциалов U2, тормозя- щая электроны, поэтому до анода 3 могут дойти только те электроны, энергия которых больше (e . U2). При наименьшем значении U2, при котором электроны не доходятдо анода 3, гальванометр в цепи анода 3 покажет отсутствие тока.Измерив запирающую разность потенциа- лов, можно установить, теряют ли электроны энергию при столкно- вениях с атомами ртути. Передача энергии от электронов к атомам существенно зависит от энергии электрона. Пока энергия электронов меньше, чем 4,9 эВ (U1 < 4, 9 эВ), электроны не теряют энергии при соударениях с атомами и U2 = U1. Но когда энергия электронов дости- гаетили несколько превышает4,9 эВ (U1 ≥ 4,9 эВ),потеря энергии при соударенияхсразустановитсязначительнойиU2 <<U1.Пристолкнове- нии электрон отдает, а атом ртути принимает всегда именно эту одну порцию энергии,равную 4,9 эВ. Эта величина характеризует свойство атома ртути, то есть энергия его может меняться только на конечную величину, равную 4,9 эВ. Меньшую энергию атом ртути не восприни- мает.
Известно, в макромире энергия любого тела или системы тел впринципеизменяетсянепрерывноискольугодномалымипорциями. В случае с атомом ртути непрерывное изменение энергии невозмож- но: энергия атома ртути меняется только прерывно и на определён- ную конечную величину, что указывает на прерывность (дискрет- ность) энергетических состояний атомов.
Элементы в газообразном состояниидаютлинейчатые спектры ис- пускания и поглощения света. Каждому элементу свойственны опре- деленные спектральные линии,отличные отлиний других элементов. Атомы газа, находясь в среднем на больших расстояниях, не влияют друг на друга, поэтому частоты линейчатого спектра элемента опре- деляются свойствами отдельного атома этого элемента. Световая энергия в виде мельчайших неделимых порций — квантов изучается и поглощается атомами. Энергия кванта пропорциональна частоте ν света и равна (h . ν), где h = 6,6 . 10–34 Дж . сек — постоянная Планка. Энергия испущенного атомом кванта по закону сохранения энергии равна разности энергий атома до и после излучения: h . ν= W — W’.
Энергия атома может изменяться только на некоторые опреде- ленные значения. Зная спектр вещества, можно найти эти значения с помощью этого соотношения. Энергия атома не может изменять- сянепрерывно.Онаизменяетсяскачкаминаопределенные,конечные порции, различные для разных атомов. Энергия атома не может быть любой, а может принимать только некоторые избранные значения, характерные для каждого атома. Возможные значения внутренней энергии атома получили название энергетических или квантовых уровней.
281
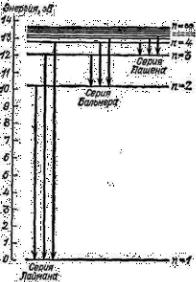
Схема энергетических уровней атома водорода (рисунок слева), по- строенная на основе спектральных данных, имеет вид ряда параллель- ныхлиний.Расстояние междудвумя линиями равно разности энергий двух состояний атома водорода и, следовательно, пропорционально частоте кванта,излучаемого при пе- реходеизодногосостояниявдругое, более низкое. Поэтому расстояния между уровнями выражают в неко- тором масштабе частоты спектраль- ных линий водорода.
Горизонтальные линии — это энергетические уровни n = 1, n = 2, n= 3 …
За начало отсчета по шкале энер- гий принята наименьшая внутренняя энергия атома водорода — уро- вень n= 1. Вертикальные линии это переходы с верхних энергетиче- ских уровней на нижние. Длина такой линии дает энергию светового кванта(h . v),излучаемогоприданномпереходе(серияЛаймана,серия Бальмера, серия Пашена).
Атом, находящийся в одном из высших энергетических состояний (n>1)черезнезначительныйпромежутоквремени(около10–8 сек,поч- ти мгновенно) переходит на более бедное энергией состояние, испу- ская соответствующий квант. Из низшего энергетического состояния n= 1 атом не может самопроизвольно (без сообщения энергии извне) перейтивдругоесостояние:нениже,невыше.Этосостояниеявляется устойчивым с минимумом энергии, к которому атомы стремятся.
При нормальных условиях все атомы находятся на низшем энерге- тическом уровне, и потому газ не светится. Сообщая атому энергию, то есть,возбуждая его,мы переводим атом из нормального (низшего) состояния на одно из высших энергетических состояний. Для водоро- да расстояние от низшего энергетического уровня n= 1 до ближайше- го высшего уровня определяется энергией в 10,1 эВ. Это наименьшая порция энергии, которую находящийся на низшем состоянии атом водорода может поглотить. Меньшую энергию он не воспринимает, так как у него не существует состояний, энергия которых отличается от энергии нормального состояния меньше, чем на 10,1 эВ (в частно- сти,для ртути она = 4,9 эВ).
Представление о квантовых энергетических уровнях атомов было введено в физику Н. Бором (1913 г). Оно объяснило линейчатый ха-
282
рактер атомных спектров как результат процессов спонтанного (са- мопроизвольного) излучения и резонансного (избирательного) по- глощения света атомами.
А. Эйнштейн (1919 г.) показал (путём теоретических рассуждений), что наряду с процессами спонтанного излучения и резонансного по- глощениясуществуеттретийпроцесс —вынужденного(индуцирован- ного) излучения. Свет резонансной частоты, которую атомы способ- ны поглощать, при переходе атома на более высокий энергетический уровень вызывает высвечивание тех атомов, которые уже находятся на этом верхнем уровне, если они имеются в исследуемой среде. Ха- рактерная особенность вынужденного излучения состоит в том, что испускаемый свет неотличим от вынуждающего света, т. е. совпадает с ним по всем признакам — по частоте, фазе, поляризации и направ- лению распространения. Это означает, что вынужденное излучение добавляет в световой пучок точно такие же кванты, какие извлекает из него резонансное поглощение. Если среда содержит на нижнем энергетическом уровне больше атомов, чем на верхнем, то преобла- дает процесс поглощения — световой пучок ослабляется средой. Если больше населен атомами верхний энергетический уровень, то преоб- ладаетвынужденное излучение и среда усиливаетпроходящий свет — среда становится активной. Это явление стало основой технического преимущества и получило применение в очень перспективных при- борах — квантовых усилителях и генераторах света.
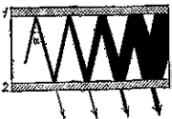
Схема оптического квантового гене- ратора (рисунок справа) содержит пло- скопараллельные зеркала 1 и 2, причём зеркало 2 полупрозрачно.
Пространство между зеркалами за- полнено активной средой, то есть сре- дой, содержащей больше возбужденных атомов, чем невозбужденных. Среда
усиливаетпроходящий через неё свет,начало которому даетспонтан- ное излучение одного из её атомов.
Большое усиление достигается при очень малом угле α. Свет испы- тываетмножество отражений,лучи накладываются,усиливая другдру- га с образованием в пространстве между пластинами 1 и 2 стоячей све- товой волны. Излучение генератора выходит наружу через зеркало 2.
Генератор излучает свет с частотой соответствующей разности энергий уровней, участвующих в процессе. На этом принципе по- строены генераторы и усилители,действующие в диапазоне коротких радиоволн, инфракрасного, видимого и ультрафиолетового света.
При излучении света атомы переходят с верхнего уровня на ниж- ний,игенерацияприводиткбыстромууменьшениюизбытканаселён-
283
ности верхнего уровня. Если не восполнять уменьшение, то действие генератора прекратится, как только избыточная населённость сни- зится до некоторого предельного уровня. В обычных условиях всегда сильнее заселён нижний уровень.Для перехода в него подвод энергии не требуется, поэтому охлаждённые вещества не светятся.
С повышением температуры населенность возбужденных уровней возрастает и появляется свечение. Но добиться, чтобы верхний уро- вень стал более заселённым, чем нижний, с помощью нагрева нельзя. Чтобыверхнийуровеньсталболеезаселённым,чемнижний,тоэтодо- стигается только с помощью специальных методов, один из которых применён в оптическом квантовом генераторе на рубине. Рубин это кристалл окиси алюминия Al2 O3 (корунд), который содержит неболь- шуюпримесьокисихрома.Дляработыквантовогогенератораисполь- зуются энергетические уровни ионов хрома, входящих в рубин.
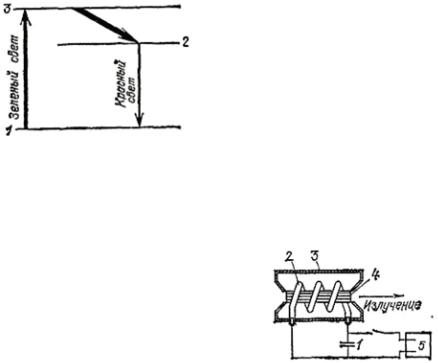
Схема уровней атомов хрома показана ниже.
Освещая кристалл зелёным све- том, можно перевести атом хрома
сосновного уровня 1 на уровень 3.
Суровня 3 атом хрома в большин- стве случаев переходит на уровень 2 без излучения, отдавая энергию кристаллической решётке корунда, а уже с уровня 2 на уровень 1 ис- пускает красное излучение. Ско-
рость переходов с уровня 3 на уровень 2 втысячи раз больше скорости перехода с уровня 2 на уровень 1. Благодаря этому атомы «оседают» на уровне 2. Если кристалл освещать зелёным и синим светом очень большой интенсивности,то на уровень 2 можно перевести больше по- ловины атомов хрома, содержащихся в кристалле, т. е. получить «не- естественное» соотношение населённостей уровней, которое нужно для работы квантовых генераторов.
Устройство рубинового генератора со-
держит: 1 — конденсатор, 2 — газоразрядную лампу,3—отражающийкожух,4—рубиновый стержень и 5 — источник питания.
«Накачивающая» вспышка зелёного и синего света возникает при разряде конденсатора 1 при зажигании импульсной газоразрядной лампы 2, помещённой в отражающий кожух 3.
Лампа в виде спирали окружает рубиновый стерженёк 4 со строго плоскопараллельными отполированными торцами, на которые на-
284
несены зеркальные слои. Как только под действием «накачивающей» вспышки на энергетическом уровне 2 накопится достаточный избы- ток атомов по сравнению с уровнем 1, то возникает рассмотренный ранее процесс генерации света с частотой,соответствующей разности уровней 2 и 1, а именно: красный свет с длиной волны около 690 нм.
Через один из своих торцов, выполненный полупрозрачным, ру- бин испустит узкий красный луч. Луч будет в высокой степени парал- лельным,так как генерация происходит на волнах, многократно про- ходящих вдоль кристалла, отражаясь от зеркал на его концах (волны распространяются перпендикулярно к торцам рубинового стержня). Очевидно, что излучение такого лазера будет продолжаться только во время разряда конденсатора 1 через газоразрядную лампу 2.Такой лазер работает в импульсном режиме. При ином механизме возбуж- дения можно обеспечить непрерывную генерацию света лазером, что легко осуществимо в газовых лазерах.
Очень важным свойством излучения квантового генератора явля- етсякогерентностьиспускаемойсветовойволны(волны,испускаемые разными участками светящейся поверхности генератора, находятся в одной фазе колебания и являются правильными в том смысле, что их частота постоянна, а фаза не испытывает нерегулярных измене- ний). В этом отношении квантовые генераторы намного превосходят все другие источники света и,по существу,не отличаются от обычных генераторов радиоволн.
Когерентность, правильность излучения квантового генератора обусловлена тем, что вынужденно испущенный свет строго согласо- ван с вынуждающим светом и неотличим от него. Правильность из- лучения квантового генератора настолько велика, что с некоторыми типами таких устройств удается наблюдать интерференцию пучков света,испускаемыхдвумянезависимымигенератора(собычнымиис- точниками света такой результат не получается). Когерентность, мо- нохроматичность и направленность излучения квантовых генерато- ров позволяютс помощью собирающихлинз фокусировать излучение на малую площадь размером порядка квадрата длины волны света. Концентрация энергии в фокусе оказывается настолько большой, что лучрубиновогогенератора,сфокусированныйнастальнуюпластинку, мгновенно прожигает в ней тончайшее отверстие.
Свойства квантовых генераторов имеют применение в меди- цине (хирургия), сварке, лазерной обработке и термообработке. В ла- зерном оружии, спектроскопии, зондировании поверхностей Земли и планет, адаптивной оптике, лазерном намагничивании и охлажде- нии, в манипулировании микрообъектами, в термоядерном синтезе.
Существованиедискретныхэнергетическихуровнейявляетсяфун- даментальным свойством атомов (так же как и молекул и атомных
285

ядер). Между ядром (атома водорода) и электроном действует сила притяжения электрических зарядов (тогда как в макромире предме- тов доминируют гравитационные силы — слабейшие в микромире). Наличие этой силы обеспечивает радиальное (центростремительное) ускорение,благодаря чему лёгкий электрон вращается вокругтяжёло- го ядра по круговой или эллиптической орбите (подобно планетарной системе). Различным возможным состояниям атома соответствует
иразличие в размерах (и форме) орбиты электрона, вращающегося вокругядра.Основномуэнергетическомууровнюатомасоответствует орбита наименьшего радиуса.Электрон нормально находится на этой орбите. При сообщении достаточно большой порции энергии элек- трон переходит на другой энергетический уровень: «перескакивает» наоднуизвнешнихорбит.Втакомвозбужденномсостоянииатомнеу- стойчив. Через некоторое время электрон переходит на более низкий уровень: самопроизвольно «перескакивает» на орбиту меньшего ра- диуса.Переходэлектронасдальнейорбитынанижележащуюсопрово- ждается испусканием светового кванта.Электрон не можетвращаться вокруг ядра по орбите произвольного радиуса, поэтому существуют дозволенные и недозволенные орбиты. Всякий заряд, движущийся
сускорением,излучает электромагнитные волны,а излучение уносит энергию, но атом остаётся устойчивым в основном состоянии, без ис- пускания излучения.В атоме электрон движется с большой скоростью по орбите малого радиуса и обладает огромным центростремитель- ным ускорением, но падения на ядро не происходит.
Потенциальная энергия электрона больше на дальней орбите, ибо для отдаления электрона от ядра нужно совершить работу про- тив сил электрического притяжения,действующих между электроном
иядром.Этаработаидётлишьнаувеличениепотенциальнойэнергии. При переходе электрона с дальней орбиты на нижележащую умень-
шение его потенциальной энергии равно удвоенному приросту кинетической энер- гии (у обычных тел подобное превращение идёт пропорци- онально и непрерывно).
В более сложных атомах электроны могут двигаться вокруг ядра только по опреде- ленным избранным орбитам.
Возможные орбиты элек- тронов в атоме (рисунок сле- ва) группируются в систему оболочек в виде концентриче-
286
ских сфер, окружающих ядро. Каждая из оболочек содержит опреде- ленное число орбит, на каждой из которых может находиться только один электрон.
Оболочка K наименьшего радиуса содержитдве орбиты. На второй оболочке L имеется восемь орбит. Столько же орбит на третьей обо- лочке M. Далее идет четвертая оболочка N с 18 орбитами и т. д.
Внешние электроны атома связаны с ядром значительно сла- бее внутренних, сказывается отдалённость от ядра и отталкивание внутренних электронов, связанных с положительным ядром. Что- бы оторвать от атома один из внешних электронов, нужна энергия от 5 до 20 эВ в зависимости от рода атома. Для того чтобы перевести какой-либо внешний электрон на вышележащую оболочку, не отры- вая его от атома,достаточна ещё меньшая энергия. При возвращении такого электрона на нижележащую оболочку будет испущен световой квант с энергией, не более 5 ÷ 20 эВ, которая соответствует волне дли- ной лежащей в области видимого или ультрафиолетового света. Ис- пускание света в оптических областях спектра связано лишь с поведе- нием внешних электронов атома.
Для отделения внутренних электронов от ядра атома нужна более значительная энергия, растущая очень быстро с увеличением заряда атомного ядра. Поэтому переход электронов с L оболочки и вышеле- жащих оболочек (М и N) на свободное место в K оболочке приводит к испусканию квантов большой энергии с малой длиной волны, соот- ветствующей рентгеновскому излучению.
Известный механизм образования рентгеновского излучения, например в рентгеновской трубке, основан на резком торможении электронов в веществе анода (тормозное излучение). Уточнение это- го механизма состоит в том, что электронная бомбардировка анода в рентгеновской трубке приводит к вырыванию электронов из вну- тренних оболочек атомов, составляющих анод. На освободившиеся места переходят электроны из внешних оболочек тех же атомов. При таких переходах испускается рентгеновское излучение, получившее название характеристического рентгеновского излучения данно-
го атома.
Следовательно, испускание рентгеновского излучения атомами связано с внутренними электронными оболочками атомов. Имен- но поэтому изучение рентгеновских спектров даёт ценные сведения о строении внутренних электронных оболочек атомов.
Периодический закон изменения химических свойств элементов, открытый Д. И. Менделеевым,является отражением закономерностей строения атомов. Химические свойства проявляются при сближении атомов, при взаимодействии их электронных оболочек. Поэтому хи- мические особенности атома определяются строением его электрон-
287

ных оболочек или что то же зарядом атомного ядра. В этом причина того, что элементы в периодической системе располагаются в поряд- ке возрастания заряда ядра. Этим же объясняется совпадение хими- ческих свойств атомов изотопов, ядра которых отличаются по массе, но имеют равные заряды. В таблице Д. И. Менделеева у каждого эле- мента возможные орбиты электронов группируются в оболочки K, L, M, N …Номер группы (по вертикали) в периодической системе Мен- делеева, куда входит элемент, равен числу электронов на последней из занятых оболочек атома.
Впервую группу (рисунок слева) входят водород
содним электроном в K оболочке, литий также с од- ним электроном в L оболочке, натрий с од-
ним электроном в M оболочке и т. д. Все эти элементы обладают сходными химическими свойствами.
Во вторую группу (рисунок справа) входят бериллий с двумя электронами в L оболочке, магний с двумя электронами в M оболочке, ит. д.Элементы второй группытакже химиче- ски весьма сходны.
Аналогичное положение имеет место и для остальных групп.
Следовательно, химические свойства атомов определяются элек- тронами, расположенными на последней, не полностью занятой обо- лочке. Эти электроны названы валентными, их число определяет ва- лентность (с лат. «имеющий силу») элемента.
Щелочные металлы Li, Na, K, Rb, Cs имеют по одному валентному электрону, значит одновалентны.
Все щелочно-земельные элементы Be, Mg, Ca, Sr, Ba двухвалентны, имеют по два валентных электрона и т. д.
Атомы с полностью заполненными оболочками не имеют валент- ных электронов и химически неактивны.Они образуютгруппу инерт- ных газов: по вертикали гелий, неон, аргон, криптон, ксенон, радон. Они составляют нулевую группу элементов, валентности у которых равны нулю.
С возрастанием числа электронов в атоме свойства элемента изменяются от металлов к неметаллам. Когда очередная оболочка целиком заполняется электронами, образуется инертный газ. При дальнейшем увеличении количества электронов начинает строиться новая атомная оболочка —открывается следующий (по горизонтали) период периодической системы, в котором снова имеет место пере- ход от металлов к неметаллам. Химическая активность элементов изменяется от свойств оснований к свойствам кислотным,от вечных
288
к распадающимся (коротко живущим),от нерадиоактивных к радио- активным.
Начиная с 4 го периода системы Менделеева, наблюдаются от- ступления от указанного порядка заполнения оболочек. На неко- торых участках периодической системы новая оболочка начинает заполняться ещё до того, как завершилось построение предыдущей оболочки.На других участках с увеличением числа электронов в ато- ме число электронов на последней оболочке остается неизменным, и достраиваются предыдущие оболочки. В этом случае образуется группа соседних элементов с одинаковым числом валентных элек- тронов, имеющие сходные химические свойства. Примером такой группы являются так называемые «редкие земли» (скандий, иттрий, лантал, церий и др.).
Следовательно, периодичность химических свойств обусловле- на числом внешних (валентных) электронов в атоме, при этом число внешних электронов периодически повторяется по мере заполнения оболочек K, L, M и т. д.
На химических свойствах атома сказывается не вся совокупность атомных электронов, а только внешние электроны. Это связано с тем, что энергия, выделяемая или поглощаемая при химических реакци- ях, не превышает нескольких электронвольт на атом, и её достаточ- но,чтобы изменить расположение внешних электронов атома.Но она совершенно недостаточна, чтобы изменить орбиты внутренних элек- тронов, для которых энергия переходов значительно больше. Поэто- му при объединении атомов в молекулы расположение внутренних электронов этих атомов не меняется. Спектр рентгеновского излуче- ния химических соединений (возбужденного,например,электронной бомбардировкой) представляет собой наложение спектров излучений чистых элементов, входящих в это соединение.
Оптический спектр обусловлен лишь поведением внешних элек- тронов, которые определяют химические свойства атома. Поэтому химически сходные элементы характеризуются сходными оптиче- скими спектрами. При образовании из атомов молекулы происходит перегруппировка валентных электронов, которые являются «оптиче- скими».
Следовательно, образование молекулы сопровождается изменени- ем оптических свойств атомов. Поэтому оптический спектр молекулы обычно резко отличается от спектров атомов, составляющих молекулу.
Устойчивость (прочность) атома обусловлена устойчивостью его ядра. Ионизация, а также образование сложных молекул из атомов, ограничивается перегруппировкой внешних электронов и не затра- гивает атомного ядра. После таких изменений атом сравнительно легко вновь может быть восстановлен нейтрализацией иона, рас-
289
