
- •Газовые смеси
- •1.1. Основные признаки газовых смесей
- •1.2. Основные понятия и определения газовых смесей
- •1.3. Способы задания состава смеси реальных газов
- •1.4. Смеси идеальных газов
- •1.4.1. Характеристические функции и функции состояния газовых смесей
- •1.4.1.1. Удельные значения функций и параметров смеси газов
- •По аналогии с внутренней энергией можно получить формулу для удельной энтальпии смеси газов iсм , Дж / кг:
- •1.4.1.2. Мольные значения функций и параметров смеси газов
- •1.4.2. Парциальное давление.
- •1.4.3.Парциальный объем.
- •1.4.4. Задание состава смеси идеальных газов объемными долями.
- •1.4.5. Формулы пересчета для различных способов задания состава газовых смесей
- •1.4.6. Кажущаяся молекулярная масса смеси газов
- •1.4.7. Газовая постоянная смеси газов
- •1.4.8. Плотность смеси газов
- •1.4.9. Энтропия смеси идеальных газов
- •1.4.10. Теплоемкость газовой смеси
- •1.4.11. Коэффициент теплопроводности, коэффициент динамической вязкости газовой смеси.
- •1.4.11.1. Бинарные смеси
- •1.4.11.2. Многокомпонентные смеси
- •2. Смешение газов
- •Смешение газовых потоков
- •Температура смеси газовых потоков
- •Объемный расход смеси газовых потоков
- •2.2.3. Частные случаи смешения газовых потоков
- •Содержание
1.4.11. Коэффициент теплопроводности, коэффициент динамической вязкости газовой смеси.
1.4.11.1. Бинарные смеси
В работе
 ,
для бинарных газовых смесей (смесей
двух газов) рекомендован универсальный
метод расчета коэффициентов
теплопроводности и динамической
вязкости.
,
для бинарных газовых смесей (смесей
двух газов) рекомендован универсальный
метод расчета коэффициентов
теплопроводности и динамической
вязкости.
- Коэффициент теплопроводности смеси:λ см , Вт / (м · К):
![]() ,
,
где: ![]() и
и![]() - коэффициенты теплопроводности первого
и второго
- коэффициенты теплопроводности первого
и второго
компонентов бинарной смеси, взятые при температуре смеси.
![]() -
поправочные коэффициенты.
-
поправочные коэффициенты.
![]()

![]()

Здесь: ![]() - коэффициенты динамической вязкости
компонентов
- коэффициенты динамической вязкости
компонентов
![]() - молекулярные массы компонентов.
- молекулярные массы компонентов.
Коэффициент динамической вязкости смесиηсм, Па · С:
![]()
Средняя
погрешность вычисления
![]() по этому методу составляет примерно
4%, а погрешность вычисления
по этому методу составляет примерно
4%, а погрешность вычисления![]() - в среднем 2%.
- в среднем 2%.
Бинарные смеси являются наиболее исследованными. Опыт показывает следующее
 :
:
При малыхразличиях в значениях молекулярной массы компонентов величина коэффициента теплопроводности смеси подчиняется условиюаддитивности:
![]()
При большомразличии молекулярных масс компонентов (смеси водорода) лучшее согласование с опытом даетлогарифмическаязависимость
![]()
или
![]()
Во всех остальных случаях истинное значение
 находится в области, ограниченной
вышеприведенными значениями, т. е.
находится в области, ограниченной
вышеприведенными значениями, т. е.
![]()
1.4.11.2. Многокомпонентные смеси
Коэффициент динамической вязкости многокомпонентной смеси можно определить с использованием методов Гиршфельдера и его школы [3].
Эти методы дают хорошее согласование с опытом, особенно для коэффициента вязкости, но используют громоздкие и неудобные для практики формулы. В связи с этим получили распространение более простые аппроксимационные формулы, например, приближенная формула Уилке [4]:
 ,
,
где: ![]() - мольная (объемная) концентрацияi-го
компонента смеси.
- мольная (объемная) концентрацияi-го
компонента смеси.

Погрешность результатов расчетов по формуле Уилке по сравнению с опытом находится в пределах 4%.
Коэффициент
теплопроводности
![]() -компонентной
газовой смеси можно определить по
приближенной формуле Масона-Саксена
[4]:
-компонентной
газовой смеси можно определить по
приближенной формуле Масона-Саксена
[4]:
![]()
В работе [5] для газовых смесей рекомендуется формула Брокау:
![]()
где: ![]() и
и![]()
2. Смешение газов
Пусть смешиваютсяn химически невзаимодействующихмежду собойидеальныхгазов. Предполагается, что известны начальные термодинамические параметры состояния всех компонентов до смешения и условия смешения (условия взаимодействия с окружающей средой). Требуется найтиравновесные параметры состояния газов после смешения.
Рассмотрим два случая смешения, для простоты полагая, что этот процесс идет без теплообмена с окружающей средой.
2.1. Смешение при W=Const
В этом случае условия смешения таковы, что объем образующейся смеси Wсм равен сумме начальных объемов компонентов смесиWH i:
![]() .
.
(Не следует путать WH iс парциальными объемамиWi, рассмотренными в параграфе 1.4.3.)
Обозначим:
РH i – начальное давлениеi-го газа;
ТH i , tH i – начальная температураi-го газа соответственно в0Кили0С.
Т.к. вся система
из nгазов при смешении
в условияхW=Const
не совершает внешней работы, то в
соответствии с первым началом термодинамики
для этого случая (![]() )
можно записать:
)
можно записать:
![]() (2.1.1)
(2.1.1)
Здесь: Uсм– внутренняя энергия смеси газов массойmсм килограммов
с температурой Т0 К;
UH i- внутренняя энергияi-го газа массойmi килограммов
с начальной температурой ТH i.
Введем обозначения:
uсм – удельная внутренняя энергия смеси газов при температуреТ0 К;
uH i – удельная внутренняя энергияi-го газа с начальной температуройТH i.
Тогда уравнение (2.1.1) принимает следующий вид:
![]() (2.1.2)
(2.1.2)
Как известно, для идеального газа du=Cv dT, откуда при отсчете внутренней энергии от00 К можно записать:
![]() и
и
![]() . (2.1.3)
. (2.1.3)
Здесь: ![]() - средняя в диапазоне0
- средняя в диапазоне0![]() Т0
К массовая изохорная теплоемкость
смеси газов;
Т0
К массовая изохорная теплоемкость
смеси газов;
![]()
![]() - средняя в диапазоне0
- средняя в диапазоне0![]() ТH
i
0К массовая изохорная
теплоемкостьi-го
газа.
ТH
i
0К массовая изохорная
теплоемкостьi-го
газа.
После подстановки (2.1.3) в (2.1.2) получим:
![]()
![]() . (2.1.4)
. (2.1.4)
Но в соответствии с параграфом 1.4.10 истинная массовая теплоемкость смеси газов выражается через массовые доли компонентов giи их истинные теплоемкости следующим образом:
![]() .
.
Аналогично средняя
в диапазоне 0![]() Т0
К массовая изохорная теплоемкость
смеси газов определится как:
Т0
К массовая изохорная теплоемкость
смеси газов определится как:
![]() .
.
Подставляя это выражение в левую часть уравнения (2.1.4) получим:
![]()
![]() ,
,
откуда  (2.1.5)
(2.1.5)
Т.к. из уравнения
состояния
 ,
то после подстановкиmiв уравнение (2.1.5) окончательно получим
формулу для температуры смесиnгазов:
,
то после подстановкиmiв уравнение (2.1.5) окончательно получим
формулу для температуры смесиnгазов:
 (2.1.6)
(2.1.6)
Как известно,
![]() ,
поэтому формула (2.1.6) может быть записана
в следующем виде:
,
поэтому формула (2.1.6) может быть записана
в следующем виде:
 (2.1.7)
(2.1.7)
(Следует
напомнить, что произведение
 - это средняя в диапазоне 0- ТH
i
0К молярная изохорная
теплоемкостьi-го
газа.)
- это средняя в диапазоне 0- ТH
i
0К молярная изохорная
теплоемкостьi-го
газа.)
В справочной
литературе эмпирические зависимости
теплоемкости от температуры часто
даются для диапазона 0![]() t
0 С.
t
0 С.
Тогда:
![]() и
и
![]() ,
(2.1.8)
,
(2.1.8)
где ![]() (2.1.9)
(2.1.9)
После подстановки (2.1.8) и (2.1.9) в уравнение (2.1.2) получим:
![]()
![]() ,
,
откуда  .
.
Заменяя miего значением ,
окончательно получим формулу для
температуры смеси газов в градусахЦельсия:
,
окончательно получим формулу для
температуры смеси газов в градусахЦельсия:
 (2.1.10)
(2.1.10)
Выражая
Riчерез малекулярную массу![]() ,
получим еще одну формулу:
,
получим еще одну формулу:
 (2.1.11)
(2.1.11)
В знаменателях формул (2.1.6), (2.1.7), (2.1.10) и (2.1.11) содержатся средние теплоемкости, у которых в качестве верхнего предела осреднения используется температура смеси (tилиТ), подлежащая определению. В силу этого, температура смеси по этим формулам определяетсяметодом последовательных приближений.
2.1.1. Частные случаи смешения газов при W=Const
Рассмотрим несколько частных случаев формул (2.1.6), (2.1.7), (2.1.10) и (2.1.11).
Пусть смешиваются газы, у которых зависимостью показателя адиабаты Кiот температуры можно пренебречь.
(В действительности К убывает с ростом температуры, т. к.
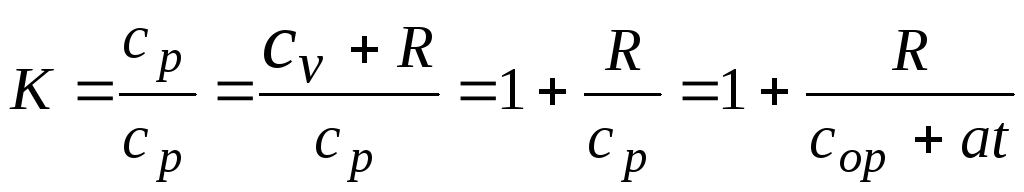
гдесо р , а–эмперические положительные коэффициенты.
Для технических расчетов в диапазоне от 0 до 20000С можно пользоваться следующими формулами:
а)
для двухатомных газовК
![]() 1,40- 0,5010-4
t;
1,40- 0,5010-4
t;
б)
для продуктов сгоранияК
![]() 1,35- 0,5510-4
t.
1,35- 0,5510-4
t.
Из этих формул видно, что влияние температуры на показатель адиабаты К становится заметным лишь при температурах, порядка сотен градусов по шкале Цельсия.)
Т. о., если допустить, что
 ,
,
то формула (2.1.6) примет следующий вид:
 (2.1.12)
(2.1.12)
Формулу (2.1.12) можно использовать в качестве первого приближения для формул (2.1.6), (2.1.7), (2.1.10) и (2.1.11)
Пусть смешиваются газы, у которых мольные изохорные теплоемкости равны и зависимостью этих теплоемкостей от температуры можно пренебречь, т. е.:
![]()
![]() .
.
Тогда уравнение (2.1.7) принимает очень простой вид:
 (2.1.13)
(2.1.13)
Если у газов равны между собой мольные изохорные теплоемкости, то в соответствии с уравнением Майера
![]() ,
,
должны быть равны между собой и мольные изобарные теплоемкости, а, следовательно, равны и показатели адиабаты, т. е.
![]() .
.
При этом условии уравнение (2.1.12) превращается в (2.1.13).
2.1.2. Давление после смешения газов при W=Const
Давление, устанавливающееся после смешения газов, можно определить либо по формулам параграфа 1.4.2, либо из условия:
РсмWсм
=mсмRсмТ
=mсмТ
![]() .
.
Откуда ![]()
или
 (2.1.14)
(2.1.14)
Для частного случая 2 давление смеси получим путем подстановки формулы (2.1.13) в (2.1.14), откуда
![]()
