
- •Газовые смеси
- •1.1. Основные признаки газовых смесей
- •1.2. Основные понятия и определения газовых смесей
- •1.3. Способы задания состава смеси реальных газов
- •1.4. Смеси идеальных газов
- •1.4.1. Характеристические функции и функции состояния газовых смесей
- •1.4.1.1. Удельные значения функций и параметров смеси газов
- •По аналогии с внутренней энергией можно получить формулу для удельной энтальпии смеси газов iсм , Дж / кг:
- •1.4.1.2. Мольные значения функций и параметров смеси газов
- •1.4.2. Парциальное давление.
- •1.4.3.Парциальный объем.
- •1.4.4. Задание состава смеси идеальных газов объемными долями.
- •1.4.5. Формулы пересчета для различных способов задания состава газовых смесей
- •1.4.6. Кажущаяся молекулярная масса смеси газов
- •1.4.7. Газовая постоянная смеси газов
- •1.4.8. Плотность смеси газов
- •1.4.9. Энтропия смеси идеальных газов
- •1.4.10. Теплоемкость газовой смеси
- •1.4.11. Коэффициент теплопроводности, коэффициент динамической вязкости газовой смеси.
- •1.4.11.1. Бинарные смеси
- •1.4.11.2. Многокомпонентные смеси
- •2. Смешение газов
- •Смешение газовых потоков
- •Температура смеси газовых потоков
- •Объемный расход смеси газовых потоков
- •2.2.3. Частные случаи смешения газовых потоков
- •Содержание
1.4.3.Парциальный объем.
Для сравнения количества газов в смеси по объему, необходимо их объемы при температуре смеси привести к одинаковому давлению.
Если этим
одинаковым давлением
является давление смеси
![]() ,
то приведенные
к этому
давлению объемы
компонентов называются парциальными.
,
то приведенные
к этому
давлению объемы
компонентов называются парциальными.
Парциальный
(приведенный) объем
![]() - это объем, который занимал бы i-тый
компонент, если бы он один находился
при температуре
- это объем, который занимал бы i-тый
компонент, если бы он один находился
при температуре ![]() и давлении смеси
и давлении смеси ![]() .
.
Для понимания
физического смысла парциального объема
рассмотрим смесь двух идеальных газов.
Как отмечалось ранее, молекулы обоих
газов равномерно распределены по всему
объему ![]() ,
занимаемому смесью при давлении
,
занимаемому смесью при давлении ![]() и температуре
и температуре ![]() .
.
Представим себе,
что каким-то
образом удалось разделить
молекулы этих двух газов так, что в общем
объеме ![]() первый газ занимает объем
первый газ занимает объем ![]() ,
а второй -
,
а второй - ![]() при одинаковой температуре
при одинаковой температуре ![]() .
Для того, чтобы эта гипотетическая
система находилась в
равновесии
и газы не
смешивались
за счет разности давлений, давление в
объемах
.
Для того, чтобы эта гипотетическая
система находилась в
равновесии
и газы не
смешивались
за счет разности давлений, давление в
объемах ![]() и
и ![]() должно быть одинаковым
и равным общему давлению смеси
должно быть одинаковым
и равным общему давлению смеси ![]() ,
т. е.
,
т. е.
![]()
Или в общем случае
![]()
Типичной
студенческой ошибкой
является подстановка в это уравнение
вместо
давления смеси
![]() величины парциального давления
величины парциального давления ![]() .
.
1.4.4. Задание состава смеси идеальных газов объемными долями.
Во многих практических задачах состав смеси газов задается объемными долями:
![]() ,
,
![]()
где: ![]() - парциальный объем i-го
газа в составе смеси газов, занимающей
объем
- парциальный объем i-го
газа в составе смеси газов, занимающей
объем ![]() .
.
Установим связь между объемными и мольными долями газов смеси.
Т. к. универсальная
газовая постоянная
![]() Дж / (кмоль · К)
Дж / (кмоль · К)
связана с удельными
газовыми постоянными ![]() ,
Дж / (кг · К), соотношением
,
Дж / (кг · К), соотношением
![]() ,
,
то из определения парциального объема идеального газа в составе смеси получим:
![]() или
или ![]() ,
,
где: ![]() -число
киломолей i-го
газа.
-число
киломолей i-го
газа.
Просуммировав
значения ![]() для всех газов, входящих в смесь, получим
для всех газов, входящих в смесь, получим
![]() ,
,
где: ![]() и
и ![]()
Разделив выражения
для ![]() на выражение для
на выражение для ![]() получим
получим
![]()
Т. о. для смеси идеальных газов мольная и объемная доли i-го газа равны между собой по величине
![]() .
.
и
![]() .
.
1.4.5. Формулы пересчета для различных способов задания состава газовых смесей
Получим формулу пересчета мольных долей на массовые и наоборот.
Т. к. ![]() и
и ![]() ,
то
,
то 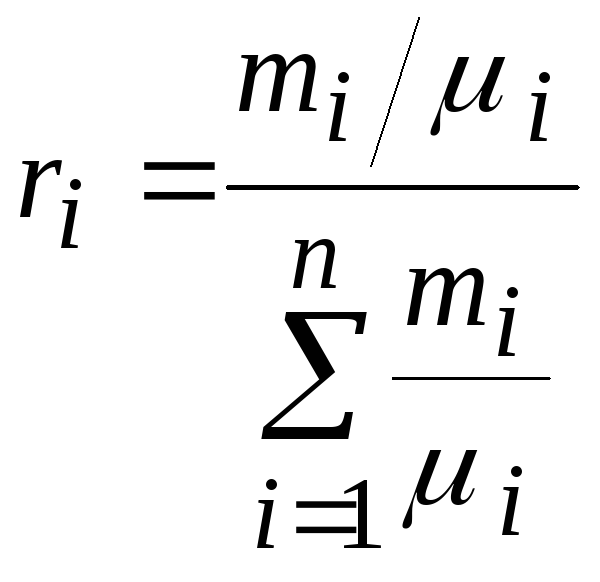 .
.
Разделив числитель
и знаменатель полученного выражения
на массу смеси ![]() получим
получим
 ,
,
или окончательно:
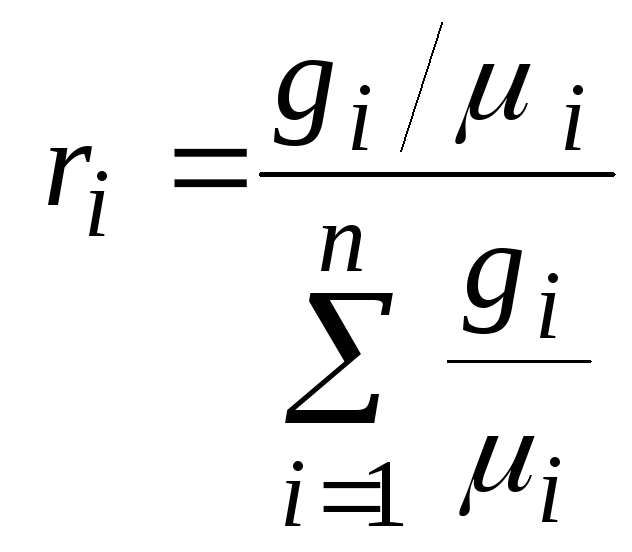
Т. к. ![]() и
и ![]() ,
,
то  .
.
Разделив числитель
и знаменатель этого выражения на ![]() получим
получим  ,
,
или окончательно

1.4.6. Кажущаяся молекулярная масса смеси газов
Для упрощения
расчетов смесь идеальных газов условно
полагают однородным
газом с той
же суммарной массой ![]() и с тем же
суммарным числом молекул,
равным
и с тем же
суммарным числом молекул,
равным
![]() ,
,
где ![]() - число молекул в единице объема смеси
газов;
- число молекул в единице объема смеси
газов;
![]() - число Авогадро
(число молекул в одном киломоле вещества):
- число Авогадро
(число молекул в одном киломоле вещества):
![]() , 1 / кмоль
, 1 / кмоль
Молекулярная масса
такого однородного газа обозначается
![]() и называется кажущейся молекулярной
массой смеси:
и называется кажущейся молекулярной
массой смеси:
 .
.
Разделив числитель
и знаменатель этого выражения на ![]() ,
получим
,
получим 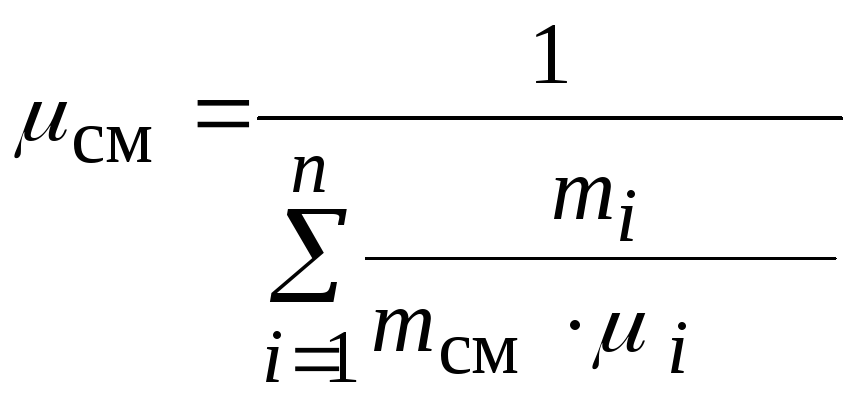 ,
,
или окончательно

Через мольные доли
величина ![]() выражается проще:
выражается проще:
 ,
,
или окончательно
![]()
