
Литература
И.В. Савельев. Курс общей физики. т. 3. –М.: Наука, 1982, с. 46-48, 55-61, 93-99.
Приложение элементарная боровская теория водородного атома
Первая попытка построения неклассической теории атома была предпринята Бором. В теории Бора не содержалось принципиального отказа от описания поведения электрона в атоме при помощи законов классической физики. Бор считал модель атома Резерфорда правильной. Цель его теории состояла в освобождении этой модели от противоречий. В постулатах, лежащих в основе теории, Бор показал, от каких положений классической физики следует отказаться, чтобы устранить противоречия между теорией и экспериментом. Постулаты Бора построены так, чтобы объяснить:
а) устойчивость атома;
б) сериальный характер спектров.
Формулируются постулаты следующим образом:
Из бесконечного множества электронных орбит, возможных с точки зрения классической механики, в действительности осуществляются лишь некоторые дискретные орбиты, удовлетворяющие определенным квантовым условием. Электроны, находящиеся на одной из этих орбит, не излучают.
При переходе из одного стационарного состояния в другое атомы испускают или поглощают излучение в виде кванта энергии
 .
Величина кванта энергии равна разности
энергий тех стационарных состояний,
между которыми совершается квантовый
переход:
.
Величина кванта энергии равна разности
энергий тех стационарных состояний,
между которыми совершается квантовый
переход:
![]() .
(1)
.
(1)
Согласно
квантовому условию Бора, из всех круговых
орбит электрона в атоме водорода,
возможных с точки зрения классической
механики, осуществляются лишь те, для
которых момент количества движения
![]() равен целому кратному постоянной Планка
равен целому кратному постоянной Планка
![]() ,
(2)
,
(2)
где те– масса электрона;
![]() – скорость электрона;
– скорость электрона;
![]() – радиус орбиты электрона;
– радиус орбиты электрона;
п– главное квантовое число.
На электрон,
движущийся в поле атомного ядра с зарядом
![]() ,
действует сила Кулона:
,
действует сила Кулона:
![]() ,
(3)
,
(3)
где
![]() –
порядковый номер элемента в таблице
Менделеева, для водорода
–
порядковый номер элемента в таблице
Менделеева, для водорода![]() =1;
=1;
е– заряд электрона;
![]() – электрическая постоянная.
– электрическая постоянная.
Уравнение движения электрона в классической механике в этом случае имеет вид:
![]() .
(4)
.
(4)
Исключив
![]() из уравнений (3) и (4), получим выражение
для радиусов допустимых орбит (боровских
орбит):
из уравнений (3) и (4), получим выражение
для радиусов допустимых орбит (боровских
орбит):
 .
(5)
.
(5)
Радиус первой орбиты водородного атома называется боровским радиусов. Его значение равно:
 ,
м. (6)
,
м. (6)
Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром
![]() .
(7)
.
(7)
Из формулы (4) следует, что
![]() .
.
Следовательно,
![]() .
(8)
.
(8)
Подставив в
(8) значение
![]() из формулы (5), найдем дозволенные значения
внутренней энергии атома:
из формулы (5), найдем дозволенные значения
внутренней энергии атома:
 .
(9)
.
(9)
Схема энергетических уровней приведена на рисунке 1.
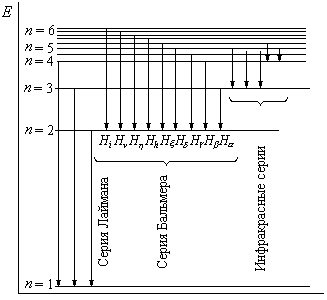
Рис.1 Схема энергетических уровней атома водорода
При переходе атома
водорода (![]() =1)
из состояния
=1)
из состояния![]() в состояние
в состояние![]() излучается, согласно формулам (1) и (9),
фотон энергии:
излучается, согласно формулам (1) и (9),
фотон энергии:
 .
.
Частота испущенного фотона:
 .
(10)
.
(10)
Учитывая, что
![]() ,
получим:
,
получим:
 .
(11)
.
(11)
Получена обобщенная формула Бальмера, причем для постоянной Ридберга определено значение:
 ,
(12)
,
(12)
тогда
![]() .
(13)
.
(13)
Из формулы (13) следует,
что все линии в спектре водорода могут
быть объединены в серии. Серией называется
совокупность линий, длины волн которых
описываются формулой (13) при
![]() ,
т.е. серия возникает при переходе
электрона с вышележащих энергетических
уровней на уровень с данным квантовым
числом (
,
т.е. серия возникает при переходе
электрона с вышележащих энергетических
уровней на уровень с данным квантовым
числом (![]() ).
).
