дов между собой. Непосредственное наблюдение расположения органически* коллоидов и бактерий на поверхности минералов стало доступно только при та ком увеличении, какое может дать электронный микроскоп.
§ 98. Рентгенографический метод
Рентгенографические исследования в последние годы получили широкое распространение в почвоведении. Определение содержания высокодисперсных минералов в почвах или в каких-либо других объектах методом рентгенографии основано на явлении дифракции рентгеновских лучей от плоскостей кристаллов и интерференции. Лучи, отраженные от исследуемого объекта, попадают на фото
бумагу, где образуют симметрично рас
|
|
|
|
|
|
|
|
|
|
|
положенные линии |
дугообразной |
фор |
|
мы различной степени интенсивности. |
|
Атомы, молекулы и ионы, |
образую |
|
щие кристалл, |
располагаются |
в нем |
|
в правильном порядке, образуя струк |
|
туру. |
Характер этого |
порядка |
может |
|
быть разным, |
но для данного вида кри |
|
сталла всегда одинаков. |
|
служить |
|
В качестве примера может |
|
хлорид натрия (см. рис. |
12). |
Его |
кри |
|
сталлы |
построены |
из |
ионов |
натрия и |
|
хлора, которые, чередуясь, |
распола |
|
гаются правильными рядами, объеди |
|
няющимися |
в |
плоскостную |
решетку. |
|
В узлах решетки в шахматном порядке |
|
находятся ионы Na+ и С1~. Плоскости |
|
располагаются |
в пространстве парал |
|
лельно одна другой (смещаясь на одно |
|
звено) |
и |
образуют |
пространственную |
|
кристаллическую решетку*. |
|
|
|
Решетка имеет три |
измерения и ее |
Рис. 121. Рентгеновский аппарат |
можно представить |
в виде примыкаю |
УРС-55А |
щих друг |
к |
другу |
параллелепипедов, |
каждый из которых можно назвать эле ментарной ячейкой. В пространствен ной решетке можно выделить узловые прямые и узловые плоскости, кото
рые находятся друг от друга на определенном расстоянии d, которое является
характерным для каждой системы плоскостей данного кристалла.
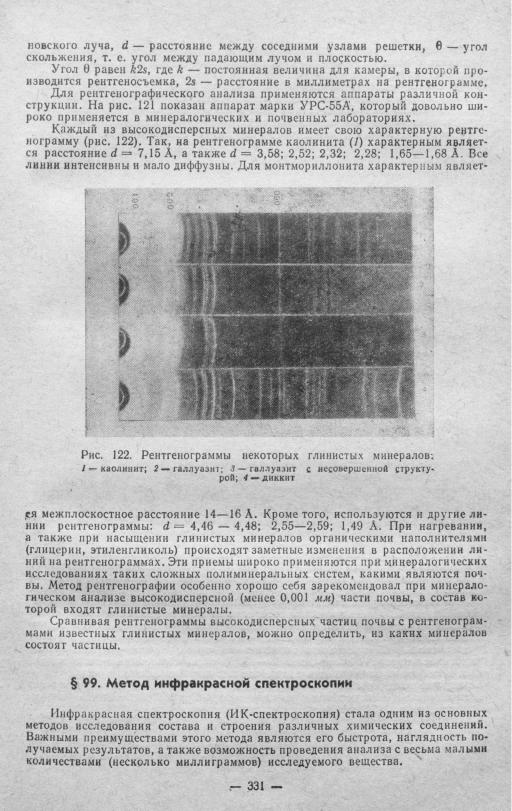
Длины волн рентгеновских лучей имеют тот же порядок, что и расстояние между атомами или ионами в кристаллах (10~8сж). Именно благодаря этому при дифракции рентгеновских лучей от граней кристалла и получается рентгенограм ма, которая дает возможность, в частности, определить расстояние между узловы ми плоскостями, а также между частицами в кристалле. Каждая линия на рентге нограмме соответствует отражению рентгеновских лучей от определенных узло вые плоскостей.^При расшифровке рентгенограмм сначала делают точные про меры расстояний между симметрично расположенными линиями (дугами). Зная эти величины, можно сравнительно легко рассчитать межплоскостные расстоя ния в кристаллах, являющиеся характерными для каждого минерала.
При расчете пользуются формулой Брегга—Вульфа: |
|
nk = 2d sin 0, |
(VIII,2) |
где п — целое число или порядок отражения от разных параллельно располо женных плоскостей в кристалле, X — длина волны падающего на объект рентге
* Расположение частиц в пространстве может быть иным и более сложным,
чем у хлорида натрия. В таком случае усложняется геометрическая форма самих кристаллов.
Инфракрасный спектр любого химического соединения — одна из наиболее важных его характеристик и может использоваться для идентификации вещества. При сравнении двух соединений идентичность их инфракрасных спектров указы вает (за очень редким исключением) на идентичность самих соединений. Инфра красные спектры любых веществ дают ценные сведения об их внутренней струк туре. Для расшифровки ИК-спектра нужно найти соответствие между положением полос поглощения и наличием отдельных структурных элементов в молекуле, а уж е затем по ИК-спектру определить присутствие тех или иных атомных групп и их взаимное расположение.
|
У |
У |
АХг~НРШЧШ ' A Веерное |
АХг-крутильное |
ил'и плдхдсщнув |
ипи6нерцдскошное |
или днеллоскостное • |
У
АХzмаятниковое АХ3-симметричное АХ3-асимметричное
|
|
|
АХг-симметричное |
АХ}-симметричное |
AXZ-асимметричное |
АХ3-асимметричное |
Рис. 123. Валентные колебания молекул типа АХг и АХз
Метод инфракрасной спектроскопии в последние годы стал особенно широ ко применяться в органической и неорганической химии, биохимии, биологии, почвоведении, минералогии и во многих других областях науки и народного хо зяйства.
Что же собой представляет инфракрасный спектр любого химического соеди нения? Известно, что все молекулы состоят из атомов, соединенных между собой химическими связями. Атомы в молекуле находятся в постоянном колебательном движении. В простейшем случае, когда молекула вещества состоит только из двух атомов А и Б , происходит единственный вид колебаний — периодическое растяжение и сжатие по линии связи А — Б . Движение химически связанных ато мов в молекуле можно сравнить с непрерывным колебанием систем шаров, кото рые связаны между собой пружинами. Оба вида колебательного движения хорошо описываются математически при помощи закона Гука. Колебательная частота в случае двухатомной молекулы определяется уравнением:
( V I I I .3)
где v — колебательная частота, |
с м - 1 , |
с -г- скорость света, Ц—- силовая постоян |
ная связи и ) 1 — приведенная |
масса, |
определяемая уравнением: |
тАтъ
(V III ,4)
тА+тБ ’
где т А и т Б — массы отдельных атомов А и Б.
Аналогичным образом могут рассматриваться валентные колебания и в бо лее сложных молекулах, хотя здесь становятся возможными и другие виды коле баний, в частности деформационные колебания. При валентных колебаниях из меняются в основном длины связей, углы между ними остаются приближенно не изменными. В случае деформационных колебаний изменяются главным образом углы между связями. Валентные колебания молекул типа A X j и АХд схематич но представлены на рис. 123, где стрелки показывают направление периодическо го смещения атомов, а знаки плюс и минус соответствуют периодическим смеще ниям перед плоскостью или за плоскостью бумаги.
Инфракрасное излучение принято характеризовать волновым числом v, ко торое выражается в обратных сантиметрах (с м '" 1) и называется обычно частотой,
хотя на |
самом деле единица частоты v |
имеет размерность |
обратной секунды |
(сек-1). |
Д ля |
характеристики излучения используется также длина волны X, из |
меряемая в |
микронах. Волновое число v |
связано с длиной |
волы X следующей |
простой зависимостью: |
|
|
104 V“ X -
Таким образом, частота v представляет собой величину, равную числу длин волн, выраженных в микронах, уложенных на расстоянии 1 см. Например, интервал от 2,5 до 40,0 мк соответствует интервалу от 4000 до 250 см~1.
Как видно из уравнений (V III, 3) и (V III, 4), частоты колебаний зависят не только от самой природы отдельных связей, но и от всей молекулы и ее окруж е ния. В случае системы шариков, связанных пружинками, происходит совершенно аналогичное явление — на колебание одной пружинки оказывает влияние вся система в целом. Если по такой системе произвести удар, амплитуды колебаний шариков возрастут. Аналогичное явление происходит и в молекуле вещества при воздействии на нее электромагнитных волн (инфракрасных лучей): амплиту ды колебаний отдельных связей и вместе с ними колебаний электрических зарядов будут увеличиваться.
Полной аналогии между системой шаров на пружинах и молекулой какоголибо химического вещества быть не может: колебательные энергетические уров ни молекулы изменяются скачкообразно. В системе же шаров на пружинах ам плитуды колебаний изменяются непрерывно. Следовательно, молекула погло щает только те частоты инфракрасного излучения, энергия которых точно соот ветствует разностям между двумя уровнями энергии связи, т. е. амплитуды ко лебаний возрастают скачкообразно.
Таким образом, при взаимодействии молекулы какого-либо вещества с элект ромагнитным полем (инфракрасным излучением) может произойти передача энер гии от поля молекуле, в результате чего молекула перейдет из одного квантового состояния в другое (возбужденное). Приобретенная молекулой величина энергии Е связана с частотой поглощенного излучения v простым соотношением:
АЕ =hv, ( V I I I ,5)
где h — постоянная Планка (Л = 1,623 • 10 -27 эрг-сек).
При возвращении молекулы в исходное состояние она испускает такой же квант энергии АЕ частоты v. Итак, если исследуемое вещество облучать инфра красным светом с непрерывно меняющейся частотой, определенные участки спект ра излучения будут поглощаться молекулой, в результате чего луч, проходящий через вещество, в области поглощения будет ослабляться. Регистрируя интен сивность прошедшего через данное вещество инфракрасного излучения в зависи мости от длин волн или от волновых чисел, можно получить кривую, на которой
будут в и д н ы п о л о с ы п о г л о щ е н и я . Э та к р и в а я и н а з ы в а е т с я и н ф р а к р а с н ы м с п е к т -
Р° М Инфракрасные спектры могут дать весьма богатую информацию, поскольку
каждая молекула имеет только ей присущий набор колебаний, К°3 ° Р “ ■ ® “ С11Г от массы и взаимного расположения атомов в данной молекуле, межатомных рас стояний, типов меж- и внутримолекулярных взаимодействий. Д аж е самые незначительные изменения в структуре молекул отражаются на инфракрасных спект рах поглощения, поэтому инфракрасный спектр поглощения может являться од нозначной характеристикой вещества, образно говоря его «паспортом».
Рис. 124. Принципиальная схема однолучевого |
инфракра |
|
|
сного спектрометра: |
|
|
/ — источник |
инфракрасных |
лучей; // — монохроматор; / // — уси |
литель термотока; |
IV — регистрирующее |
устройство; |
/ — источник |
излучения (штифт |
Нернста |
или глобар); |
2 — исследуемое |
вещест |
во; 3 — входная щель монохроматора; 4 — выходная |
щель |
моно |
хроматора; |
5 — отсчетное |
устройство; |
6 — приемник |
излучения |
|
|
(термоэлемент) |
|
|
|
Метод инфракрасной спектроскопии может применяться для идентификации различных химических соединений. Поскольку полосы поглощения непосредст венно отражают состояние связей и наличие в молекуле различных атомных труппироврк, можно получать весьма ценную информацию о структуре данного ве щества. Интенсивность полосы поглощения в ИК-спектре любого химического соединения пропорциональна количеству исследуемого вещества, и это обстоя тельство лежит в основе еще одного важного направления применения инфра красной спектроскопии — количественного анализа.
Прибор, в котором получают запись инфракрасного спектра поглощения, норит название инфракрасного спектрофотометра (или спектрометра). Принцип действия инфракрасных спектрометров в общем довольно прост, сложны лишь их механические и электрические устройства, необходимые для воспроизведения мддейших изменений поглощаемой энергии в виде точно зарегистрированного спектра. Поскольку обычное стекло не прозрачно для инфракрасных лучей, в ин фракрасных спектрометрах оптика изготовляется из кристаллов галидов (NaCl, K Br, L iF), которые не поглощают инфракрасные излучения.
Принцип работы инфракрасного спектрометра заключается в следующем. Инфракрасное излучение, получаемое от специального источника, проходит
через исследуемое вещество и далее разлагается в спектр с помощью моно хроматора. Отдельные лучи этого спектра последовательно направляются на приемник излучения и затем, после усиления, фиксируются соответст вующим записывающим устройством. Принципиальная схема однолучевого прибора представлена на рис. 124. Имеются более сложные двухлучевые инфра красные спектрометры, в которых световое излучение от источника разделяется
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
на два потока: один из них |
проходит че |
|
|
|
|
рез кювету |
с |
исследуемым |
веществом, |
|
|
|
|
другой — через |
аналогичную |
|
кювету, |
|
|
|
|
не содержащую этого вещества. |
|
|
|
|
|
|
|
|
Наша промышленность серийно |
вы |
|
|
|
|
пускает |
однолучевые |
|
инфракрасные |
|
|
|
|
спектрометры моделей ИКС-9, |
И К С -11, |
|
|
|
|
И К С -12, |
а также |
двухлучевой |
прибор |
|
|
|
|
марки |
И КС -14. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
На рис. 125 приведены |
инфракра |
|
|
|
|
сные спектры |
поглощения |
некоторых |
|
|
|
|
высокодисперсных |
глинистых |
|
минера |
|
|
|
|
лов, |
|
наиболее |
часто |
встречающихся |
|
|
|
|
в почвах. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Полосы |
|
поглощения |
|
ИК-спектров |
% |
|
л |
| |
любых веществ, |
в том числе |
и |
|
минера |
|
|
' 80 г |
лов, |
обусловлены колебаниями |
опреде |
ленных атомных групп и их |
связей. |
|
-fV |
Так, полосы, обусловленные Si — О ко |
60 |
|
1 1 |
лебаниями, в спектрах диккита и каоли |
00 |
|
нита |
|
наблюдаются |
при |
v = |
435, |
470, |
г |
ц |
Г |
685, |
1010 , |
1030 |
и 1110 |
см"1, |
Полосы |
го |
поглощения, |
приписываемые Si — О — |
|
_Li |
_JL |
А1 колебаниями, проявляются |
|
при |
v = |
я |
|
2т 3200 |
= 7 5 0 |
и |
790 |
см“ х, |
полоса |
|
при |
v = |
|
|
= 910 |
см- 1 |
обусловлена |
|
колебаниями |
|
|
|
|
связи |
Н — О — А 1. |
Все рассмотренные |
|
|
|
|
полосы |
поглощения |
характерны |
для |
|
|
|
|
обоих |
минералов. |
|
Отличие в |
|
этой об |
|
|
|
|
ласти спектра каолинита и |
|
диккита |
за |
|
|
|
|
ключается |
в |
том, |
что |
диккит |
имеет |
|
|
|
|
в своем ИК-спектре две |
полосы |
погло |
|
|
|
|
щения: |
слабую |
при |
v = |
|
645 |
см-1 и |
|
|
|
|
очень интенсивную |
при |
V— 1435 |
см"1. |
|
|
|
|
В ИК-спектре каолинита эти полосы от |
|
|
|
|
сутствуют. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Однако главные отличия в спектрах |
|
|
|
|
минералов каолинитовой группы наблю |
|
|
|
|
даются в коротковолновой области. |
Ко |
|
|
|
|
лебания в этом участке спектра обуслов |
|
|
|
|
лены |
|
О — Н-группами, |
|
входящими |
|
|
|
|
в состав исследуемых минералов. Н а |
|
|
|
|
пример, |
каолинит имеет очень узкую и |
|
|
|
|
интенсивную |
полосу |
поглощения при |
|
|
|
|
v = 3700 |
см"1 |
и |
|
менее |
|
интенсивную |
|
|
|
|
при |
|
v = 3630 |
см"1. |
Полосы |
|
погло |
|
|
|
|
щения при |
v = |
3675 и 3660 см"1у него |
|
|
|
|
очень слабые. У диккита только три |
|
|
|
|
очень интенсивных |
|
полосы |
поглощения |
|
|
|
|
с максимумами |
при v = |
|
3630, |
|
3660 и |
|
|
|
|
3710 |
см"1. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Минералы |
группы |
|
галлуазита со |
Рис. 125. ИК-спектрограммы раз |
держат в своих |
ИК-спектрах |
те же по |
личных |
глинистых минералов: |
лосы |
поглощения, |
что и минералы груп |
а — каолинит; б — |
галлуазит; в — |
пы |
каолинита. |
Отличие |
наблюдается |
|
монтмориллонит; |
. вермикулит |
в коротковолновой области спектра. Так, галлуазит характеризуется лишь дву мя узкими полосами поглощения при v = 3640 и 3700сж-1, причем полоса 3640 с.н-1 значительно интенсивнее аналогичной полосы поглощения при v = =3630 см~1 каолинита. Для галлуазита характерно обратное (чем у каолинита) соотношение интенсивностей этих полос.
Из этого примера явствует: даже близкие по структуре глинистые минералы можно сравнительно легко идентифицировать по их инфракрасным спектрам поглощения. Напомним, что идентификация этих минералов с помощью других физико-химических методов (термический анализ, рентгенография) очень затруд
нена.
Метод инфракрасной спектроскопии широко применяется во многих облас тях сельского хозяйства. В частности, с его помощью изучают гуминовые соеди нения почвы, а также проводят анализ растений на содержание различных органических соединений (аминокислотный состав, сахара, кислоты жирного ряда и целый ряд других жизненно важных веществ).
§ 100. Фотометрический анализ
Фотометрический метод количественного анализа основан на измерении светопоглощения растворами окрашенных соединений. Через слой окрашенного ве щества свет частично проходит, частично отражается, частично поглощается
(рис. 126).
Интенсивность* падающего светового потока при прохождении через погло щающий раствор разлагается на составляющие:
1ъ = 1 + / п + ^ о т .
где / — интенсивность светового потока, прошедшего через слой вещества, /от — интенсивность отраженного светового потока, /п — интенсивность светового потока, поглощенного окрашенным веществом.
Интенсивность падающего светового потока /0 и прошедшего через раствор / можно определять экспериментально. Эти две величины связаны между собой
соотношением (закон Бугера—Ламберта): |
|
/ = l 0e~al, |
(V III,6) |
где е — основание натуральных логарифмов, |
а — коэффициент поглощения, |
I — толщина поглощающего слоя. Для различных фотометрических исследо ваний наиболее удобно выражать интенсивность светопоглощения уравнением:
D= \ g ~ . |
(V III,7) |
Эта величина называется оптической плотностью. Связь между |
концентрацией |
поглощающего раствора и его оптической плотностью выражается законом Бера:
0 = lg y - = ftiC, |
(V III,8) |
где kf — коэффициент пропорциональности, С — концентрация |
растворенного |
вещества. |
|
Зависимость интенсивности прошедшего через раствор монохроматического светового потока от интенсивности падающего потока света, концентрации окра
шенного вещества и толщины просвечиваемого слоя |
выражается уравнением: |
/ = /о-10-ш . |
(V III,9) |
Под интенсивностью света понимают энергию светового потока, испускае мого источником света в 1 сек внутри телесного угла, равного единице. Единица
световой энергии (люмен-секунда) — это энергия светового потока в 1 лм, кото рая расходуется в течение 1 сек.
где k — коэффициент погашения, который зависит от природы растворенного вещества, температуры, растворителя и длины волны падающего светового пото ка. Это соотношение носит название основного закона светопоглощения или объединенного закона Бугера—Ламберта—Вера. Оно лежит в основе большинст ва фотометрических методов анализа.
Рис. 126. Прохождение светового потока через окрашенный раствор
Если концентрация С выражена в моль/л, а толщина слоя I в см, то k стано вится молярным коэффициентом погашения и обозначается е^. Уравнение (VIII,9)
в этом случае будет иметь вид:
/ = /<>• Ю гхс1- |
(V III,10) |
Если раствор подчиняется закону Бугера—Ламберта—Бера, то оптическая плот ность раствора прямо пропорциональна концентрации поглощающего вещества, толщине слоя раствора и молярному коэффициенту погашения:
Различают в основном три группы способов измерений концентрации окра шенного соединения в растворе: визуальное сравнение, фотоколориметрирование и спектрофотометрирование. Остановимся на краткой их характеристике.
Визуальный метод сравнения. Как известно, визуально можно довольно точ но устанавливать равенство интенсивности окрасок двух растворов. Визуальный колориметрический метод отличается быстротой и простотой. В силу этого он получил довольно широкое распространение в количественном агрохимическом анализе. Он принципиально основан на том, что согласно закону Бугера— Ламберта—Бера при определенных условиях существует прямая пропорциональ ная зависимость между интенсивностью окраски раствора и концентрацией окрашенного соединения. Окраски стандартного и испытуемого растворов сравнивают в приборе, который носит название колориметра. Уравнивания окрасок обоих растворов добиваются изменением толщины слоев окрашенных растворов, что осуществляется при помощи погружателей, которые представляют собой призмы, связанные с отсчетной шкалой и изготовленные из оптического стекла.
Наиболее распространенным прибором является колориметр марки КОЛ-1М, общий вид которого показан на рис. 127.
В момент равенства окрасок стандартного и испытуемого растворов^ опти ческие плотности их одинаковы. Таким образом, отношение концентраций раст воров обратно пропорционально толщине их поглощающих слоев:
С-у 1ст Сет
откуда
Ся = -^ -е -т - , |
(VIII, 12) |
где Сх и Сст—соответственно концентрации исследуемого и стандартного раст воров, a U и /ст — толщина слоев этих растворов. Визуальный метод колоримет рии имеет существенные недостатки. Он является очень субъективным, точность анализа во многом зависит от индивидуальных особенностей зрения исследовате ля. Кроме того, при длительной и непрерывной работе глаза сравнительно быст
ро устают, что отрицательно сказывается на точности измерений. Фотоколориметрический анализ. В фотоколориметрии степень поглощения
света окрашенными растворами определяется не визуально, а йри помощи спе циальных приборов с ф о т о э л е м е н т о м . Такие приборы называются фо тоэлектроколориметрами (ФЭК). Фотоэлемент преобразует световую энергию, проходйщую через окрашенный раствор, в электрическую. Поскольку сила возникающего фототока прямо пропорциональна интенсивности падающего на фотоэлемент света, с помощью ФЭК можно непосредственно измерить ослабле-
Рис. 127. Внешний |
вид |
концентрационного калоримет |
|
|
ра КОЛ-1М: |
|
|
/ — окуляр; 2 —диск |
со светофильтрами; |
3 — лупа нониуса |
от- |
счетной шкалы; |
4 — рукоятка перемещения погружателя; |
5 — |
трансформатор; |
б — патрон |
для лампы; |
7 — кожух; б — потру- |
жатель; 9 — кювета
ние интенсивности первоначального светового потока. Нет необходимости каж дый раз готовить стандартные растворы. При работе с ФЭК обычно строят гра дуировочный график по серии растворов с известной концентрацией окрашенного соединения. Такой график особенно удобен при массовых однотипных анализах.
В настоящее время существует много фотоэлектроколориметров различных конструкций. Все они имеют обязательно следующие элементы схемы: 1) осве титель, 2) светофильтры, 3) кюветы, 4) фотоэлементы, 5) система регулируемых сопротивлений, 6) гальванометры.
Различают два типа фотоэлектроколориметров: однолучевые, или приборы
содним фотоэлементом, и двухлучевые, или приборы с двумя фотоэлементами
Внастоящее время однолучевьщ фотоэлектроколориметры практически не при меняются. В двухлучевом приборе оба фотоэлемента соединены по принципу про тивотока, гальванометр показывает разницу фототоков между исследуемым раст вором и чистым растворителем, так что небольшие колебания света осветителя практически не отражаются на точности определений.
Современные фотоэлектроколориметры ФЭК-М, ФЭК-Н-52, 64, 57, ФЭК-56, которые наиболее широко распространены, являются двухлучевыми приборами
иимеют одинаковые оптические схемы. На рис. 128 показан внешний вид и прин-
-338 -
ципиальная схема фотоэлектроколориметра ФЭК-М. Как видно из рисунка, один из фотоэлементов находится в «контрольном» световом потоке, что позволяет автоматически компенсировать колебания тока в цепи осветителя. Для уравни вания двух световых потоков в ФЭК-М применена щелевая диафрагма. Для По вышения точности измерений в прибор вмонтировано два набора из четырех светофильтров: нейтрального, синего, зеленого и красного. Оптическая характе ристика этих светофильтров представлена на рис. 129. От визуальных приборов фотоэлектроколориметры отличаются значительно более высокой точностью.
Рис. |
128. |
Принципиальная схема |
(а) |
и внешний |
вид |
(б) фотоколориметра |
|
|
|
|
ФЭК-М: |
|
|
|
/ — лампа; |
2 и 2 ' — конденсаторы; J я |
S' - |
зеркала; 4 |
и 4' — светофильтры; J и S'. 7 и |
V — линзы; 6 и 5' — кюветы с растворами; |
8 и 81 — |
призмы; |
9 и У — фотоэлементы; |
10 и |
// — фотометрические клинья; 12 |
— щелевая диафрагма; |
13 — отсчетный барабан} |
14 — |
гальванометр; /5 — шкала |
отсчетных |
барабанов: |
16 — шторка, перекрывающая |
световые потоки; 17 — арретир |
гальванометра; 18 — механический корректор; 19 — пере |
ключатель |
чувствительности гальванометра; |
20 — кюветодержатель; 21 — переключатель |
|
|
|
светофильтров |
|
|
|
Спектрофотометрический анализ. Наиболее совершенным и сложным фото метрическим прибором является спектрофотометр. Ослабление интенсивности светового потока в спектрофотометре измеряется с помощью фотоэлементов. Од нако в отличие от фотоэлектроколориметров спектрофотометры дают возможность применять строго монохроматический свет для проведения фотометрических из мерений. Достигается это с помощью специальной призмы, которая разлагает «белый» свет в спектр, и щелевого устройства. Все это позволяет выделить очень узкий участок спектра с определенной длиной волны. Измерение светопоглоще-
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ния в узком участке спектра |
дает более |
стро |
|
|
|
|
гую пропорциональность между концентра |
|
|
|
|
цией исследуемого окрашенного |
соединения |
|
|
|
|
и численным отклонением показания прибо |
|
|
|
|
ра. Рассмотрим это положение на конкретном |
|
|
|
|
примере. |
|
что |
исследуемое |
вещество |
|
|
|
|
Допустим, |
|
|
|
|
имеет спектр |
поглощения, |
представленный |
|
|
|
|
на рис. |
130, |
а. |
Максимума |
поглощение |
до |
|
|
|
|
стигает при длине волны |
к = 550 нм, |
а |
ми |
|
|
|
|
нимума — при к = 640 нм. |
Спектры |
погло |
|
|
|
|
щения построены для |
трех |
различных |
кон |
|
|
|
|
центраций, |
причем |
С1 < |
С2 < С3. На рис. |
|
|
|
|
130, б показана |
зависимость оптической плот- |
|
|
|
|
"°HCoT" T |
n X“aKC |
И Хши 0Т концеатРации |
Ра- |
Рис. 129. Спектральная ка |
пп^‘°Ра опРеделяемого |
вещества. Из него вид- |
рактеристика |
Исветофнль- |
но, что при |
изменении |
концентрации |
в ин- |
v |
v |
t d o b - |
тервале |
от |
Сг до С2 |
(АС) |
соответствующее |
|
^ |
2 - |
зетеный з - |
ему изменение оптической плотности |
AD бу- |
|
|
‘красный ‘ |