
Вторые номера: Альдегид:
1)Производство ацетальдегида. Альтернативные варианты и сравнение. Причины наличия коагуляции этилена в одной реакторной схеме производства уксусного альдегида из этилена. Технологические схемы.
Существует два технологических варианта проведения этого процесса–двухреакторный и однореакторный. В случае двухреакторной схемы водном реакторе проводят первую и вторую реакции из трёх, а во втором реакторе - реакцию реокисления меди кислородом воздуха.

Двухреакторная схема. В Советском Союзе (России) была реализована только двухреакторная схема. Процесс в этом случае проводят при 100-110º и 1 МПа. Этилен и водный раствор солей палладия и меди подают в реактор типа «труба в трубе» 3, который содержит инертную насадку для увеличения межфазной поверхности газ-жидкость. После реактора 3 контактный раствор вместе с реакционными газами поступает в отпарную колонну 4. Газовая фаза из колонны 4 (органические продукты) попадает в ректификационную колонну 5. Кубовый продукт колонны 5 используют для орошения колонны 4. Жидкую фазу из колонны 4 (водный слой) перекачивают в реактор 1, в котором происходит реокисление солей меди воздухом. Регенерированный каталитический раствор через фазовый сепаратор 2 поступает в реактор 3. Часть раствора из фазового сепаратора 2 отводится в регенератор 10, в котором под воздействием хлористого водорода при 150º происходит разложение труднорастворимых оксалатов меди и палладия (щавелевая кислота – один из побочных продуктов). Это необходимо для поддержания активности катализатора. Газовая фаза из сепаратора 2 поступает в скруббер 7, орошаемый, как и скруббер 6, кубовым продуктом из колонны 5. В скруббере 6 промывается несконденсировавшийся газ с верха колонны 5. Конденсат из колонны 5, содержащий ацетальдегид, через холодильник поступает на ректификацию в колонну 8 для отделения лёгких побочных продуктов (диоксид углерода, хлористый метил, хлористый этил), а затем в колонну 9 для отделения более высококипящих продуктов (хлорацетальдегид, уксусная и щавелевая кислоты). Тепло реакции (52 ккал/моль) используется для обогрева колонны 4.
В
случае однореакторной схемы все три
реакции протекают в одном аппарате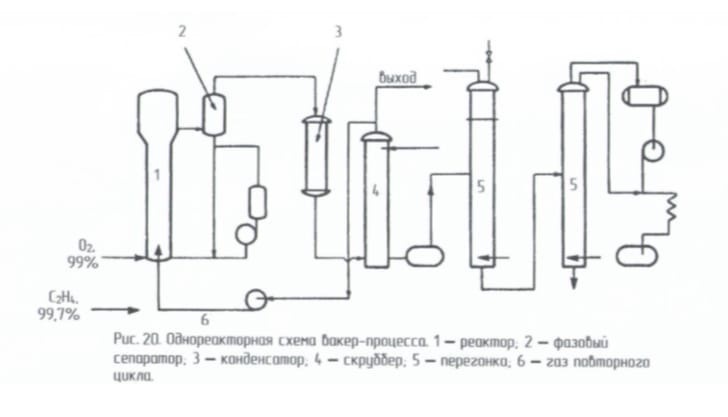
Однореакторная схема. Альтернативная схема использует один реактор, содержащий контактный раствор, в который подают высокочистые этилен и кислород. Процесс проводят при 120-130º и 0,3 МПа. Тепловой эффект снимают за счет испарения части воды. Убыль воды восполняется. Газообразные продукты, пройдя фазовый сеператор 2 и холодильник 3, поглощаются в скрубберах 4. Непрореагировавший этилен в избытке которого проводят процесс (выше верхнего предела взрываемости) рециркулируют обратно в реактор 1. Ацетальдегид очищают ректификацией в колоннах 5.
Основной проблемой двухреакторной схемы является большое количество аппаратов, через которые циркулирует коррозионноактивный контактный раствор. Реакторы 1, 3, 10, сепаратор 2, насосы, коммуникации необходимо изготавливать из дорогих коррозионностойких материалов (титановых сплавов). Еще одним недостатком двухреакторной схемы является низкая производительность (~7 г/л·час). Преимущество двухреакторной схемы над однореакторной – безопасность, поскольку этилен и кислород не контактируют между собой.
Достоинства однореакторной схемы:
1) Мало аппаратов соприкасается с контактным раствором.
2) Производительность выше, чем в 2-х реакторном варианте.
Недостатки:
1) Необходимость использования чистого кислорода и этилена из-за рециркуляции газа.
2) Большой расход энергии на рециркуляцию газа.
3) Взрывоопасность.
4) Потери части этилена из-за отдувки газа из рецикла
Промышленные способы получения ацетальдегида
1)Гидратация ацетилена. Реакция открыта Кучеровым в 1881 году. Производство ацетальдегида этим способом началось в Германии в 1916 году. Классический синтез ацетальдегида по реакции Кучерова заключается во взаимодействии ацетилена с водой в присутствии окиси ртути, растворенной в серной кислоте. Процесс гидратации ацетилена проводится по непрерывной схеме: ацетилен барботируют через водный раствор катализатора (раствор сульфата ртути в серной кислоте). Процесс идёт при 90- 95оС. Степень превращения ацетилена за один проход 30-50%. На выходе получают 8-10% раствор ацетальдегида. Недостатки этого метода – использование токсичного катализатора и дорогого сырья
2) Дегидрирование и окислительное дегидрирование этилового спирта на оксидных (ZnO, CuO, FeO) и металлических катализаторах (Ag, Cu, Au), соответственно. С2Н5ОН → СН3СНО + Н2 С2Н5ОН + 0,5О2 → СН3СНО + Н2О Дегидрирование проводят при температуре 270-300оС, селективность образования ацетальдегида 90-95%. Образующийся водород достаточно чистый и может быть использован в реакциях гидрирования. Пары этанола смешивают с воздухом при 0,3 МПа и 450-550оС и пропускают через серебряный катализатор. Температура реакции контролируется количеством подаваемого воздуха. Селективность образования ацетальдегида 85-95%.
3) Окисление этилена (Вакер-процесс)
Метод был основан на трех стехиометрических реакциях, которые в совокупности складывались в каталитический цикл. Сложение этих реакций приводит к итоговому уравнению каталитического процесса.
C2H4 + H2O + PdCl2 → CH3CHO + Pd(0) + 2HCl
Pd(0) + 2CuCl2 → PdCl2 + 2CuCl
2СuCl + 2HCl + 0,5O2 → 2CuCl2 + H2O
С2Н4 + 0,5O2 → CН3СНО (Процесс необратимый, экзотермический)
Это полифункциональная каталитическая система, в которой каждый из трех катализаторов (PdCl2 , CuCl2 , H2O) выполняет свою кинетическую функцию. Палладий (II) и нуклеофильный катализатор – вода – участвуют в стадиях окисления этилена в ацетальдегид. Медь (II) катализирует окисление восстановленного палладия кислородом. Процесс может проводиться с различными алкенами. Продуктами являются альдегиды и кетоны. Показатели зависят от природы используемого алкена. В случае этилена селективность – до 95%, побочные продукты – уксусная кислота – 2%, СО2 – 1%, хлорпроизводные – 1% (хлористый метил, хлористый этил, хлоруксусный альдегид). В случае окисления пропилена основным продуктом является ацетон. Селективность его образования достигает 90%. Характеристика процесса: сложный, необратимый, экзотермический, гомогенно-каталитический процесс. Термодинамика процесса С2Н4 + 0,5O2 → CН3СНО, ΔН0 = 218,5 кДж/моль, ΔS 0 = 57,62 Дж/моль*К
Механизм и кинетика Вакер-процесса
Включает стадии замещения анионов хлора в тетрахлорпалладате на этилен и воду с последующим депротонированием координированной в транс-положении к этилену воды.
Производство ацетальдегида. Основные источники сырья для получения ацетальдегида. Стадии процесса. Технологические схемы производства ацетальдегида их сравнительный анализ.
Метан:
Производство азотно-водородной смеси для синтеза аммиака на базе двухступенчатой конверсии метана. Основные стадии процесса паровоздушной конверсии метана. Выбор катализатора и оптимальных условий процесса. Технологическая схема.
Производство азотно-водородной смеси для синтеза аммиака на базе двухступенчатой конверсии метана. Основные стадии процесса. Конверсия монооксида углерода, равновесия и кинетика процесса, обоснование выбора катализатора для оптимальных условий процесса. Технологическая схема процесса конверсии метана.
Производство азото-водородной смеси для синтеза аммиака на базе двухступенчатой конверсии метана. Основные стадии процесса. Конверсия СО. Кинетика и равновесие процесса. Обоснование и выбор катализатора, оптимальных условий. Технологическая схема конверсии метана.
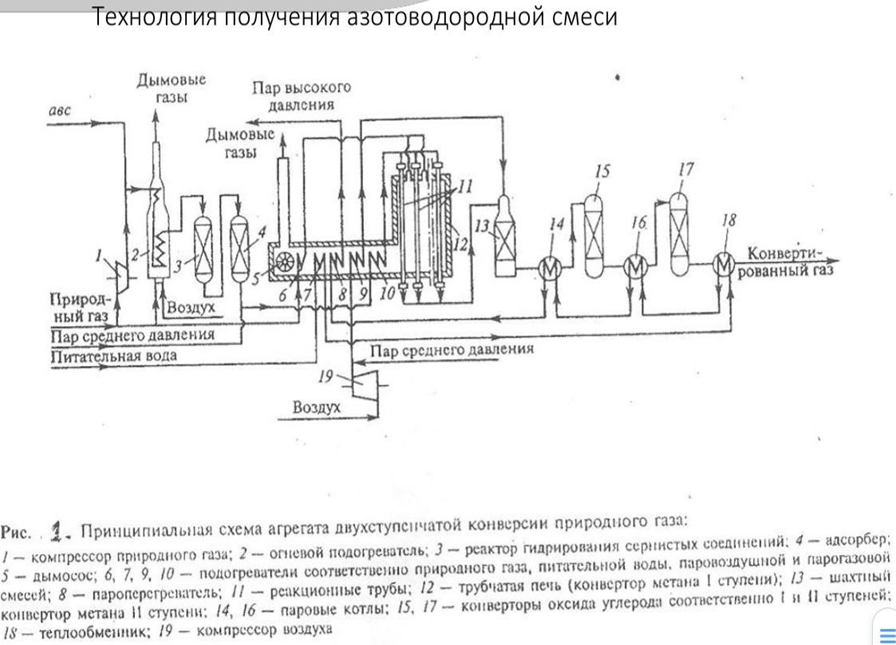
Описание технологической схемы получения азотоводородной смеси для синтеза аммиака Природный газ сжимается в компрессоре (1) смешивается с азотоводородной смесью (10% об.) подогревается в топочном устройстве (2) до 350о и поступает в реактор гидрирования (3), котором соединения, содержащие серу, превращаются в сероводород и углеводороды на алюмокобальт(никель)молибденовых катализаторах. Сероводород адсорбируется в аппарате (4) сорбентом (ZnO). Очищенный газ смешивается с паром среднего давления, подогревается в теплообменнике (10), помещённом в конвекционной части трубчатой печи (12), и поступает в трубки, заполненные никелевым катализатором и помещённые в радиационной части трубчатой печи (12). В межтрубное пространство печи (12) помещены форсунки, в которые подаётся природный газ и воздух для сжигания и создания температуры 900о . При этих условиях подвергается паровой конверсии примерно 90% метана. Остальные ~10% превращаются в шахтном конверторе 13, в который подаётся воздух. Поток газа из шахтного конвертора при температуре ~1000о поступает в котёл-утилизатор (14) для охлаждения газа до 450о и получения пара с давлением 10 Мпа. Далее происходит двухступенчатая конверсия СО в конверторах (15) и (17) с промежуточным охлаждением до 230о в котле-утилизаторе (16). Полученный газ содержит примерно 61% водорода, 20% азота, 17% диоксида углерода. Остальное составляют остатки кислорода, метана, СО, аргон. Очистку от диоксида углерода проводят абсорбцией растворами карбоната калия, моноэтаноламина и др.
Энерготехнологическая система двухступенчатой конверсии


Конверсия метана в азотоводородную смесь для синтеза аммиака
Окисление метана протекает по следующим основным реакциям: СН4 + Н2О(пар)↔ СО + 3Н2 (1) (∆Н = 206,4 кДж)
СН4 + 0,5О2 → СО + 2Н2 (3) (∆Н = -35,6 кДж)
Одновременно протекает реакция (4): СО + Н2О (пар) ↔ СО2 + Н2 (4) (∆Н = -41,3 кДж) Паровая конверсия метана .
Термодинамика процесса СН4 + Н2О(пар)↔ СО + 3Н2 (1) ∆Н = 206,4 кДж; ∆S = 200 Дж/моль∙К Реакция обратимая в широком интервале температур , эндотермическая, с увеличением числа молей газообразных веществ..(Зависимость величины константы равновесия (Кр ) реакции (1) от температуры
Кинетика процесса
Энергия активации паровой конверсии в газовой фазе - 260 кДж/моль. Для достижения приемлемой скорости требуется 1300о , но при этой температуре протекает реакция: СН4 ↔ С + 2Н2 (9) (∆Н = 75,6 кДж) Для подавления реакции используют кат-р Ni/-Al2O3 при 950о , 4 Мпа и соотношении пар:СН4= 24. Повышенное давление используется для экономии энергии, т.к. в трубопроводе газ под давлением до 7 Мпа, а используется азотоводородная смесь тоже под давлением.
Парокислородная конверсия метана
Для получения азотоводородной смеси нужен азот. Его вводят вместе с воздухом. Вторая стадия - паровоздушная конверсия метана протекает автотермически в тех же условиях: СН4 +0,5О2 = СО + 2Н2 + Q (1.2.) Полученный газ очищают от оксидов углерода конверсией монооксида в диоксид углерода в две стадии с последующей абсорбцией СО2 : СО + Н2О = СО2 Кат-ры: Fe2О3 ∙Cr2О3 (450÷500o ), CuO ∙Cr2О3 + добавки(220÷280o )
