
- •Примечание
- •ОГЛАВЛЕНИЕ
- •ВВЕДЕНИЕ
- •Роль физической химии в развитии современной техники
- •1. ЭНЕРГЕТИКА ФИЗИКО–ХИМИЧЕСКИХ ПРОЦЕССОВ, НАПРАВЛЕННОСТЬ ИХ ПРОТЕКАНИЯ
- •1.1. Предмет химической термодинамики. Основные определения и понятия
- •1.2. Внутренняя энергия, энтальпия, работа. Первый закон термодинамики
- •1.3. Тепловые эффекты физико-химических процессов. Термохимические законы
- •1.4. Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
- •1.5. Работа идеального газа
- •1.6. Второй закон термодинамики. Энтропия
- •1.7. Свободная энергия Гиббса и свободная энергия Гельмгольца
- •1.8. Третий закон термодинамики. Абсолютное значение энтропии
- •1.9. Характеристические (термодинамические) функции
- •1.9.1. Изохорно-изотермический потенциал или свободная энергия Гельмгольца (F)
- •1.9.3. Энтальпия системы (H)
- •1.9.4. Изобарно-изотермический потенциал или свободная энергия Гиббса (G)
- •1.9.5. Уравнение Гиббса-Гельмгольца (объединенные первое и второе начала термодинамики)
- •1.10. Химический потенциал
- •1.11. Термодинамика химического равновесия
- •1.11.1. Уравнение изотермы химической реакции
- •1.11.2. Уравнения изобары химической реакции
- •1.11.3. Уравнение изохоры химической реакции
- •2. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. ТЕРМОДИНАМИКА ПОВЕРХНОСТНЫХ ЯВЛЕНИЙ
- •2.1. Поверхностные явления. Адсорбция
- •2.2. Поверхностная энергия и поверхностное натяжение
- •2.3. Практическое применение адсорбции
- •3.2. Основной закон фазового равновесия. Правило фаз Гиббса
- •3.4. Закон распределения Нернста-Шилова
- •3.7.1. Фазовые равновесия в двухкомпонентных системах. Диаграммы состояния бинарных систем
- •3.7.1. Физико-химический и термический анализ
- •3.7.2. Диаграмма состояния системы с простой эвтектикой
- •3.7.3. Диаграммы состояния системы с химическим соединением
- •3.7.3.1. Соединение с конгруэнтной точкой плавления
- •3.7.3.2. Соединение с инконгруэнтной точкой плавления
- •3.7.4. Диаграммы состояния с неограниченной растворимостью компонентов в жидком и твёрдом состояниях
- •Типы диаграмм состояния твёрдых растворов.
- •3.7.5. Диаграммы состояния системы с ограниченной растворимостью компонентов в твёрдом состоянии
- •3.7.7. Диаграммы состояния полупроводниковых систем, применяющихся в электронике. Особенности их построения
- •Система Si – Ge.
- •Система Ge – Sb.
- •Система Al – Si.
- •Система In – Ge.
- •Система Au – Si.
- •Система Pb – Sn.
- •Полупроводниковые соединения.
- •4. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ И ЯВЛЕНИЯ
- •4.1. Кинетика и термодинамика электрохимических процессов
- •4.1.1. Электродные процессы и потенциалы. Классификация электродов
- •4.1.2. Гальванические элементы
- •4.1.3. Кинетика процессов электролиза. Законы электролиза
- •Законы электролиза
- •4.1.3.2. Катодные процессы
- •4.1.3.3. Анодные процессы
- •4.1.4.1. Химические источники тока
- •4.1.4.2. Применение электролиза в технике
- •Электрохимическое производство химических продуктов
- •Гальванотехника
- •Электрохимическая обработка металлов и сплавов
- •Электрохимические преобразователи информации
- •4.2. Кинетика и термодинамика процессов электрохимической коррозии. Методы защиты от коррозии
- •4.2.1. Понятие коррозии. Виды коррозионных повреждений. Скорость коррозии
- •4.2.2. Классификация процессов коррозии
- •4.2.2.1. Классификация по условиям протекания
- •4.2.2.2. Классификация по механизму их протекания
- •Химическая коррозия
- •Электрохимическая коррозия
- •4.2.3. Методы защиты металлов от коррозии
- •4.2.3.1. Легирование
- •4.2.3.2. Защитные покрытия
- •Органические защитные покрытия
- •Неорганические покрытия
- •Металлические защитные покрытия
- •4.2.3.3. Электрохимическая защита
- •4.2.3.4. Другие способы защиты
- •ЛИТЕРАТУРА
- •1. Основная литература
- •2. Дополнительная литература
99
4.1.3. Кинетика процессов электролиза. Законы электролиза
Простейшая электролизная система состоит из электролизера (элек- тролитическая ванна), электродов (инертных или активных), электролита (раствора или расплава), источника постоянного тока. Электрод, под- ключенный к отрицательному полюсу источника тока, называется като- дом, к положительному — анодом.
Законы электролиза
Зависимость между количеством электричества (Q), прошедшего че- рез электролизер и массой (объёмом) веществ, претерпевших превраще- ние на электродах и в электролите, выражается двумя законами Фара- дея, которые можно записать уравнениями, приведенными ниже
1-й закон Фарадея:
m = kQ = kIτ, или V = kQ = kIτ,.
где k — коэффициент пропорциональности, при этом k = m (k = V), если Q = 1 Кл;
m (V) — массы ( объёмы) веществ, претерпевших превращения,
г (л);
I — сила тока, А;
τ — время прохождения тока, с.
2–й закон Фарадея (Q = сonst):
|
|
|
|
m |
Э |
|
V0 |
|
VЭ0 |
|
|
|||||
|
|
|
|
|
|
1 = |
|
1 |
, или |
1 |
= |
|
1 |
, |
|
|
|
|
|
|
m |
Э |
|
|
|
|
|||||||
|
|
|
|
2 |
2 |
|
V0 |
|
V0 |
|
|
|||||
|
|
|
|
|
|
|
|
2 |
|
|
Э |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
где |
Э , Э |
2 |
и V0 |
, V0 |
— |
эквивалентные |
|
массы и |
эквивалентные |
|||||||
|
1 |
Э |
Э |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
объёмы (н.у.) веществ, претерпевающих превращения. |
|
|
||||||||||||||
Из |
2–го |
закона |
|
|
Фарадея |
|
|
следует, |
что |
при |
||||||
Q = F = 96500 Кл, m = Э или V0 |
= V0 , тогда |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
Э |
|
|
|
|
|
|
|
|
|
|
|
|
k = |
Э |
, или |
k = |
V0 |
, |
|
|
|
||
|
|
|
|
|
|
F |
Э |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
||
где k — электрохимический эквивалент вещества, г/Кл или л/Кл. Отсюда можно записать уравнение, объединяющее 1-й и
2-й законы Фарадея:
m = Iτ |
Э |
, или |
V0 = |
V0 |
, |
F |
Э |
||||
|
|
|
F |
|
100
Следует заметить, что количества веществ, полученных практи- чески, всегда меньше рассчитанных, что численно характеризует- ся величиной выхода по току (Вт), при этом Вт < 1.
Вт = |
mпp |
, или |
Вт = |
Qp |
, |
|
|
||||
|
mp |
|
Qпp |
||
где mпp , mp — масса практически выделившегося на электро-
дах вещества и расчётная;
Qпp , Qp — заряд (количество электричества), практиче-
ски затраченный на осуществление электрохимического про- цесса и его расчётное значение.
Уравнение, объединяющее 1-й и 2-й законы Фарадея, с учётом выхода по току будет иметь вид
m = |
Э |
Iτ Вт |
или |
V0 = |
V0 |
Iτ Вт. |
F |
Э |
|||||
|
|
|
|
F |
|
Снижение выхода по току обусловлено различными причи- нами, важнейшими из которых являются поляризация и пере- напряжение при прохождении тока.
Поляризация и перенапряжение при электролизе водных растворов электролитов.
Природа возникновения поляризации при электролизе обусловлена отклонением величин электродных потенциалов от их равновесных зна- чений при прохождении через электролит тока. Величина поляризации зависит от природы выделяемых на электродах веществ, природы элек- тродов и состояния их поверхности, плотности тока j, A/м2, которая равна по определению
j = I/S,
где I — ток через электрохимическую ячейку (электролизную ванну), А, S — площадь электрода, м2;
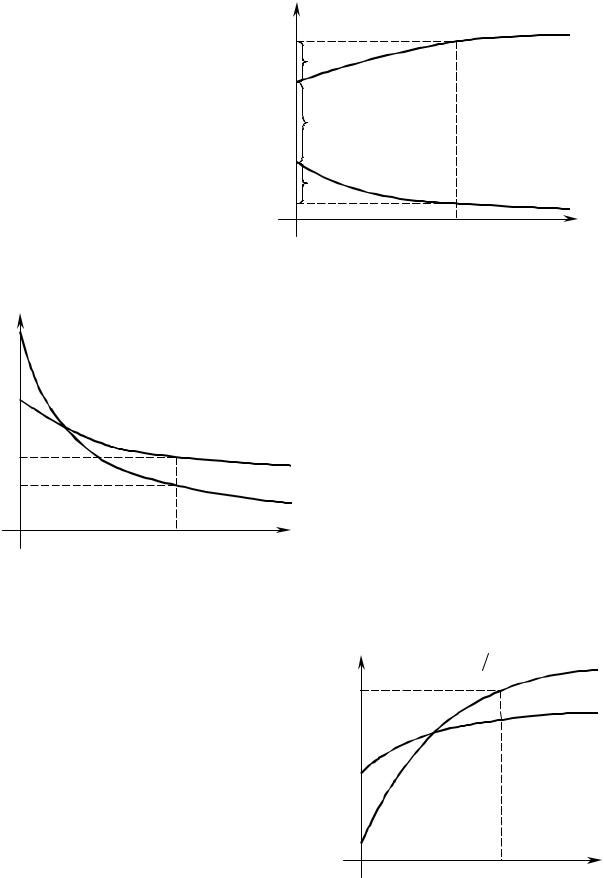
и других факторов. Чем больше плотность тока j, тем в большей степени поляризуются электроды. Вследствие катодной поляризации потенциал катода становится более отрицательным, при анодной поляризации по- тенциал анода становится более положительным (рис. 4.1).
Поляризация может связана с замедленностью электрохимических процессов разряда частиц. Кроме того, накопление продуктов электроли- за на электродах изменяет их природу и величину электродных потен-
|
|
|
|
|
|
|
|
101 |
|
циалов (химическая поляриза- |
φ |
|
|
|
|||||
ция). При этом в электролизе- |
φполярА |
∆φА |
1 |
|
|||||
ре |
возникает |
внутренний |
|
|
|||||
|
|
|
|||||||
гальванический элемент, ЭДС |
φАр |
|
|
|
|||||
которого направлена встречно |
|
Eр = φАр −φрК |
Eполяр = φполярА |
−φполярК |
|||||
внешней |
ЭДС |
и называется |
|
||||||
ЭДС поляризации (Eполяр ). Ве- |
φрК |
|
|
|
|||||
личина перенапряжения зави- |
|
∆φК |
2 |
|
|||||
сит от природы выделяющих- |
поляр |
|
|||||||
φК |
|
|
|
||||||
ся |
на |
электродах |
веществ, |
|
|
jраб |
j |
||
природы |
электродов |
и вели- |
|
|
|||||
Рис. 4.1. Поляризация электродов при |
|||||||||
чины их поверхности, приро- |
|||||||||
электролизе: 1 ― поляризация анода; |
|||||||||
ды электролита и, в частности, |
|||||||||
|
2 ― поляризация катода |
|
|||||||
|
|
|
|
|
|
|
|||
φ |
|
|
|
|
|
|
|
|
величины pH, температуры, нали- |
||||
φрH2 |
|
|
|
|
|
|
|
|
чия катализатора. Для преодоления |
||||
|
|
|
|
|
|
|
|
|
поляризации извне |
на |
электроды |
||
φZnр |
|
|
|
|
|
|
|
|
подается избыточное напряжение, |
||||
|
|
|
|
|
|
|
|
|
называемое перенапряжением (ηК |
||||
φполярZn |
|
|
|
Zn |
2+ |
+ 2e = Zn |
и ηА). При этом перенапряжение, |
||||||
|
|
|
|
связанное с выделением газов зна- |
|||||||||
φполяр |
|
|
|
|
|
|
|
|
чительно |
превышает |
таковое при |
||
H2 |
|
|
|
2H+ + 2e = H2 |
выделении металлов. При электро- |
||||||||
|
|
|
|
||||||||||
|
|
|
|
лизе водных растворов электроли- |
|||||||||
|
|
|
|
jраб |
|
|
|
j |
тов поляризация катода обусловле- |
||||
Рис. 4.2. Поляризационные кривые |
на выделением H2 , поляризация |
||||||||||||
катодного выделения водорода и цинка |
анода ― выделением |
O |
. Таким об- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
разом η |
>> η |
(рис. 4.2). Как следует из рисунка ∆φполяр << ∆φполяр и при |
|||||||||||
|
H |
|
Me |
|
|
|
|
|
|
|
Zn |
|
H |
|
2 |
|
|
|
|
|
|
|
|
|
|
2 |
|
рабочей |
поляр |
плотности |
тока |
jраб |
φ |
2OH− −2e =1 2O2 + H2O |
|||||||
поляр |
|
|
|
|
|
|
|
|
поляр |
|
|
|
|
φZn |
> φH2 |
, что и обусловливает вы- |
|
|
|
||||||||
φO2 |
|
|
|
||||||||||
деление Zn с большей скоростью. |
|
|
поляр |
|
|
|
|||||||
Исследование кинетики анодных про- |
|
2Cl− −2e = Cl2 |
|||||||||||
φCl2 |
|
||||||||||||
цессов показало, что выделение кислорода |
φр |
|
|
|
|||||||||
на аноде при электролизе водных раство- |
|
|
|
||||||||||
ров протекает с более высокой поляриза- |
Cl2 |
|
|
|
|||||||||
|
|
|
|
||||||||||
цией, чем выделение хлора (рис. 4.3). Как |
|
|
|
|
|||||||||
видно из рисунка, ∆φClполяр << ∆φOполяр |
при |
φр |
|
|
|
||||||||
|
|
|
|
2 |
поляр |
2 |
поляр |
, |
O2 |
|
|
|
|
|
|
|
|
|
|
|
jраб |
j |
|||||
рабочей плотности тока jраб φCl |
|
< φO2 |
|
||||||||||
что обусловливает выделение Cl2 |
при |
Рис. 4.3. Поляризационные кривые |
|||||||||||
электролизеводныхрастворовхлоридов. |
анодного выделения кислорода |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
и хлора |
|
|

102
Отсюда ЭДС разложения электролита будет равна
Eразл = Eполяр + ηК + ηА . |
(4.154) |
||||||||||
Исходя из вышесказанного, рассчитаем Eполяр раствора |
|||||||||||
хлорида цинка pH = 5 |
на |
электродах из Pt , если ηZn = 0 ; |
|||||||||
ηCl2 = 0,3 B и определим Eразл |
ZnCl2 . |
|
|||||||||
Запишем схему электролизной системы: |
|
||||||||||
(К (–)) Pt |
|
|
|
|
|
|
|
|
|
|
Pt ((+) А) |
|
|
|
|
|
|
|
|
|
|
|
|
Н2О |
ZnCl2 |
|
|
|
|
|
|
||||
, Н2О |
Н2О |
||||||||||
H+ |
|
pH=5 |
Cl- |
||||||||
Zn2+ Zn2+ + 2e = Zn 2Cl– – 2e = Cl2
частично протекают процессы: 2H+ + 2e = H2 H2O – 2e = 1/2O2+2H+
Процессы выделения H2 и O2 при низких плотностях то- ка снижают выход по току Zn и Cl2 .
Суммарное уравнение электролиза имеет вид
ZnCl2 ток, I →Zn + Cl2
Накопление на электродах продуктов электролиза ( Zn и Cl2 ) приводит к образованию внутреннего гальванического
элемента и ЭДС поляризации Eполяр .
Запишем схему гальванического элемента, уравнения электродных реакций, суммарное уравнение электрохими- ческой реакции и рассчитаем Eполяр .
Pt, Zn│ZnCl2, Н2О│Cl2, Pt,
ϕp |
2+ |
Zn |
= −0,76 B , pH = 5 , ϕp |
Cl |
− =1,36 B |
Zn |
|
Cl2 |
|
А: Zn – 2e = Zn2+,
К: Cl2 + 2e = 2Cl-
Zn + Cl2 =Zn2+ + 2Cl-
Eполяр = φK − φA =1,36 + 0,76 = 2,12 B.
Исходя из уравнения (4.154) рассчитаем
Eразл = Eполяр + ηК + ηА = 2,12 + 0 + 0,3 = 2,42 B .
