
Лекции химия_1 / 18_Общие свойства металлов
.pdf
HCl, HBr, HJ, H2S, H2Se, H2Te или кислоты с устойчивыми анионами, имеющие низкие окислительно-восстановительные потенциалы (H2СO3, H3ВO3, H3РO4 и др.), а также разбавленная серная кислота H2SO4.В растворах
таких кислот стандартный потенциал окислителя |
Eo |
0 , т.е. с ними |
|
2H /H |
|
|
2 |
|
реагируют металлы с положительными значениями потенциалов (стоящие в ряду напряжений левее водорода).
Пример. Zn + H2SO4 разб.  в-ль ок-ль
в-ль ок-ль
E0 E0 E0 E0 E0 0 ( 0,76) 0,76 B,
ок ля в ля 2H /H 2 Zn2 /Zn
цинк растворяется в разбавленной серной кислоте:
1 Zn - 2 e = Zn2+
1 2H+ + 2 e = H2
Zn + 2H+ = Zn2+ + H2
Zn + H2SO4 разб. = ZnSO4 + H2.
Пример . Cu + H2SO4 разб. или HCl 
в-ль ок-ль |
ок-ль |
Реакция взаимодействия меди с хлороводородной (соляной) и разбавленной серной кислотами невозможна, так как потенциал окислителя меньше потенциала восстановителя:
Eок0 |
ля E02H /H 2 |
0 ; Eв0 |
ля ECu0 |
2 |
/Cu 0,34 B . |
Для растворения в |
подобных кислотах |
малоактивных металлов, стоящих в |
|||
ряду стандартных |
потенциалов после водорода, |
необходимо приcутствие |
|||
какого-либо другого окислителя, потенциал которого был бы выше потенциала данного металла в кислой среде. Так, медь может растворяться в
соляной |
кислоте в |
присутствии кислорода. |
Потенциал меди |
|
ECuo |
2 /Cu |
0,34B. потенциал кислорода при рН=0 EOo |
2 /2H2O 1,22B. . |
|
|
|
2 |
Cu - 2e = Cu2+ |
|
|
|
1 |
O2 + 4H+ + 4e = 2H2O |
|
2Cu + O2 + 4H+ = 2Cu2+ + 2H2O 2Cu + O2 + 4HCl = 2CuCl2 + 2H2O
Соляная кислота здесь играет роль среды, а сама в окислительном процессе не участвует.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
Если в системе одновременно присутствуют два окислителя, то всегда выбирают окислитель с большим значением потенциала.
В ряде случаев при взаимодействии металлов с разбавленными кислотами на поверхности некоторых металлов образуются труднорастворимые в кислотах соединения, образующие защитные пленки из продуктов реакции, тормозящие реакцию. Так, свинец не растворяется в серной кислоте при ее концентрации ниже 80%, так как образующаяся при взаимодействии свинца с серной кислотой соль PbSO4 нерастворима и создает на поверхности металла защитную пленку.
Взаимодействие металлов с кислотами, в которых окислитель - анион кислоты.
В концентрированной серной и разбавленной азотной кислотах продукты восстановления аниона зависят от активности металла. По активности металлы можно условно разделить на три группы:
Li Ba Ca Na Mg Al Mn Zn Cr Fe Cd Ni Sn Pb H Bi Cu Ag Hg Au
активные |
средней активности |
малоактивные |
Взаимодействие металлов с H2SO4 конц.
При взаимодействии металлов с концентрированной серной кислотой сульфат-ион может восстанавливаться до H2S, S, SO2. В концентрированной серной кислоте роль окислителя выполняет ион - SO42 , восстановление которого может протекать по следующим реакциям:
SO42 + 4H+ + 2e = SO2 + 2H2O SO42
+ 4H+ + 2e = SO2 + 2H2O SO42 + 8H+ + 6e = S + 4H2O
+ 8H+ + 6e = S + 4H2O
SO42 + 10H+ + 8e = H2S + 4H2O
+ 10H+ + 8e = H2S + 4H2O
Условная схема взаимодействия металлов с концентрированной серной кислотой может быть представлена следующим образом:
М активные
H2S
М средн. активности
М+ H2SO4конц. сульфат М + H2O +  S
S
Ммалоактивные
SO2
Пример. Mn + H2SO4 конц.
Марганец – активный металл, поэтому при взаимодействии образуется H2S:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

4Мn - 2 e = Мn2+
SO42 + 8 e + 10H+ = H2S + 4H2O
+ 8 e + 10H+ = H2S + 4H2O
4Mn + SO42 |
+ 10H+ = 4Mn2+ + H2S + 4H2O |
|
4SO42 |
|
4SO42 |
4Mn + 5H2SO4конц. = 4MnSO4 + H2S + 4H2O.
Серная кислота в данной реакции не только окислитель, но и среда, в которой проходит ОВР.
Взаимодействие металлов с HNO3
При взаимодействии металлов с разбавленной азотной кислотой нитрат-ион также может восстанавливаться до разных продуктов - NH4+, N2, N2O, NO. Даже разбавленные водные растворы азотной кислоты окисляют металлы без выделения водорода. Восстановление нитрат-иона NO3 может протекать следующим образом:
может протекать следующим образом:
NO3 + 1e + 2H+ = NO2 + H2O
+ 1e + 2H+ = NO2 + H2O
NO3 + 3e + 4H+ = NO + 2H2O
NO3 + 8e + 10H+ = N2O + 5H2O
+ 8e + 10H+ = N2O + 5H2O
2NO3 + 10e + 12H+ = N2 + 6H2O
+ 10e + 12H+ = N2 + 6H2O
NO3 + 8e + 10H+ = NН4+ + 3H2O
+ 8e + 10H+ = NН4+ + 3H2O
Степень восстановления нитрат-иона зависит как от концентрации кислоты, так и от окислительно-восстановительного потенциала металла. Чем выше концентрация кислоты, тем менее глубоко восстанавливается ион NO3 . В реакциях металлов с концентрированной азотной кислотой обычно выделяется диоксид азота NO2, независимо от активности металла.
Условная схема взаимодействия металлов с разбавленной азотной кислотой:
|
М активные |
|
NH4NO3 |
|
М средн. активности |
М + HNO3 разб. нитрат М + H2O + |
N2, N2O |
|
М малоактивные |
|
NO |
|
Пример составления окислительно-восстановительной реакции взаимодействия металла с разбавленной азотной кислотой:
|
Mg + HNO3(разб) |
Mg(NO3)2 ; NH4+ |
|||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||

4 |
Mg |
2e = Mg2+ |
1 |
NO3 |
+ 8e + 10H+ = NH4+ + 3H2O |
4Mg + NO3 + 10H+ = 4Mg2+ + NH4+ + 3H2O
+ 10H+ = 4Mg2+ + NH4+ + 3H2O
4Mg + 10HNO3(разб) = 4Mg(NO3)2 + NH4NO3 +3H2O
Пример. Cu + HNO3 разб. 
Медь – малоактивный металл, E0Cu 2 /Cu 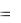 0,34 B , поэтому при взаимодействии с разбавленной азотной кислотой образуется NO:
0,34 B , поэтому при взаимодействии с разбавленной азотной кислотой образуется NO:
3 |
|
Cu 2 e |
= Cu2+ |
||||
|
|||||||
2 |
|
NO3 + 3 e + 4H+ = NO + 2H2O |
|||||
|
|
|
|
|
|
|
|
|
3Cu + 2NO3 |
+ 8H+ = 3Cu2+ + 2NO + 4H2O |
|||||
|
|
|
|
|
|
||
|
6NO3 |
6NO3 |
|||||
3Cu + 8HNO3разб. = 3Cu(NO3)2 + 2NO + 4H2O.
В реальных условиях при реакциях с концентрированной серной и разбавленной азотной кислотами, как правило, образуется смесь продуктов восстановления анионов, в которой количественно преобладает тот или иной компонент. Состав смеси во многом определяется концентрацией раствора кислоты. Так, например, действие на металлы сильно разбавленной азотной кислоты приводит к появлению в продуктах реакции нитрата аммония.
При взаимодействии металлов с концентрированной азотной кислотой, независимо от активности металла, образуется NO2:
М + HNO3конц. нитрат М + NO2 + H2O.
Пример. Zn + HNO3 конц. 
Zn 2 e = Zn2+
2 NO3 + e + 2H+ = NO2 + H2O
+ e + 2H+ = NO2 + H2O
Zn + 2NO3 + 4H+ = Zn2+ + 2NO2 + 2H2O 2NO3
+ 4H+ = Zn2+ + 2NO2 + 2H2O 2NO3 2NO3
2NO3
Zn + 4HNO3 конц. = Zn(NO3)2 + 2NO2 + 2H2O.
Элементы, для которых характерна высокая степень окисления, в результате взаимодействия с концентрированной азотной кислотой образуют кислородсодержащие кислоты. Азотная кислота при этом восстанавливается до NO.
3 Re - 7e + 4H2O = ReO4ˉ + 8H+
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

7 |
|
NO3 |
+ 3e + 4H+ = NO + 2H2O |
|
|||
3Re + 7 NO3 |
+ 4H+ = 3ReO4ˉ + 7NO + 2H2O |
||
3Re + 7HNO3 = 3HReO4 + 7NO + 2H2O
Концентрированные кислоты, в частности, серная и азотная, на некоторые металлы оказывают пассивирующее действие. В результате многие металлы не растворяются в таких кислотах. К примеру, с концентрированной серной кислотой при комнатной температуре не реагирует железо. Вследствие перехода металла в пассивное состояние при реакциях с рассматриваемой группой кислот могут образоваться продукты, не соответствующие приведенным схемам. Например, при нагревании железо реагирует с концентрированной серной кислотой, но образуется продукт восстановления SO2, более характерный для реакций с участием малоактивных металлов.
Взаимодействие металлов с водой.
Потенциал электродного процесса 2H+ |
+ 2e = H2 |
зависит от рН среды и |
||||
определяется соотношением E |
|
|
|
Eo |
0,059pH. В нейтральной |
|
|
|
2H /H2 |
2H /H2 |
|
||
среде при рН=7, когда окислителем является вода, для реакции |
||||||
2H2O |
|
2e H2 2OH |
|
|||
Eок ля |
E2H |
2 |
O/H |
0,41B, |
||
|
|
|
|
2 |
|
|
Реакции взаимодействия металлов с водой в общем виде описываются схемой
M + H2O M(OH)n + H2.
в-ль ок-ль
следовательно, реагировать с водой могут те металлы, потенциал которых менее 0,41 B. Водород из воды вытесняют наиболее активные металлы и лишь при условии образования растворимых гидроксидов. В случае образования малорастворимых соединений, а большинство гидроксидов металлов являются именно таковыми, они пассивируют поверхность металла (такие металлы как алюминий, цинк, хром, титан), и реакция, едва начавшись, тут же прекращается или протекает крайне медленно.
Пример. Ca + H2O 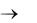
в-ль ок-ль
Потенциал кальция вследствие растворимости гидроксида может быть принят равным стандартному потенциалу:
E0Ca 2 /Ca 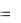 2,84 B, Eок ля E2H2O/H2
2,84 B, Eок ля E2H2O/H2 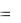 0,41B,
0,41B,
Eок ля Eв ля , кроме того, гидроксид кальция частично растворим в воде, оэтому кальций (щелочноземельный металл) растворяется в воде:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
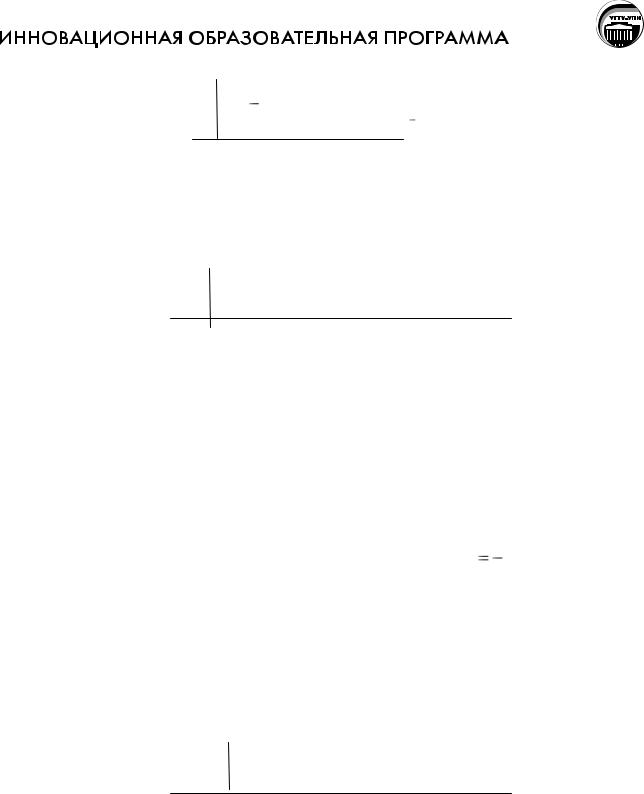
1 |
Сa 2 e = Ca2+ |
1 |
2H2O + 2 e = H2 + 2 OH |
Сa + 2H2O = Ca2+ + H2 + 2OH
Ca + 2H2O = Ca(OH)2 + H2.
Магний - химически активный металл при комнатной температуре не взаимодействует с водой - произведение растворимости (ПР) равно 1,1∙10-11. Магний вытесняет водород только из горячей воды.
1 Mg +2H2O - 2e = Mg(OH)2 + 2H+ 1 2H2O + 2e = H2 + 2OH
Mg + 2H2O = Mg(OH)2 + H2
Металлы, расположенные в ряду напряжений между магнием и кадмием, при обычной температуре с водой не взаимодействуют и не вытесняют водород из воды.
Рассматривая взаимодействие металлов с водой, нельзя не учитывать, что большинство металлов имеют на своей поверхности прочную оксидную пленку, обладающую защитными функциями. Чаще всего именно она является причиной невозможности протекания реакции между достаточно активным металлом и водой.
Например, алюминий судя по потенциалу EoAl(OH) |
/Fe |
1,88 B должен |
3 |
|
|
энергично реагировать с водой, но этого не происходит из-за наличия на поверхности металла прочной, нерастворимой в воде оксидной пленки. Разрушение защитной пленки (например, путем образования амальгамы – образование сплавов с ртутью при взаимодействии металла с раствором нитрата ртути (I) приводит к активному протеканию реакции между металлом и водой, хотя ПР гидроксида алюминия равно 1∙10-33 . Алюминий энергично реагирует с водой с выделением водорода:
2 Al +3H2O - 3e = Al(OH)3 + 3H+ 3 2H2O + 2e = H2 + 2OH
2 Al + 6H2O = 2Al(OH)3 + 3H2
Явление глубокого торможения окисления металла, обусловленное наличием на его поверхности защитных оксидных или солевых пленок, называется пассивацией. В условиях атмосферного воздуха пассивирующие пленки образуются на хроме, никеле, алюминии, кадмии, цинке.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

Взаимодействие металлов с растворами щелочей
В растворах щелочей окислительное действие оказывают также молекулы воды, но с увеличением pH окислительная способность воды уменьшается,
при pH = 14 E02H2O/H2 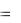 0,83 B . Другое отличие поведения металлов в
0,83 B . Другое отличие поведения металлов в
растворах щелочей обусловлено растворением пассивирующих плѐнок на металлах, оксиды которых амфотерны. Таким образом, в растворах щелочей растворяются металлы, потенциалы которых меньше -0,83В, склонные к образованию гидроксокомплексов типа [Me(OH)4 ]n , то есть металлы, чьи гидроксиды являются амфотерными: Ве(OH)2, (Al(OH)3, Zn(OH)2, Sn(OH)2, Рb(OH)2, Cr(OH)3 и др. Упрощенно вместо гидроксокомплексов продукты реакции могут записываться в следующем виде: AlO2 , ZnO22 , SnO22 , CrO2 и т.д.
и т.д.
Пример. Al + NaOH + H2O 
в-ль ок-ль
В |
водных |
|
растворах |
щелочей |
роль |
окислителя выполняет вода, |
||
Eок |
ля |
E02H |
|
O/H |
0,83 B . Выписываем потенциал алюминия в щелочной |
|||
|
|
|
2 |
|
2 |
|
|
|
среде: Eв ля |
EAlO2 /Al |
2,36 B. Реакция взаимодействия алюминия с рас- |
||||||
твором щѐлочи возможна, Eок ля |
Eв ля . |
Другим условием взаимодействия |
||||||
является растворимость гидроксида и оксида металла в растворе щѐлочи, это условие выполняется, так как оксид и гидроксид алюминия амфотерны. Таким образом, алюминий реагирует с раствором едкого натра:
2 |
|
Al 3 e + 4OH = AlO2 + 2H2O |
|||
3 |
|
2H2O + 2 e = H2 + 2OH |
|||
|
|
|
|
|
|
2Al + 8OH |
+ 6H2O = 2AlO2 + 4H2O + 3H2 + 6OH |
||||
|
|
|
2Al + 2OH + |
2H2O = 2AlO2 + 3H2, |
|
|
|
|
2Na+ |
2Na+ |
|
|
|
|
2Al + 2NaOH + |
2H2O = 2NaAlO2 + 3H2. |
|
Пример. Взаимодействие цинка с водным раствором щелочи.
Расчет величины ЭДС системы с учетом рН среды показывает, что ЭДС больше нуля и данная реакция возможна:
∆Е = Eo2H2O/H 2 |
|
– EoZnO22 /Zn = -0,827 – (-1,220) = +0,393В |
|||||||||||||||||
|
|||||||||||||||||||
|
|
|
|
Zn - 2e + 4OH |
ZnO22 + 2H2O |
||||||||||||||
Исполнитель: |
|
|
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
|||

2H2O + 2e = H2 + 2OH
Zn + 2OH |
ZnO22 + H2 |
Zn + 2NaOH |
Na2ZnO2+ H2 |
или, через образование комплексных соединений:
Zn -2e + 4OH [Zn(OH)4]2
[Zn(OH)4]2 2H2O + 2e = H2 + 2OH
2H2O + 2e = H2 + 2OH
Zn + 2H2O + 2OH = [Zn(OH)4]2 + H2
Zn + 2H2O + 2NaOH = Na2 Zn(OH)4 + H2
Выше рассмотрены лишь общие закономерности взаимодействия металлов с водой, растворами кислот и щелочей. При анализе поведения металла в той или иной среде необходимо также учитывать его индивидуальные особенности.
ОКИСЛИТЕЛЬКИСЛОРОД.
Полуреакции кислорода в качестве окислителя:
O2 + 2H2O + 4e = 4OH в нейтральной и щелочной средах) O2 + 4H+ + 4e = 2H2O
в нейтральной и щелочной средах) O2 + 4H+ + 4e = 2H2O  в кислой среде)
в кислой среде)
Пример. Взаимодействие меди с водным соляной кислоты в присутствии кислорода.
2 Cu - 2e = Cu2+
1 O2 + 4H+ + 4e = 2H2O
2Cu + O2 + 4H+ = 2Cu2+ + 2H2O
2Cu + O2 + 4HCl = 2CuCl2 + 2H2O
Если в системе одновременно присутствуют два окислителя, то всегда выбирают окислитель с большим значением потенциала.
Например, если в условии указаны H2 и O2 (подразумевается, что условия стандартные и газы подаются к поверхности металла под давлением 1 атм.), то окислителем, судя по потенциалам, будет кислород.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

ЛИТЕРАТУРА
1.Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа. 2002. ч.1.
2.Полторак О.М., Ковба Л.М.. «Физико-химические основы неорганической химии». М.: МГУ, 1994.
3.Горшков В.И., Кузнецов И.А. . «Физическая химия». М.: МГУ, 1993.
4.Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984.
5.Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М., Химия, 1987.
6.Фичини Ж., Ламброзо-Бадер Н., Депезе Ж.-К. Основы физической хи-
мии. М. Мир. 1972.
7.Дж. Кемпбел. Современная общая химия. М.:Мир. 1975г.
8.Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.:
Мир,1982. 2.
9.Дамаскин Б.Б., Петрий О.А . Электрохимия. М: Высшая школа, 1987.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
