
Лекции химия_1 / 18_Общие свойства металлов
.pdf
ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ
СОДЕРЖАНИЕ
Содержание………………………………………………………………………. 1
Положение металлов в периодической таблице………………………………. 2
Способы извлечения металлов из руд ………………………………….……….3
Природа химической связи в металлах………………………………………… 5
Общие химические свойства металлов………………………………………… 7
Реакции с неметаллами …………………………………………………………..7
Взаимодействие металлов с растворами электролитов……………………….. 8
Взаимодействие металлов с растворами солей………………………………... 9
Взаимодействие металлов с водой, водными растворами кислот и щелочей ..9
Действие кислот на металлы ……………………………………………...10
Взаимодействие металлов с водой………………………………………. 15
Взаимодействие металлов с растворами щелочей ………………………17
Окислителькислород. …………………………………………………………18
ЛИТЕРАТУРА ………………………………………………………………….19
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ.
Положение металлов в периодической таблице.
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бериллия к астату, то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся элементы побочных подгрупп), а справа вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером. К элементам - металлам относятся s - элементы I и II групп, все d- и f - элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго).
Общей особенностью атомов металлов являются их большие в сравнении с атомами неметаллов размеры. Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо. Атомы металлов характеризуются низкими потенциалами ионизации и близким к нулю или отрицательным сродством к электрону. Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей, и, как правило, не способны присоединять электроны — проявлять окислительные свойства.
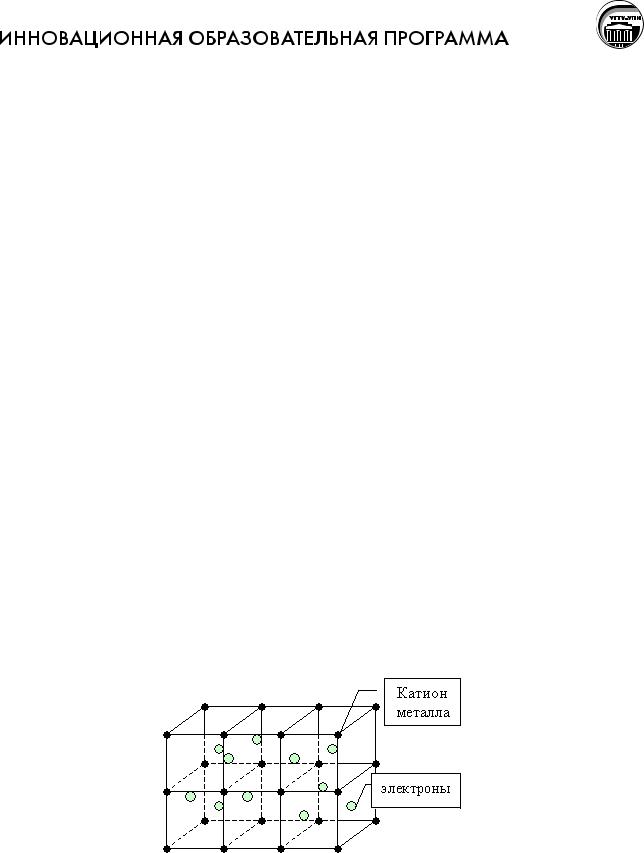
Свойства вещества, называемые ―металлическими‖, определяются его электронным строением, т.е. природой химической связи, называемой ―металлической”. Этот тип связи свойственен лишь коллективам атомов или молекул (отдельные атомы и молекулы никакими металлическими свойствами не обладают) и поэтому возможен лишь в конденсированном (жидком или твердом) состоянии.
Химическая связь предполагает определенный вид кристаллической решетки. Металлическая химическая связь способствует образованию кристаллов с металлической кристаллической решеткой. В узлах кристаллической решетки находятся атомыионы металлов, а между ними свободно движущиеся электроны. Металлическая связь отличается от ионной, т.к. нет анионов, хотя
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

есть катионы. Отличается она и от ковалентной, т.к. не образуются общие электронные пары.
Таким образом, кристаллическая решетка зависит и определяется видом химической связи, но в то же время является причиной для физических свойств.
Способы извлечения металлов из руд
В самородном состоянии в природе встречаются лишь немного металлов: золото, платина, изредка серебро, медь, ртуть. Подавляющее большинство металлов находится в виде соединений с другими элементами. Минералы и горные породы, содержащие соединения металлов количестве и виде, пригодном для промышленного извлечения носят названия руд.
РУДЫ
Оксиды |
Сульфиды |
Соли |
(MenOm ) |
(MenSm) |
(Карбонаты, сульфаты) |
Стадии переработки руд обычно включают:
1). Для сульфидных и карбонатных руд - обжигMeS + O2 = MeO + SO2 МеCO3 = CO2 + MeO
2). Восстановление металлов из MeO:
MeO + C (CO) |
Me + CO2 |
MeO + Al |
Me + Al2O3 |
3).Выщелачивание (гидрометаллургические методы):
Руда + Реагент (кислота, соль) + вода раствор комплексного соединения (соли). Полученный раствор подвергают (через стадии разделения металлов) электролизу.
Общие физические свойства.
Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа").
1.Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду - Au, Ag, Cu, Sn, Pb, Zn, Fe уменьшается.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

2.Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
3.Электропроводность. Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду - Ag,Cu,Al,Fe уменьшается. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
4.Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
5.Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
6.Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (ρ=0,53 г/см3); самый тяжелый – осмий (ρ =22,6 г/см3). Металлы, имеющие ρ < 5 г/см3 считаются "легкими металлами".
7.Температуры плавления и кипения. Самый легкоплавкий металл –
ртуть (т.пл. = -39°C), самый тугоплавкий металл – вольфрам (t°пл. = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Примеры электро- и теплопроводности некоторых металлов (относительно значений для ртути = 1)
Металл |
Электропроводность |
Теплопроводность |
Висмут |
0,8 |
1 |
Сурьма |
2,5 |
2,2 |
Железо |
9,8 |
9,5 |
Алюминий |
36,0 |
26,0 |
Медь |
56,9 |
46,2 |
Серебро |
59,9 |
48,8 |
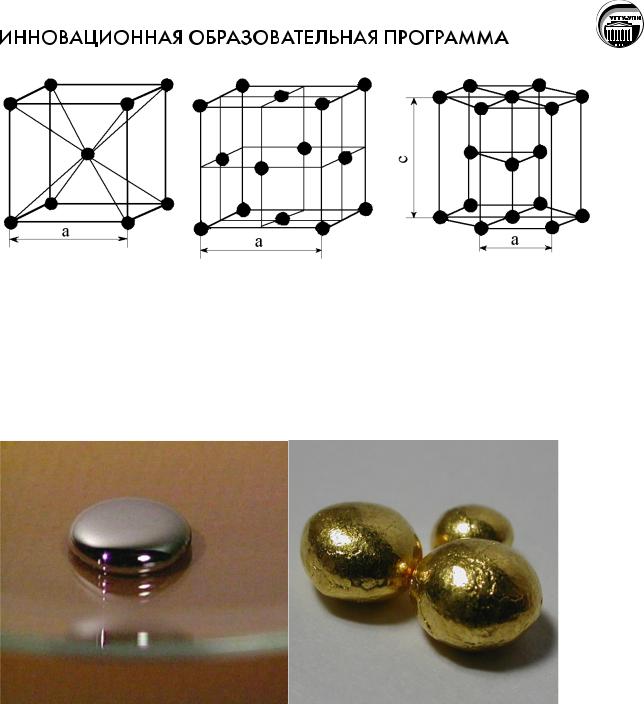
При комнатной температуре все металлы кроме ртутикристаллические вещества. Металлы кристаллизуются в основном в трех видах кристаллических решеток:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
a) |
b) |
c) |
a)объемно-центрированная (Na. K и др.);
b)гранецентрированная (Cu, Ag, Au и др.);
c)гексагональная (Be, Mg, Zn, Ti и др.
Все металлы имеют оттенки белого цвета, за исключением Cu и Au.
Ртуть |
Золото |
Природа химической связи в металлах.
По современным представлениям металл можно рассматривать как совокупность системы положительно заряженных ионов, колеблющихся относительно их положения равновесия и системы относительно свободных коллективизированных электронов, заполняющих решетку, которые компенсируют силы взаимного отталкивания положительных ионов. Энергия этих делокализованных электроновэлектронов проводимости - отвечает зоне проводимости. Согласно зонной теории, у металлов оттсутствует запрещенная зона между валентной зоной и зоной проводимости.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

При образовании кристалла атомные орбитали металла в результате перекрывания образуют молекулярные. При этом число молекулярных орбиталей равно числу атомных, из которых они образовались , и имеет в кристалле порядок числа Авогадро. Разность энергий между отдельными орбиталями становится очень малой, так что электроны могут беспрепятственно переходить с одного энергетического уровня на соседний. Каждая группа молекулярных орбиталей образует зону возможных энергетических состояний электронов в данном кристалле.
Рассмотрим образование зон в магнии.
Магнийэлемент 3 периода. В нормальном (газовом) состоянии валентные электроны находятся на 3s подуровне:
Mg: 1s22s22p63s2
3d
3p
3s 
При образовании кристалла атомные орбитали перекрываются и образуется такое же число молекулярных орбиталей. Происходит расщепление атомных орбиталей в зону. В магнии образуется 3s- и ближайшая к ней - 3pзоны, которые перекрываются между собой при образовании кристаллической решетки.
Зона, образованная молекулярными орбиталями из 3s-подуровней заполненная электронами называют валентной (В) зоной, а наиболее низкую из незаполненных (целиком или частично) - зоной проводимости (П).
Схема зонной структуры твердых тел и заполнения зон электронами
Е
|
|
П |
|
|
П |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
П |
|
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
В |
|
|
В |
|
|
В |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
диэлектрик |
металл |
полупроводник |
||||||
Области энергий между разрешенными зонами, которыми электроны обладать не могут называются запрещенными зонами. Для полупроводников ширина запрещенной зоны в пределах 0,1- 3 эВ (для кремния- 1,1 эВ, германия- 0,7 эВ, для серого олова- 0,1 эВ).
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

Кристалл, у которого нижние зоны заполнены целиком, а верхние пустые является диэлектриком (ширина запрещенной зоны 3 эВ).
Общие химические свойства металлов
Впериодах при переходе от щелочного металла к инертному газу заряд ядра возрастает, а радиус атома уменьшается. Поэтому энергия ионизации постепенно увеличивается, а металлические свойства ослабевают.
Вгруппах и подгруппах радиус атома возрастает с увеличением порядкового номера элемента. Кроме того, увеличение числа промежуточных электронных слоев, расположенных между ядром и внешними электронами, приводит к более сильному экранированию ядра. Оба этих фактора приводят к ослаблению связи внешних электронов с ядром и уменьшению энергии ионизации, что свидетельствует об усилении металлических и, соответственно, восстановительных свойств.
Химические свойства металлов весьма разнообразны, однако общим для всех металлов в свободном виде является то, что они хорошие восстановители. Этим обусловлена способность металлов вступать во взаимодействие с различными окислителями, в качестве которых могут быть элементарные вещества с большой электроотрицательностью, ионы менее активных металлов, молекулы сложных веществ и др.
Как правило, металлы окисляются элементами, электроотрицательность которых выше, чем у металла. Однако на химическую активность металла оказывает влияние химическая активность самого элементарного окислителя, а также энергия диссоциации молекул элементарного окислителя. Так, несмотря на сравнительно большие значения энергии электроотрицательности у кислорода и азота окисление металлов галогенами, обладающих малой величиной энергии диссоциации молекулы, часто происходит легче, чем кислородом или азотом. Окисление азотом происходит с большим трудом из-за значительной величины энергии диссоциации его молекулы.
Реакции с неметаллами
1)С кислородом:
2Mg + O2 = 2Mg O
2)С серой:
Hg + S = Hg S
3)С галогенами:
Ni + Cl2 = NiCl2
4)С азотом:
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

3Ca + N2 = Ca3N2
5)С фосфором:
3Ca + 2P = Ca3P2
6) С водородом (реагируют только щелочные и щелочноземельные металлы):
2Li + H2 = 2LiH
Ca + H2 = CaH2
Взаимодействие металлов с растворами электролитов.
Взаимодействие металлов со сложными окислителями протекает в зависимости от устойчивости этих соединений, которая определяется температурой и характером среды. Изучение реакций взаимодействия металлов в водных растворах осложняется гидролизом солей, а иногда и выпадением осадков гидроксидов или основных солей.
В соответствии с уравнением Нернста окислите5льно-восстановительная способность систем зависит от активности (концентрации) окисленной и восстановленной форм вещества, а для химических реакций с участием ионов Н+ и ОНˉ и от рН раствора.
По величинам окислительно-восстановительных потенциалов можно определить возможное направление самопроизвольного протекания окислительно-восстановительных реакций. Знание величины стандартных окислительно-восстановительных потенциалов дает возможность выяснить глубину (степень) самопроизвольного протекания окислительновосстановительных реакций в определенном направлении.
Электродный потенциал служит мерой изменения свободной энергии Гиббса ( G) в системе и тем самым указывает на направление протекания окислительновосстановительного процесса. При постоянных давлении и температуре убыль стандартной энергии Гиббса ( Gо) равна:
Gо = - ∆ЕоnF,
где F - число Фарадея (96485 Кл);
n - число электронов на один перенесенный ион.
∆Ео - разность стандартных потенциалов системы, В.
Поскольку знак «-» при Gо соответствует самопроизвольно протекающему процессу, то чем больше Ео, тем более отрицательно значение энергии Гиббса и тем более вероятен электродный процесс.
Для определения направления самопроизвольного протекания окислительно-
восстановительных процессов необходимо |
|
рассчитать ЭДС |
системы как |
|||||||||||||||
разность |
потенциалов окислительно-восстановительных |
электродов, |
||||||||||||||||
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
7 |
1 |
||||

участвующих в данном процессе. Реакция протекает самопроизвольно в прямом направлении, если ЭДС системы положительна, то есть
|
Eокo |
ля Eвo |
ля . |
|
|
По значению |
величины электродного потенциала |
металла |
можно |
||
предсказать поведение металлов по отношению к воде, |
растворам |
кислот, |
|||
щелочей и солей. |
|
|
|
|
|
Взаимодействие металлов с растворами солей
Металлы способны вступать во взаимодействие с растворами солей. В реакциях с водными растворами солей отрыв электрона от атома активного металла осуществляется ионом металла, находящимся в растворе и выступающим здесь в качестве окислителя. Металлы, имеющие более отрицательный стандартный электродный потенциал, вытесняют из растворов солей другие металлы, с более положительной величиной стандартного электродного потенциала. Так, например, в реакции:
Fe + SnCl2 = FeCl2 +Sn
Выписываем значения потенциалов обоих металлов и окислителя с учетом
рН среды: EoFe2 /Fe = -0,44B; ESno 2 /Sn = -0,136B.
окислителем будут выступать ионы Sn2+, так как стандартный потенциал олова больше, чем у железа.
ЭДС системы ∆Е = |
Eo |
2 |
/Sn |
– Eo |
2 |
/Fe |
= -0,136 – (-0,44) = 0,304B |
|
Sn |
|
Fe |
|
|
положительна и реакция протекает самопроизвольно в прямом направлении:
1 Fe -2e = Fe2+
1 Sn2+ + 2e = Sn
Fe + Sn2+ = Fe2+ + Sn
Взаимодействие металлов с водой, водными растворами кислот и щелочей
Рассмотрим взаимодействие типичных восстановителей, металлов, с некоторыми окислителями - водой, растворами кислот и щелочей. Необходимое условие осуществления реакции окисления металла - Eокислителя  .
.
Окислительно-восстановительные потенциалы некоторых металлов, а также водорода и кислорода в кислой, нейтральной и щелочной среде приведены в таблице.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |

Среда
кислая |
|
|
нейтральная |
|
щелочная |
|||
(рН=0) |
|
|
(рН=7) |
|
|
(рН=14) |
||
окисл.-восст. |
Е0, В |
окисл.-восст. |
|
Е, В |
окисл.-восст. |
Е0, В |
||
пара |
|
|
пара |
|
|
|
пара |
|
2H+/H2 |
0 |
2H2O/H2 |
|
0,41 |
2H2O/H2 |
0,83 |
||
O2/2H2O |
+1,22 |
O2/4OH |
|
+0,81 |
O2/4OH |
+0,40 |
||
Al3+/Al |
1,66 |
Al(OH)3/Al |
|
1,88 |
AlO2 /Al |
2,36 |
||
Bi3+/Bi |
+1,21 |
BiO+/Bi |
|
0,04 |
Bi2O3/Bi |
0,45 |
||
Cd2+/Cd |
0,40 |
Cd(OH)2/Cd |
|
0,41 |
Cd(OH)2/Cd |
0,82 |
||
Co2+/Co |
0,28 |
Co(OH)2/Co |
|
0,32 |
Co(OH)2/Co |
0,73 |
||
Cr3+/Cr |
0,74 |
Cr(OH)3/Cr |
|
0,93 |
CrO2 /Cr |
1,32 |
||
Cu2+/Cu |
+0,34 |
Cu(OH)2/Cu |
|
+0,19 |
Cu(OH)2/Cu |
0,22 |
||
Fe2+/Fe |
0,44 |
Fe(OH)2/Fe |
|
0,46 |
Fe(OH)2/Fe |
0,87 |
||
Mg2+/Mg |
2,36 |
Mg(OH)2/Mg |
|
2,38 |
Mg(OH)2/Mg |
2,69 |
||
Ni2+/Ni |
0,25 |
Ni(OH)2/Ni |
|
0,30 |
Ni(OH)2/Ni |
0,72 |
||
Pb2+/Pb |
0,13 |
Pb(OH)2/Pb |
|
0,14 |
PbO22 /Pb |
0,54 |
||
Sn2+/Sn |
0,14 |
Sn(OH)2/Sn |
|
0,50 |
SnO22 /Sn |
0,91 |
||
Zn2+/Zn |
0,76 |
Zn(OH)2/Zn |
|
0,81 |
ZnO22 /Zn |
1,22 |
||
Реальное прохождение реакции, помимо соотношения потенциалов окислителя и восстановителя, определяет кинетика процесса. Взаимодействие металлов с окислителями в отдельных случаях тормозится оксидными или солевыми плѐнками на поверхности металла. Такое состояние металла называют пассивным, а явление перехода в пассивное состояние - пассивацией.
Действие кислот на металлы
В растворах кислот окислителями могут быть либо ионы водорода H+, либо анионы кислоты. Взаимодействие металлов с кислотами следует рассматривать с учетом следующих факторов:
1.Величины стандартного электродного потенциала металла;
2.Окислительной способности кислотного остатка;
3.Концентрации кислоты.
При взаимодействии металлов с разбавленными кислотами (за исключением разбавленной азотной кислоты) окислителем является ион водорода H+. К числу таких кислот, содержащих в качестве окислителя ион H+, относятся кислоты, не содержащие кислорода в анионе (бескислородные кислоты): HF,
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
